响应面试验优化中性蛋白酶辅助提取青稞淀粉工艺
2016-11-11赵彦巧朱志勇李建颖张丽君天津商业大学生物技术与食品科学学院天津市食品生物技术重点实验室天津300134
赵彦巧,朱志勇,李建颖,张丽君(天津商业大学生物技术与食品科学学院,天津市食品生物技术重点实验室,天津 300134)
响应面试验优化中性蛋白酶辅助提取青稞淀粉工艺
赵彦巧,朱志勇,李建颖,张丽君
(天津商业大学生物技术与食品科学学院,天津市食品生物技术重点实验室,天津 300134)
采用中性蛋白酶辅助提取青稞淀粉,研究料液比、加酶量、酶解时间、酶解温度和pH值对青稞淀粉中蛋白残留量的影响,选择加酶量、酶解时间、酶解温度为影响因素进行响应面优化试验。以淀粉蛋白残留量和淀粉提取率为评价指标,确定最佳提取工艺条件。结果表明,加酶量、酶解温度、酶解时间、加酶量与酶解温度的交互作用及加酶量与酶解时间的交互作用对淀粉蛋白残留量有极显著影响,而对淀粉提取率无显著影响。实验范围内得到的最佳提取工艺条件为加酶量140.79 U/g、酶解温度45.01 ℃、酶解时间2.57 h,在此条件下青稞淀粉的提取率为60.36%,淀粉蛋白残留量为1.31%。
青稞淀粉;中性蛋白酶;蛋白残留;响应面
青稞是一种生长在我国西北、西南特别是西藏、青海一带的极其重要的粮食作物,对青稞的研究主要集中在青稞葡聚糖[1-2]。青稞的淀粉平均含量为59.25%,远高于其他谷类作物[3]。青稞淀粉理化性质非常独特,有良好的工业应用潜力。对于淀粉的提取与分离,文献报道的方法有碱法[4-6]和酶法[7-10],碱法提取的淀粉一般糊化温度较低,凝胶硬度较大,易于回生,溶解度和膨润力较大,对淀粉颗粒有一定程度的破坏[11];酶法提取的淀粉中一般蛋白质残留量较大,结构紧密,糊化温度和糊化黏度较高[12]。在酶法提取淀粉的过程中,采用碱性蛋白酶分离淀粉的报道居多,但是,碱性蛋白酶分离淀粉的过程中水解时间长(18~24 h),而且作用的pH值在碱性范围内,会产生黄淀粉,并存在污水处理的问题[13]。也有关于中性蛋白酶进行淀粉提取的报道[14-15],多用于玉米淀粉和小麦淀粉的提取,采用中性蛋白酶进行青稞淀粉提取鲜见报道。本实验采用中性蛋白酶辅助提取青稞淀粉,通过单因素试验研究料液比、加酶量、酶解时间、酶解温度、pH值等因素对淀粉蛋白残留量的影响,选择主要因素进行响应面优化试验,探究中性蛋白酶辅助青稞粉提取淀粉的最佳工艺条件,为建立理想的青稞淀粉提取工艺路线及青稞的深加工和综合利用提供理论依据。
1 材料与方法
1.1 材料与试剂
青稞粉来自云南香格里拉县。
中性蛋白酶(酶活力≥10 000 U/g) 天津市诺奥科技发展有限公司;磷酸氢二钠、磷酸二氢钠 天津市化学试剂一厂;无水碳酸钠 天津市北方天医化学试剂厂;三氯乙酸 上海伊卡生物技术有限公司;干酪素 杭州微生物试剂有限公司、L-酪氨酸、福林试剂 上海金穗生物科技有限公司;氢氧化钠 天津市德恩化学试剂有限公司;牛血清蛋白 上海伯奥生物科技有限公司;考马斯亮蓝G-250 上海蓝季科技发展有限公司;95%乙醇 天津市风船化学试剂科技有限公司;85%磷酸天津大学科威公司。以上试剂均为分析纯。
1.2 仪器与设备
AUY-220电子分析天平 日本Shimadzu公司;WE-3水浴恒温振荡器、XMTD-204型数显式电热恒温水浴锅 天津市欧诺仪器仪表有限公司;DGG-H-3型电热鼓风干燥箱 天津市天宇实验仪器有限公司;SK5210LHC超声波清洗器 上海科导超声仪器有限公司;PHS-3B型精密pH计 上海精密科学仪器有限公司;UV-7504型紫外-可见分光光度计 上海欣茂仪器有限公司;DL-6000型低速冷冻离心机 上海安亭科学仪器厂;3-18K低温高速离心机 德国Sigma公司;高速万能粉碎机 北京市永光明医疗仪器有限公司。
1.3 方法
1.3.1 淀粉提取工艺条件
酶解辅助淀粉提取工艺流程参考文献[16-19]的淀粉提取工艺并加以改进,提取工艺如下:青稞粉过100 目筛,称质量,按一定料液比加水浸泡制浆,加入中性蛋白酶,恒温振荡水浴酶解一定时间(加入三氯乙酸终止酶解);将酶解液在5 000 r/min进行第1次离心,离心10 min,倒出上清液,刮去上层(暗黄色层),取下层(白色层);将第1次离心得到的下层(白色层)加水制浆,过200 目筛后,淀粉浆在5 000 r/min进行第2次离心,离心10 min,倒出上清液,小心刮去上层(灰色层),收集下层产品;自然条件干燥24 h,得青稞淀粉。
1.3.2 响应面试验优化提取工艺
根据Box-Behnken试验设计原理[20-21],选取加酶量、酶解时间及酶解温度3 个因素,采用三因素三水平响应面试验设计,响应面试验的因素水平见表1。

表1 响应面试验因素与水平Table 1 Factors and levels used in response surface design
1.3.3 指标测定
1.3.3.1 淀粉含量的测定
依据GB/T 5009.9—2008《食品中淀粉的测定》第一法酶水解法测定淀粉含量。
1.3.3.2 中性蛋白酶比活力的测定
依据GB/T 23527—2009《蛋白酶制剂》附录B蛋白酶活力的测定-福林法测定中性蛋白酶的比活力。
1.3.3.3 淀粉中蛋白质含量的测定
采用考马斯亮蓝法测定淀粉中蛋白质的含量[22]。
1.3.3.4 淀粉提取率的计算

1.3.3.5 淀粉中蛋白残留量的计算

2 结果与分析
2.1 青稞原料中淀粉含量
经测定,本实验所选用的青稞原料的平均淀粉含量为56.77%,与文献[1]报道的淀粉平均含量59.25%相当。
2.2 中性蛋白酶的比活力
经测定,本实验所选用中性蛋白酶的比活力为8 000 U/g,与中性蛋白酶生产厂家所标示的比活力基本一致,酶活力较高且稳定。
2.3 单因素试验结果
2.3.1 料液比对蛋白残留量的影响

图1 料液比对淀粉蛋白残留量的影响Fig.1 Effect of solid/liquid ratio on the residual protein content of starch
在中性蛋白酶添加量100 U/g、提取温度45 ℃、提取时间1.5 h的条件下,分别按照料液比为1∶3、1∶4、1∶5、1∶6、1∶7(g/mL)进行青稞淀粉的提取,探讨料液比对其蛋白残留量的影响,由图1可以看出,当溶剂用量过小时,淀粉蛋白残留量较高,原因可能是溶剂用量过小时,酶促反应体系过小,不利于酶促反应的进行;随溶剂用量的增加,酶与底物充分接触,酶解完全,淀粉蛋白残留量逐渐降低,使淀粉粒子最大限度游离出来[23-24]。在料液比1∶4之后,蛋白残留量下降速率变缓,考虑到废液处理和环境保护的问题,故在响应面优化试验中不再考虑料液比对蛋白残留量的影响,选择料液比1∶4进行后续试验。
2.3.2 加酶量对蛋白残留量的影响

图2 加酶量对淀粉蛋白残留量的影响Fig.2 Effect of enzyme dosage on the residual protein content of starch
在料液比1∶4(g/mL)、提取温度45 ℃、提取时间1.5 h的条件下,分别按照加酶量为80、100、120、140、160 U/g进行青稞淀粉的提取,探讨加酶量对其蛋白残留量的影响,由图2可以看出,加酶量对淀粉蛋白残留量的影响较为显著,随着加酶量的增加,淀粉蛋白残留量下降速率呈现先增大后减小的趋势。当加酶量较少时,酶质量浓度大大低于饱和质量浓度,由酶促反应动力学可知,加酶量成为酶促反应的主要限制因素,此时酶质量浓度与反应速率呈正比关系[25],因此蛋白残留量也随着酶质量浓度的增加而降低。当加酶量为120 U/g时,酶质量浓度达到饱和,所以蛋白残留量降低速率减缓,考虑到实际生产的成本问题,加酶量不宜过高,且当考察加酶量与其他因素的交互作用时,较低水平的加酶量也可能产生良好的催化效果,故选取120、140、160 U/g 3 个水平进行响应面优化试验。
2.3.3 酶解时间对蛋白残留量的影响

图3 酶解时间对淀粉蛋白残留量的影响Fig.3 Effect of hydrolysis time on the residual protein content of starch
在料液比1∶4(g/mL)、中性蛋白酶添加量100 U/g、酶解温度45 ℃的条件下,分别酶解1.5、2.0、2.5、3.0、3.5 h,探讨酶解时间对其蛋白残留量的影响,由图3可以看出,酶解时间对淀粉蛋白残留量的影响较为显著,随酶解时间的延长,淀粉蛋白残留量降低速率呈现先增大后减小的总趋势。在酶促反应初期,酶活性及反应速率都比较高,随酶解时间的延长,酶促反应不断进行,所以淀粉蛋白残留量不断减少。但当酶解时间超过3 h后,酶促反应基本进行完全,与文献[26]报道的中性蛋白酶酶解时间基本相同。考虑到时间成本,选取2.0、2.5、3.0 h 3 个水平进行响应面优化试验,探究酶解时间及其与其他因素的交互作用对淀粉蛋白残留量的影响。
2.3.4 酶解温度对蛋白残留量的影响

图4 酶解温度对淀粉蛋白残留量的影响Fig.4 Effect of hydrolysis temperatures on the residual protein content of starch
在料液比1∶4(g/mL)、中性蛋白酶添加量100 U/g、酶解时间1.5 h的条件下,控制酶解温度分别为35、40、45、50、55 ℃,探讨酶解温度对蛋白残留量的影响,由图4可以看出,酶解温度对淀粉蛋白残留量的影响较为显著,随酶解温度的升高,蛋白残留量先减小后增大,最小值出现在酶解温度为50 ℃时。温度是影响酶活性的最重要因素之一[27-28]。蛋白酶具有特定的空间结构,温度较低时,不能使结构充分的舒展,活性也不能充分发挥,升温有利于加快反应速率,而当温度过高时,蛋白质变性而导致蛋白酶结构破坏,从而丧失或部分丧失活性;此外,较高的温度也可能使产生的淀粉糊化,黏度增大,影响蛋白酶的作用效果。考虑到经济成本,选取40、45、50 ℃ 3 个水平进行响应面优化试验。
2.3.5 pH值对蛋白残留量的影响

图5 pH值对淀粉蛋白残留量的影响Fig.5 Effect of pH on the residual protein content of starch
在料液比1∶4(g/mL)、中性蛋白酶添加量100 U/g、酶解温度45 ℃、酶解时间1.5 h的条件下,分别调节pH值为6.0、6.5、7.0、7.5、8.0,探讨pH值对淀粉蛋白残留量的影响,由图5可以看出,pH值升高,淀粉蛋白残留量先减小后增大,在pH值为7时,淀粉蛋白残留量最小,与文献[29]报道的中性蛋白酶的最适pH值相当。考虑到调节pH值之后,还需要进行中和,后续过程中会涉及废水处理和脱盐处理,工序复杂,而且不利于环境保护,故选择不调节pH值,此时pH值为6.8。
2.4 响应面优化提取工艺结果
2.4.1 响应面试验结果
以蛋白残留量(R1)和淀粉提取率(R2)为考察指标,响应面试验结果见表2。
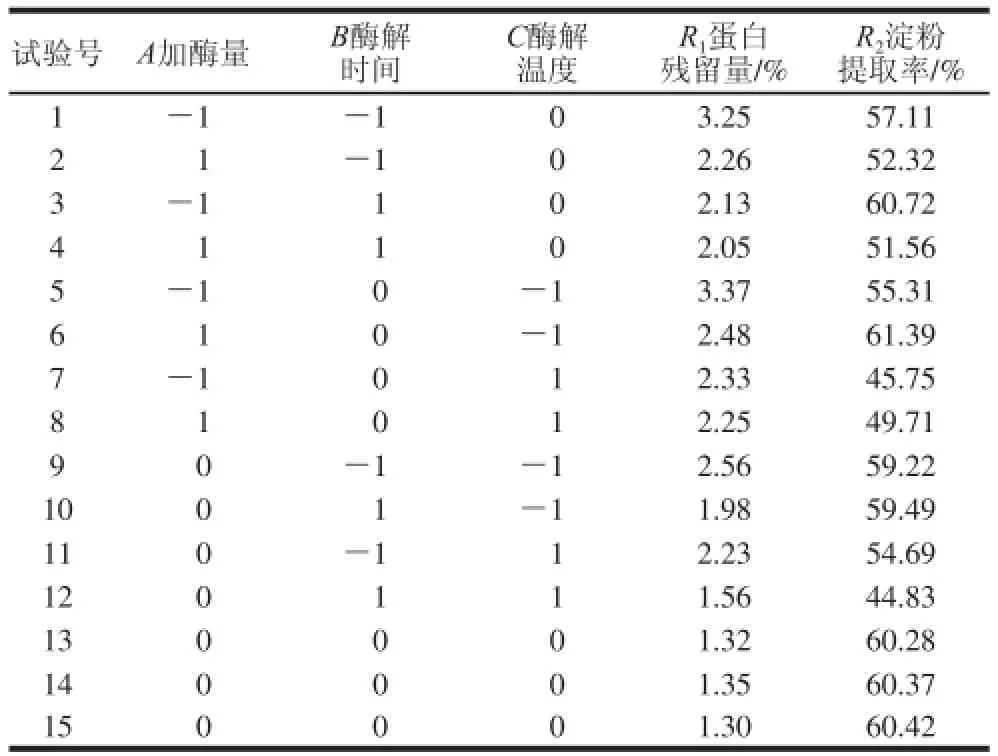
表2 响应面试验设计及结果Table 2 Experimental design and results for response surface analysis
经回归拟合后,各试验因素对响应值蛋白残留量的影响可用如下函数表示:
R1=111.908 75-0.729 21A-9.166 67B-2.011 00C+0.022 750AB+2.025 00×10-3AC-9.000 00×10-3BC+2.030 21×10-3A2+1.148 33B2+0.018 883C2
运用Design-Expert 8.0.6软件对15 个试验点的响应值进行回归分析,结果见表3。
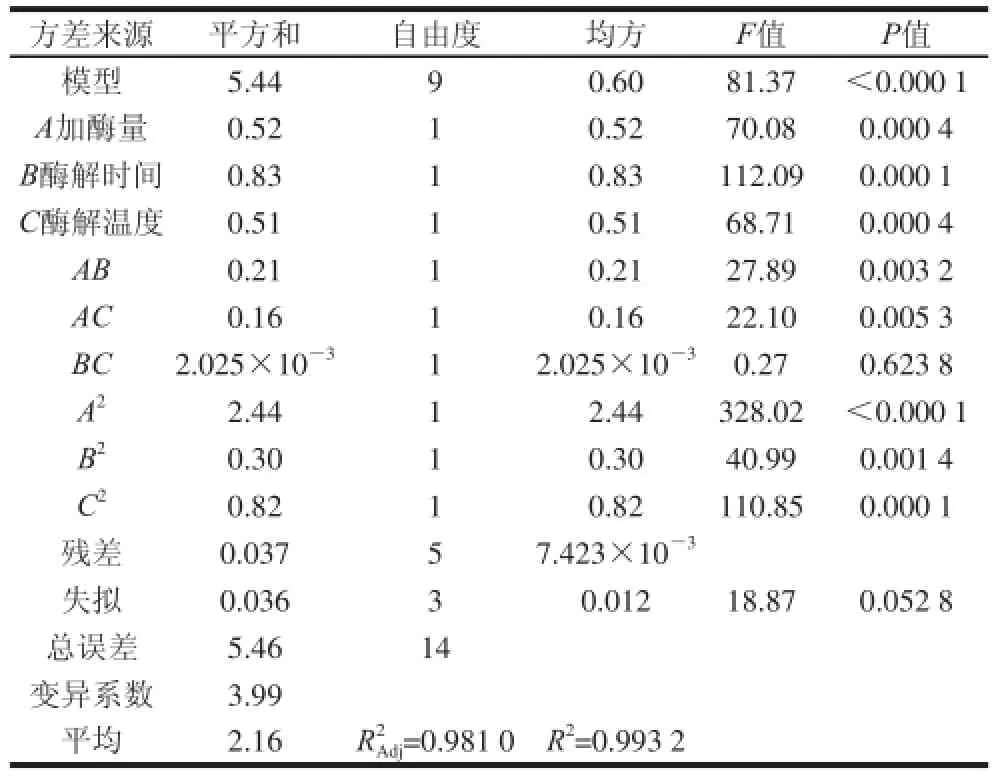
表3 蛋白残留量回归模型的方差分析Table 3 Analysis of variance of regression model
由表3可知,此模型的F值81.37,P<0.000 1,回归模型高度显著。模型的一次项A、B、C极显著,二次项A2、B2、C2极显著,交互项AB、AC极显著。回归模型的决定系数R2=0.993 2,调整后的回归模型决定系数=0.981 0,说明模型拟合程度好。失拟项P=0.050 8,不显著,说明本试验无其他显著因素的影响,试验条件合适。各因素对淀粉蛋白残留量的影响次序是:B(酶解时间)>A(加酶量)>C(酶解温度)>AB>AC>BC,其中加酶量、酶解时间、酶解温度、加酶量与酶解时间的交互作用及加酶量与酶解温度的交互作用对蛋白残留量有极显著影响。
经回归拟合后发现,各试验因素对淀粉提取率的影响并不显著,故在此不再讨论。
2.4.2 因素间交互作用的响应面
为了进一步研究相关因素之间的交互作用,通过Design-Expert绘制响应面图进行直观分析,对蛋白残留量有交互影响的响应面分析立体曲面见图6。

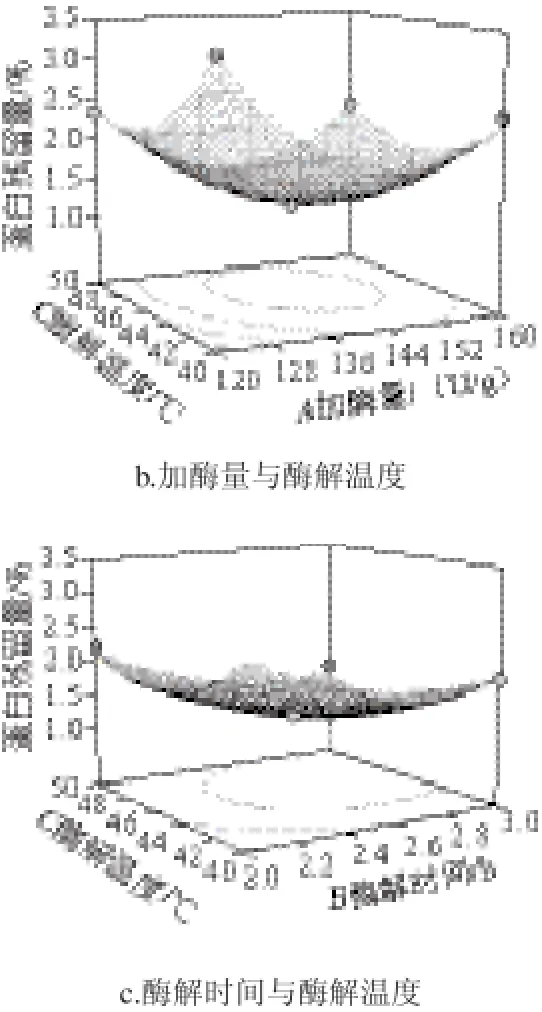
图6 各因素交互作用对淀粉蛋白残留量的影响Fig.6 Effect of interaction between various factors on the residual protein content of starch
由图6a可以看出,加酶量与酶解时间之间存在明显的交互作用,表现为等高线呈椭圆形。中性蛋白酶的添加量在130~150 U/g之间时,随着酶解时间的延长,淀粉蛋白残留量减少。当中性蛋白酶的添加量大于150 U/g时,淀粉的蛋白残留量又随着酶解时间的延长而升高。由图6b可以看出,加酶量与酶解温度之间存在明显的交互作用,表现为等高线呈椭圆形。中性蛋白酶的添加量在130~150 U/g之间时,随着酶解温度的升高,淀粉蛋白残留量减少。当中性蛋白酶的添加量大于150 U/g时,淀粉的蛋白残留量又随着酶解温度的升高而增大。由图6c可以看出,酶解时间和酶解温度之间无明显交互作用。
按照响应面最佳条件,即加酶量140.79 U/g,在45.01 ℃条件下酶解2.57 h,对中性蛋白酶辅助青稞淀粉的提取进行3 次平行验证实验。验证实验结果表明在上述最佳条件下淀粉的平均提取率为60.36%,淀粉蛋白残留量平均值为1.31%,而预测的最小值为1.27%,两者吻合较好。
3 结 论
本实验采用中性蛋白酶辅助从青稞粉中提取淀粉,在单因素试验的基础上选择加酶量、酶解时间、酶解温度3 个主要影响因素进行响应面优化试验,探究中性蛋白酶辅助青稞粉提取淀粉的最佳工艺条件,降低淀粉蛋白残留量,得出如下主要结论:料液比对淀粉蛋白残留量的影响并不显著,但过低的溶剂用量会使蛋白残留量升高,考虑到废水处理及节水节能,较为理想的料液比为1∶4;各因素对淀粉提取率的影响并不显著;各因素对淀粉蛋白残留量的影响次序是:B(酶解时间)>A(加酶量)>C(酶解温度)>AB>AC>BC,其中加酶量、酶解时间、酶解温度、加酶量与酶解时间的交互作用及加酶量与酶解温度的交互作用对蛋白残留量有极显著影响。
根据响应面优化试验结果,得到最佳提取工艺条件:中性蛋白酶量140.79 U/g,在45.01 ℃条件下酶解2.57 h。此时青稞淀粉的提取率为60.36%,淀粉蛋白残留量为1.31%。
[1] 马栋, 邹妍, 龚倩云, 等. 响应面法优化青稞β-葡聚糖提取条件的研究[J]. 食品工业科技, 2012, 33(1): 204-206; 210. DOI:10.13386/ j.issn1002-0306.2012.01.004.
[2] 贾莹. 青稞麸皮水溶性β-葡聚糖的提取、分离纯化和性质研究[D].上海: 华东理工大学, 2013.
[3] VASANTHAN T, BHATTY R S. Starch purification after pin milling and classification of waxy, normal and high amylase barleys[J]. Cereal Chemistry, 1995, 72(4): 379-384.
[4] 刘新兴, 李建颖, 赵彦巧, 等. 青稞淀粉的提取工艺优化研究[J]. 食品研究与开发, 2014, 35(5): 34-36. DOI:10.3969/ j.issn.1005-6521.2014.05.010.
[5] 代钰, 丁文平, 王毅梅, 等. 稀碱法分离工艺对糯米中蛋白质提取率的影响[J]. 中国粮油学报, 2011, 26(4): 1-5.
[6] 马丽娜, 姜丹, 张守文, 等. 碱法提取五常稻花香大米淀粉工艺优化[J]. 农产品加工, 2014(11): 46-47; 53. DOI:10.3969/jissn.1671-9646(X).2014.11.044.
[7] 盛志佳, 林亲禄, 肖华西, 等. 大米淀粉的提取及纯化方法研究[J]. 湖南农业科学, 2011(7): 80-84. DOI:10.3969/j.issn.1006-060X.2011.07.025.
[8] 胡爱军, 李立, 郑捷, 等. 酶法提取香芋淀粉工艺研究[J]. 粮食与油脂, 2014, 27(10): 18-20. DOI:10.3969/j.issn.1008-9578.2014.10.005.
[9] 李涛, 王金水, 渠琛玲, 等. 水酶法提取青稞淀粉工艺研究[J]. 河南工业大学学报(自然科学版), 2010, 31(2): 62-65.
[10] 谢新华, 李晓方, 肖昕, 等. 中性蛋白酶与超声波结合分离稻米淀粉及其黏滞性研究[J]. 河南农业科学, 2009(7): 50-53. DOI:10.3969/ j.issn.1004-3268.2009.07.013.
[11] 郭晓冬, 李颖. 小米淀粉提取方法的比较[J]. 中国粮油学报, 2011, 26(5): 26-29.
[12] SIT N, DEKA S C, MISRA S. Optimization of starch isolation from taro using combination of enzymes and comparison of properties of starches isolated by enzymatic and conventional methods[J]. Journal of Food Science and Technology, 2014, 51(7): 1-9. DOI:10.1007/s13197-014-1462-z.
[13] 芦鑫, 张晖, 姚惠源. 中性蛋白酶-超声波处理降低大米淀粉中蛋白质的残留[J]. 粮食与饲料工业, 2006(11): 24-26. DOI:10.3969/ j.issn.1003-6202.2006.11.010.
[14] 谭博文, 徐怀德, 米林峰, 等. 中性蛋白酶酶解制备魔芋飞粉淀粉及其性质的研究[J]. 食品科学, 2010, 31(18): 41-45.
[15] WITTROCK E, JIANG H, CAMPBELL M, et al. A simplified isolation of high-amylose maize starch using neutral proteases[J]. Starch-Stärke, 2008, 60(11): 601-608. DOI:10.1002/star.200800223.
[16] PUCHONGKAVARIN H, VARAVINIT S, BERGTHALLER W. Comparative study of pilot scale rice starch production by an alkaline and an enzymatic process[J]. Starch, 2005, 57(3/4): 134-144. DOI:10.1002/star.200400279.
[17] ANDERSSON A A M, ANDERSSON R, ÅMAN P. Starch and by-products from a laboratory-scale barley starch isolation procedure[J]. Cereal Chemistry, 2001, 78(5): 507-513. DOI:10.1094/ CCHEM.2001.78.5.507.
[18] LI Y, SHOEMAKER C F, SHEN X, et al. The isolation of rice starch with food grade proteases combined with other treatments[J]. Food Science and Technology International, 2008, 14(3): 215-224. DOI:10.1177/1082013208092824.
[19] 张玉玉. 青棵淀粉的提取及特性研究[D]. 郑州: 河南工业大学, 2010.
[20] BAS D, BOYACI I H. Modeling and optimization Ⅰ: usability of response surface methodology[J]. Journal of Food Engineering, 2007, 78(3): 836-845. DOI:10.1016/j.jfoodeng.2005.11.024.
[21] 范文亮, 张春涛, 李正良, 等. 考虑交叉项的自适应响应面法[J]. 工程力学, 2013, 30(4): 68-72. DOI:10.6052/ j.issn.1000-4750.2011.10.0697.
[22] 赵英永, 戴云, 崔秀明, 等. 考马斯亮蓝G-250染色法测定草乌中可溶性蛋白质含量[J]. 云南民族大学学报(自然科学版), 2006, 15(3): 235-237. DOI:10.3969/j.issn.1672-8513.2006.03.018.
[23] 王淑媛, 王素英. 中性蛋白酶酶解玉米肽及其醒酒活性研究[J]. 食品研究与开发, 2007, 28(4): 60-64. DOI:10.3969/ j.issn.1005-6521.2007.04.018.
[24] PASCOAL A M. Extraction and chemical characterization of starch from S. lycocarpum fruits[J]. Carbohydrate Polymers, 2013, 98(2): 1304-1310. DOI:10.1016/j.carbpol.2013.08.009.
[25] 陈银霞. 影响酶促反应速度的外因研究[J]. 现代农业科技, 2008(18): 238-239. DOI:10.3969/j.issn.1007-5739.2008.18.166.
[26] 高丹丹, 常通, 曹郁生, 等. 响应面法优化中性蛋白酶水解棉籽蛋白工艺[J]. 食品科学, 2009, 30(16): 153-157. DOI:0.3321/ j.issn:1002-6630.2009.16.030.
[27] 王镜岩, 朱圣庚, 徐长法. 生物化学: 上册[M]. 3版. 北京: 高等教育出版社, 2002: 378-379.
[28] 卢虹, 邱雁临, 吴军林. 中性蛋白酶和木瓜蛋白酶水解啤酒糟中蛋白质的研究[J]. 中国酿造, 2001, 20(4): 22-24. DOI:10.3969/ j.issn.0254-5071.2001.04.008.
[29] 仪凯, 周瑞宝. 中性蛋白酶水解花生粕的研究[J]. 中国油脂, 2005, 30(7): 71-73. DOI:10.3321/j.issn:1003-7969.2005.07.020.
Optimization of Neutral Protease-Assisted Extraction of Highland Barley Starch
ZHAO Yanqiao, ZHU Zhiyong, LI Jianying, ZHANG Lijun
(Tianjin Key Laboratory of Food Biotechnology, College of Biotechnology and Food Science, Tianjin University of Commerce, Tianjin 300134, China)
The neutral protease-assisted extraction of highland barley starch was optimized using response surface methodology. The effects of several operating parameters, namely solid to liquid ratio, enzyme dosage, hydrolysis time, temperature and pH, on the residual protein content of highland barley starch were studied. Three main factors including enzyme dosage, hydrolysis time and temperature were chosen to design response surface experiments using residual protein content and starch yield as the responses. The results showed that the three selected factors as well as the interaction between enzyme dosage and either hydrolysis time or temperature all had significant effects on residual protein content, but had no significant effects on starch yield. The optimal extraction conditions in the selected experimental ranges were determined as follows: enzyme dosage, 140.79 U/g; temperature, 45.01 ℃; and hydrolysis time, 2.57 h, leading to a starch yield of 60.36% and a residual protein content of 1.31%.
highland barley starch; neutral protease; residual protein; response surface methodology
10.7506/spkx1002-6630-201604006
TS235.1
A
1002-6630(2016)04-0031-06
赵彦巧, 朱志勇, 李建颖, 等. 响应面试验优化中性蛋白酶辅助提取青稞淀粉工艺[J]. 食品科学, 2016, 37(4): 31-36. DOI:10.7506/spkx1002-6630-201604006. http://www.spkx.net.cn
ZHAO Yanqiao, ZHU Zhiyong, LI Jianying, et al. Optimization of neutral protease-assisted extraction of highland barley starch[J]. Food Science, 2016, 37(4): 31-36. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201604006. http://www.spkx.net.cn
2015-07-09
天津市高校科技发展基金项目(140023);天津市高等学校“十二五”综合投资人才培养项目(507-125RCPY0315);
天津市教育科学“十二五”规划重点研究课题(HE3024);天津市科学技术普及项目(13KPXM01SY008);
天津市科技型中小企业技术创新资金项目(13ZXCXSY08400)
赵彦巧(1979—),女,副教授,博士,研究方向为天然产物的提取与分离。E-mail:yqzhao@tjcu.edu.cn
