核桃青皮提取液与壳聚糖复合物对甜瓜采后品质的影响
2016-11-11马晓芬阿塔吾拉铁木尔王刚霞新疆农业科学研究院食品贮藏加工研究所新疆乌鲁木齐830091
魏 佳,马晓芬,阿塔吾拉·铁木尔,王刚霞,吴 斌(新疆农业科学研究院食品贮藏加工研究所,新疆 乌鲁木齐 830091)
核桃青皮提取液与壳聚糖复合物对甜瓜采后品质的影响
魏 佳,马晓芬,阿塔吾拉·铁木尔,王刚霞,吴 斌*
(新疆农业科学研究院食品贮藏加工研究所,新疆 乌鲁木齐 830091)
利用核桃青皮提取液与壳聚糖复配制备出一系列不同配比的复合物溶液,应用于新疆甜瓜的保鲜实验。分析3 种不同配比复合物溶液对甜瓜采后贮藏品质及生理指标的影响。结果表明,在温度25 ℃、相对湿度55%~60%条件下,核桃青皮提取液-壳聚糖复合物能够有效地降低甜瓜的发病率、质量损失率和呼吸强度,减少甜瓜中可溶性固形物和可滴定酸含量的降低,促进多酚氧化酶和过氧化物酶的活性,保持甜瓜中苯丙氨酸解氨酶的活性,但其对甜瓜硬度的影响不明显。核桃青皮提取液含量较高的CHE-25复合物溶液在甜瓜采后贮藏多个生理指标和酶活性等因素上表现均优于其他组,其保鲜作用效果最优,说明核桃青皮提取物可作为天然保鲜剂应用于甜瓜采后贮藏保鲜。
核桃青皮;壳聚糖;甜瓜;贮藏;复合物
新疆甜瓜因品种繁多、品质优良、栽培历史悠久而闻名遐迩[1]。甜瓜果实糖度较高,水分含量较大,其采后代谢旺盛,属于不耐贮藏的水果。由于收采集的时间正值高温季节,在运输、贮藏及销售过程中易受外界病菌侵染而发生腐烂变质,损耗严重,从而造成大量经济损失[2]。目前,新疆甜瓜采后贮藏保鲜技术的研究严重滞后于生产,甜瓜采后病害的控制技术主要包括气调、低温贮藏保鲜技术、涂膜保鲜技术和热处理保鲜技术等,国内外均有报道[3-6]。化学防腐剂对新疆甜瓜的保鲜作用虽十分有效,但是化学杀菌剂残留危害人类健康,同时病原菌会对化学杀菌剂产生抗药性。
核桃青皮为核桃未成熟时的外果皮,其性辛、苦、涩、有毒、微寒,含有大量的多酚类、黄酮类和有机酸等活性物质[7],其中多酚类化合物、香豆素类具有较强的抑菌杀菌及抗氧化作用。为了充分利用这一资源,国内外学者对核桃青皮提取物的抗氧化性、抑菌性、杀虫、除草以及抗病毒等方面进行了大量研究工作,但是很多研究仅仅停留在理论阶段,没有进行大范围的推广应用[8-12]。
壳聚糖是从虾、鳖、昆虫外壳或真菌细胞壁中提取的甲壳素脱去乙酰基的多糖类生物大分子,具有安全无毒、抑菌、可食用、可生物降解等多种特性[13],因此可用在制备可食性保鲜膜上。Oms-Oliu等[14]采用多糖涂膜对甜瓜进行保鲜,保鲜层较好地降低了果实呼吸强度,可诱导果实产生抗病性,较好地保持了果实的硬度。
针对目前甜瓜采后存在的贮运问题,本研究将核桃青皮提取物和壳聚糖进行复配,制备不同剂型复合物溶液,应用于甜瓜采后贮藏保鲜。分析保鲜处理后甜瓜的不同指标,研究不同配比复合物对甜瓜贮藏品质和生理变化的不同影响,以期为甜瓜的采后保鲜提供参考。
1 材料与方法
1.1 材料与试剂
鲜核桃(Juglans regia Linn.)于2013年7月20日采自新疆吐鲁番。将核桃青皮在-20 ℃条件下用植物粉碎机粉碎,在-50 ℃条件下真空冷冻干燥除去水分,过40 目筛,得核桃青皮干粉,置于-80 ℃冰箱中备用。
供试的甜瓜品种为‘西周蜜-25’,2013年8月18日在甜瓜成熟期采摘自新疆吐鲁番。采收当天,在果园里挑出有机械损伤和病害的果实,装入塑料筐运回新疆农科院农产品贮藏加工研究所冷库。取果形端正,大小均一(质量在4.0 kg左右),色泽成熟度一致的果实,垫上泡沫垫在温度为 0 ℃的冷库中预冷24 h后在25 ℃条件下贮藏。
邻苯二酚、过氧化氢 天津市化学试剂三厂;磷酸氢二钠 天津市天达净化材料精细化工厂;硼酸、硼砂、四乙酸乙二胺 天津市福晨化学试剂厂;聚乙烯吡咯烷酮(polyvinyl pyrrolidone,PVP)、柠檬酸、愈创木酚、磷酸二氢钠 天津市致远化学试剂有限公司;硫代巴比妥酸(2-thiobarbituric acid,TBA)、核黄素、氯化硝基四氮唑蓝(nitro blue tetrazolium chloride monohydrate,NBT)、三氯乙酸(trichloroacetic acid, TCA)(均为分析纯) 上海化学试剂有限公司试剂一厂;壳聚糖(食用级) 西安百川生物科技有限公司。
1.2 仪器与设备
GY-4硬度计 西安云仪仪器仪表公司;PAL-1手持折光仪 日本Atago科技公司;CR-22G日立高速冷冻离心机 日本Hitachi公司;ST303红外CO2呼吸测定仪北京金仕特仪器仪表公司;UV-2600分光光度计 日本岛津公司;Milli-Q-B超纯水系统 美国Millipoe公司;Coulter AvantiJ-25台式高速冷冻离心机 德国Beckman公司;DELTA320台式pH计 江苏海门士其林贝仪器公司;ML204分析天平 梅特勒-托利多仪器(上海)有限公司。
1.3 方法
1.3.1 核桃青皮提取液的配制
提取方法参照Oliveira等[15]的方法略有调整。称取核桃青皮干粉15 g,使用80%乙醇溶液溶解。室温条件下超声45 min后过滤,将滤液在4 ℃转速8 000 r/min条件下离心30 min,然后真空抽滤,再将滤液在40 ℃条件下旋转蒸发去溶剂(水提物在48 ℃条件下蒸干),得到固体物质。按照不同质量浓度要求配制核桃青皮提取液。
1.3.2 壳聚糖溶液(以下用CH表示)的配制
将壳聚糖溶于2%柠檬酸溶液配成质量分数为2%的CH,用1.00 mol/L NaOH溶液调节pH值为5.4,超声波处理0.5 h。
1.3.3 核桃青皮提取物-壳聚糖复合物溶液(以下用CHE表示)的配制
将核桃青皮提取液、壳聚糖按表1的对应参数进行复配,溶液按1∶1(V/V)混合,即得CHE。将配制好的复合物溶液超声处理0.5 h,再放置12 h,取上清液处理甜瓜。
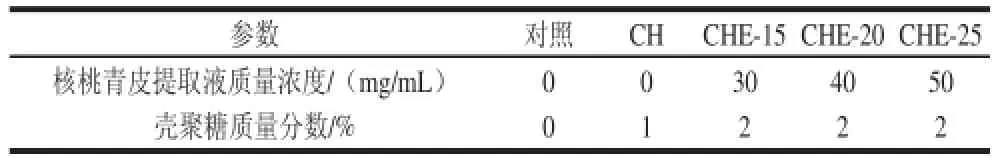
表1 复合物溶液参数Table 1 Mixing ratios of walnut green husk and chitosan
1.3.4 甜瓜处理
随机挑选甜瓜置于不同的复合物溶液内浸泡3 min后取出自然晾干,对照组甜瓜用清水处理,共5 个处理,每个处理3 个重复。将晾干的甜瓜用泡沫袋包装后,装箱入库(温度25 ℃,相对湿度55%~60%),依据甜瓜表形变化6~8 d取一次样,进行生理指标的测定。
1.3.5 生理指标的测定
1.3.5.1 甜瓜发病率的计算
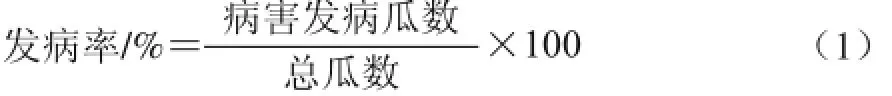
1.3.5.2 质量损失率的计算

1.3.5.3 硬度的测定
参考Wang等[16]的方法,取甜瓜(去皮)用果实硬度计测其硬度,在每个甜瓜的直径位置分别测3 个不同点,取平均值。
1.3.5.4 呼吸速率的测定
采用SANTRY ST303型红 外线CO2测定仪测定箱内的CO2含量(mg/kg),CO2转换为质量浓度(mg/m3)后换算为呼吸强度[17]。
1.3.5.5 可溶性固形物含量的测定
在实验期间,定期在每个处理样品中随机选取甜瓜,去皮,打汁,采用PR PAL-1型数显折射仪测定[18]。
1.3.5.6 可滴定酸含量和pH值的测定
采用酸碱滴定法和pH计测定。
1.3.5.7 多酚氧化酶(polyphenol oxidase,PPO)活性的测定
酶液制备参照Li Wenhao等[19]的方法,准确称取5.000 0 g去皮甜瓜果肉和0.500 0 g PVP加到20 mL 0.2 mol/L磷酸缓冲液(pH 6.4)中,冰浴研磨,充分浸提。再将浸提液冷冻离心(离心条件:4 ℃,15 000 r/min,30 min),取上清液测定酶活性。在酶活性测定反应体系中,依次加入0.04 mL粗酶提取液和5 mL 0.02 mol/L邻苯二酚液(用0.2 mol/L(pH 6.4)磷酸缓冲液配成),充分混匀,反应温度为30 ℃。调零空白为5 mL邻苯二酚液加1 mL缓冲液(不加酶),加酶液后1 min开始扫描3 min内410 nm波长处吸光度变化,以每分钟吸光度变化 0.01表示1 个酶活性单位。
1.3.5.8 过氧化物酶(peroxidase,POD)活性的测定
测定方法参照文献[20],酶液制备同1.3.5.7节,将0.8 mL粗酶提取液加入3 mL 0.1 mol/L愈创木酚(0.2 mol/L磷酸缓冲液(pH 6.4)配成)中,在30 ℃水浴中平衡5 min,(调零空白为3 mL 0.1 mol/L愈创木酚),然后加1 mL 0.2% H2O2(用0.2 mol/L磷酸缓冲液(pH 6.4)配成)混匀,1 min后扫描1 min内470 nm波长处吸光度变化,以每分钟吸光度变化0.01表示1 个酶活性单位。
1.3.5.9 苯丙氨酸解氨酶(phenylalamine ammonialyase,PAL)活性的测定
测定方法参照文献[21],略有改动,准确称取5.000 0 g甜瓜果肉,加0.500 0 g PVP,再加入0.100 mol/L的硼酸缓冲液20 mL(pH 8.8,含有10.00 mmol/L巯基乙醇和50 mmol/L EDTA-Na2),冰浴研磨,在0 ℃条件下12 000 r/min离心15 min,取上清液用于酶活测定。取1 mL粗提酶液于10.00 mL试管中加入2.00 mL pH 8.8硼酸缓冲液和1 mL蒸馏水,再加1 mL 0.02 mol/L的L-苯丙氨酸,总体积为4 mL。对照中不加L-苯丙氨酸,多加1 mL水。反应液混匀,置30 ℃恒温水浴中60 min,加入0.20 mL 6.00 mol/L盐酸终止反应,在290 nm波长条件下测定吸光度(A290nm)。PAL活性按式(3)计算:
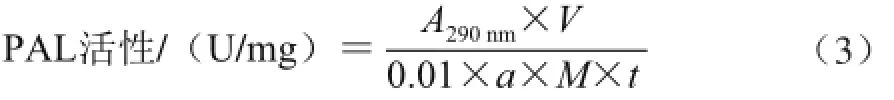
式中:V为酶液总体积/mL;a为测定时所用酶液体积/mL;t为反应时间/min;M为材料的质量/g。
1.4 数据分析
用SPSS 13.0软件进行数据分析,用Duncan’s新复极差法对测试结果进行显著性分析。
2 结果与分析
2.1 复合物溶液对甜瓜发病率的影响

图1 复合物溶液对甜瓜发病率的影响(25 ℃)Fig.1 Effect of composite preservative treatments on decay index of muskmelon at 25 ℃
由图1可知,在贮藏的36 d内,不同组成的复合物溶液均显著降低了甜瓜的发病率,且CHE-15、CHE-20、CHE-25处理效果均比CH效果明显。在前8 d之内,复合物溶液处理组和对照组的发病率均比较低,且各处理组相互之间差别不明显。8~12 d期间,对照组甜瓜发病率显著上升,复合物溶液处理的甜瓜发病率仍然保持在10%以下。贮藏30 d时,对照组甜瓜的发病率高达45.78%,而复合物溶液处理甜瓜的发病率在23.1%~30.9%之间。通过比较最小显著差异值,不同配比复合物溶液之间差异不明显,但是CHE-20与CH之间存在着显著性差异(P<0.05)。
结果表明,复合物溶液可以有效控制甜瓜的发病率,从而使甜瓜的发病率有所减少。复合物溶液中壳聚糖成分具有良好的成膜效果,降低了甜瓜的呼吸强度,同时核桃青皮提取物和壳聚糖都具有良好的抑菌性,抑制了微生物的入侵,较好地降低了甜瓜的发病率。
2.2 复合物溶液对甜瓜质量损失率的影响
质量损失率反映果蔬贮藏期间以水分为主要成分的质量减少,由失水引起的质量损失约占总质量损失的80%,所以果蔬保鲜的首要任务是保水[22]。从图2可以看出,在18 d之前,各处理组和对照组甜瓜的质量损失率变化幅度均较缓慢。甜瓜质量损失的主要原因是其呼吸蒸腾作用,且各处理组之间腐烂率差异不显著,可能是因为甜瓜贮存初期,腐烂现象不明显。18~30 d期间,对照组甜瓜质量损失率上升幅度较快,结合其相同时间的发病率可知,由于甜瓜腐烂而失水的情况出现。方差分析表明,各处理组甜瓜的质量损失率和对照组发病率之间存在着显著差异(P<0.05),CHE-20、CHE-25与CHE-15及CH之间达到显著差异。这是因为复合物溶液中含有壳聚糖,在果实表面形成一层均匀细致的膜,堵塞了甜瓜果皮上部分裂纹和果梗上的毛孔,减缓了果实的呼吸作用,减少了果实的水分蒸发。此外,复合物溶液具有抗菌防腐和抗病性的诱导作用,在贮藏后期处理组甜瓜发病率明显低于对照组甜瓜,和其质量损失率的变化基本保持一致,说明核桃青皮复合物溶液有效控制了甜瓜的发病率,从而达到了保持甜瓜水分的作用。

图2 复合物溶液对甜瓜质量损失率的影响(25 ℃)Fig.2 Effect of composite preservative treatments on weight loss of muskmelon at 25 ℃

图3 复合物溶液对甜瓜硬度的影响(25 ℃)Fig.3 Effect of composite preservative treatments on fruit rmness of muskmelon at 25 ℃
由图3可以看出,甜瓜在整个贮藏期硬度呈现下降趋势,表明随着贮藏时间的加长,甜瓜在不断的变软。在贮藏的第10天,处理组和对照组的甜瓜下降速率很快,且相互之间差异性不是很明显,这可能是因为甜瓜有一段后熟期,使果肉变软。10~18 d期间,对照组甜瓜的硬度迅速下降,处理组甜瓜的硬度下降比较缓慢,且处理组之间的差异逐渐开始明显;贮藏至24 d时,对照组甜瓜的硬度为7.39 N,CHE-25处理的硬度为22.9 N,CH和 CHE-15下降速率基本一致。方差分析表明,贮存至36 d时,对照组甜瓜和处理组甜瓜的硬度均很低,尽管处理组甜瓜硬度显著高于对照组(P<0.05),但是甜瓜基本没有可食用价值。结果表明,CHE处理可以在一定时间(24 d内)较好地保持甜瓜的硬度,防止甜瓜变软。这可能是复合物溶液中含有壳聚糖,可以很好减缓甜瓜水分散失,以及其含有两种均具有良好抑菌性的成分,有效地防止了微生物的侵害,减缓了果实的衰老,以至降低甜瓜硬度的下降。
2.4 复合物溶液对甜瓜呼吸强度的影响
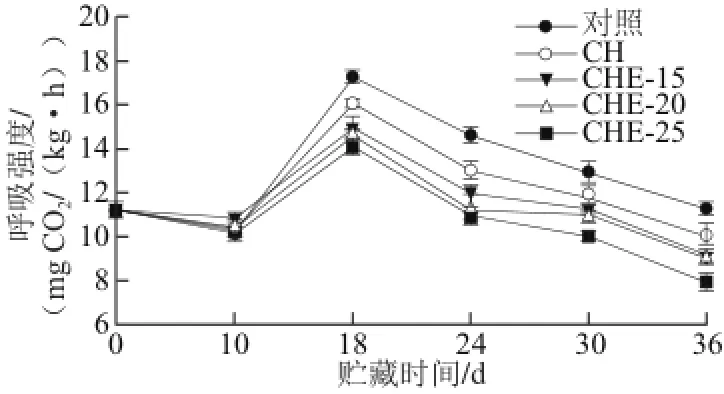
图4 复合物溶液对甜瓜呼吸强度的影响(25 ℃)Fig.4 Effect of composite preservative treatments on respiratory rate of muskmelon at 25 ℃
呼吸强度是果实生理代谢最重要的指标之一[23]。如图4所示,甜瓜呼吸强度分为3 个阶段:0~10 d,所有处理组和对 照组甜瓜的呼吸强度均呈下降趋势,且各处理组和对照组甜瓜之间没有明显差异,可能的原因是新采摘的甜瓜离体之后呼吸强度均减弱;10~18 d,所有处理组和对照甜瓜的呼吸强度均开始呈上升趋势,甜瓜果实进入采后呼吸跃变,在18 d时达到峰值。在相同贮存时间内,对照组甜瓜呼吸强度的速率均大于各处理组,采后甜瓜为呼吸跃变型果实,呼吸跃变在18 d左右(25 ℃),与马文平等[24]结论相一致;在第18~36天,甜瓜经过呼吸跃变之后,呼吸强度随着贮存时间的延长而一直呈下降趋势,在相同的时间内,处理组甜瓜的呼吸速率均比对照组的低。
2.5 复合物溶液对甜瓜可溶性固形物含量的影响
由图5可以看出,在0~10 d期间,除CHE-20处理组甜瓜外,其余处理组和对照甜瓜中可溶性固形物含量均呈现了上升趋势,这是由于绝大多数的甜瓜在采摘后,生理活动还持续一段活跃期。10~18 d,所有处理组和对照组甜瓜中可溶性固形物含量均呈现下降趋势,其中CHE-15及CHE-25处理组甜瓜下降比较缓慢,CH及对照组甜瓜可溶性固形物含量下降幅度相对较大。贮藏至30 d时,CHE-25、CHE-20、CHE-15、CH处理甜瓜中可溶性固形物含量为分别为0.109%、0.088%、0.080 8%及0.073 2%,对照组的甜瓜可溶性固形物含量仅为0.058 9%。结果表明,采用复合物溶液能延缓甜瓜消耗营养物质,有效控制甜瓜的呼吸强度,从而保持了甜瓜中可溶性固形物含量的较高水平。
2.6 复合物溶液对甜瓜可滴定酸含量的影响

图6 复合物溶液对甜瓜可滴定酸含量的影响(25 ℃)Fig.6 Effect of composite preservative treatments on titratable acidity of muskmelon at 25 ℃
糖酸比是衡量水果风味的一个重要指标,从甜瓜中可滴定酸含量的变化可以评价甜瓜口感风味[18]。在贮藏过程中,一部分酸用作呼吸底物被消耗,另一部分转化成糖[25-26]。因此,甜瓜果实中的可滴定酸含量随着贮藏时间延长而减少,保存越好的甜瓜,可滴定酸含量变化越小。由图6可知,处理组和对照组甜瓜的可滴定酸含量在前10 d有小幅度的增加,可能的原因是新采摘的甜瓜在高温条件下有一段迅速后熟过程,甜瓜中可滴定酸含量略微增加。在10 d后,对照组和处理组甜瓜的可滴定酸含量均呈下降趋势,处理组甜瓜的含量下降速度小于对照组,特别是CHE-25处理组甜瓜的可滴定酸含量下降幅度最小,速率最慢。CHE-25中核桃青皮提取物含量较高,抑菌性强,其含有的壳聚糖也厚度相宜,能够有效抑制甜瓜的呼吸强度,减少酸性物质的损失;CHE-20中核桃青皮提取物含量较少,与CHE-25相比,差异性不明显;CHE-15和CH相近,营养物质及有机酸消耗较多,保鲜效果较差。由此可见,采用CHE处理在有效降低甜瓜质量损失率和腐烂率、控制其呼吸率的基础上,能有效地延缓甜瓜酸性物质的消耗,从而保持了甜瓜中可滴定酸较高的含量。
2.7 复合物溶液对甜瓜相关酶活性的影响
2.7.1 复合物溶液对甜瓜PPO活性的影响
PPO活性与果实的褐变有关,在贮藏过程中常常把PPO活性看作果实色变衰老的一个指标[27]。从图7可看出,处理组和对照组甜瓜,在10 d前,PPO活性变化不明显,这是因为贮藏前期,甜瓜腐烂现象不明显,PPO活性保持不变。10~24 d内,所有处理组和对照组甜瓜果实中PPO在贮存期呈持续上升的趋势,且PPO活性在这个贮藏期变化幅度较大,其中CHE处理能较早的提高甜瓜PPO活性。此后,各处理组和对照组甜瓜中PPO活性开始变化幅度较为平缓,而且在相同贮藏期内所有复合物溶液处理组的甜瓜中PPO的活性均高于对照组。贮存至18~36 d时,所有处理组甜瓜中PPO活性显著高于对照组,这说明复合物溶液能较好地延缓PPO活性的下降。方差结果说明,第24天时,用CHE处理甜瓜的PPO活性显著高于对照组(P<0.05)。
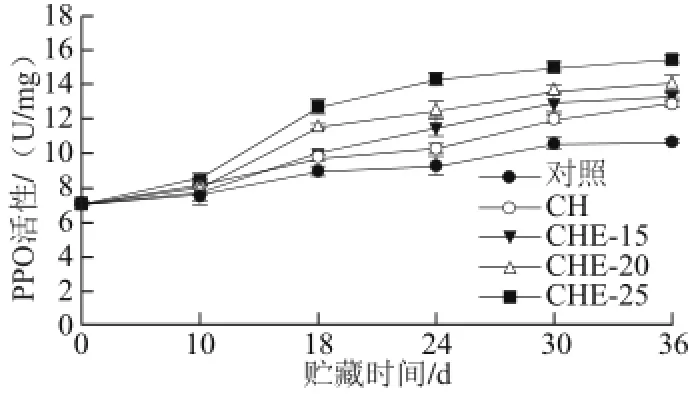
图7 复合物溶液对甜瓜PPO活性的影响(25 ℃)Fig.7 Effect of composite preservative treatments on PPO activity of muskmelon at 25 ℃
2.7.2 复合物溶液对甜瓜POD活性的影响
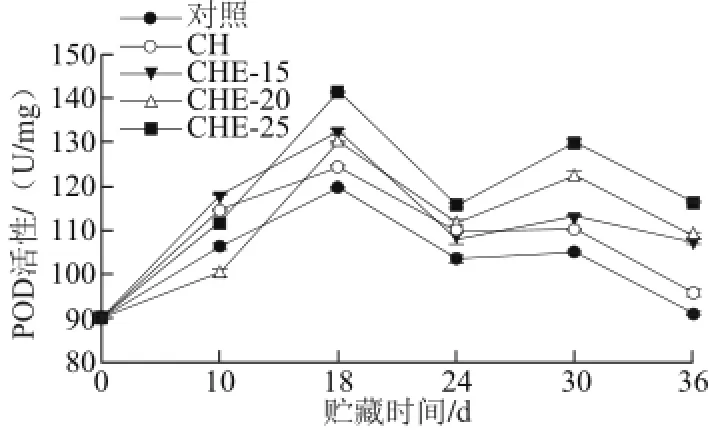
图8 复合物溶液对甜瓜POD活性的影响(25 ℃)Fig.8 Effect of composite preservative treatments on POD activity of muskmelon at 25 ℃
POD是活性较高的一种酶,它与呼吸作用、光合作用及生长素的氧化等都有关系[28],可作为组织老化的一种生理指标[29]。如图8所示,在0~18 d期间,处理组和对照组甜瓜的POD活性不断上升,在第18天, 对照组和处理组甜瓜POD活性出现了第一个高峰后开始下降,贮藏至30 d又出现一个高峰,表明甜瓜在36 d贮藏期间,POD有两个活性高峰。1~18 d的高峰,可能与新采摘的甜瓜后熟期及复合物溶液的诱导有关,在18 d时,处理组和对照组甜瓜POD活性差异显著(P<0.05),说明复合物溶液能有效提高POD的活性。在30 d的活性高峰,可能是贮藏后期甜瓜果实内生理调整引起的。各处理组甜瓜中的POD活性在36 d内均高于对照组,其效果依次为:CHE-25>CHE-20>CHE-15>CH,说明高质量浓度复合物溶液有利于甜瓜POD活性的提高,从而增强甜瓜的抗病性,这个结果与Oms-Oliu等[30]报道是一致的。
2.7.3 复合物溶液对甜瓜PAL活性的影响
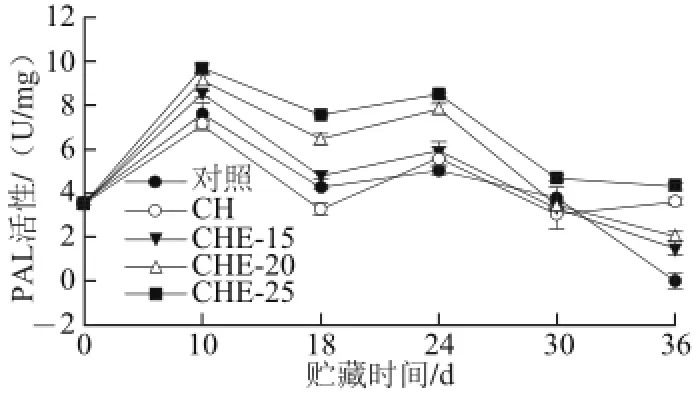
图9 复合物溶液对甜瓜PAL活性的影响(25 ℃)Fig.9 Effect of composite preservative treatments on PAL activity of muskmelon at 25 ℃
PAL是苯丙烷类代谢途径中关键酶和限速酶,在木质素和酚类物质的合成中起着重要作用[31]。如图9所示,处理组和对照组甜瓜在贮藏中PAL活性呈上升趋势,各处理组和对照组PAL活性在10 d时出现第1个高峰,其中以CHE-25处理甜瓜的PAL活性最高。在此后的贮藏时期内,各处理组及对照组甜瓜PAL活性均开始下降,在第24天时,出现了第2个活性高峰,可能的原因是甜瓜贮藏后期,腐烂现象严重,诱导PAL活性,使甜瓜的抗病性增强。在相同贮藏时间内CHE-25、CHE-20和CHE-15的PAL活性一直高于对照,24 d时,CHE-25和CHE20与对照组之间均有显著差异(P<0.05),其中CHE-25处理甜瓜中PAL活性最高,表明用复合物溶液处理甜瓜可以保持甜瓜PAL活性。
3 结 论
采用CHE处理能降低甜瓜的发病率和质量损失率,延缓果实硬度的下降,有效控制甜瓜的呼吸强度,延缓甜瓜营养成分的消耗,较好地保持了甜瓜中糖酸的含量。核桃青皮提取物中含有具有抗氧化性的多酚类和香豆素类天然抑菌素;壳聚糖富含抑菌成分,具有成膜效果,因此,核桃青皮提取物-壳聚糖复合物既可以防止微生物的侵害,又较好地保持了甜瓜果实的水分,具有一定的保鲜效果。
CHE涂膜处理有效降低甜瓜的发病率,同时减少了甜瓜果实内外的气体交换,因此减弱了甜瓜的呼吸作用,从而降低呼吸底物的消耗。通过PPO和POD活性的提高以及PAL活性的保持,说明复合物溶液能够减缓果实的褐变和组织的老化。综合比较,以CHE-25的保鲜效果最为显著。核桃青皮提取物可作一种天然保鲜剂应用于园艺产品采前和采后贮藏保鲜。
[1] 王吉德, 张旭龙, 刘瑞泉, 等. 新疆甜瓜保鲜技术的研究[J]. 食品科学, 2003, 24(6): 151-153. DOI:10.3321/j.issn:1002-6630.2003.06.040.
[2] ZHANG B Y, SAMAPUNDO S, POTHAKOS V, et al. Effect of high oxygen and high carbon dioxide atmosphere packaging on the microbial spoilage and shelf-life of fresh-cut honeydew melon[J]. International Journal of Food Microbiology, 2013, 166(3): 378-390. DOI:10.1016/j.ijfoodmicro.2013.08.002.
[3] 党娅, 张润光, 张有林, 等. 不同处理方式对厚皮甜瓜贮藏品质的影响[J]. 食品工业科技, 2015, 36(5): 311-314. DOI:10.13386/ j.issn1002-0306.2015.18.058.
[4] 马凌云, 赵亮. 涂膜保鲜剂中添加茶多酚对甜瓜贮藏品质的影响[J].食品工业, 2013, 34(12): 159-161.
[5] 白晓航, 齐红岩, 吕德卿. EFF和乙醇对采后薄皮甜瓜果实贮藏品质及相关生理指标的影响[J]. 食品科学, 2014, 35(14): 311-314. DOI:10.7506/spkx1002-6630-201414050.
[6] JUSTUS I, KUBOTA C. Effects of low temperature storage on growth and transplant quality of non-grafted and grafted cantaloupe-type muskmelon seedlings[J]. Scientia Horticulturae, 2010, 125(1): 47-54. DOI:10.1016/j.scienta.2010.02.020.
[7] 索绪斌, 高奎滨, 张云凌, 等. 高效液相色谱法测定青龙衣中胡桃醌含量[J]. 中草药, 2003, 26(11): 793. DOI:10.3321/ j.issn:1001-4454.2003.11.012.
[8] 张卫星, 何开泽, 蒲蔷. 核桃青皮提取物的抗菌和抗氧化活性[J]. 应用与环境生物学报, 2014, 20(1): 87-92.
[9] 刘艳, 方晨, 曹凯, 等. 新疆核桃青皮提取物抗氧化作用研究[J]. 食品工业, 2012, 33(9): 114-117.
[10] 王刚霞, 彭新媛, 吴忠红, 等. 核桃青皮提取物对几种采后病原真菌抑制作用的研究[J]. 食品工业科技, 2014, 35(10): 142-149. DOI:10.13386/j.issn1002-0306.2014.10.023.
[11] 丁存宝, 吴尚卓, 李桂秋, 等. 核桃青皮提取物的抑真菌活性研究[J].现代食品科技, 2013, 29(4): 722-725.
[12] FERNANDEZ-AGULL A, PEREIRA E, FREIRE M S, et al. Influence of solvent on the antioxidant and antimicrobial properties of walnut (Juglans regia L.) green husk extracts[J]. Industrial Crops and Products, 2013, 42: 126-132. DOI:10.1016/j.indcrop.2012.05.021.
[13] HONG K Q, XIE J H, ZHANG L B, et al. Effects of chitosan coating on postharvest life and quality of guava (Psidium guajava L.) fruit during cold storage[J]. Scientia Horticulturae, 2012, 144(6): 172-178. DOI:10.1016/j.scienta.2012.07.002.
[14] OMS-OLIU G, SOLIVA-FORTUNY R, MART N-BELLOSO O. Using polysaccharide-based edible coatings to enhance quality and antioxidant properties of fresh-cut melon[J]. LWT-Food Science and Technology, 2008, 41(10): 1862-1870. DOI:10.1016/ j.lwt.2008.01.007.
[15] OLIVEIRA I, SOUSA A, FERREIRA I C F R, et al. Total phenols, antioxidant potential and antimicrobial activity of walnut (Juglans regia L.) green husks[J]. Food and Chemical Toxicology, 2008, 46(7): 2326-2331. DOI:10.1016/j.fct.2008.03.017.
[16] WANG S Y, GAO H Y. Effect of chitosan-based edible coating on antioxidants, antioxidant enzyme system, and postharvest fruit quality of strawberries (Fragaria × aranassa Duch.)[J]. LWT-Food Science and Technology, 2013, 52(2): 71-79. DOI:10.1016/j.lwt.2012.05.003.
[17] 郑素慧, 葛清华, 车凤斌, 等. 气调贮藏不同温度对新疆骏枣干枣贮期品质及生理活性的影响[J]. 新疆农业科学, 2014(4): 620-626. DOI:10.6048/j.issn.1001-4330.2014.04.005.
[18] 李洁, 温昕晔, 张辉, 等. 一氧化氮对绿熟期和粉红期番茄采后抗氧化相关酶的影响[J]. 食品工业科技, 2014, 35(6): 329-333.
[19] LI W H, BI Y, GE Y C, et al. Effects of postharvest sodium silicate treatment on pink rot disease and oxidative stress-antioxidative system in muskmelon fruit[J]. European Food Research and Technology, 2011, 234(1): 137-145. DOI:10.1007/s00217-0 11-1611-9.
[20] LI R P, ZHANG H Y, LIU W M, et al. Biocontrol of postharvest gray and blue mold decay of apples with Rhodotorula mucilaginosa and possible mechanisms of action[J]. International Journal of Food Microbiology, 2011, 146(2): 151-156. DOI:10.1016/ j.ijfoodmicro.2011.02.015.
[21] LU L F, YE C Z, GUO S H, et al. Preharvest application of antagonistic yeast Rhodosporidium paludigenum induced resistance against postharvest diseases in mandarin orange[J]. Biological Control, 2013, 67(2): 130-136. DOI:10.1016/j.biocontrol.2013.07.016.
[22] SAFTNER R, LUO Y, MCEVOY J, et al. Quality characteristics of fresh-cut watermelon slices from non-treated and 1-methylcyclopropene- and/or ethylene-treated whole fruit[J]. Postharvest Biology and Technology, 2007, 44(1): 71-79. DOI:10.1016/j.postharvbio.2006.11.002.
[23] SANGSUWAN J, RATTANAPANONE N, RACHTANAPUN P. Effect of chitosan/methyl cellulose films on microbial and quality characteristics of fresh-cut cantaloupe and pineapple[J]. Postharvest Biology and Technology, 2008, 49(3): 403-410. DOI:10.1016/ j.postharvbio.2008.02.014.
[24] 马文平, 倪志婧, 任贤, 等. 贮藏温度对果实品质及生理的影响[J]. 安徽农业科学, 2011, 39(24): 1496-1500. DOI:10.3969/ j.issn.0517-6611.2011.24.165.
[25] SIPAHI R E, CASTELL-PEREZ M E, MOREIRA R G, et al. Improved multilayered antimicrobial alginate-based edible coating extends the shelf life of fresh-cut watermelon (Citrullus lanatus)[J]. LW T-Food Science and Technology, 2013, 51(1): 9-15. DOI:10.1016/ j.lwt.2012.11.013.
[26] SAYYARI M, CASTILLO S, VALERO D, et al. Acetyl s alicylic acid alleviates chilling injury and maintains nutritive and bioactive compounds and antioxidant activity during postharvest storage of pomegranates[J]. Postharvest Biology and Technology, 2011, 60(2): 136-142. DOI:10.1016/j.postharvbio.2010.12.012.
[27] YUAN L, BI Y, GE Y H, et al. P ostharvest hot water dipping reduces decay by inducing disease resistance and maintaining firmness in muskmelon (Cucumis melo L.) fruit[J]. Scientia Ho rticulturae, 2013, 161: 101-110. DOI:10.1016/j.scienta.2013.06.041.
[28] CHEN J L, ZHANG J, SONG L J, et al. Changes in microorganism, enzyme, aroma of hami melon (Cucumis melo L.) juice treated with dense phase carbon dioxide and stored at 4 ℃[J]. Innovativ e Food Science and Emerging Technologies, 2010, 11(4): 623-629. DOI:10.1016/j.ifset.2010.05.008.
[29] LAMIKANRA O, WATSON M A. Mild heat and calcium treatment effects on fresh-cut cantaloupe melon during storage[J]. Food Chemistry, 2007, 102(4): 1383-1388. DOI:10.1016/ j.foodchem.2006.05.060.
[30] OMS-OLIU G, ODRIOZOLA-SERRANO I, SOLIVA-FORTUNY R, et al. The role of peroxidase on th e antioxidant potential of freshcut ‘Piel de Sapo’ melon packaged under different modified atmospheres[ J]. Food Chemistry, 2008, 106(3): 1085-1092.
[31] 杨敏, 于立梅, 刘朝霞, 等. 贮藏温度对山竹果皮木质化相关酶活性和果肉腐烂的影响[J]. 食品科学, 2013, 34(18): 307-311. DOI:10.7506/spkx1002-6630-201318063.
Effect of Walnut Green Husk Extract and Chitosan Mxitures on the Postharvest Quality of Muskmelon during Storage
WEI Jia, MA Xiaofen, ATAWULA·Tiemur, WANG Gangxia, WU Bin*
(Institute of Food Storage and Processing, Xinjiang Academy of Agricultural Sciences, Ürümqi 830091, China)
In this study, the effect of walnut green husk extract and chitosan mixtures in three different proportions on the postharvest quality and physiology of muskmelon from Xinjiang autonomous, China was analyzed. The results showed the composite preservatives could decrease the decay index, weight loss rate and respiratory intensity of muskmelon, inhibit the reductions in total soluble solid content and titratable acidity, and increase polyphenol oxidase (PPO) and peroxidase (POD) activities during storage at 25 ℃ and 55%–60% relative humidity, while not significantly affecting fruits hardness. The CHE-25 treatment with walnut green husk extract at high concentration showed better performance in terms of postharvest quality and physiological factors, as well as enzyme activities. The CHE-25 could be the most suitable composite preservative for muskmelon storage. Walnut green husk extract as a potential natural compound can be uesd to control the postharvest quality of muskmelon.
walnut green husk; chitosan; muskmelon; storage; compounds
10.7506/spkx1002-6630-201604044
S652.1
A
1002-6630(2016)04-0242-07
魏佳, 马晓芬, 阿塔吾拉•铁木尔, 等. 核桃青皮提取液与壳聚糖复合物 对甜瓜采后品质的影响[J]. 食品科学, 2016, 37(4): 242-248. DOI:10.7506/spkx1002-6630-201604044. http://www.spkx.net.cn
WEI Jia, MA Xiaofen, ATAWULA·Tiemur, et al. Effects of walnut green husk extract and chitosan mxitures on the postharvest quality of muskmelon during storage[J]. Food Science, 2016, 37(4): 242-248. (in Chinese with English abstract)
DOI:10.7506/spkx1002-6630-201604044. http://www.spkx.net.cn
2015-06-10
“十二五”农村领域国家科技计划课题项目(2011BAD27B01-01-02)
魏佳(1981—),女,博士研究生,研究方向为应用化学。E-mail:327645095@qq.com
*通信作者:吴斌(1973—),男,副研究员,博士研究生,研究方向为农产品贮藏与加工。E-mail:xjuwubin0320@sina.com
