苦参碱诱导宫颈癌SiHa细胞凋亡的相关机制研究*
2016-11-11周美英魏林珍王海琳张爱笠甄洁玉
周美英 魏林珍 王海琳# 张爱笠 甄洁玉
(1甘肃省人民医院妇产科 兰州 730000;2甘肃中医药大学 兰州 730000)
论著
苦参碱诱导宫颈癌SiHa细胞凋亡的相关机制研究*
周美英1魏林珍1王海琳1#张爱笠2甄洁玉1
(1甘肃省人民医院妇产科 兰州 730000;2甘肃中医药大学 兰州 730000)
目的:观察苦参碱体外诱导宫颈癌SiHa细胞凋亡效应并对其可能的作用机制进行初步探讨。方法:将不同浓度(0.00、0.25、0.50、1.00、2.00 mg/ml)的苦参碱分别作用于体外培养的宫颈癌细胞,在不同时间点(24、48、72 h),采用MTT法检测细胞的增殖情况;采用Annexin-Ⅴ和PI双染法在流式细胞仪上检测细胞的凋亡率;采用Western blot检测细胞中凋亡相关蛋白Caspase-3的表达。结果:各组苦参碱对SiHa细胞的增殖均有抑制作用,MTT和流式细胞结果显示,不同浓度的苦参碱对细胞生长抑制率与对照组相比存在明显差异(P<0.05),呈剂量效应正相关及时间效应正相关。加入Caspase-3抑制剂Z-DEVD-FMK后,各组细胞凋亡率与只加苦参碱组相比凋亡率下降。Western blot检测结果显示Caspase-3蛋白水平随苦参碱浓度的提高而增加(P<0.05)。结论:苦参碱可诱导宫颈癌SiHa细胞的增殖,促进其凋亡,其作用机制可能与提高Caspase-3活性有关。
苦参碱;宫颈癌;细胞增殖;细胞凋亡;Z-DEVD-FMK;Caspase-3
对鼻咽癌、胃癌、视网膜母细胞瘤、上皮性卵巢癌和大肠癌等都有不同程度的诱导凋亡的作用[3]。苦参碱抗肿瘤机制较为复杂,具体的凋亡作用机制因细胞种类不同而异。目前,苦参碱对宫颈癌SiHa细胞的影响及分子机制尚未见报道。本研究拟观察苦参碱是否具有诱导宫颈癌SiHa细胞凋亡的效应,同时通过观察Caspase-3的变化情况,初步探讨苦参碱对SiHa细胞的作用机制,为苦参碱治疗宫颈癌的临床应用提供科学依据。
1 材料与方法
1.1 材料宫颈癌细胞株购自于兰州大学第一临床医学院科研中心;苦参碱购自宝鸡市方晟生物开
发有限公司(纯度98%);DMEM为Gibco公司产品;胎牛血清购自Hyclone公司;四单甲基偶氮唑蓝(MTT)、DMSO购自Sigma公司;细胞凋亡检测试剂盒(包括Annexin-Ⅴ-FITC,PI等)购自美国BioLegend公司;兔抗人Caspase-3抗体购自Sant Cruz公司;辣根过氧化物酶标记的羊抗兔IgG抗体为中山金桥公司产品;Caspase-3抑制剂Z-DEVD-FMK购于Sigma公司。
1.2 方法
1.2.1 细胞培养与药物配置将冻存的宫颈癌SiHa细胞37℃快速溶解,常规复苏和传代。细胞接种在含10%胎牛血清的DMEM培养基培养液中(含100 U/ml青霉素和100 U/ml链霉素),在37℃、5%二氧化碳培养箱中培养。细胞贴壁80%时传代,1周大约2次。苦参碱采用无血清DMEM配制成浓度为32 mg/ml储存液,0.22 μm一次性滤器过滤后,-20℃避光保存备用,使用时分别配为终浓度为0.25~2.00 mg/ml溶液。经前期预试验证实,25 μmol/L的Z-DEVD-FMK不影响肿瘤细胞增殖,但可显著减弱苦参碱诱导宫颈癌细胞的凋亡。
1.2.2 细胞增殖的测定(MTT法)分别取对数生长期SiHa细胞,以5 000个细胞接种到96孔板内,生长24 h后,加入不同浓度的苦参碱,分别为0.25、0.50、1.00、2.00 mg/ml,每个浓度设5个复孔,同时设置空白对照组、溶剂对照组和调零孔。分别培养24、48、72 h后,每孔加入新鲜配置的MTT溶液20 μl(浓度为5 g/L),37℃孵育4 h,弃上清,每孔加入DMSO 150 μl,水平振荡器振荡10 min(60次/min)后,用Multiskan MS ELISA reader(Labsysterms,Helsinki,Finland)在490 nm处检测吸光度值(OD值)。细胞抑制率(%)=(1-实验组A值/对照组A值)×100%,实验重复3次,取平均值。
1.2.3 流式细胞仪分析细胞凋亡率将1×105密度的对数生长期宫颈癌SiHa细胞,接种进25 cm2培养瓶中,培养24 h后,弃去旧培养液,实验组分别加入含不同药物浓度的苦参碱(0.5、1.0、2.0 mg/ml)干预,对照组加等量培养基。苦参碱作用24、48、72 h后,收集对照组和实验组细胞(数目1~5×106个/ml),预冷PBS洗涤2次,将细胞重悬于200 μl Binding Buffer中,加入10 μl AnnexinV一FITC和5 μl PI,轻轻混匀,室温避光孵育5 min,流式细胞仪检测凋亡率。另外,用25 μmol/L Caspase-3抑制剂Z-DEVD-FMK处理各组细胞1 h后,然后加入不同浓度苦参碱(0.5、1.0、2.0 mg/ml),24 h后观察各组凋亡率。流式细胞仪检测凋亡率,实验重复3次,取平均值。
1.2.4 Western blotting分析Caspase-3蛋白的表达
SiHa细胞经0.0、0.5、1.0、2.0 mg/ml浓度苦参碱处理24 h后,收集细胞提取蛋白,BCA法定量,12% SDS-PAGE凝胶电泳,蛋白上样量为40 μg,湿法转印至硝酸纤维素膜,5%脱脂奶粉溶于TBST液中封闭1 h,一抗(1∶500)4℃过夜,TBST洗5 min,3次,二抗(1∶2 000)室温孵育1 h,TBST洗5 min,3次,ECL系统显影,以β-actin为内参照。以上实验重复3次。
1.3 统计学方法应用SPSS16.0软件进行单因素方差分析及两个独立样本的t检验,实验结果以(±s)表示。
2 结果
2.1 苦参碱对人宫颈癌细胞增殖的影响不同浓度的苦参碱作用宫颈癌SiHa细胞不同时间后,MTT法检测抑制细胞增殖的作用结果见表1。随着苦参碱浓度的增加和作用时间的延长,SiHa细胞的数量逐渐减少,呈剂量和时间效应关系。实验结果表明,在0.25~2.00 mg/ml浓度范围的苦参碱对宫颈癌SiHa细胞具有抑制作用,与空白对照组比较,差异有统计学意义(P<0.05)。
表1 不同浓度苦参碱作用后各时点SiHa细胞生长抑制率比较(±s)
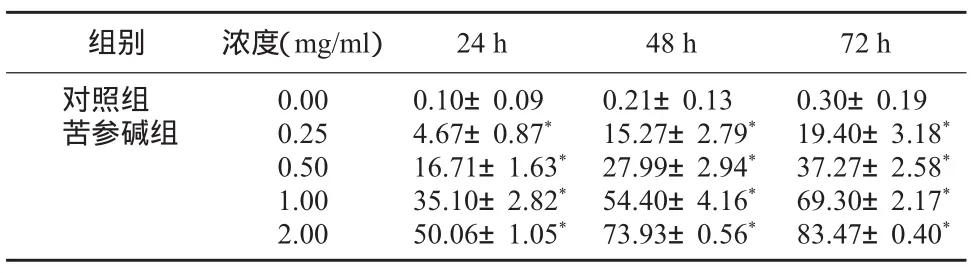
表1 不同浓度苦参碱作用后各时点SiHa细胞生长抑制率比较(±s)
注:与对照组比较,*P<0.05。
24 h48 h72 h 0.10±0.09 4.67±0.87*16.71±1.63*35.10±2.82*50.06±1.05*0.21±0.13 15.27±2.79*27.99±2.94*54.40±4.16*73.93±0.56*0.30±0.19 19.40±3.18*37.27±2.58*69.30±2.17*83.47±0.40*组别浓度(mg/ml)0.00 0.25 0.50 1.00 2.00对照组苦参碱组
2.2 苦参碱对宫颈癌SiHa细胞凋亡率的影响经流式细胞仪检测结果显示,苦参碱诱导SiHa细胞凋亡的作用随着作用时间的延长和给药剂量的增加,细胞凋亡率增高,且具有统计学意义(P<0.05)。其中,2.0 mg/ml的苦参碱作用72 h时SiHa细胞凋亡率最高为70.08%。见图1。0.5、1.0、2.0 mg/ml的苦参碱作用于SiHa细胞48 h后,SiHa细胞凋亡率分别为(7.42±0.43)%、(22.94±0.83)%、(39.34±0.74)%,空白对照组为(0.57±0.21)%。见图2。与空白对照组比较,随着苦参碱浓度的增强细胞晚期凋亡率增高。
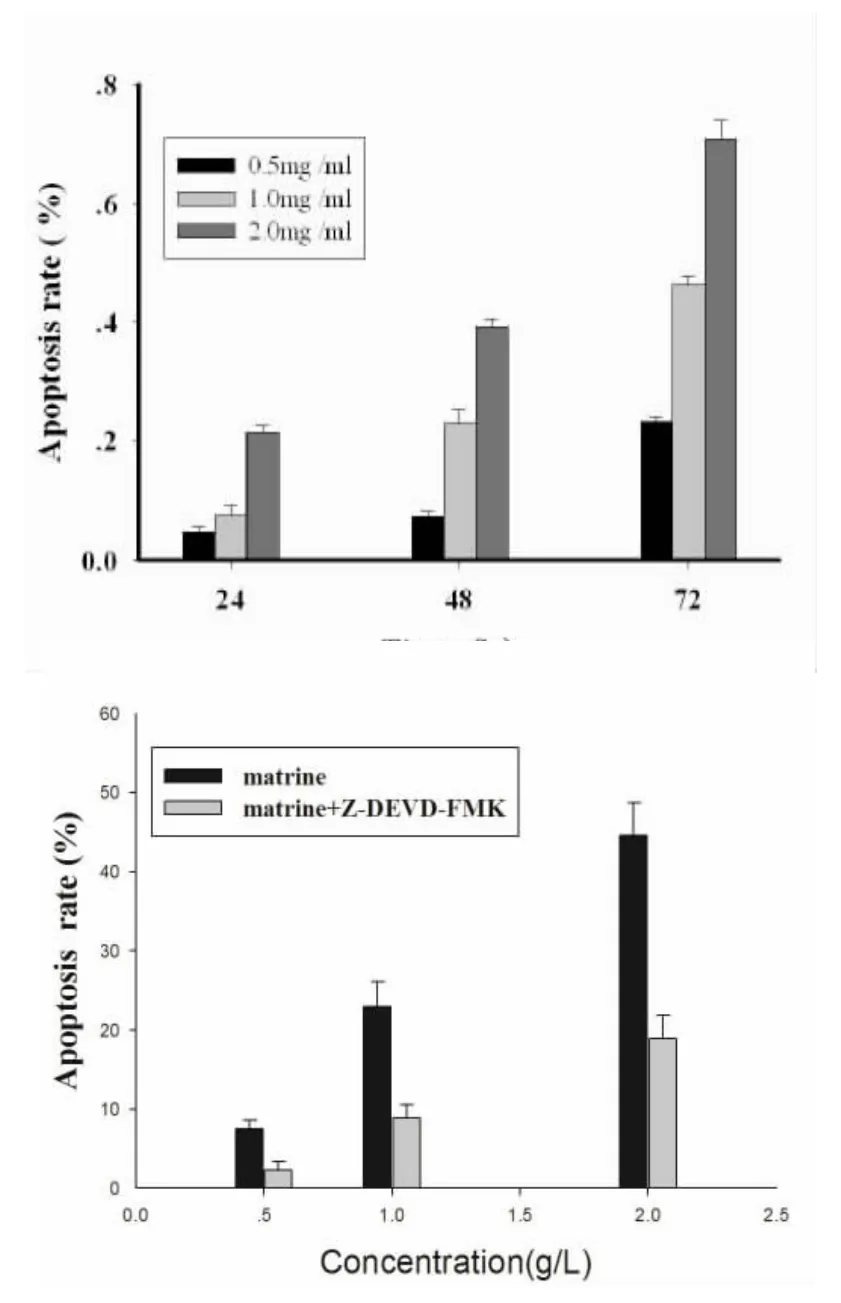
图1 AnnexinV2FITC/PI双标法检测苦参碱对宫颈癌细胞凋亡的影响

图2 苦参碱作用SiHa细胞48 h流式细胞术检测结果
2.3 苦参碱对SiHa细胞Caspase-3蛋白表达的影响对不同浓度的苦参碱处理后的SiHa细胞进行Caspase-3蛋白水平的检测中发现,随着苦参碱浓度的增加,细胞中Caspase-3蛋白水平也逐渐增加。见图3。对Western blot结果进行灰度扫描分析后,经β-actin内参的校正,结果发现,0.5、1.0、2.0 mg/ml的苦参碱处理后,细胞内的Caspase-3蛋白水平与对照组细胞比较,差异具有统计学意义(P<0.05)。见图4。

图3 不同浓度的苦参碱处理后的SiHa细胞进行Caspase-3蛋白水平的检测

图4 不同浓度的苦参碱处理后的SiHa细胞进行Caspase-3蛋白水平的检测(β-actin内参的校正)
3 讨论
宫颈癌是位居第二位危害妇女健康的恶性肿瘤,化疗是当前主要治疗手段之一。然而由于化疗药物的毒副作用及耐药性的产生,寻求新的高效、低毒的抗肿瘤药物成为科研工作者面临的新挑战。研究证实苦参碱对体内多种肿瘤具有明显抑制作用且未发现明显的不良反应,逐渐成为研究的焦点。
本研究发现不同浓度苦参碱(0.25、0.50、1.00、2.00 mg/ml)作用于宫颈癌SiHa细胞24、48、72 h后,抑制率与对照组比较差异均具有统计学意义,提示苦参碱抗肿瘤机制之一是抑制肿瘤细胞的增殖,且随着药物剂量的增加,作用时间的延长,抑制率增高。进一步应用流式细胞仪检测细胞凋亡,结果显示分别用苦参碱0.5、1.0、2.0 mg/ml作用于SiHa细胞24、48、72 h后,抑制率具有时间剂量依赖性。0.5、1.0、2.0 mg/ml的苦参碱作用于SiHa细胞48 h后,与对照组相比细胞晚期凋亡率明显增加,可见苦参碱诱导Siha细胞晚期凋亡率亦随着给药剂量的增加而增高,说明苦参碱能够同时诱导肿瘤细胞晚期凋亡,发挥其抗肿瘤作用。
目前,大多数学者认为凋亡相关基因的激活与肿瘤的增殖受抑相关,其中以Caspase家族最为关注[4~5]。Caspase为半胱氨酸天门冬氨酸蛋白酶的简称,是一组具有相似氨基酸序列的半胱氨酸蛋白酶,迄今已发现16个成员[6~7]。所有的Caspase均以无活性的酶原形式存在,一经激活将产生Caspase级联反应,最终导致细胞凋亡[8]。Caspase蛋白酶在组织分布及降解已知底物的功能上彼此有重叠现象,但在不同细胞或同一细胞受不同刺激诱发凋亡过程中,激活的Caspase不尽相同。但普遍认为该家族成员Caspase-3是哺乳动物细胞凋亡中的关键蛋白酶[9]。激活的Caspase-3能使许多与细胞结构、细胞周期及DNA修复等有关的蛋白或激酶失活,从而使细胞凋亡。本研究结果显示,0.5、1.0、2.0 mg/ml苦参碱分别作用SiHa细胞24 h,结果显示与对照组相比,随着药物浓度的增加,宫颈癌细胞Caspase-3蛋白表达量也增加(P<0.05),提示在苦参碱作用组中Caspase-3高表达,可使肿瘤细胞对凋亡更敏感,更易发生凋亡,这可能是苦参碱诱导细胞凋亡、发挥抗肿瘤作用的重要机制之一。流式细胞术结果显示苦参碱作用24 h后,不同浓度实验组细胞凋亡率均高于对照组(P<0.05),而用Caspase-3特异性抑制剂Z-DEVD-FMK预处理,均可使细胞凋亡率下降。进一步证实,苦参碱可通过激活Caspase-3的表达诱导SiHa细胞凋亡,发挥其抗肿瘤作用。
综上所述,苦参碱能抑制SiHa细胞的增殖而诱导凋亡,呈剂量时间依赖性。应用Caspase-3特异性抑制剂Z-DEVD-FMK预处理后,细胞凋亡率有所下降,但还存在凋亡。表明苦参碱能明显诱导体外培养宫颈癌细胞的凋亡,该作用可能通过激活Caspase-3的表达,除Caspase-3外,可能尚有其它凋亡通路被激活,值得进一步探讨。参考文献
[1]张丽华,陈邦恩,潘明佳.苦参碱药理作用研究进展[J].中草药,2009,40(6):1000-1003
[2]杨钰萍,沈祥春.氧化苦参碱药理作用的研究进展[J].中国医院药学杂志,2009,29(5):405-407
[3]熊小春,安春妹.苦参碱抗肿瘤研究概况[J].中国医药导报,2009,6(33):10-12
[4]LoMY,KimHT.Chondrocyte apoptosis inducedby hydrogen peroxide requires caspase activation but not mitochondrial pore transition[J].Journal of Orthopaedic Research,2004,22(5):1120-1125[5]Liang CZ,Zhang JK,Shi Z,et al.Matrine induces caspase-dependent apoptosis in human osteosarcoma cells in vitro and in vivo through the upregulation of Bax and Fas/FasL and downregulation of Bcl-2[J].Cancer Chemother Pharmacol,2012,69(2):317-331
[6]MarksN,BergMJ.Recentadvancesonneuronalcaspasesin development and neurodegeneration[J].Neurochem Int,1999,35(3):195-220
[7]Leist M,Jaattela M.Four deaths and a funeral:from caspases to alternative mechanisms[J].Nat Rev Mol Cell Biol,2001,2(8):589-598[8]Degterev A,Boyce M,Yuan J.A decade of caspases[J].Oncogene,2003,22(53):8543-8567
[9]Lakhani SA,Masud A,Kuida K,et al.Caspases 3 and 7:key mediators of mitochondrial events of apoptosis[J].Science,2006,311(5762):847-851
Effects of Matrine on Apoptosis of Human Cervical Cancer Cell SiHa and Its Mechanism
ZHOU Mei-ying1,WEI Lin-zhen1,WANG Hai-lin1#,ZHANG Ai-li2,ZHEN Jie-yu1
(1Department of Obstetrics and Gynecology,Gansu Provincial Hospital,Lanzhou730000;2Gansu University of Traditional Chinese Medicine,Lanzhou730000)
Objective:To observe the role of matrine(Mat)induced apoptosis of human cervical cancer SiHa cells and its mechanism.Methods:SiHa cells were exposed to the concentrations of matrine 0.00,0.25,0.50,1.00 and 2.00 mg/ml for 24,48,72 h.Cell proliferation was detected by MTT assay.Apoptosis was determined by double stained assay with Annexin-Ⅴand PI.Caspase-3 protein level was determined with western blot assay.Results:After SiHa cells were cocultured with matrine in vitro,the cell proliferation was inhibited in time and dose dependent manner.When the SiHa cells were cultured for 24,48,72 h by matrine 0.50,1.00,2.00 mg/ml,the total apoptosis rate was increased,which had ststistical significance compared with control group(P<0.05).The addition of the caspase-3 inhibitor Z-DEVD-FMK,the apoptotic rate and increase of matrine group decreased apoptosis rate.And the caspase-3 protein level increased with the increase of the concentration of matrine(P<0.05).Conclusion:Matrine can inhibit the proliferation and induce the apoptosis of SiHa cells in vitro,one of its possible mechanisms is that matrine increasing caspase-3 activity.
Matrine;Cervical cancer;Proliferation;Apoptosis;Z-DEVD-FMK,Caspase-3
R285.5
B
10.13638/j.issn.1671-4040.2016.08.001苦参碱(Matrine)是从中药苦参的干燥根中提取出的具有药理作用的一种中草药,其具有抗心率失常、抗动脉粥样硬化、解热镇痛、升高白细胞、抗炎杀菌、治疗乙型肝炎等作用[1~2]。随着研究深入,发现苦参碱还具有抑制肿瘤细胞增殖和诱导凋亡作用,
2016-06-23)
国家自然科学基金(编号:H1621);甘肃省自然基金(编号:1208RJZA109)
#通讯作者:王海琳,E-mail:wanghailinyx@163.com
