强的松增强HBV感染小鼠体内病毒复制表达
2016-11-11于毅刘凤君石瑶陆明娇魏小丽
于毅,刘凤君,石瑶,3,陆明娇,魏小丽
(1. 川北医学院附属医院感染科,四川 南充 637000;2 达州市人民医院感染科,四川 达州 635000;3.成都市第三人民医院内科,四川 成都 610000)
强的松增强HBV感染小鼠体内病毒复制表达
于毅1,2,刘凤君1,石瑶1,3,陆明娇1,魏小丽1
(1. 川北医学院附属医院感染科,四川 南充637000;2 达州市人民医院感染科,四川 达州635000;3.成都市第三人民医院内科,四川 成都610000)
目的:检测糖皮质激素对HBV感染小鼠体内HBV复制的作用。方法:采用高压注射体内转染法将HBV复制型重组质粒pAAV /HBV1.2导入雄性C57BL/6小鼠,转染后24 h按体重、年龄、血清HBeAg水平对小鼠进行配对,分为实验组和对照组,分别连续给予强的松或生理盐水灌胃。于第3天和第10天给药后4~6 h处死小鼠。采用Southern杂交检测小鼠肝脏HBV-DNA复制中间体;化学发光法检测血清中HBeAg和HBsAg。结果:对HBV感染小鼠连续给予强的松或生理盐水3 d后,所有小鼠肝脏中均可检测到较高水平的HBV-DNA复制中间体,给予强的松的实验组稍高于给予生理盐水的对照组,二者比值为1.127∶1;连续处理10 d后,实验组小鼠肝脏中HBV-DNA复制中间体的水平明显高于对照组,比值为2.534∶1。处理3 d后对照组和实验组小鼠血清HBsAg平均值分别为:1 618.28 μg/μL、1 666.23 μg/μL,实验组与对照组无明显差别;小鼠血清对照组和实验组HBeAg平均值分别为14.68μg/μL、14.95 μg/μL,实验组对照组无明显差别;处理10 d后对照组和实验组小鼠血清HBsAg平均值分别为:8 059.40 μg/μL、11 885.87 μg/μL,实验组高于对照组。小鼠血清对照组和实验组HBeAg平均值分别为183.15 μg/μL、286.14 μg/μL,实验组高于对照组。结论:强的松可增强HBV感染小鼠体内乙肝病毒的复制和表达,并且随着作用时间的延长,作用也越明显。本研究为糖皮质激素及引起HBV再激活的相关研究奠定基础,同时也再次提醒临床医生,应充分重视糖皮质激素的使用中HBV再激活的问题。
强的松;乙型肝炎病毒;复制;小鼠模型;高压注射体内转染法
乙肝病毒(hepatitis B Virus, HBV)感染是一个全球性的公共卫生问题,严重危害着乙肝患者的健康,在发展中国家尤为严重。据2006年我国流行病学调查结果显示,1~59岁的一般人群HBsAg携带率为7.18% ,5岁以下儿童的HBsAg携带率为0.96%[1-2]。据此估计,我国现有的慢性HBV感染者约9 300万人,其中慢性乙型肝炎患者约2 000万例[3]。
免疫抑制剂在临床医疗中被广泛应用,如在自身免疫性疾病、器官移植、肿瘤化疗、哮喘以及某些感染性疾病的治疗中具有不可替代的作用。然而,该类疾病患者中常有部分患者合并HBV感染。临床研究发现:使用免疫抑制剂可引起HBV感染者病毒再激活而引起肝功能损害,甚至出现肝功能衰竭[4-5]。在所有免疫抑制剂中,糖皮质激素是引起HBV再激活并导致肝脏损害的高危因素。通过两种机制可增强HBV的复制,一是抑制机体的免疫功能,二是直接激活HBV的转录和复制。但其激活HBV的具体机制以及如何引起肝脏损害的机制尚未完全阐明。本研究拟进行动物实验,检测糖皮质激素对HBV转录复制的影响进行体内研究,为上述机制的研究奠定基础。
HBV属于嗜肝DNA病毒家族,具有严格的宿主特异性。在有关HBV研究的动物模型中,HBV转基因小鼠已经成为HBV研究领域公认的模型[6],但是转基因小鼠的建立技术要求很高,价格昂贵且先天免疫耐受,难以应用HBV感染免疫学方面的研究。本研究小组曾通过高压尾静脉法将HBV复制型质粒pHBV4.1导入BALB/C小鼠建立了乙型肝炎病毒复制型小鼠模型,同时用该模型检测到临床多种抗病毒药物对HBV的抑制作用,但是该模型为一短期HBV感染模型,HBV复制表达的持续时间仅为10 d[7-9]。2006年台湾大学陈培哲等报道将腺相关病毒作载体的HBV复制质粒pAAV/HBV1.2通过高压尾静脉注射的方法导入C57BL/6品系小鼠,成功的建立了HBV慢性感染的小鼠模型。该小鼠模型体内HBV的复制表达可持续6个月以上,与人类慢乙肝患者极为相似[10]。本研究小组有幸得到陈培哲教授惠赠的pAAV/HBV1.2质粒,因此拟采用该质粒建立该HBV慢性感染小鼠模型,初步研究强的松对小鼠体内HBV的影响,为进一步研究奠定基础。
1 材料与方法
1.1主要材料
1.1.1实验动物雄性C57BL/6小鼠购自重庆滕鑫生物有限公司(SPF级),6~9周龄、体重20~22 g。
1.1.2实验材料重组质粒pAAV/HBV1.2由台湾医科大学微生物实验室陈培哲教授惠赠;质粒DNA 抽提纯化试剂盒Qiagen-Tip 500 购自QIAGEN 公司;蛋白酶、DNaseⅠ、鱼精DNA 等购自Sigma 公司;地高辛探针标记试剂和化学发光检测试剂盒购自Roche 公司;强的松购自浙江仙据制药股份有限公司(批号:110681)。
1.2实验方法
1.2.1质粒制备将pAAV/HBV1.2质粒DNA转化感受态大肠杆菌JM109, 扩增、提取及纯化采用QIAGEN TIP-500,操作按试剂盒说明书的程序进行。
1.2.2动物实验将质粒DNA10 μg用生理盐水稀释,注射液体的总量为小鼠体重的8%,采用高压尾静脉转染法将质粒导入小鼠体内(注射过程在5~8 s内完成)[7]。高压注射后24 h自小鼠眶静脉采血,检测血清HBeAg,按小鼠体重、年龄、血清HBeAg水平配对,分为试验组和对照组。实验组给予强的松200 μg(溶于200 mL生理盐水)灌胃,每日1次(该剂量由预实验所得,可以激活小鼠体内HBV的表达,又保证小鼠较高的存活率)。对照组给予同等剂量生理盐水灌胃。分别于第3天和第10天最后一次给药后4~6 h处死小鼠,留取小鼠的血清和肝脏。血清保存于-20 ℃,肝组织迅速置入液氮冷冻,然后-70 ℃保存。
1.2.3小鼠肝组织HBVDNA复制中间体的提取及检测分析 将冻存的肝组织在液氮中碾成粉末,用于提取HBV DNA复制中间体。取30 μL HBV DNA溶液以10 g/L的琼脂糖凝胶电泳,用Southern杂交检测HBV DNA复制中间体,杂交采用地高辛标记的全长HBV基因组。采用化学发光法检测杂交结果,具体操作按以前的方法进行[7]。将杂交结果的胶片经灰度扫描,用Quantity One 4.6软件对结果进行半定量分析。
1.2.4化学发光法检测小鼠血清HBV相关抗原分别取50 μL血清采用化学发光法检测HBV表面抗原(HBV surface antigen,HBsAg)和HBV e抗原(HBeAg),抗原的检测采用雅培i-2000自动化学发光免疫分析仪及配套试剂盒检测,具体操作按说明书进行。
2 结果
2.1强的松对小鼠体内HBV复制的影响
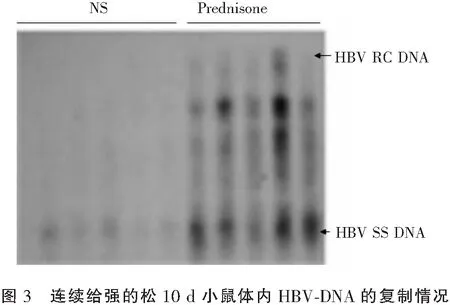
如图1和图2所示,对HBV感染小鼠连续给予强的松或生理盐水3 d后,所有小鼠肝脏中均可检测到较高水平的HBV 制中间体DNA,给予强的松的实验组稍高于给予生理盐水对照组,经 Quantitiy One分析,二者比值为1.127∶1(图1和图2)。而连续给予强的松或生理盐水10 d后,实验组小鼠肝脏中HBV 复制中间体 DNA 的水平明显高于对照组,为对照组的 2.534倍 (图3和图4)。

生理盐水(NS)为对照组,强的松(prednisone)为实验组; RC DNA (relaxed circular DNA)为双股链松弛环状DNA,SS DNA(single-strandde DNA)为单链DNA。


2.2强的松对小鼠体内HBV抗原表达的影响
2.2.1强的松处理3 d对小鼠体内HBV抗原标的影响如图5所示:处理3 d后对照组和实验组小鼠血清HBsAg平均值分别为:1618.28 μg/μL、1666.23 μg/μL,实验组与对照组无明显差别;实验组与对照组小鼠血清中HBeAg也无明显差别,其平均值分别为14.68 μg/μL、14.95 μg/μL。

2.2.2强的松处理10 d对小鼠体内HBV抗原标的影响给与强的松处理10 d后对照组和实验组小鼠血清HBsAg平均值分别为:8059.402 μg/μL、11885.868 μg/μL,实验组高于对照组。处理10 d后小鼠血清对照组和实验组平均值分别为183.15 μg/μL、286.136 μg/μL,实验组也高于对照组(图6)。

3 讨论
糖皮质激素的应用使免疫相关疾病的预后得到明显改善,而在这些患者中,常有部分存在HBV感染者未受到医生的重视而随着糖皮质激素的应用出现了HBV再激活,肝损导致原有治疗的中断,甚至出现肝衰竭死亡。早在1975年,Wands等[11]就首先报道20例患淋巴瘤、骨髓增殖性疾病合并HBV携带的患者在化疗时使用免疫抑制剂(特别是糖皮质激素)中出现HBV复发, 表现为肝功能急剧损伤,自此后渐渐引入了HBV再激活的概念。HBV再激活是指在化疗和(或)免疫抑制治疗期间,或紧随其后发生的HBV DNA定量升高10倍以上或其绝对值>109 copies/mL[12]。此后,国内外陆续有研究者相继报道,Cheng等[13]对非霍奇金淋巴瘤患者采用含激素与不含激素方案化疗,比较乙肝病毒激活发生率,结果提示含激素组HBV再激活发生率显著增高。谭竞等[14]回顾性分析了46例患有不同基础疾病但均需使用免疫抑制剂的HBV感染者的临床资料,发现不论其基础疾病如何,糖皮质激素及化疗药物(蒽环类、环磷酰胺等)均易引起HBV再激活,其中6例发生重症肝炎的患者均使用过糖皮质激素。陈彦帆等[15]研究者应用二值多元logistic回归模型对HBV再激活的高危因素进行了分析,发现使用激素与蒽环类是HBV激活的高危因素,这与Yeo 等[16]报道淋巴瘤、乳腺癌患者 HBV激活率高是由于这些肿瘤患者的化疗方案中一般都含有蒽环类和皮质类固醇类药物的理论相一致。以上资料均提示,糖皮质激素是HBV再激活并引起肝损的高危因素。
根据目前研究报道,关于免疫抑制剂及糖皮质激素引起HBV感染者肝脏损伤的机制的观点均支持免疫抑制剂先引起HBV载量升高,待免疫功能恢复后出现肝损。但这不能完全解释在应用糖皮质激素过程中,患者仍处于免疫抑制阶段发生的肝损,这还需要进一步研究。另外,为了避免肝损的出现,目前主张抗病毒治疗。关于给予抗病毒治疗的时间,多数人主张在使用免疫抑制剂前一周,但缺乏基础实验支持。而且能否将提前的时间缩短,尚无证据回答,而缩短的时间对某些疾病的疗效、预后可能具有非常重要的意义,这也需要研究进行探索。本研究拟在小鼠体内观察糖皮质激素对HBV复制的影响,为深入的研究奠定基础。
本研究通过对使用高压注射法建立的HBV感染小鼠模型进行研究发现,给予强的松处理后,小鼠血清中HBV载量和HBV抗原水平表达明显增高,且随着用药时间的延长,其增强作用愈明显。这提示强的松对HBV感染小鼠体内的病毒的复制、表达均有增强作用,且随着时间的延长,作用越明显。这与临床观察结果及很多文献报道一致。
总之,本研究在HBV感染小鼠体内检测到强的松对乙肝病毒的复制和表达的增强作用,且随着时间愈长增强作用愈明显,为糖皮质激素及其他免疫抑制剂引起HBV再激活的相关研究奠定基础。同时也再次提醒临床医生,尤其是非感染专业医生应充分重视糖皮质激素的使用中HBV再激活的问题。
[1]Liang X,Bi S,Yang W,etal.Epidemiological serosurvey of hepatitis B in China-declining HBV prevalence due to hepatitis B vaccination[J].Vaccine,2009,27(9):6550-6557.
[2]Liang X,Bi S,Yang W,etal.Evaluation of the impact of hepatitis B vaccination among children born during 1992-2005 in China[J].Infect Dis,2009,200(9):39-47.
[3]Lu FM,Zhuang H.Management of hepatitis B in China[J].Chin Med J (Engl),2009,122(9):3-4.
[4]Rossi G,Pelizzari A,Motta M,etal.Primary prophylaxis with lamivudine of hepatitis B virus reactivation in chronic HbsAg carriers with lymphoid malignancies treated with chemotherapy [J] .Br J Haematol,2001,115 (1):58-62.
[5]Yeo W,Chan PK,Zhong S,etal.Frequency of hepatitis B virus reactivation in cancer patients undergoing cytotoxic chemotherapy:a prospective study of 626 patients with identification of risk factors[J].Med Virol,2000,62(3):299-307.
[6]Larkin J,Clayton M,Sun B,etal.Hepatitis B virus transgenic mouse model of chronic liver disease[J].Nat Med,1999,5(8):907-912.
[7]Liu FJ,Liu L,He F,etal.Establishment and primary application of a mouse model with hepatitis B virus replication[J].World J Gastroenterology,2007,13(40):5324-5330.
[8]Gao Z,Liu FJ,Liu L,etal.Application of hepatitis B virus replication mouse model[J].World J Gastroenterology,2010,16(16):1979-1855.
[9]刘凤君,刘丽,蒋智, 等. 恩替卡韦抑制乙型肝炎病毒复制型小鼠体内病毒的复制[J].基础医学与临床,2009,29(10):1017-1020.
[10]Huang LR,Wu HL, Chen PJ,etal.An immunocompetent mouse model for the tolerance of human chronic hepatitis B virus infection[J].Proc Natl Acad Sci USA,2006,103(47):17862-17867.
[11]Wands JR,Chura CM,Roll FJ,etal.Serial studies of hepatitis-associated antigen and antibody in patients receiving antitumor chemotherapy formyeloproliferative and lymphoproliferative disorders[J].Gastroenterology,1975,68(5):105-112.
[12]贾继东.免疫抑制治疗与乙型肝炎病毒再激活[J].中华内科杂志,2006,45(6):443-444.
[13]Cheng AL,Hsiung CA,Su IJ,etal.Steroid-free chemotherapy decreases risk of hepatitis B virus(HBV)reactivation in HBV-carriers with lymphoma[J].Hepatology,2003,37(6):1320-1328.
[14]谭竞,魏锦,邹兴立.免疫抑制剂致乙肝病毒再激活的临床分析[J].临床内科杂志,2010,8(27):531-533.
[15]陈彦帆,韦燕,龚建忠.恶性肿瘤化疗与乙肝病毒再激活及相关高危因素的临床分析[J].实用癌症杂志,2012,27(1):45-47.
[16]Yeo W,Johnson PJ.Diagnosis,prevention and management of hepatitis B virus reactivation during anticancer therapy[J].Hepatology,2006,43(2):209-220.
(学术编辑:周仲辉)
Prednisone enhancing viral replication and expression in HBV transfection mice
YU Yi1,2,LIU Feng-jun1,SHI Yao1,3,LU Ming-jiao1,WEI Xiao-li1
(1.DepartmentofInfection,AffiliatedHospitalofNorthSichuanMedicalCollege,Nanchong637000;2.DepartmentofInfection,DazhouPeople′sHospital,Dazhou635000;3.InternalMedicine,TheThirdPeople′sHospitalofChengdu,Chengdu610000,Sichuan,China)
Objective:To detect the effect of glucorticoid on HBV replication of mice in vivo.Methods:HBV replication competent plasmid pAAV/HBV1.2 was transferred into male C57L/6 mice by hydrodynamics-based in vivo transfection.24 h after transfection,the mice were matched by body weight, age and serum level of Hepatitis B e antigen (HBeAg) and were divided into experiment group and control group,and then treated orally with prednisone or normal saline at interval of twenty four hours for 3 and 10 days.Four to six hours after the last administration, the mice were killed.HBV-DNA replication intermediates in liver were analyzed by Southern Blot Hybridization.The serum HBsAg and HBeAg were detected by chemiluminescent detection system. Results:HBV-DNA replication intermediates were detected in the livers of mice after treating orally with prednisone or normal saline for 3 days,the level of HBV-DNA replication intermediates of the experimental group was 0.127 times higher than that of the control group.However,after treatment for 10 days,compared with the control group of mice,the level of HBV-DNA replication intermediates of the experimental mice increased greatly.Quantitative analysis showed that prednisone enhanced the level of HBV-DNA replication intermediates appropriately 1.534 fold. Three days after the above treatment,the serum HBsAg of the control mice and the experimental mice were 1 618.28 μg/μL and 1 666.23 μg/μL on average respectively,which showed no significant difference.Similarly,there was no significant difference in the serum HBeAg,which showed as follows:14.68 μg/μL,14.95 μg/μL on average respectively.In contrast,10 days after the same treatment,the serum HBsAg of the control and the experimental of mice were on average 8 059.40 μg/μL,11 885.87 μg/μL,respectively,and the serum HBeAg were 183.15 μg/μL,286.14 μg/μL,respectively.Both of the level of serum HBsAg and HbeAg from experimental mice were higher than that of control animals.Conclusion:The replication and expression of hepatitis B virus in the HBV infection mice could be increased by prednisone orally and the increasing effect of prednisone on HBV is time-dependant,which provides further research about HBV reactivation caused by prednisone and other immunosuppressive drugs,and reminds clinicians,especially non-infected professional doctors to pay full attention to HBV reactivation when glucocorticoid is used in patients with HBV infection.
Prednisone;Hepatitis B virus;Replication;Mouse model;Hydrodynamics-based in vivo transfection
10.3969/j.issn.1005-3697.2016.03.013
四川省卫生厅项目(100150)
2015-08-09
于毅(1977-),男,硕士,主治医师。通讯作者:刘凤君,E-mail: lfj116@126.com
时间:2016-6-1617∶46
http://www.cnki.net/kcms/detail/51.1254.R.20160616.1746.026.html
1005-3697(2016)03-0331-05
R512.6
A
