产腈水解酶基因工程菌的产酶诱导条件及培养基优化
2016-11-11唐璐敏薛建萍
唐璐敏, 薛建萍
上海市农药研究所生物工程中心, 上海 200032
产腈水解酶基因工程菌的产酶诱导条件及培养基优化
唐璐敏, 薛建萍*
上海市农药研究所生物工程中心, 上海 200032
本文通过对产酶诱导条件及发酵培养基进行优化,成功提高了产腈水解酶基因工程菌E.coliBL21(DE3)-pETNYNit的产酶水平。研究结果显示,最佳发酵培养基为:葡萄糖0.2%、甘油0.7%(v/v)、蛋白胨1.2%、酵母膏0.8%、NaCl 0.3%、(NH4)2SO40.3%、NH4Cl 0.13%、Na2HPO4·12H2O 1.04%、KH2PO40.39%、MgSO4·7H2O 0.03%,pH 7.2。最佳产酶诱导条件为:发酵4 h时加入0.5 mmol/L IPTG,然后在28℃、240 r/min下诱导腈水解酶基因表达14 h~16 h。采用优化方案,重组菌产酶水平可提升至0.9~1×105U,与野生菌株的产酶水平相比,提高幅度超过50%。同时重组菌培养仅需 24 h,培养周期缩短超过50 h。
腈水解酶; 重组菌; 诱导优化; 培养基优化
天然腈化物在自然界中广泛存在,很多微生物具备转化腈化物的能力。微生物所产腈水解酶能将多种有机腈催化生成相应的有机酸,这些有机酸在工业、医药等领域具有很高的应用价值,因此近年来关于腈水解酶的研究倍受关注[1-4]。作者单位保藏的一株产腈水解酶菌株Arthrobacternitroguajacolicus可以转化羟基乙腈生产羟基乙酸,已在工业化羟基乙酸生产项目中应用,但与化学法生产羟基乙酸相比,产能优势尚不明显,因此希望通过提高菌株发酵产酶水平来进一步提升产能。研究发现,采用传统诱变方法难以继续提高该菌株的发酵产酶水平,因此开展A.nitroguajacolicus腈水解酶基因的克隆及表达研究,通过酶基因的克隆和异源超量表达来突破瓶颈,进一步提高产能。
作者已克隆到A.nitroguajacolicus的腈水解酶基因,构建了一株产腈水解酶基因工程菌E.coliBL21(DE3)-pETNYNit(以下简称为重组菌)[5,6],但重组酶基因在宿主胞内的表达水平远低于野生菌株的产酶水平,不能满足工业化应用的需求。
通过对该重组菌的酶基因诱导表达条件及发酵培养基配方进行优化,显著提高了重组菌的产酶水平,并缩短了培养周期,优化结果可应用于工业化生产。
在本文研究基础上,另一株基因工程菌E.coliBL21(DE3)-pETNYNitd[基于基因工程菌E.coliBL21(DE3)-pETNYNit改造并已申请专利(申请号201510995654.7)]的产酶水平有更大幅度的提高,用于转化羟基乙腈生产乙醇酸具有显著的竞争优势[7]。
1 材料与方法
1.1 材料
1.1.1 菌株
产腈水解酶野生菌株Arthrobacternitroguajacolicus由上海市农药研究所保藏;基因工程菌E.coliBL21(DE3)-pETNYNit由上海市农药研究所构建并保藏。
1.1.2 培养基
野生菌种子培养基(g/L):葡萄糖7.5、蛋白胨5、K2HPO40.5、KH2PO40.5、MgSO40.5,pH 7.0;发酵培养基(g/L):葡萄糖15、蛋白胨10、味精0.75、K2HPO40.5、KH2PO40.5、MgSO40.5、半胱氨酸盐酸盐0.15,pH 7.0。
重组菌种子培养基(g/L):葡萄糖5、蛋白胨10、NaCl 10、酵母膏5,pH 7.2。
氨苄抗性(Ampr)培养基:培养基中加入终浓度100 μg/μl的氨苄青霉素(Amp)。
1.1.3 主要试剂和仪器
异丙基-β-D-硫代半乳糖苷(简写IPTG)和氨苄青霉素钠(Amp)购自捷瑞生物工程(上海)有限公司;蛋白胨购自南通东海龙生生物制品有限公司,可用OXOID公司胰蛋白胨(tryptone)替代;酵母膏购自广东江门生物技术开发中心有限公司,可用OXOID公司酵母浸粉(yeast extract)替代;其他化学试剂均购自国药集团化学试剂有限公司。岛津气相色谱仪GC-2014购自上海纳锘实业有限公司。
1.2 方法
1.2.1 酶活测定
1 mL细胞液或发酵液加入0.05 mL丙烯腈,40℃下振荡反应5 min后加入0.08 mL浓HCl终止反应(反应液pH 1~2),然后在15 000 r/min下离心5 min,取上清液用气相色谱法测定丙烯酸含量。
酶活计算公式:C样品=C标样×A样品/A标样×60/t,其中C:浓度(μg/mL);A:峰面积;t:反应时间(min)。
酶活单位( U )定义:1 mL细胞液或发酵液反应1 h产生1 μg丙烯酸为1个酶活力单位。
1.2.2 菌浓测定
取0.2 mL适当稀释的菌液,10 000 r/min下离心2 min,沉淀部分用去离子水等体积重悬,以去离子水为对照测OD600。
1.2.3 菌体培养
1.2.3.1 野生菌培养
种子培养:28 ℃、220 r/min、24 h~48 h,以10%接种量转接入发酵培养基;发酵培养:28 ℃、220 r/min、48 h~72 h。
1.2.3.2 重组菌培养
斜面培养:37 ℃培养16 h~18 h;种子培养:37 ℃、240 r/min,培养4 h~6 h,至OD600为0.6~0.8,以3%接种量转接入发酵培养基;发酵培养:37 ℃、240 r/min下培养一定时间后加诱导剂IPTG,然后在28 ℃、240 r/min下进行酶基因的诱导表达。
1.2.4 重组酶基因的诱导表达条件优化
1.2.4.1 重组菌发酵培养生长曲线
重组菌发酵培养阶段每隔0.5 h~1 h取样测定OD600,绘制生长曲线。根据生长曲线确定诱导剂IPTG的加入时间点。
1.2.4.2 诱导因素优化
分别对IPTG浓度、IPTG加入时的菌株培养时间(以下简称培养时间),IPTG加入后诱导表达时间这三个因素进行全正交优化试验。放瓶菌液在10 000 r/min下离心5 min收集细胞,去离子水重悬细胞,再次离心收集细胞,再用1mL去离子水悬浮细胞(此细胞液与放瓶菌液相比浓缩了15倍),测定细胞液酶活。
各因素所取水平为IPTG终浓度 (mmol/L):0.10、0.25、0.50、0.75和1.00;培养时间(h):2.5、3.0、3.5、4.0、4.5、5.0、5.5、6.0和6.5(选取范围根据菌体生长曲线测定结果确定);诱导表达时间(h):7、15和20。
1.2.5 发酵培养基优化
通过3轮正交试验获得最佳发酵培养基配方。具体内容见结果与讨论部分。
2 结果和讨论
2.1 酶基因诱导表达条件优化
2.1.1 重组菌的生长曲线
重组菌的生长曲线如图1所示。从图中可以看出,2.5 h~5.5 h为菌体生长对数期,此后进入稳定期。2.5 h~6.5 h涵盖了菌体对数生长期和稳定期。
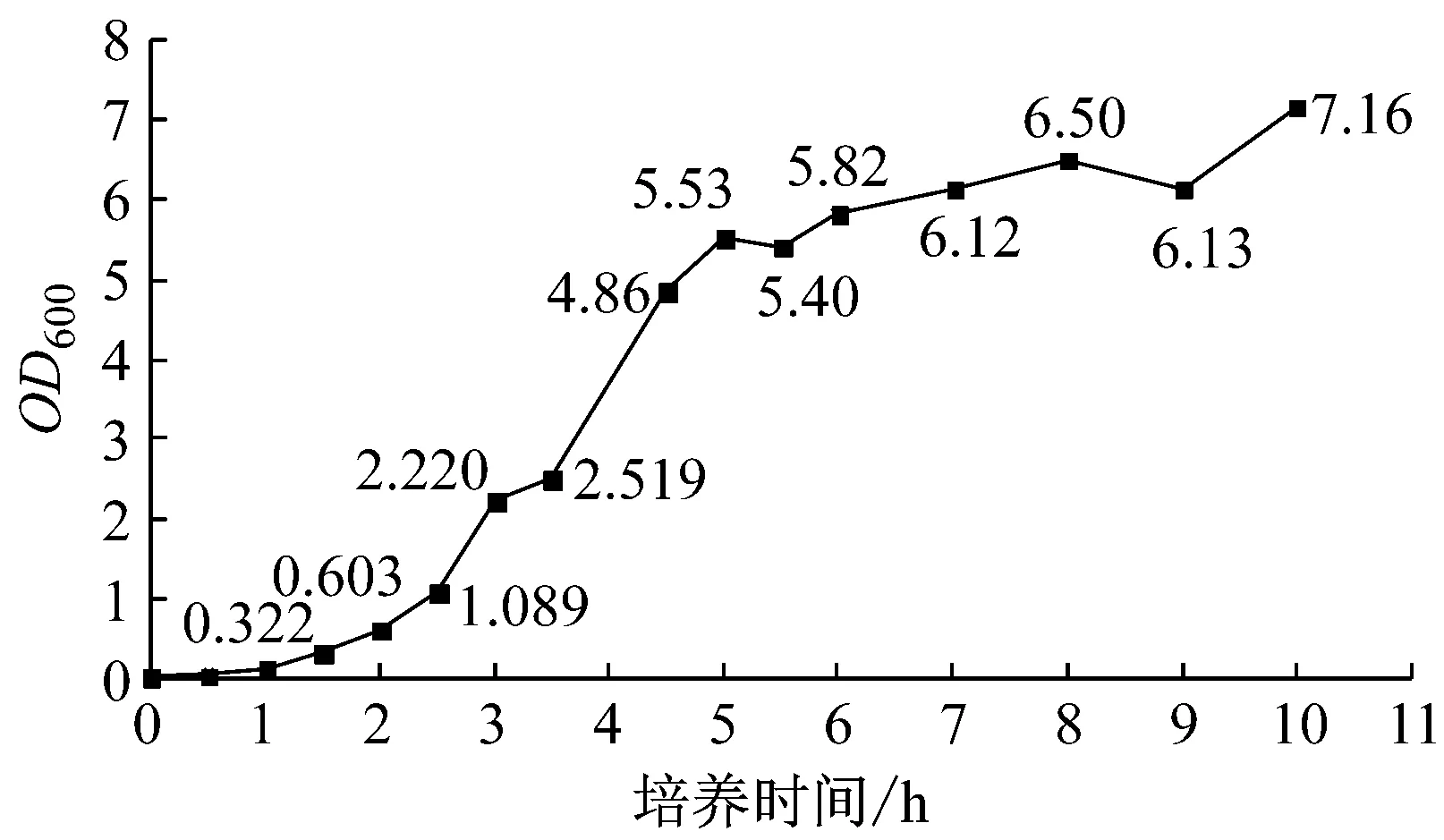
图1 E. coli BL21(DE3)-pETNYNit的生长曲线
2.1.2 诱导表达条件优化
按1.2.4.2的方法试验,酶活测定结果如表1所示。从表中可看出,在重组菌对数生长期的中后期至稳定期的初期加入0.5~1 mmol/L IPTG并诱导表达15 h的效果较好,其中培养5.5 h、加0.5 mmol/L IPTG诱导表达15 h,重组菌产酶水平最高,可达34 939 U,而野生菌株产酶水平在5~6×104U,相比仍有一定差距。
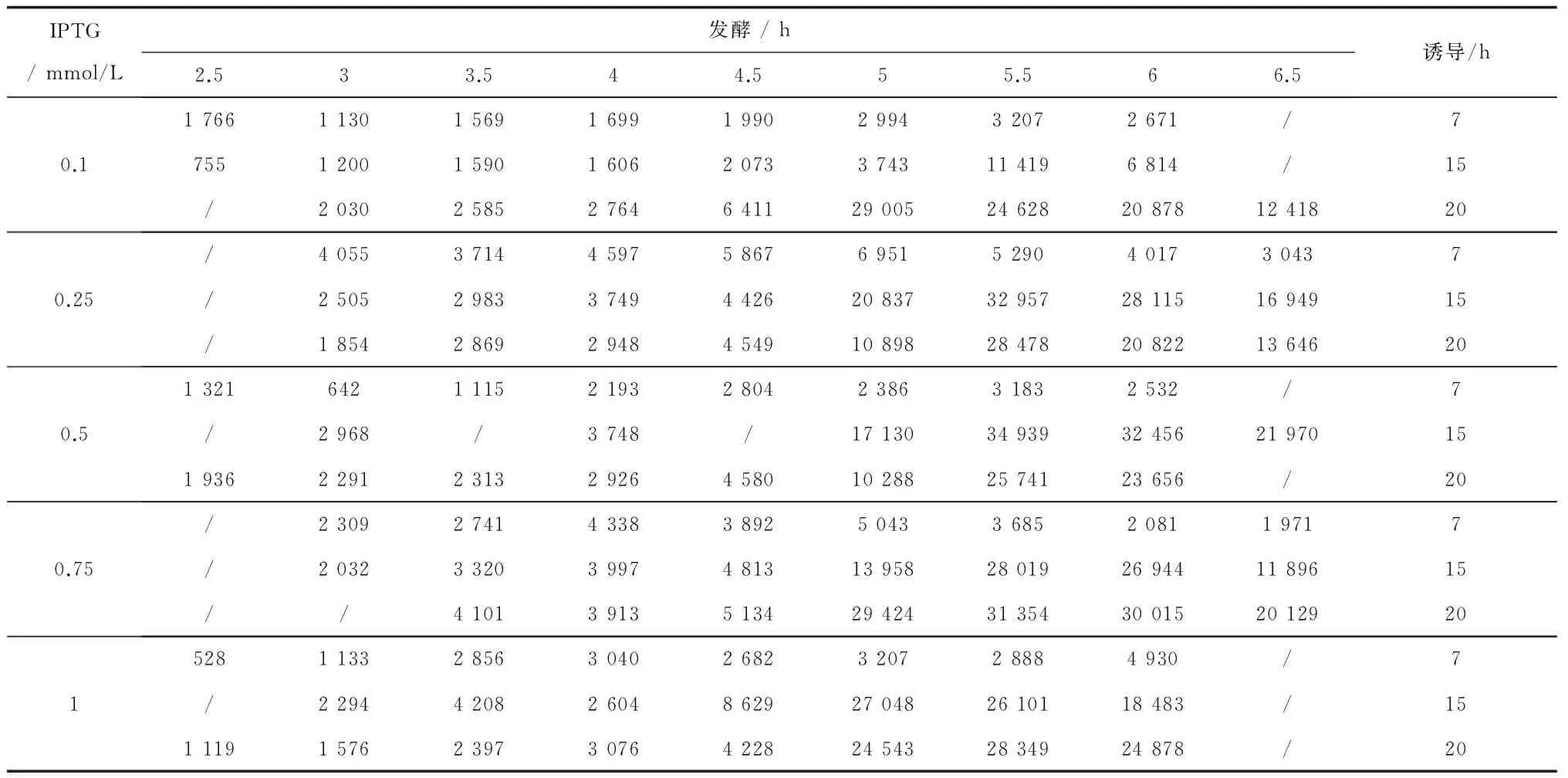
表1 重组腈水解酶的诱导表达条件优化
2.2 发酵培养基优化
2.2.1 正交试验一
据文献报道,以半复合培养基培养重组大肠杆菌可提高菌体细胞密度,培养基中所含无机盐如(NH4)2SO4、NH4Cl等有利于可溶性蛋白的合成[8]。
以重组菌种子培养基为基础培养基,对其中的碳源(葡萄糖)、氮源(蛋白胨、酵母膏)及无机盐(NaCl)配比进行优化,另外再加入组分(NH4)2SO4和10*M9 salt(10*M9 salt 为含NH4Cl 1%、Na2HPO4·12H2O 8%、KH2PO43%、MgSO4·7H2O 0.25%的盐溶液),进行3水平正交试验,培养基pH 7.2。试验设计见表2,采用L18(37)正交试验表共18个实验组。
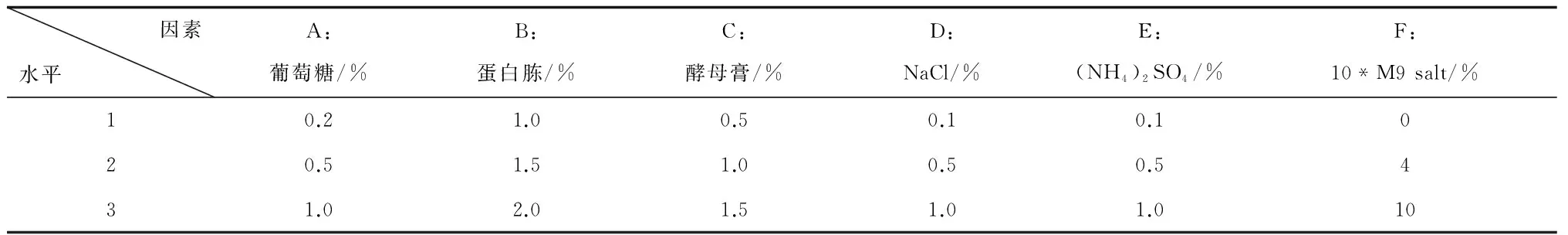
表2 正交试验一的因素和水平设计
注:10*M9 salt水平为v/v%,其他组分水平为w/v%。
先按1.2.3.2的方法培养种子液并转发酵,做重组菌在18组发酵培养基中的生长曲线 ,综合18组生长曲线走势,发酵培养3.5 h的重组菌处于对数生长中前期,4 h则处于对数生长于中后期。根据生长曲线,选定在转发酵培养3.5 h和4 h加IPTG(终浓度0.5 mmol/L),28 ℃、240 r/min诱导培养过夜(14 h ~16 h)。放瓶方法同2.1.2所述方法,转发酵培养3.5 h加IPTG的正交试验1-1结果及分析见表3、表4;转发酵培养4 h加IPTG的正交试验1-2结果及分析见表5、表6。
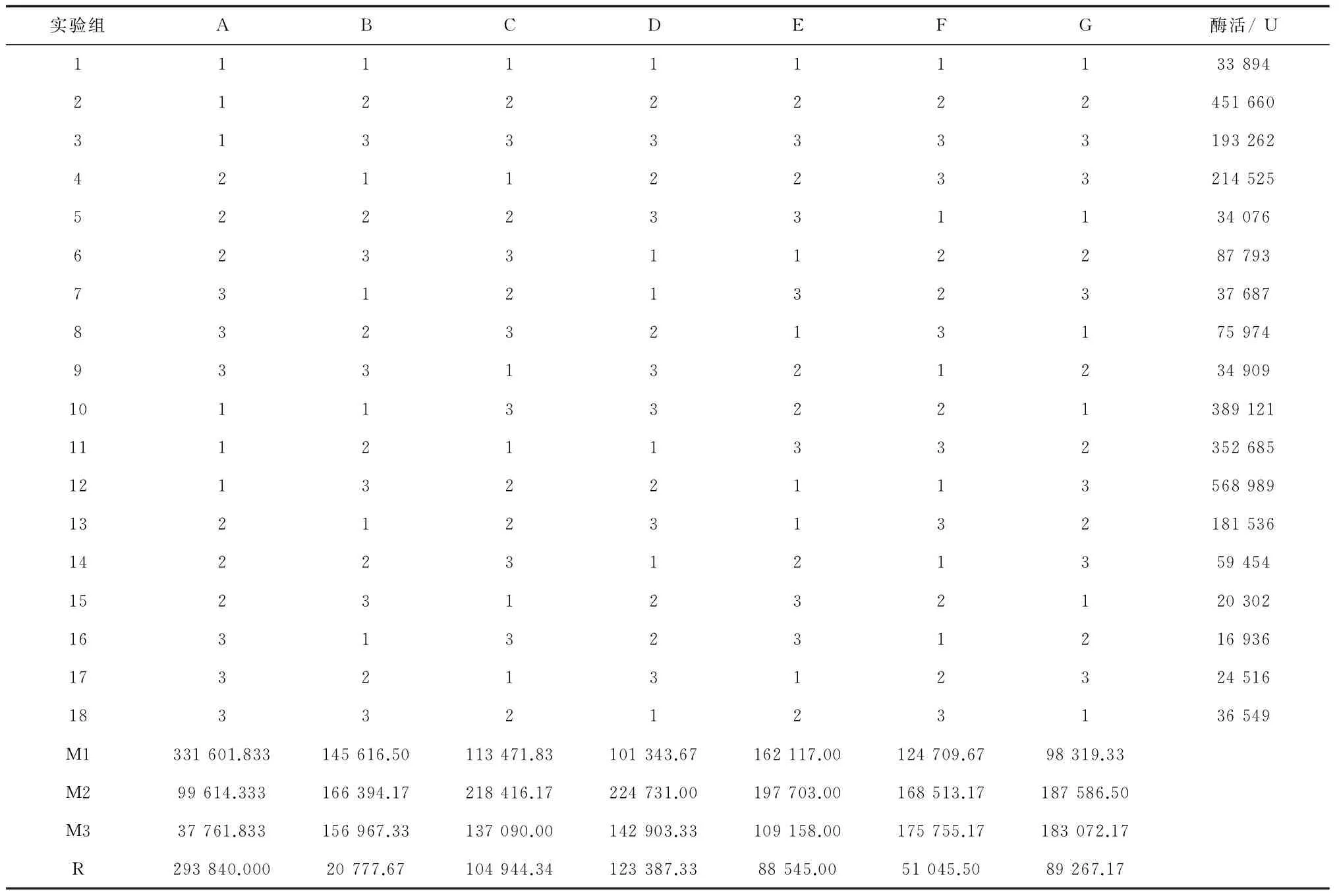
表3 正交试验1-1的结果
注:以上表格中的酶活数据未除以浓缩倍数,为浓缩15倍的酶活。
从正交试验1-1的方差分析结果表4看,葡萄糖(因素A)F值最高,为9.490,其他因素的F值都较低,当F0.05(2,2) = 19.00时各因素都无显著性影响,当F0.25(2,2) = 3.00时葡萄糖具有显著性影响。根据表3中的极差分析得到最佳发酵培养基(命名为Ⅰ-1)为:葡萄糖0.2%、蛋白胨1.5%、酵母膏1.0%、NaCl 0.5%、(NH4)2SO40.5%、10*M9salt 10% (v/v),pH 7.2。
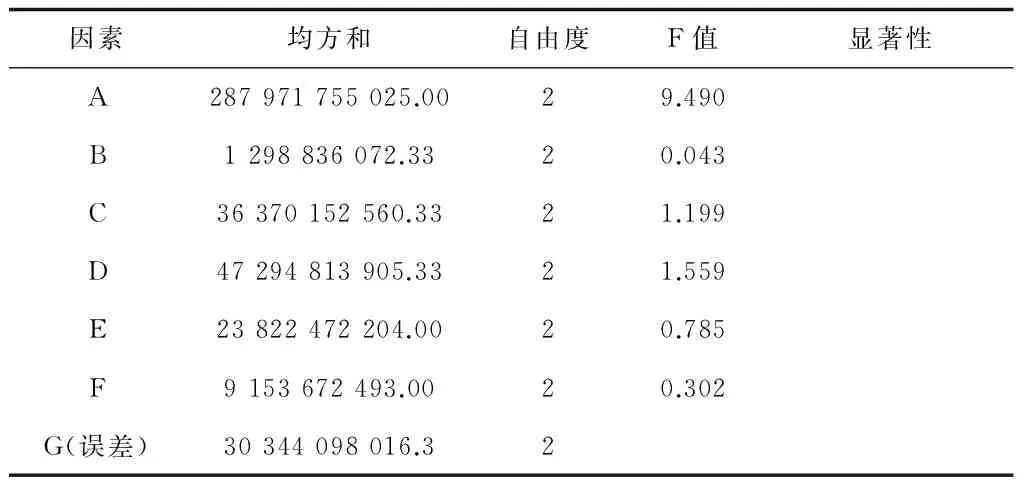
表4 正交试验1-1的方差分析结果
注:F0.05(2,2)=19.00,F0.01(2,2)=99.01,F0.25(2,2)=3.00,表中显著性以F0.05(2,2)为临界值。
从正交试验1-2的方差分析结果表5看,葡萄糖(因素A)F值最高,为44.343,而其他因素的F值都较低,当F0.05(2,2)=19.00时葡萄糖具有显著性影响。根据表6极差分析得到最佳发酵培养基(命名为Ⅰ-2)为:葡萄糖0.2%、蛋白胨1.0%、酵母膏1.0%、NaCl 0.5%、(NH4)2SO40.5%、10*M9salt 10% (v/v),pH 7.2。
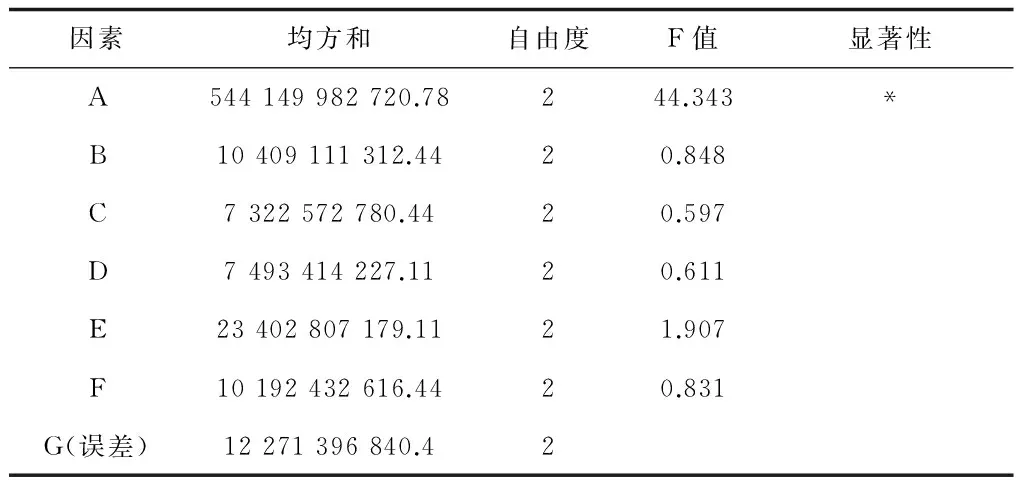
表5 正交试验1-2的方差分析结果
注:F0.05(2,2)=19.00,F0.01(2,2)=99.01,F0.25(2,2)=3.00,表中显著性以F0.05(2,2)为临界值。
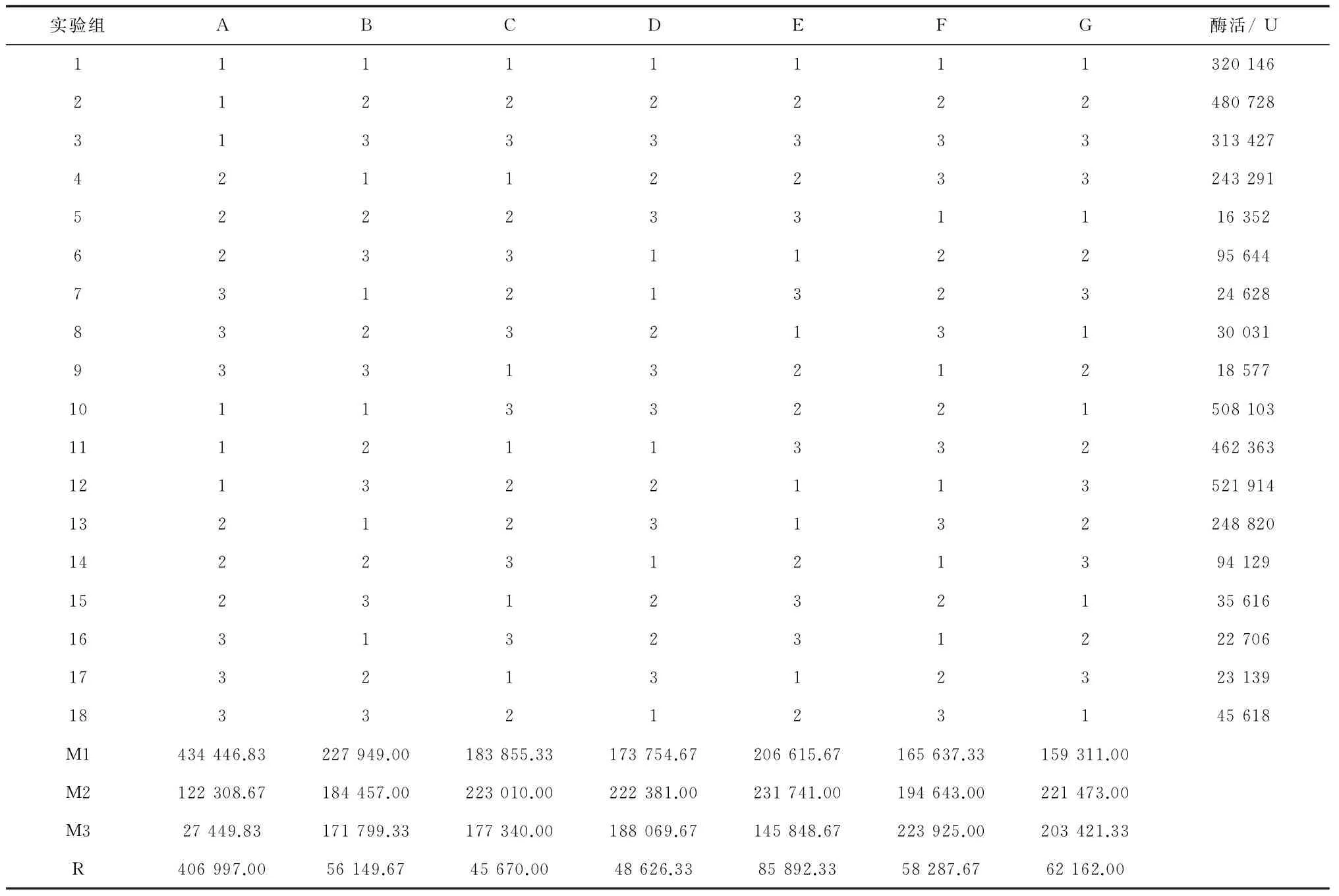
表6 正交试验1-2的结果
注:以上表格中的酶活数据未除以浓缩倍数,为浓缩15倍的酶活。
Ⅰ-1、Ⅰ-2培养基在蛋白胨含量上有区别,前者为1.5%,后者为1.0%,再次以Ⅰ-1、Ⅰ-2培养基为发酵培养基进行一次实验,每组培养基都分别于转发酵培养3.5 h和4 h加IPTG(终浓度0.5 mmol/L),进一步验证正交试验结果,同时做对照组(发酵培养基配方与种子培养基配方相同),结果见表7。
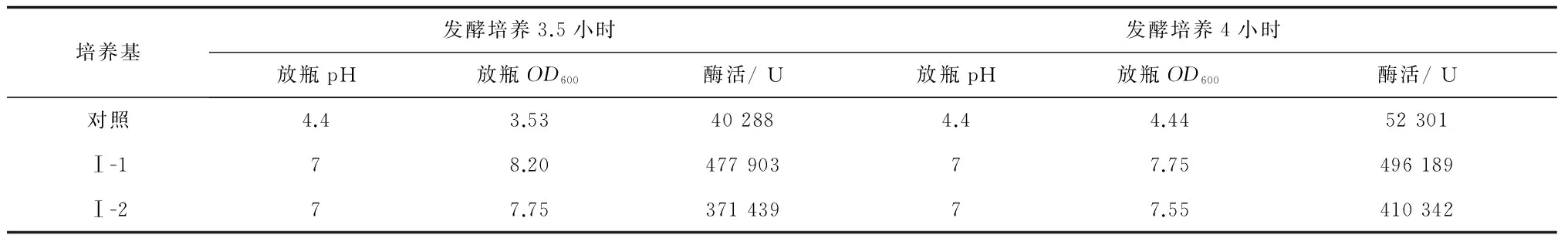
表7 3种发酵培养基的比较
注:表格中的酶活数据未除以浓缩倍数,为浓缩15倍的酶活。
根据表7的结果,正交试验一得到的发酵培养基Ⅰ-1为最优培养基,其组分为:葡萄糖0.2%、蛋白胨1.5%、酵母膏1.0%、NaCl 0.5%、(NH4)2SO40.5%、10*M9 salt 10% (v/v),pH 7.2。使用此培养基时,重组菌培养条件为:37 ℃、240 r/min种子培养至OD600为0.6~0.8,以3%接种量转发酵;37 ℃、240 r/min发酵培养4 h加入IPTG,IPTG终浓度为0.5 mmol/L;28 ℃、240 r/min诱导培养14 h~16 h。
2.2.2 正交试验二
以发酵培养基Ⅰ-1为基础,进行第二轮发酵培养基优化。从正交试验一的实验结果看,葡萄糖浓度 >0.2%时重组菌的酶活明显降低,原因可能是作为常用碳源的葡萄糖,其含量对大肠杆菌生长有显著影响,存在明显的葡萄糖效应。葡萄糖浓度过高会抑制大肠杆菌的生长。而碳源是菌体产酶必需的营养元素,0.2%的葡萄糖含量无法满足此需求(一般产酶细菌的发酵培养基中葡萄糖含量为1%~2%),在无法以葡萄糖为碳源的情况下,采用一些非快速利用的碳源来替代葡萄糖。
甘油是一种常见的非快速利用的碳源,在Ⅰ-1培养基中加入不同量的甘油,考察重组菌放瓶发酵液的酶活。培养方法同2.2.1所述最优方法,放瓶发酵液直接按酶活测定方法测酶活,结果见表8。
从表8结果可看出,发酵培养基中加入甘油有助于菌体量及酶活的提高,将甘油与正交试验一中除葡萄糖外的其他组分一起进行正交试验,进一步细化正交试验一各组分的水平,缩小各因素水平范围,培养基中0.2%葡萄糖为确定组分。正交试验采用L18(37),试验设计和结果如表9、10、11所示。
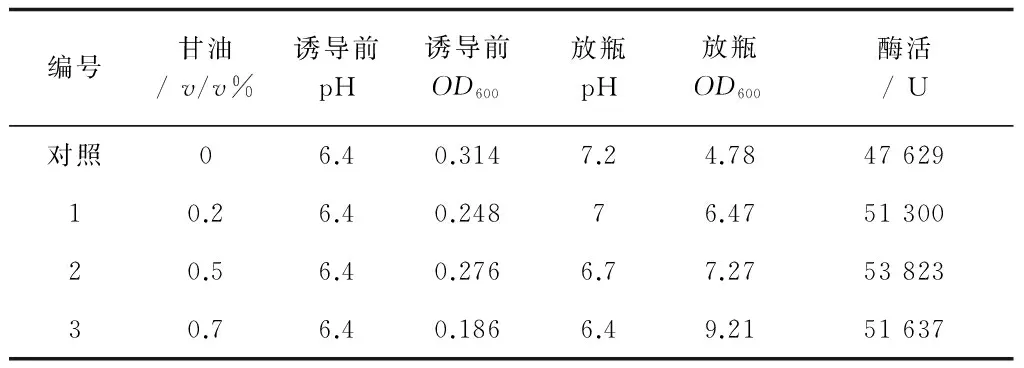
表8 甘油对重组菌发酵的影响
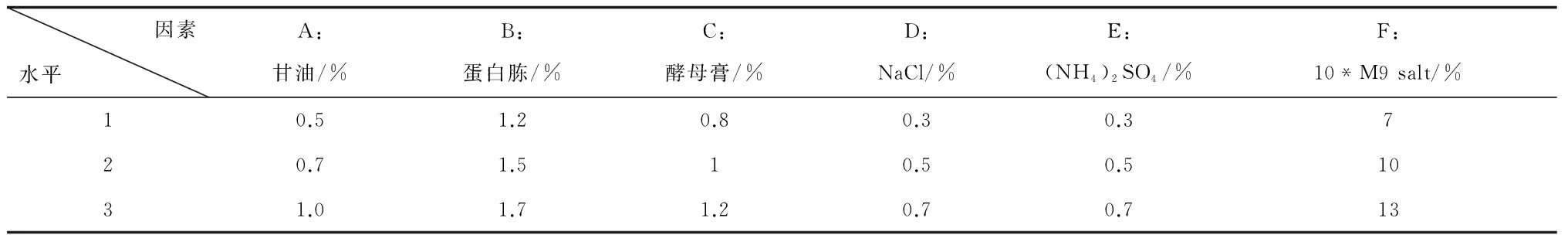
表9 正交试验二的因素和水平设计
注:10*M9 salt水平为v/v%;甘油配成10%(v/v)的溶液,按表中体积百分比加入培养基中;培养基中其他组分水平为w/v%。
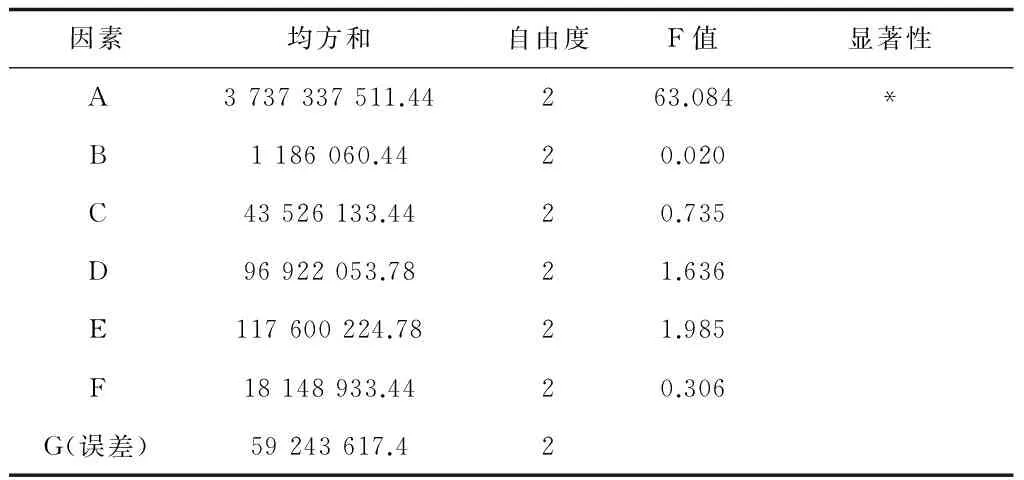
表10 正交试验二的方差分析
注:F0.05(2,2)=19.00,F0.01(2,2)=99.01,F0.25(2,2)=3.00,表中显著性以F0.05(2,2)为临界值。
从表10看,甘油为显著影响因素,与试验前所做碳源对产酶的重要性分析相符。
在表11的极差分析中,甘油的均值M1(对应水平0.5%)与均值M2(对应水平0.7%)相近且明显高于均值M3(对应水平1.0%),需做进一步试验确定。其他各组分的M1、M2和M3值都很接近。蛋白胨各水平的均值很接近。考虑到氮源浓度不易过高,以保证培养基的碳氮比适中及控制培养基成本,选用蛋白胨1.2%。10*M9 salt各水平均值接近,呈现出谷形走势而不是峰形走势,选用两端水平点7%和13%做进一步试验确定。除了需进一步确定的因素水平(甘油0.5%或0.7%、10*M9 salt 7%或13%)外,根据极差分析结果确定其他培养基组分为:葡萄糖0.2%、蛋白胨1.2%、酵母膏0.8%、NaCl 0.3%、(NH4)2SO40.3%,pH 7.2。
将需要确定的两个因素的两个水平相互组合,加入已确定的培养基组分配制成以下4组培养基,试验设计和结果见表12、13。
从表13结果看,Ⅱ-1为最佳培养基:葡萄糖0.2%、甘油0.7% (v/v)、蛋白胨1.2%、酵母膏0.8%、NaCl 0.3%、(NH4)2SO40.3%、10*M9 salt 13% (v/v),pH 7.2。将10*M9 salt中各组分拆分换算得到各组分含量:NH4Cl 0.13%、Na2HPO4·12H2O 1.04%、KH2PO40.39%、MgSO4·7H2O 0.03%。
2.2.3 正交试验三
将发酵培养基Ⅱ-1中10*M9 salt的各组分拆分,进行第三轮正交试验优化。同时加入在第二轮优化结果中显示具有显著影响性的甘油,培养基中其他组分为葡萄糖0.2%、蛋白胨1.2%、酵母膏0.8%、NaCl 0.3%、(NH4)2SO40.3%,pH 7.2。试验设计见表14,采用正交试验表L18(37)。培养方法同2.2.1所述最优方法,放瓶发酵液直接按酶活测定方法测酶活,试验结果及分析见表15、16。
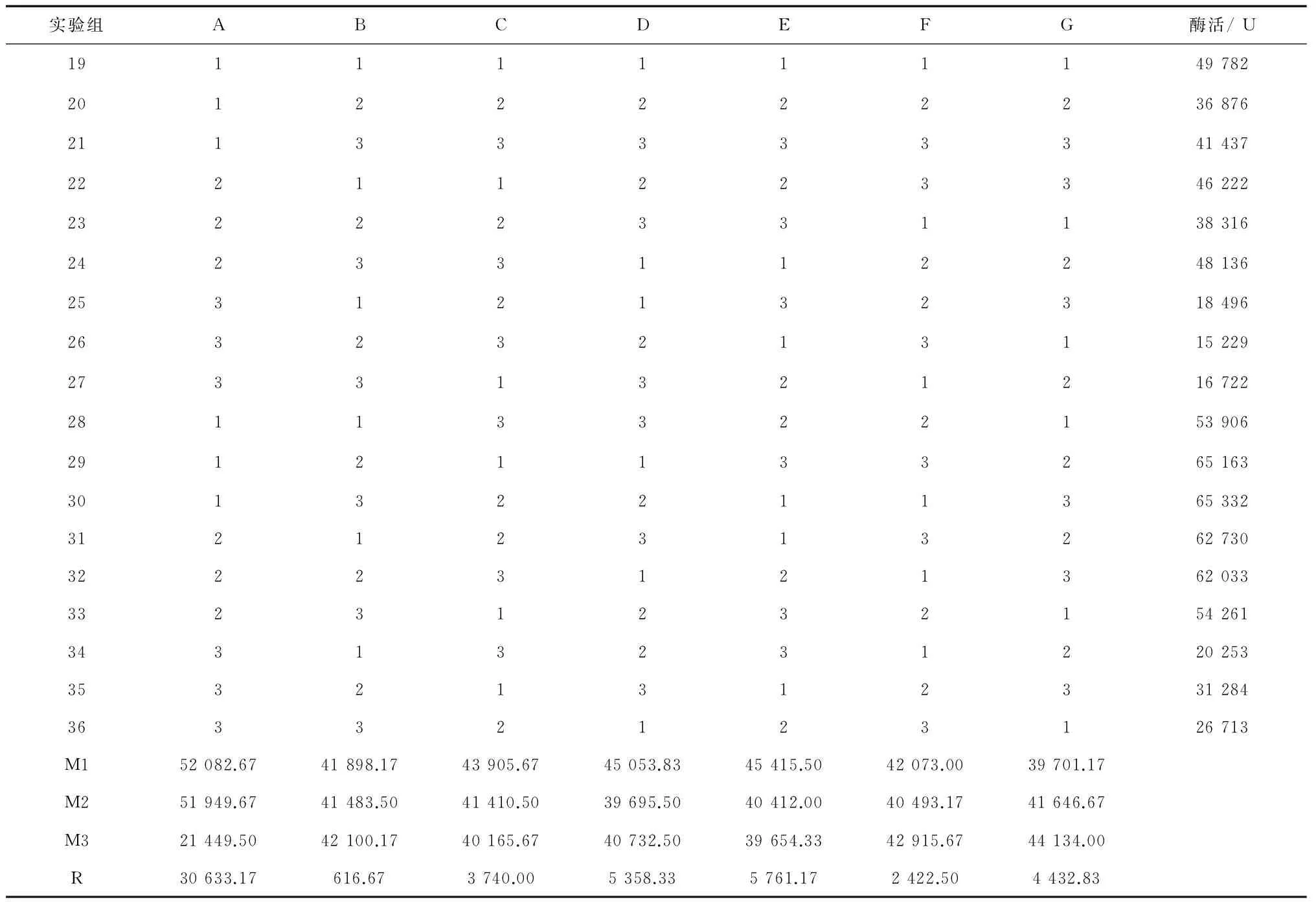
表11 正交试验二的结果
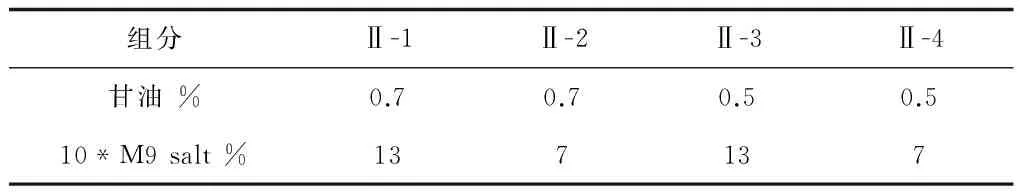
表12 甘油及M9 salt组分含量的确定
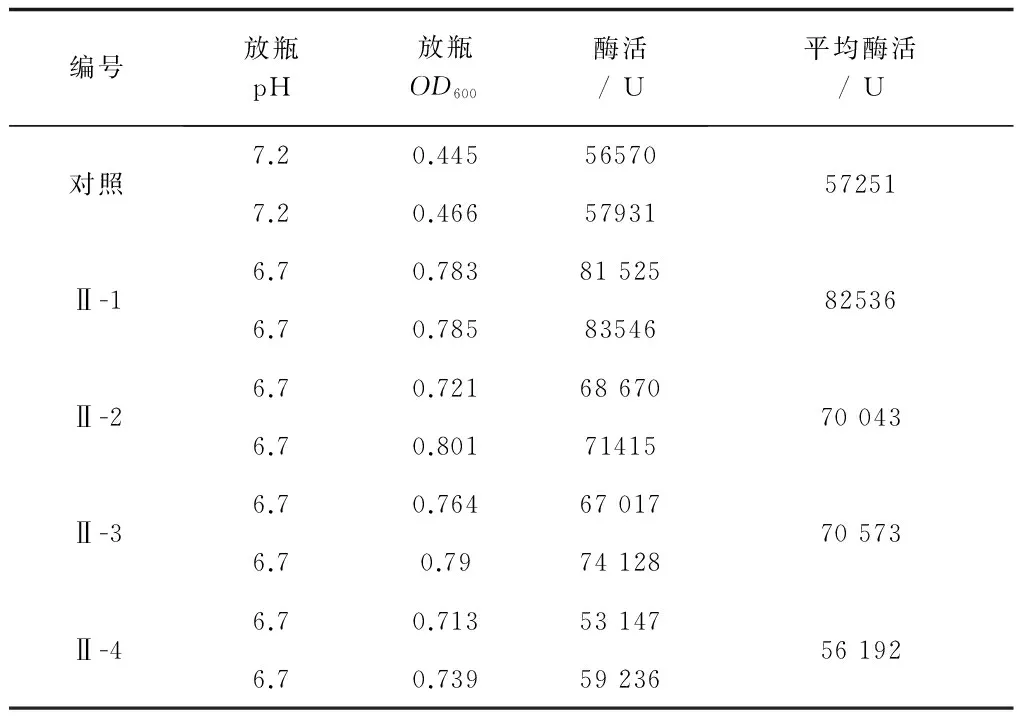
表13 甘油及M9 salt组分含量确定的试验结果
注:对照为不加甘油。
从表16可看出,各因素的F值都较低,当F0.25(2,2)=3.00和F0.05(2,2)=19.00时都不具有显著性影响。根据表15的极差分析得到最佳发酵培养基(命名为Ⅲ-1)为葡萄糖0.2%、甘油0.5% (v/v)、蛋白胨1.2%、酵母膏0.8%、NaCl 0.3%、(NH4)2SO40.3%、NH4Cl 0.15%、Na2HPO4·12H2O 1.5%、KH2PO40.8%、MgSO4·7H2O 0.1%,pH 7.2。
将培养基Ⅱ-1和Ⅲ-1作为发酵培养基进行比较,试验结果见表17。
表17结果显示,Ⅱ-1和Ⅲ-1的发酵产酶效果相近,在无机盐使用量上后者明显高于前者,增加了原料成本,因此仍选Ⅱ-1为最佳培养基。
2.2.4 水质实验
以上发酵培养基优化试验中都是用去离子水配制培养基,为了适应工业化生产,改用自来水配制培养基。用去离子水和自来水分别配制以上优化试验获得的Ⅱ-1和Ⅲ-1培养基,既考察了水质对发酵的影响,又再次比较优化培养基Ⅱ-1和Ⅲ-1。结果见表18。

表14 正交试验三的因素和水平设计
注:甘油配成10%(v/v)的溶液,按表中体积百分比加入培养基中;其他组分水平为w/v%。
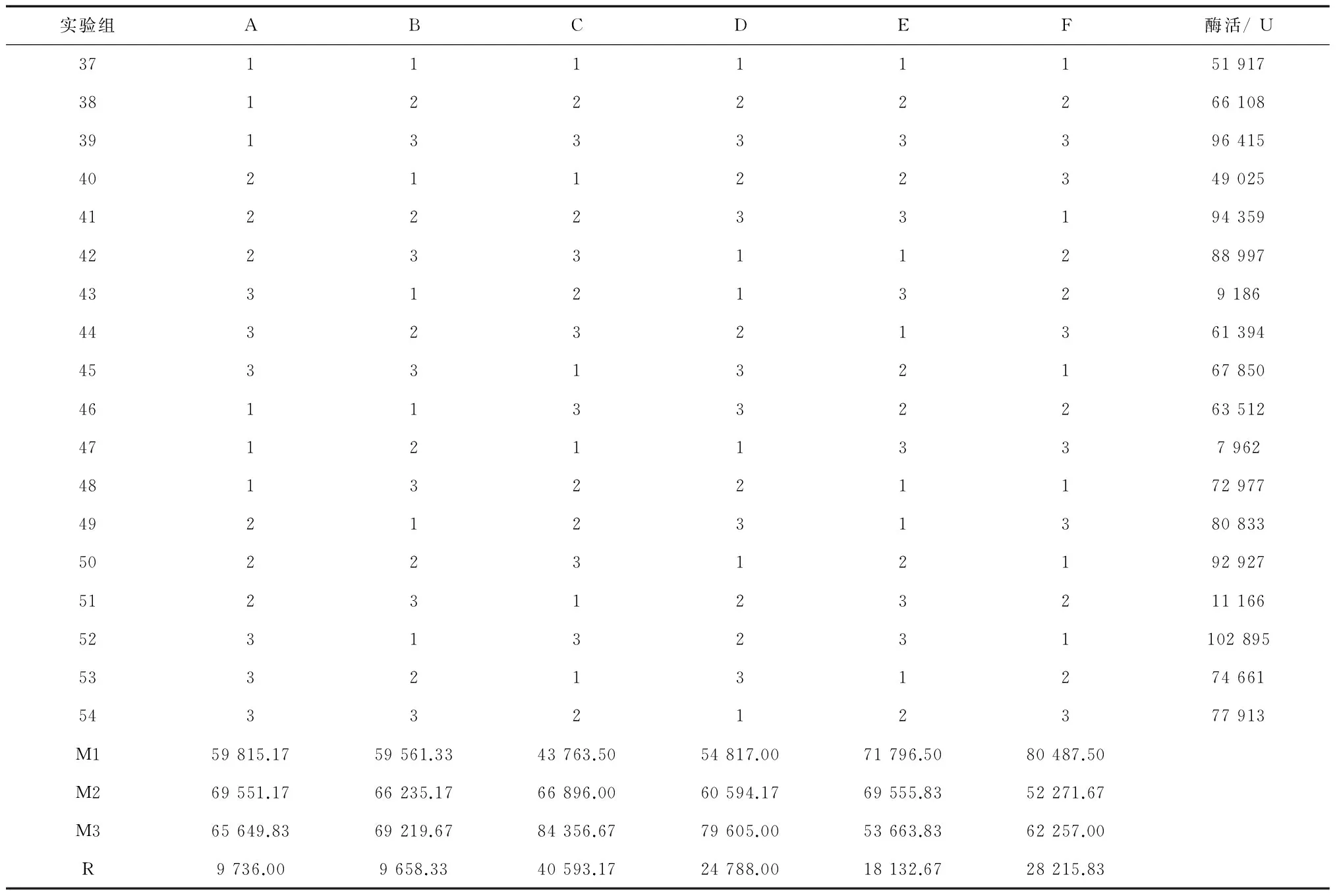
表15 正交试验三的结果
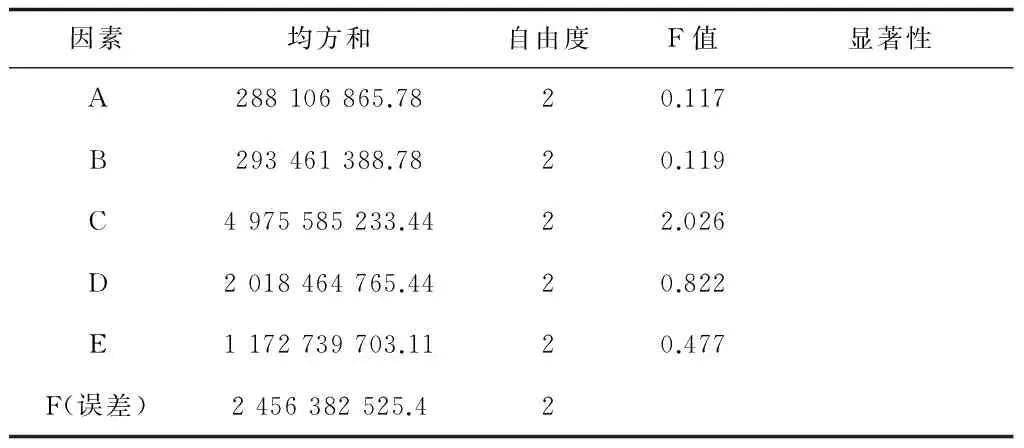
表16 正交试验二的方差分析结果
注:F0.05(2,2)=19.00,F0.01(2,2)=99.01,F0.25(2,2)=3.00,表中显著性以F0.05(2,2)为临界值。

表17 发酵培养基Ⅱ-1和Ⅲ-1对产酶效果
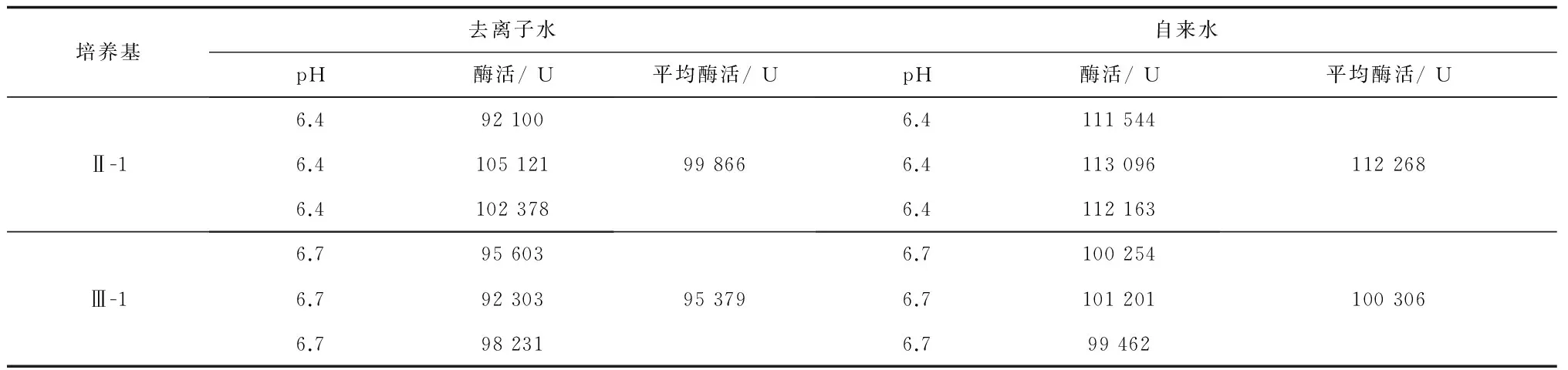
表18 水质对发酵效果的影响
从表18的结果可知,可用自来水替代去离子水配制培养基,用发酵培养基Ⅱ-1和Ⅲ-1的发酵结果相近,结果能重现。确定最优培养基为Ⅱ-1:葡萄糖0.2%、甘油0.7% (v/v)、蛋白胨1.2%、酵母膏0.8%、NaCl 0.3%、(NH4)2SO40.3%、NH4Cl 0.13%、Na2HPO4·12H2O 1.04%、KH2PO40.39%、MgSO4·7H2O 0.03%,自来水配制,pH 7.2。
经过3轮正交试验,确定了最佳培养基配方及相应培养方法。在优化条件下,重组菌的产酶水平可达(0.9~1)×105U,比野生菌的产酶水平提高了50%以上。
3 结论
通过对产腈水解酶基因工程菌E.coliBL21(DE3)-pETNYNit的酶基因诱导表达条件及发酵条件进行优化,成功提高了该重组菌的产酶水平。
通过研究获得的最优培养方法为:斜面挑菌接入种子培养基,种子培养至OD600为0.6~0.8时,以3%接种量转接发酵培养基,培养4 h加入0.5 mmol/L的诱导剂IPTG。种子及发酵培养条件均为37 ℃、240 r/min。加入IPTG后,在28 ℃、240 r/min下诱导酶基因表达14 h~16 h。经正交优化所得的最佳发酵培养基为:葡萄糖0.2%、甘油0.7% (v/v)、蛋白胨1.2%、酵母膏0.8%、NaCl 0.3%、(NH4)2SO40.3%、NH4Cl 0.13%、Na2HPO4·12H2O 1.04%、KH2PO40.39%、MgSO4·7H2O 0.03%,pH 7.2。试验同时证明,培养基可使用自来水进行配制。培养基中均含100 μg/mL Amp。
采用最优培养方法,重组菌产酶水平可提升到(0.9~1)×105U,与野生菌株相比提高幅度超过50%。同时重组菌培养仅需 24 h,相比之下,野生菌株培养需72 h~120 h,培养周期大幅缩短。该优化方法在工业生产中能有效提高腈水解酶的产能,具有很高的工业应用价值。
[1] 徐建妙,郑裕国,沈寅初. 腈水解酶的来源、结构、作用机制及其应用 [J]. 微生物学通报,2005,32(5):141-146.
[2] 何玉财,许建和. 腈水解酶在羧酸合成中的研究进展 [J]. 生物加工过程,2009,7(1):7-11.
[3] 郑裕国,薛亚萍,柳志强等. 腈转化酶在精细化学品生产中的应用 [J]. 生物工程学报,2009,25(12):1795-1807.
[4] 刘鑫,游松,苏昕. 微生物酶催化腈类化合物的研究进展 [J]. 沈阳药科大学学报,2012,29(6):485-490.
[5] 唐璐敏,徐玉华,薛建萍. Arthrobacter nitroguajacolicus 腈水解酶基因的克隆和表达 [J]. 工业微生物,2014,44(6):13-20.
[6] Novagen,pET System Manual 10thEd. 2006.
[7] 司文,唐璐敏,李还宝. 一株产腈水解酶基因工程菌转化羟基乙腈生产乙醇酸的工艺初探 [J]. 工业微生物,2015,45(6):48-52.
[8] 李寅,高海军,陈坚. 高细胞密度发酵技术. 化学工业出版社. 2006-10. 第三章.
Optimization of culture conditions for production of nitrilase by using recombinantE.coli
TANG Lu-min, XUE Jian-ping
Biological Engineering Center,Shanghai Pesticide Research Institute,Shanghai 200032, China
In this study, the production of nitrilase by using recombinant strainE.coliBL21 (DE3) -pETNYNit was improved by optimization of induced conditions and fermentation medium. The results indicated that the optimal medium were as follows: glucose 0.2%, glycerol 0.7% (v/v), peptone 1.2%, yeast extract 0.8%, NaCl 0.3%, (NH4)2SO40.3%, NH4Cl and 0.13%, Na2HPO4·12H2O 1.04%, KH2PO40.39%, MgSO4·7H2O 0.03%, pH 7.2; the optimal induced conditions were the following: 0.5 mmol/L IPTG induced expression after fermented for 4 hours, and then cultured for 14 hours to 16 hours at 28 ℃ and 240 r/min. After optimization, the nitrilase activity of the recombinant strain increased to (1~0.9)×105U. Compared with that of the wild strain, the enzyme activity increased by more than 50%. At the same time, the culture time of the recombinant strain was about 24 hours, reduced more than 50 hours.
nitrilase; recombinant strain; induction condition optimization; culture medium optimization
国家高技术研究发展计划(863计划),课题编号SS2014AA022106。
唐璐敏(1982~),女,工程硕士。电话:021-64387891-133,E-mail:coriah@126.com。
*通讯作者: 薛建萍(1961~),女,高级工程师。电话:021-64387891-133,E-mail:xjp54241246@163.com。
