肉牛黄体期和卵泡期阴道菌群结构的比较研究
2016-11-11刘畅王军刘红羽吕文发
刘畅,王军,刘红羽,吕文发
(吉林农业大学动物科学技术学院,吉林长春130118)
肉牛黄体期和卵泡期阴道菌群结构的比较研究
刘畅,王军,刘红羽,吕文发
(吉林农业大学动物科学技术学院,吉林长春130118)
为了研究生殖激素对阴道菌群的影响,选取7头健康肉牛,分别采集黄体期和卵泡期阴道分泌物,提取细菌总DNA,根据DGGE克隆测序结果,选择5种特异性细菌,利用荧光定量PCR技术检测各细菌数量。结果表明,总菌、大肠杆菌、鞘氨醇单胞菌和睡眠嗜血杆菌菌群数量在两组间无显著差异(P>0.05),但黄体期链球菌属数量显著高于卵泡期(P<0.01),卵泡期乳杆菌属数量显著高于黄体期(P<0.05)。结果提示,肉牛黄体期与卵泡期的阴道菌群结构存在显著差异。
肉牛;黄体期和卵泡期;阴道;Real-time PCR;菌群
机体生殖道菌群是一个复杂的微生态系统,由于细菌培养手段的局限性,传统细菌分离鉴定方法使得我们对其结构知之甚少。利用传统细菌分离方法研究发现,牛阴道内菌群主要由链球菌属、葡萄球菌属、肠杆菌属和乳杆菌属组成[1-2],对人和某些哺乳动物阴道菌群进行分析,发现乳杆菌属是主要组成成分,乳杆菌属可以保护机体免受病原菌侵入[3-4]。
Cowley等对发情周期不同阶段小鼠阴道菌群的研究发现,处于卵泡期小鼠阴道细菌数量较黄体期多[5];而Koiter等却发现小鼠黄体期阴道细菌数量高于卵泡期[6]。上述结果提示,不同生理时期生殖激素对阴道菌群有影响。前期本实验室应用PCR-DGGE技术检测出黄体期与卵泡期肉牛阴道细菌有:气球菌、绿色气球菌、睡眠嗜血杆菌、多动物链球菌、嗜冷杆菌、大肠杆菌、鞘氨醇单胞菌,但不能准确判断细菌数量上的差异。根据前期试验结果,设计不同细菌特异性引物,应用荧光定量PCR技术对健康肉牛黄体期和卵泡期阴道菌群进行定量分析,比较不同生理时期肉牛阴道菌群差异,为进一步开发微生态制剂奠定基础。
1材料与方法
1.1主要试剂QIAamp DNA MiniKit、胶回收试剂盒,购自QIAGEN公司;DL-2 000 Marker、TaqDNA聚合酶、pMD18-T质粒、SYBR@GreenIPremix-ExTaqTM等,均购自TaKaRa公司;Primer synthesis、50×TAE缓冲液,购自上海生工生物工程技术服务有限公司;质粒提取试剂盒,购自Axygen公司。
1.2基因组DNA提取选取15头西门塔尔杂交肉牛开展同期发情,筛选7头母牛,分别采集黄体期(L1-L7)和卵泡期(F1-F7)阴道样品,采用QIAamp DNA Mini Kit试剂盒[7-8]按说明书提取细菌基因组DNA。应用NanDrop 2 000检测浓度,对每个样品进行不同浓度的稀释,最终达到20 mg/L。
1.3引物的设计与合成总菌及5种菌属特异性引物根据PCR-DGGE及16S rDNA基因序列设计。将6对引物用BLAST软件进行在线核实其特异性后由上海生工生物工程技术服务有限公司合成。引物序列见表1。

表1荧光定量PCR特异性引物
1.4标准曲线的制作检测各个特异性引物最佳反应条件,之后将各标准菌株PCR产物切胶、回收后所得的产物进行连接转化,将阳性菌液提取的质粒作为荧光定量PCR的标准品,测定OD值及浓度,换算为各标准品1 μL的拷贝数,用于制作标准曲线。
1.5待测样品定量分析采用两步法进行PCR扩增,将待测肉牛黄体期与卵泡期样品提取的DNA分别进行总菌及5种细菌16S rDNA荧光定量PCR反应,反应体系20 μL:SYBR GreenⅠ10 μL,上下游引物(10 mmol/L)各0.8 μL,ROX Reference DyeⅡ0.4 μL,DNA模板2 μL,补ddH2O至20 μL;反应程序为:95℃预变性30 s;95℃变性5 min,不同退火(如表1)温度复性34 s,40个循环;95℃15 s,60℃1 min,95℃15 s,1个循环。每次试验同时设标准品校正和ddH2O代替DNA模板的阴性对照,每个样品均同时做3个平行复孔。
1.6统计学方法应用SPSS18.0软件对荧光定量结果进行统计分析。计量资料以均数±标准差表示,两个样本均数的比较根据正态分布检验结果采用独立样本t检验,P<0.05为有统计学差异。
2结果
2.1定量曲线结果根据荧光定量PCR扩增结果,总菌及5种特异性菌标准曲线的相关系数(R2)均大于0.98,斜率在-3~-3.5之间;通过溶解曲线,确定了总菌、链球菌属、大肠杆菌、鞘氨醇单胞菌、睡眠嗜血杆菌和乳杆菌属的Tm值分别在85.01℃、84.4℃、82.17℃、83.22℃、80.98℃和86.8℃左右。2.2特异菌群定量检测结果不同生理时期阴道细菌结果如表2所示,用lg copies表示。结果显示,黄体期肉牛阴道内链球菌属数量极显著高于卵泡期(P<0.01),而卵泡期肉牛阴道内乳杆菌属的数量显著高于黄体期(P<.05),其他细菌,两组间差异不显著(P>0.05)。
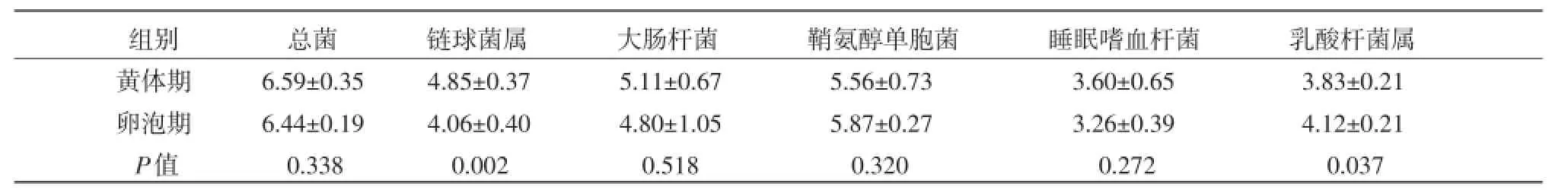
表2不同生理时期细菌定量检测结果
3讨论
生殖道菌群对生殖道健康起重要作用,本试验应用Real-time PCR检测健康肉牛阴道菌群结构,发现生殖激素对阴道菌群有影响。前期利用DGGE技术研究了肉牛黄体期和卵泡期阴道菌群结构,研究并未发现乳杆菌属,但基于DGGE技术不能检测低于1%的菌及乳杆菌属的重要价值,本研究利用Real-time PCR测定了乳杆菌数量,研究发现,牛阴道中确实存在乳杆菌,但数量低于1%,且显著低于哺乳动物阴道乳杆菌所占比例,结果与Rodriguez等对奶牛和肉牛黄体期阴道乳
斑点热(spotted fever)是由斑点热群立克次体(Spotted fever group rickettsia,SFGR)所引起的一组疾病的总称。SFGR为专性细胞内寄生,是人兽共患的一大类自然疫源性疾病。蜱作为保菌宿主,SFGR在蜱种维持着持久的感染循环,可经卵垂直传递立克次体以保持其种群的连续性。近年来,世界范围内新发及再发立克次体并逐年上升[2]。从病原学和WHO立克次体研究中心证实我国至少存在3种斑点热立克次体,而从病人分离出病原体以及从基因检测证据表明,我国至少存在10杆菌属的分离相一致[13]。黄体期总菌数量比卵泡期多,但差异不显著;黄体期链球菌属数量极显著高于卵泡期,这与H.M.COWLEY[5]研究小鼠阴道总菌及链球菌属数量黄体期比卵泡期少相反,这种结果的差异可能是由于试验动物和研究方法不同导致的。基于以上,提示发情周期不同阶段阴道菌群存在变化并与生殖激素的分泌密切相关,但具体机制尚不清楚还有待于进一步研究。
[1]李炳志.奶牛子宫内膜炎菌群分析及微生态制剂对其疗效观察[D].杨凌:西北农林科技大学,2008.
[2]Zambrano-Nava S,Boscan-Ocando J,Nava J.Normal bacterial flora from vaginas of Criollo Limonero cows[J].Trop Anim Health Pro,2011,43(2):291-294.
[3]Wang Y,Ametaj B N,Ambrose D J,et al.Characterisation of the bacterial microbiota of the vagina of dairy cows and isolation of pediocin-producing Pediococcus acidilactici[J].BMC Microbiol,2013,13:19.
[4]Lamont R F,Sobel J D,Akins R A,et al.The vaginal microbiome:new information about genital tract flora using molecular based techniques[J].BJOG,2011,118(5):533-549.
[5]H M COWLEY GSH.Changes in Vaginal Bacterial Flora During the Oestrous Cycle of the Mouse[J].Microbial ecology in health and disease,1991,4:229-235.
[6]Koiter T R,Hazenberg M P,van der Schoot P.Regulation of the bacterial microflora of the vagina in cyclic female rats[J].J Exp Zool,1977,202(1):121-128.
[7]Santos T M,Gilbert R O,Bicalho R C.Metagenomic analysis of the uterine bacterial microbiota in healthy and metritic postpartum dairy cows[J].J Dairy Sci,2011,94(1):291-302.
[8]孙城涛.健康与子宫内膜炎奶牛阴道菌群结构的比较研究[D].长春:吉林农业大学,2014.
[9]Ling Z,Liu X,Chen X,et al.Diversity of cervicovaginal microbiota associated with female lower genital tract infections[J].Microb Ecol,2011,61(3):704-714.
[10]Malinen E,Kassinen A,Rinttila T,et al.Comparison of real-time PCR with SYBR Green I or 5'-nuclease assays and dot-blot hybridization with rDNA-targeted oligonucleotide probes in quantification of selected faecal bacteria[J].Microbiology,2003,149(Pt 1):269-277.
[11]周丽沙,李慧,张颖,等.石油污染土壤鞘氨醇单胞菌遗传多样性16S rDNA-PCR-DGGE分析[J].土壤学报,2011,(04):804-812.
[12]Fu C J,Carter J N,Li Y,et al.Comparison of agar plate and real-time PCR on enumeration of Lactobacillus,Clostridium perfringens and total anaerobic bacteria in dog faeces[J].Lett Appl Microbiol,2006,42(5):490-494.
[13]Rodriguez C,Cofre J V,Sanchez M,et al.Lactobacilli isolated from vaginal vault of dairy and meat cows during progesteronic stage of estrous cycle[J].Anaerobe,2011,17(1):15-18.
Comparison of vaginal micro flora structureof beef cattlebetween luteal and follicular phase
LIU Chang,WANG Jun,LIU Hong-yu,LV Wen-fa
(College of Animal Science and Technology,Jilin Agricultural University,Changchun 130118,China)
In order to investigate the effect of hormones on the vaginal flora,vaginal swab samples from seven cattle were collected during the luteal and follicular phase.Total bacterial DNA was extracted for real-time PCR.Following the DGGE cloned results,five specific bacteria species were selected.The real-time PCR was used to measure the quantity of the vaginal flora between the luteal and follicular phase,respectively.The results indicated that there was no significant difference between the luteal phase and follicular phase in total bacteria species,Escherichia coli,Sphingomonas and Haemophilus somnus(P>0.05).However,the Streptococcus number was significantly higher in the luteal phase than that in follicular phase(P<0.01).Conversely,follicular phase Lactobacillus was significantly higher than that in the luteal phase(P<0.05).The current results suggest that beef cattle micro flora structure differs significantly during the luteal phase and the follicular phase.
beef;luteal and follicular phase;vaginal;Rea-time PCR;flora
LV Wen-fa
S814.8
A
0529-6005(2016)08-0016-02
2015-12-31
吉林省现代肉牛产业技术体系(201534);吉林省重大科技攻关专项(20140203016NY);吉林省发改委产业技术研发专项(2013779);国家自然科学基金(31172227)
刘畅(1990-),女,硕士,从事动物遗传育种与繁殖研究,E-mail:398950510@qq.com
吕文发,E-mail:wenfa2004@163.com
