普鲁兰酶突变体文库高通量筛选方法的建立及应用
2016-11-10聂简琪陈阿娜刘秀霞杨艳坤白仲虎
聂简琪, 陈阿娜, 刘秀霞, 杨艳坤, 白仲虎*
(1.粮食发酵工艺与技术国家工程实验室,江南大学,江苏 无锡 214122;2.江南大学 工业生物技术教育部重点实验室,江苏 无锡214122;3.江南大学 糖化学与生物技术教育部重点实验室,江苏 无锡 214122)
普鲁兰酶突变体文库高通量筛选方法的建立及应用
聂简琪1,2,3,陈阿娜1,2,3,刘秀霞1,2,3,杨艳坤1,2,3,白仲虎*1,2,3
(1.粮食发酵工艺与技术国家工程实验室,江南大学,江苏 无锡 214122;2.江南大学 工业生物技术教育部重点实验室,江苏 无锡214122;3.江南大学 糖化学与生物技术教育部重点实验室,江苏 无锡 214122)
在摇瓶水平实现普鲁兰酶基因 (GenBank Accession No:AX203843)在大肠杆菌BL21(DE3)的异源表达,并成功按规格缩小实现了基于深孔板的高通量细胞培养,同时建立了基于深孔板的普鲁兰酶酶活快速高效的高通量检测方法。利用易错PCR技术对普鲁兰酶基因进行定向进化,突变基因产物重组于表达载体pET-28a(+)-pelB中,并导入大肠杆菌BL21(DE3)构建突变体文库,利用该高通量筛选方法实现了突变体文库的快速高效筛选并获得了一株突变菌株4A4,其表达量提高了46.5%。该方法不仅适用于淀粉酶、纤维素酶等酶类的高通量筛选,同时为菌株文库的筛选以及蛋白质的定向进化提供了一种新思路。
普鲁兰酶;深孔细胞培养板;高通量筛选;规模缩小;突变体文库
普鲁兰酶 (pullulanase)是一类淀粉脱支酶,能够专一性切开支链淀粉分支点中的α-1,6糖苷键,切下整个分支结构,形成直链淀粉,并且可以将最小单位的支链分解,最大限度的利用淀粉原料,近年来在淀粉加工、纺织及饲料行业的需求渐增。至今已有多个普鲁兰酶基因得到了异源表达,构建并筛选到优良的普鲁兰酶突变体有望进一步促进普鲁兰酶的理论和应用,但旨在提高普鲁兰酶表达量的研究报道极少[1]。
易错PCR以其操作简便、有效等优点成为目前应用最为广泛的进化手段之一[2]。但该方法负突变频率较高,因而必须采用高效快速的筛选方法才能对文库进行快速精准的筛选。对于庞大的突变文库,如何快速高效的进行筛选,较少有相关研究见诸报道。
1951年培养板(Microtiter Plate,MTP)被设计出来并主要用于分析领域,由于MTP可进行高通量分析,后逐渐被用于细胞培养、高通量筛选、药物和酶等次级代谢产物的筛选等研究[3-5],是菌株高通量筛选中应用较广泛的一种方法。近年来也被逐渐应用于菌株筛选与选育等方面。但目前较少研究高通量筛选技术在蛋白质异源表达方面的应用。只有实现高通量培养与高通量分析检测的统一才能整体上实现高通量筛选,而目前如何实现高通量检测是实现整体高通量的瓶颈。
作者在摇瓶水平实现普鲁兰酶基因(GenBank Accession No:AX203843)的异源分泌表达。实现了基于深孔板的高通量培养并建立了基于深孔板的普鲁兰酶酶活快速高效的高通量检测方法。利用易错PCR技术构建普鲁兰酶基因突变体文库,并采用该普鲁兰酶高通量筛选方法进行快速高效的筛选,并获得了一株突变菌株4A4,其表达量提高了46.5%。本研究结果为普鲁兰酶的异源表达提供了理论基础,同时建立的普鲁兰酶高通量筛选方法为突变文库的快速筛选提供了指导,也为普鲁兰酶结构解析提供了基础数据。
1 材料与方法
1.1材料
1.1.1菌株和质粒大肠杆菌DH5α、BL21(DE3):作者所在实验室保藏;质粒pET-22b(+)、pET-28a(+):Novagen公司。本研究所用的菌株和质粒及其特性见表1。

表1 菌株与质粒Table 1 Strains and plasm ids
1.1.2主要试剂和仪器胰蛋白胨和酵母粉:Oxoid公司;Q5 High-Fidelity DNA Polymerase、限制性内切酶Bgl II、Bam H I、Xho I:NEB公司;T4 DNA连接酶、质粒提取试剂盒:北京全式金生物技术有限公司;rTaq DNA聚合酶、DNA marker:TaKaRa公司;PCR产物纯化试剂盒、硫酸卡那霉素(Kan)、氨苄青霉素(Amp):上海生工生物工程技术服务有限公司;标准相对分子质量蛋白质及SDS-PAGE凝胶配置试剂盒:碧云天生物技术研究所;其它试剂购于国药集团化学试剂有限公司(上海)。
1.1.3培养基
1)种子培养基(LB)(g/L):胰蛋白胨10,酵母粉5,NaCl 10;pH调至7.0。
2)发酵培养基(TB/SB)(g/L):胰蛋白胨12,酵母粉 24,KH2PO42.31,K2HPO4·3H2O 12.55,甘油10;pH调至7.0。
3)LB+:基础成分与LB培养基一致,诱导时补加终浓度为0.16 mol/L甘氨酸和0.1mol/L NaCl。
4)TB/SB+:基础成分与TB/SB培养基一致,诱导时补加终浓度为0.16 mol/L甘氨酸和0.1 mol/L NaCl。
1.2方法
1.2.1对照菌株的构建采用来自pET-20b(+)-pul的普鲁兰酶基因序列设计引物:上游引物5’-CGCGGATCCGATTCTACTTCGACTAAAGTTATTGT TC-3’(加下划线序列为BamH I酶切位点),下游引物 5’-CCGCTCGAGTTGTTTGAGAATAAGCGTAC TTATAGC-3’(加下划线序列为Xho I酶切位点),由上海生工生物工程技术服务有限公司提供,扩增的片段大小2 784 bp。
以质粒pET-20b(+)-pul为模板,反应体系为:10μL 5×Q5 Reaction Buffer,4μL dNTPs(10 mmo/L),上下游引物各30 pmol,模板20 pmol,0.5μL Q5 High-Fidelity DNA Polymerase,UP水至总体积为50μL。PCR程序为:98℃预变性30 s;98℃变性10 s,61℃退火1 min,72℃延伸3 min,30个循环后,72℃延伸10min,4℃保存。
PCR产物经PCR产物纯化试剂盒纯化。纯化后的产物和pET-28a(+)-pelB载体分别用Bam H I和Xho I双酶切4 h,经PCR产物纯化试剂盒纯化,纯化后的产物按比例混合后加入T4 DNA连接酶,16℃连接过夜,转化大肠杆菌BL21(DE3)感受态细胞,挑选阳性转化子并测序,测序正确的菌株即为对照菌株。
1.2.2发酵液上清及周质空间组分的分离吸取1 mL发酵液于1.5 mL离心管中,8 000 g离心10 min,上清液即为胞外组分。菌体沉淀经PBS洗涤2次,用500μL OSI溶液(0.1 mol/L Tris-HCl pH 8,1 mmol/L EDTA,20 g/dL蔗糖)重悬并于室温振荡10 min,于8 000 g离心10min,上清液即为OS I组分,用500μL OSII溶液(5 mmol/L MgSO4)重悬并于4℃振荡10 min,于8 000 g离心10 min,上清液即为OS II组分,将OS I组分与OS II组分合起来即为周质空间组分。
1.2.3普鲁兰酶摇瓶产酶条件的确定
1)培养基种类及添加剂对普鲁兰酶表达的影响:将菌株分别接种至装填25 mL培养基(LB、LB+、TB/SB、TB/SB+)的250 mL的摇瓶中,接种终OD595为0.025,37℃、230 r/min振荡培养5.5 h后,加入终浓度为0.1mmol/L的IPTG进行诱导,20℃、200 r/min诱导20 h,收获并测细胞干重 (dry cell weight,DCW)及上清液、周质空间酶活。
2)诱导时间对普鲁兰酶表达的影响:将菌株接种至装填25 mL TB/SB培养基的250 mL的摇瓶中,接种终OD5950.025,37℃、230 r/min分别振荡培养不同时间(2.5、3.5、4.5、5.5、6.5、7.5 h)后加入终浓度为0.1mmol/L的IPTG进行诱导,20℃,200 r/min诱导20 h后收获,测干重及上清液、周质空间酶活。
3)诱导温度对普鲁兰酶表达的影响:将菌株接种至装填25 mL TB/SB培养基的250 mL的摇瓶中,接种终OD5950.025,37℃,230 r/min分别振荡培养5.5 h后,加入终浓度为0.1 mmol/L的IPTG进行诱导,不同温度(16、20、24、28、32℃),200 r/min诱导20 h后收获并测干重及上清液、周质空间酶活。
4)诱导剂浓度对普鲁兰酶表达的影响:将菌株接种至装填25 mL TB/SB培养基的250 mL的摇瓶中,接种终OD5950.025,37℃、230 r/min分别振荡培养5.5 h后加入不同终浓度(0.05、0.1、0.2、0.4、0.6、0.8、1.0 mmol/L)的IPTG进行诱导,20℃、200 r/min诱导20 h后收获,测干重及上清液、周质空间酶活。1.2.4规模缩小至MTP将菌株分别接种至装填2 mL TB/SB培养基的24孔MTP与装填1 mL TB/SB培养基的48孔MTP中,接种量、诱导时间、IPTG浓度等参数均采用摇瓶单因素优化后的参数。不同转速(200、230 r/min)诱导20 h后收获,测干重及上清液、周质空间酶活。
1.2.5易错PCR扩增及突变体库的构建以质粒pET-20b(+)-pul为模板,反应体系为:5μL 10× Taq PCR buffer,5μL 10×dNTP混合物 (2 mmo/L dGTP、2mmol/L dATP、10mmol/L dCTP和10mmol/L dTTP),11μL的25mmol/LMgCl2,5μL的5mmol/L MnCl2;上下游引物各30 pmol,模板20 pmol,rTaq DNA聚合酶1μL,加水至总体积为50μL。PCR程序为:95℃预变性3 min;95℃变性1 min,61℃退火1min,72℃延伸3min,30个循环后,72℃延伸10min,4℃保存。
PCR产物经PCR产物纯化试剂盒纯化。纯化后的产物和pET-28a(+)-pelB载体分别经BamH I和Xho I双酶切4 h,经PCR产物纯化试剂盒纯化,纯化后的产物按比例混合后加入T4 DNA连接酶,16℃连接过夜,转化大肠杆菌BL21(DE3)感受态细胞,涂布固体LB(含50μg/mL的Kan)平板,抗性筛选阳性转化子,此即构建好的普鲁兰酶基因突变体库。
1.2.6突变文库的高通量筛选将结束发酵的MTP配平后于4 000 r/min离心10 min,另取96孔MTP,用8通道移液器依次向每孔加入200μL普鲁兰底物 (1%的普鲁兰多糖,0.1 mol/L、pH 5.2的乙酸-乙酸钠缓冲液),100μL发酵上清液,用硅胶垫密封后混匀,60℃水浴反应10 min,加入450μL DNS试剂终止反应后立即沸水浴10min。取96孔酶标板,用8通道移液器依次向每孔加入190μL RO水,10μL冷却后的反应液,540 nm下测定吸光度。
2 结果与分析
2.1重组大肠杆菌的构建
图1为重组表达载体pET-28a(+)-pelB-pul的构建过程,经双酶切鉴定见图2所示。目的基因全长2 770 bp,pET-28a(+)-pelB线性质粒大小约5 360 bp,电泳结果与预期符合,表明重组表达载体pET-28a(+)-pelB-pul构建成功。

图1 重组质粒pET-28a(+)-pelB-pul的构建过程Fig.1 Construction of expression pET-28a(+)-pelB-pul vector

图2 重组质粒pET-28a(+)-pelB-pul双酶(Bam H I/Xho I)切验证Fig.2 Electrophoresis of digested expression plasm id pET-28a(+)-pelB-pul by Bam H I/Xho I
2.2培养基种类及添加剂对普鲁兰酶表达的影响
为了实现普鲁兰酶的分泌表达,选择实验室常用的LB、TB/SB培养基进行了研究。该重组菌在LB培养基中生长状态较差,表达的普鲁兰酶量很少,在培养基上清液中几乎检测不到酶活,而在TB/SB培养基中,重组菌生产良好,且在上清液和周质空间均可检测到普鲁兰酶酶活,见图3-4。普鲁兰酶相对分子质量为105 400。这主要是由于TB/SB培养基营养丰富,可为宿主菌提供丰富的营养物质,此外提供普鲁兰酶合成的碳骨架。严伟[2]等人通过在诱导时添加甘氨酸和Na+均能有效促进普鲁兰酶的分泌。作者诱导时在培养基中添加了甘氨酸和氯化钠,显著地促进了普鲁兰酶的分泌表达。因此选用TB/SB为发酵培养基并在诱导时添加终浓度为0.16 mol/L甘氨酸和0.1mol/L氯化钠。
2.3诱导时间对普鲁兰酶表达的影响
由图5可以看出,诱导时间对普鲁兰酶的分泌表达有显著影响,诱导时机早于4.5 h或晚于7.5 h均不利于普鲁兰酶的分泌,当转接后小于4.5 h时进行诱导,在上清液中难以检测到普鲁兰酶酶活。当转接后5.5 h进行诱导,可发酵液上清液中普鲁兰酶酶活最高,因此选择此时进行诱导。
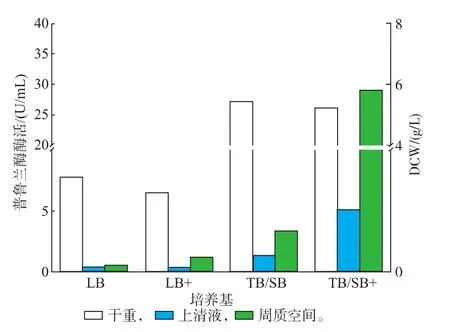
图3 培养基对普鲁兰酶表达的影响Fig.3 Effect ofmedium on pullulanse expression

图4 普鲁兰酶表达的SDS-PAGE蛋白质电泳分析Fig.4 SDS-PAGE analysis of pullulanse expression

图5 诱导时间对普鲁兰酶表达的影响Fig.5 Effect of induction time on pullulanse expression
2.4诱导温度对普鲁兰酶表达的影响
诱导温度对外源蛋白质的合成与分泌极其重要,温度过高,外源蛋白质的合成速度较快,会因来不及折叠而形成不可溶的包涵体,而低温诱导减慢了外源蛋白质合成的速度,使新合成的肽链能正确折叠,减少了包涵体的形成[6]。由图6可以看出,发酵液上清液以及周质空间的普鲁兰酶酶活随着诱导温度的升高先升高后降低,当诱导温度为20℃时,发酵上清液以及周质空间的普鲁兰酶酶活最高,因此选择诱导温度为20℃。
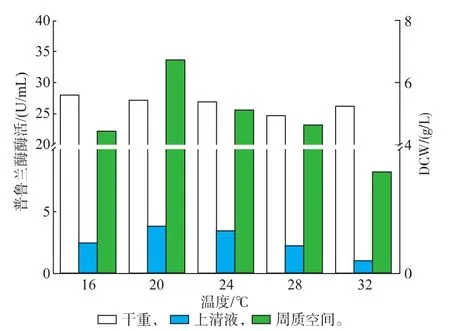
图6 温度对普鲁兰酶表达的影响Fig.6 Effect of temperature on pullulanse expression
2.5诱导剂浓度对普鲁兰酶表达的影响
诱导物IPTG的浓度直接影响目标蛋白的表达。由图7可以看出,不同的IPTG浓度对发酵上清液中的普鲁兰酶酶活没有明显的影响。尽管IPTG添加终浓度0.4 mmol/L时周质空间普鲁兰酶酶活最高,但IPTG添加终浓度0.1mmol/L时发酵上清液中的普鲁兰酶酶活较高,且从成本的角度考虑,选择IPTG添加终浓度为0.1 mmol/L。

图7 IPTG浓度对普鲁兰酶表达的影响Fig.7 Effect of IPTG concentration on pullulanse expression
2.6比例缩小至MTP普鲁兰酶表达的影响
高通量培养作为高通量筛选的第一步,只有实现高通量培养方可进行高通量筛选。为了实现高通量培养,将摇瓶规模的发酵参数比例缩小至MTP规模。MTP做为高通量培养的主要器具,其氧传递能力和混合特性会直接影响菌体的生长状况以及发酵产物的产量。对照菌株在MTP的培养效果见图8。若完全将摇瓶的发酵参数应用于MTP中,菌株的生长及普鲁兰的分泌量均有所下降,但24孔MTP要优于48孔MTP,更加接近于摇瓶水平。若提高48孔MTP诱导时的转速 (48孔MTP*:230 r/min),提高氧传递系数以及混合效果,菌株的生长及普鲁兰的分泌量均有所提高,接近于摇瓶水平。
尽管96孔MTP的通量高,但其氧传递能力和混合特性较差,菌株生长状况差,24孔MTP在氧传递能力和混合特性优于48孔/96孔MTP,但其通量仅为48孔MTP的一半,且1mL的发酵液足够用于高通量检测,因此选择48孔MTP进行高通量培养,诱导后转速由200 r/min提高到230 r/min。

图8 不同培养器皿对普鲁兰酶表达的影响Fig.8 Effect of culture vessels on pullulanse expression
2.7普鲁兰酶活高通量检测体系的建立
由图9可以看出,当以96孔MTP作为反应容器进行DNS比色法测定还原糖时,标准曲线回归系数为0.996 3,线性良好,CV≤0.07,因此该方法可行。同时与传统比色管相比,该方法具有以下优点:通量高,利用单个96孔MTP可同时处理96个样品,处理后的样品可通过8通道或96通道移液器快速转移至酶标板中,并在几分钟内完成信号值的读取;操作方便,可利用8通道移液器快速完成反应体系的配制;节约试剂材料,反应体系仅为750μL,而比色管的反应体系一般需要2.5mL。该方法可作为淀粉酶、纤维素酶等的高通量分析检测。

图9 DNS比色法测定还原糖标准曲线Fig.9 Standard curve of DNS colorimetric assay
2.8突变体文库的筛选及摇瓶复验
普鲁兰酶高通量筛选流程图见图10。阳性克隆转化子经过高通量筛选,从突变文库2 100个转化子中筛选出一株分泌性提高的普鲁兰酶克隆4A4,上清液中普鲁兰酶酶活提高了46.5%。通过在TB/ SB培养基中(不添加甘氨酸和氯化钠)进行发酵复验,结果见图11。在发酵液上清液以及周质空间中,突变株4A4的普鲁兰酶酶活均显著高于对照菌株。

图10 普鲁兰酶高通量筛选流程图Fig.10 Schematic presentation for the high-throughput screening of pullulanase
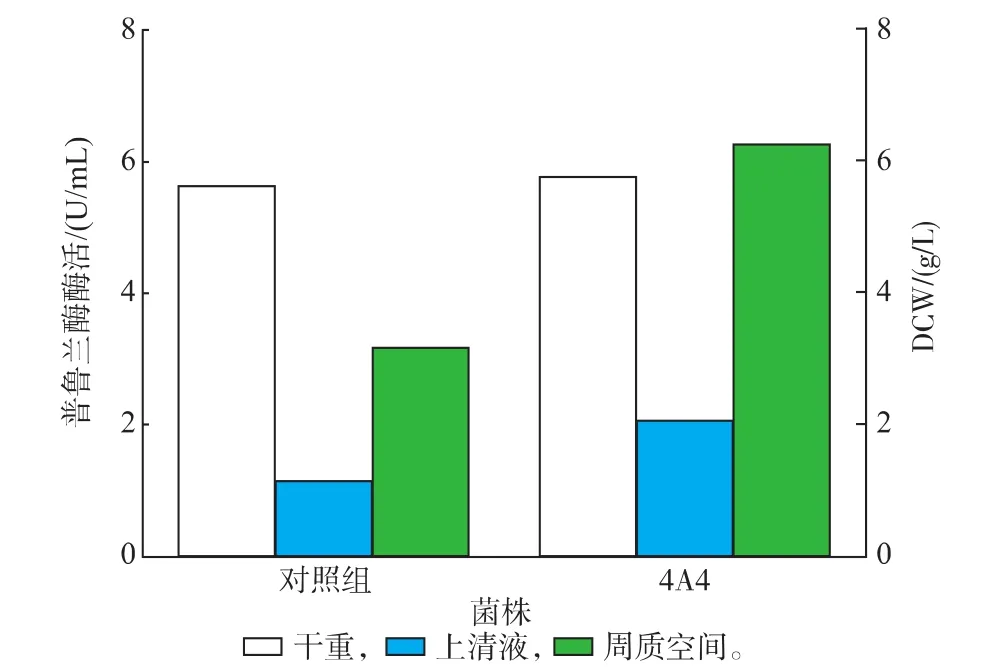
图11 摇瓶复验突变株的分泌表达Fig.11 Retest secretory expression of mutation strain by shake flask
该高通量筛选方法可同时展开768个克隆的筛选 (考虑到手动操作的疲劳以及摇床的装载量,以单人完全手动操作以及单个摇床为例),3个批次的筛选即可完成筛选。若采用三角摇瓶进行筛选,工作量将是巨大的,且耗时耗力。
2.9进化酶序列分析
基因测序委托上海生工生物公司完成,利用DNAMAN软件对野生型与突变体酶基因序列进行比对分析,突变体基因有5个氨基酸发生突变。L190P/V240D/G386E/V707A/I897V,结果表明利用易错PCR方法成功地向普鲁兰酶基因引入了突变。
3 结语
作者以普鲁兰酶为例阐述了从DNA到进化后酶蛋白的整体流程,首先实现了普鲁兰酶基因(GenBank Accession No:AX203843)的异源表达,并在摇瓶水平对发酵条件进行了初步研究,单因素优化得到的诱导条件为:采用TB/SB培养基作为发酵培养基,接种后OD5950.025,37℃、230 r/min培养5.5 h后进行诱导,IPTG终浓度0.1 mmol/L,诱导温度20℃,诱导时添加终浓度为0.16mol/L甘氨酸和0.1 mol/L氯化钠,诱导20 h后,上清液中重组普鲁兰酶的酶活为5.1 U/mL。重组宿主在LB培养基中生长状况较差,无论周质还是上清液,普鲁兰酶的表达量均明显低于在TB/SB培养,这主要是由于LB培养基为基本培养基,而LB/SB培养基营养十分丰富,宿主菌可达到一个较高的生物量,且有足够的能量进行异源蛋白质的表达。重组宿主的最佳诱导时机为发酵5.5 h后 (OD595≈6.2),而Xuguo Duan[7]等人研究的诱导时机为OD595为1.0。本研究普鲁兰基因来源于Bacillus acidopullulyticus,后者来源于 Bacillus deramificans,两者的相似性为63.38%,长度仅相差7个氨基酸,但最适诱导时间却相差很大。这也表明即使相似性高的基因在进行异源表达时也不能照搬,这也为异源表达带来一定困难。
高通量筛选技术的诞生大大的提高了筛选效率,可以减少劳力以及原料成本,大大缩减了研发成本。规模缩小至深孔板水平是实现高通量筛选的途径之一,MTP可比摇瓶缩小至少50倍培养基使用量[8]。但规模缩小时需要尽量使菌株的培养条件接近于摇瓶乃至发酵罐,只有这样通过规模缩小模型筛选出的菌株以及发酵参数在进行规模放大时才能体现一致性。而OTR(Oxygen Transfer Rate,氧传递速率)是进行规模缩小着重考虑的因素之一,OTR偏低时会使生物量以及产物产量的降低,振荡频率、偏心距、装填体积等对OTR有显著影响[8-10],在进行Scale-down时需要对振荡频率、偏心距、装填体积等参数进行探索以保证缩放的合理性。
易错PCR是诸多体外定向进化方法中一种简便、易行的手段,其核心是在PCR系统中引入不同浓度的Mn2+,导致目的基因扩增过程中引入非互补配对碱基。由于绝大多数突变是有害的[11],因而必须采用高效快速的筛选方法才能对文库进行快速精准的筛选。尽管易错PCR被广泛地应用于酶的定向进化,但对于庞大的突变文库的筛选环节,多避重就轻或采用低通量的方法[12]。利用透明圈法[13]可作为突变文库的初筛,在一定程度上大大降低了复筛的劳动强度。但对于异源表达的蛋白质,大都需要诱导剂进行诱导方可表达,而宿主菌的最适生长温度与诱导温度差异较大,且诱导时机对外源蛋白质的表达有显著影响,因而该方法存在一定的缺陷。该高通量筛选结合ELISA方法可用于生物医药的研发。
本研究仅从分泌性作为例证进行该方法的验证,该方法亦可拓展于耐热性、耐酸/碱等耐性突变酶的筛选。在精准度方面,人工手动操作下MTP与摇瓶相差不大,且在配备全自动化设备进行操作时,MTP的精确度会进一步提高。
本研究结果为普鲁兰酶的异源表达提供了理论基础,同时建立的普鲁兰酶高通量筛选方法为突变文库的快速筛选提供了指导,也为普鲁兰酶结构解析提供了基础数据。
[1]严伟,聂尧,徐岩.长野芽胞杆菌(Bacillus naganoensis)普鲁兰酶在大肠杆菌中的活性表达与分泌调控[J].微生物学报,2013,53(2):145-153.YAN Wei,NIE Yao,XU Yan.Expression and secretion regulation of Bacillus naganoensis pullulanase in recombinant Escherichia coli[J].Acta M icrobiologica Sinica,2013,53(2):145-153.(in Chinese)
[2]黄瑛,蔡勇,杨江科,等.基于易错PCR技术的短小芽孢杆菌YZ02脂肪酶基因BpL的定向进化[J].生物工程学报,2008,24(3):445-451. HUANG Ying,CAIYong,YANG Jiangke,etal.Directed evolution of lipase of Bacillus pumilus YZ02 by error-prone PCR[J]. Chinese Journal of Biotechnology,2008,24(3):445-451.(in Chinese)
[3]ROBERTHermann,MATHIASLehmann,JOCHEN Büchs.Characterization ofgas-liquidmass transfer phenomena inmicrotiter plates[J].Biotechnol Bioeng,2003,81(2):178-186.
[4]JONATHAN I Betts,FRANK Baganz.M iniature bioreactors:current practices and future opportunities[J].M icrob Cell Factories,2006,5:21.
[5]WOUTER A.Duetz.M icrotiter plates asmini-bioreactors:miniaturization of fermentation methods[J].Trends M icrobiol,2007,15(10):469-475.
[6]Agustín Correa,Dr.Pablo Oppezzo.Tuning differentexpression parameters to achieve soluble recombinant proteins in E.coli:advantagesofhigh-throughputscreening[J].Biotechnology Journal,2011,6:715-730.
[7]DUAN Xuguo,CHEN Jian,WU Jing.Optim ization of pullulanase production in Escherichia coli by regulation of process conditionsand supplementw ith naturalosmolytes[J].Bioresource Technology,2013,146:379-385.
[8]WOUTERA Duetz,LORENZRüedi,ROBERTHermann,etal.Methods for intense aeration,grow th,storage,and replication of bacterialstrains inm icrotiter plates[J].Applied and EnvironmentalM icrobiology,2000,66(6):2641-2646.
[9]WOUTER A Duetz,BERNARD W itholt.Effectiveness of orbital shaking for the aeration of suspended bacterial cultures in square-deepwellmicrotiter plates[J].Biochem ical Engineering Journal,2001,7:113-115.
[10]王莹,郝玉有,庄英萍,等.微生物高通量筛选中微孔板KLa的测定[J].工业微生物,2010,40(2):15-19. WANG Ying,HAO Yuyou,ZHUANG Yingping,et al.Determ ination of KLa of microplate in high-throughput screening bioprocess[J].IndustrialM icrobiology,2010,40(2):15-19.(in Chinese)
[11]LEUNG DW,CHEN E,GOEDDEL D V.A method for random mutagenesis of a defined DNA segment using a modified polymerase chain reaction[J].Technique,1989,1(1):11-15.
[12]冯慧玲,李春梅,吴振芳,等.易错PCR技术提高黑曲霉N25植酸酶活力的研究[J].生物技术通报,2010,10:226-230. FENG Huiling,LIChunmei,WU Zhenfang,etal.Increasing activity of phytase from Aspergillus niger N25 by error-prone PCR[J].Biotechnology Bulletin,2010,10:226-230.(in Chinese)
[13]姚友旭,李雨霏,侯晟琦,等.基于易错PCR技术的中性内切葡聚糖酶基因的定向进化[J].农业生物技术学报,2011,19(6):1136-1143. YAO Youxu,LIYufei,HOU Shengqi,etal.Directed evolution ofneutralendoglucanase gene by error-prone PCR[J].Journal of Agricultural Biotechnology,2011,19(6):1136-1143.(in Chinese)
科技信息
欧盟评估一种发酵大豆提取物作为新资源食品的安全性
2016年7月28日,欧盟食品安全局发布了发酵大豆提取物NSK-SD○R作为新资源食品的安全性。
发酵大豆提取物NSK-SD○R经过标准处理后纳豆激酶酶活性为20 000-28 000纤维蛋白降解单位/克。欧盟评估小组认为发酵大豆提取物NSK-SD○R的产品说明、批次差异性以及稳定性较好不存在安全隐患。作为膳食补充剂每天的限量为100mgNSK-SD○R,适宜人群为35岁以上健康人群,孕妇和哺乳期妇女除外。
[信息来源]食品伙伴网.欧盟评估一种发酵大豆提取物作为新资源食品的安全性[EB/OL].(2016-8-1).http://news. foodmate.net/2016/08/389608.html
Establishment and Application of High-Throughput Screening M ethod for Pullulanase M utant Library
NIE Jianqi1,2,3,CHEN Ana1,2,3,LIU Xiuxia1,2,3,YANG Yankun1,2,3,BAIZhonghu*1,2,3
(1.National Engineering Laboratory for Cereal Fermention Technology,Jiangnan University,Wuxi 214122,China;2.Key Laboratory of Industrial Biotechnology,M inistry of Education,Jiangnan University,Wuxi 214122,China;3.Key Laboratory of Carbohydrate Chem istry and Biotechnology,M inistry of Education,Jiangnan University,Wuxi214122,China)
Pullulanase gene(GenBank Accession No:AX203843)washeterologous expression in BL21(DE3)in shake flask and scale-down to them icrotiter plate scale successfully.Based on microtiter plate,ahigh-throughputculturemethod and an efficienthigh-throughputdetectionmethod for pullulanase activity were established.Random mutagenesis on pullulanase gene was performed through error-prone PCR strategy.The error-prone PCR productswere recombinated in expression vector pET-28a(+)-pelB and then introducted into BL21(DE3)to constructmutant library.The High-throughput screening method for Pullulanase in study was used to screen themutant library efficiently and optimum mutant4A4 was screened,the pullulanase activity in supernatant improved 1.465 folds.Thismethod not only is also applicable to high-throughput screening of amylase andcellulase,but also provides a new way for high-throughput screening of strain library and directed evolution of proteins.
pullulanase,m icrotiterplate,high-throughputscreening,scale-down,mutant library
Q 815
A
1673—1689(2016)09—0993—08
2015-01-09
国家973计划项目(2013CB733602);中央高校基本科研业务费专项资金项目(JUSRP51401A)。
白仲虎(1965—),男,河南郑州人,博士,教授,博士研究生导师,主要从事生物医药蛋白高效表达和过程方面的研究。E-mail:baizhonghu@jiangnan.edu.cn
