不对称合成苯乳酸的酮酸还原酶基因克隆和表达
2016-11-10张玲玲许国超
张玲玲, 许国超, 倪 晔*
(1.江南大学 生物工程学院,江苏 无锡,214122;2.江南大学 工业生物技术教育部重点实验室,江苏 无锡214122)
不对称合成苯乳酸的酮酸还原酶基因克隆和表达
张玲玲1,2,许国超1,2,倪晔*1,2
(1.江南大学 生物工程学院,江苏 无锡,214122;2.江南大学 工业生物技术教育部重点实验室,江苏 无锡214122)
采用分子克隆手段从基因组数据库中获得5个可以不对称还原苯丙酮酸合成手性苯乳酸的酮酸还原酶,并在大肠杆菌BL21(DE3)中成功表达。比较5个重组酮酸还原酶的酶活、转化率、ee值等指标,来源于干酪乳杆菌的酮酸还原酶Lc KAR表现出最高的比活力和选择性。纯酶Lc KAR的比活力为0.32 U/mg,在不对称还原反应中遵循Prelog规则,产物为(R)-苯乳酸,且ee>99%。对重组大肠杆菌BL21(DE3)/pET28a-LcKAR的培养基及发酵条件进行优化,最适培养条件为种龄6 h,接种体积分数为3%,诱导剂IPTG浓度为0.6 mmol/L,诱导时间为5 h,经发酵培养后Lc KAR的发酵酶活达到2.17×103U/L。
苯乳酸;酮酸还原酶;生物催化;不对称还原;发酵优化
苯乳酸(Phenyllactic acid,PLA),又名2-羟基-3苯基丙酸,是一类非常重要的化合物,在医药及生物防腐剂等方面具有非常广泛的应用。苯乳酸具有与其衍生物丹参素(β-3,4一二羟基苯基乳酸钠)相同的药理功能,可以调节人体内的类固醇的水平和抗血小板聚集的活性。苯乳酸也是合成许多药物的重要中间物,比如:降血糖药恩格列酮(Englitazone)、非蛋白氨基酸施德丁(Statine)、抗艾滋病毒制剂、新型驱肠虫药PFl022A等[1]。此外,近年来发现苯乳酸可作为新型的生物防腐剂,且具有非常广泛的抗菌谱,对革兰氏阳性菌(如金黄色葡萄球菌、单核增生性李斯特菌)、革兰氏阴性菌(如大肠杆菌、沙门氏菌)和真核微生物(如曲霉青霉)等均有抑制作用。
利用生物法合成苯乳酸的研究一直是国内外研究的热点,可分为发酵法和生物催化法。早在1986年,Kamata M等[2]人开始利用Brevibacterium lactofermentum发酵制备(R)-PLA,产物质量浓度为1.94 g/L;2004年,李德茂等[3]采用菌株Staphylococcus haemolyticus T0l发酵制备 (R)-PLA,产量为1.59 g/L。2013年,郁书怀等[4]通过菌株 Pediococcus pentosaceus发酵生产苯乳酸,产物质量浓度仅为0.91 g/L(5.5 mmol/L);通过发酵法生产苯乳酸的产物水平低,不能达到工业应用的要求。生物催化法主要是利用还原酶将前手性的苯丙酮酸(Phenylpyruvic acid,PPA)不对称还原生成苯乳酸。2000年,Lavermicoccca P等[1]发现 Lactobacillus plantarum菌株能用于不对称合成(R)-PLA,产物质量浓度为0.056 g/L;2011年,郑兆娟等[5]人采用菌株Bacillus coagulans还原PPA制备苯乳酸,产物质量浓度可达到37.3 g/L,2013年,通过定点突变的方法对来源于Lactobacillus bulgaricus的羰基还原酶进行改造,1.5 h内可将50 mmol/L苯丙酮酸还原为苯乳酸,且立体选择性ee>99%[6]。因此,开发高效不对称合成苯乳酸的催化剂具有重要的应用前景。
不对称合成苯乳酸的还原酶广泛地存在于大自然界中,我们可以从环境中筛选出高活力、高转化率的还原酶产生菌株。然而,目标酶在野生菌中的表达量较低,进而导致底物的上载量无法达到工业应用的要求。伴随着基因数据库资源的不断增加和蛋白质工程改造技术的发展,获得高效生物催化剂的时间逐渐缩短[7]。
作者通过对基因数据库筛选,获得5个酮酸还原酶基因 ,分别 来源于Escherichia coli、Saccharomyces cerevisiae、Lactobacillusplantarum、Kluyveromyces sp.、Lactobacillus casei,将它们在E.coli BL21(DE3)中重组表达,筛选得到能高效不对称合成光学纯苯乳酸的酮酸还原酶,并对其培养基组成及发酵产酶的条件进行了优化。
1 材料与方法
1.1菌株、质粒与试剂
所用的菌株和质粒详见表1。Ezup柱式细菌/酵母基因组提取试剂盒:上海生工生物有限公司;苯乳酸(PLA):Sigma公司;苯丙酮酸(PPA):上海笛柏化学品技术有限公司;氧化型 (NAD+)和还原型(NADH)烟酰胺腺嘌呤二核苷酸:上海玉博生物有限公司;其余试剂和药品均为国产或进口分析纯。

表1 本研究所用菌株和质粒Table 1 Strains and p lasm ids used in this study
1.2酮酸还原酶的克隆与表达
使用Ezup柱式细菌/酵母基因组提取试剂盒分别提取 E.coli、L.casei、L.plantarum、S.cerevisiae,Kluveromyces sp.的基因组。以表2所列的引物进行PCR扩增目的基因,经Nde I和Xho I双酶切后连接至载体pET24a或pET28a,并转入大肠杆菌BL21(DE3)。将重组子接种于含50μg/mL卡那青霉素的LB培养基中,37℃培养过夜。次日以2%的接种体积分数转入新鲜的LB培养基中,培养至OD660约为0.6时,加入终浓度为0.6 mmol/L的IPTG,30℃诱导5 h。然后,4℃、8 000 r/min离心收集菌体,生理盐水洗涤两次后加入10mL磷酸钾缓冲液(100mmol/L,pH 7.0),超声破碎,离心取上清液即为粗酶液。根据方法1.3测定酶活力,并进行SDS-PAGE分析。

表2 本研究中所用引物Table 2 Primers used in this study
1.3酮酸还原酶活力的测定
酮酸还原酶的活性测定方法:总反应体系为250μL,包括磷酸钾缓冲液 (KPB,100mmol/L,pH 7.0),0.5 mmol/L NADH,5 mmol/L PPA,混匀后于30℃保温2 min,加入适量的酶液,检测NADH在340 nm处吸收值的变化。酶活力单位(U)定义为:在上述条件下,每分钟催化氧化1μmol NADH所需要的酶量。酶活力计算公式:
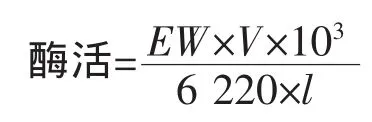
其中,EW为1 min内340 nm处吸光值的变化;V为反应液的总体积 (mL);6 220为摩尔消光系数(L/(mol·cm));l为光程距离(cm)。
蛋白质含量测定采用Bradford法,以小牛血清白蛋白BSA为标准品[8]。

1.4水相中不对称合成2-羟基-3-苯基丙酸
于10 mL KPB(100 mmol/L,pH 6.0)中加入适量的菌体,0.05 mmol/L NADH和10 g/L PPA,在30℃、200 r/min反应12 h。取一部分混合液8 000 r/min离心5 min,除去菌体等不溶物质,按照方法1.5进行HPLC分析;将另一部分混合液于8 000 r/min离心10 min,充分去除杂质,上清液用3倍体积的乙酸乙酯萃取3次,加入过量的无水硫酸镁过夜干燥,将处理后的样品高速离心后按照方法1.6进行对映选择性分析。
1.5HPLC分析苯丙酮酸和苯乳酸
采用反相HPLC分析底物及产物,色谱柱为Agilent Zorbax SB-C18(150 mm×4.6 mm,5μm),流动相成分:0.5 g/L三氟乙酸/水(A)和0.5 g/L三氟乙酸/甲醇(B)混合液。梯度洗脱程序为:0~20 min 10%~100%B;20~25 min保持100%B;柱温:30℃;流速1 mL/min。苯丙酮酸的检测波长为290 nm,保留时间17.5min,苯乳酸的检测波长为210 nm,保留时间9.5min。
1.6HPLC分析苯乳酸的手性
通过正相HPLC分析苯乳酸的手性,采用配有Chiralcel OJ-H(0.46 mm×250 mm×5μm)色谱柱的Agilent 1100 HPLC,流动相为正己烷/异丙醇/三氟乙酸(95/5/0.05),1.0mL/min流速,检测器波长为210 nm,30℃柱温,(R)-PLA保留时间32.8 min,(S)-PLA保留时间35.5min。
2 结果与讨论
2.1不同来源的酮酸还原酶的克隆表达
以Bacillus coagulans(GenBankNO:ZP-04430752)[9]、Bacillus coagulans(GenBank NO:ZP-04430367.1)[9]、Saccharomyces cerevisiae(GenBank NO:NM-001183405)[10]的3个乳酸脱氢酶为探针,在基因数据库中进行同源性比对,克隆表达与探针同源性在(60%~80%)的基因序列,它们分别来自于E.coli、Saccharomycescerevisiae、Lactobacillus plantarum、Kluyveromyces sp.、Lactobacillus casei的还原酶基因。测序结果与 GenBank中登记的Lp KAR(NC_004567.2,951 bp)、Ec KAR(EU895958,1233 bp)、Sc KAR(DAA07141,1031 bp)、Kl KAR(CBL74568.1,1475 bp)、Lc KAR(AEA57175,936 bp)的大小一致。将构建好的重组菌经诱导表达后,通过SDS-PAGE分析各蛋白质的表达效果,结果见图1。酮酸还原酶Lc KAR和Sc KAR表达量明显较其它还原酶多,但大部分Sc KAR为不可溶蛋白质,这可能是因为Sc KAR来源于真核微生物,而绝大部分Lc KAR以可溶蛋白质的形式表达。其余3种酮酸还原酶Lp KAR、Ec KAR、Kl KAR的蛋白质表达量较少(低于Sc KAR表达量的50%)。

图1 重组酮酸还原酶Lp KAR、Ec KAR、Sc KAR、Kl KAR、Lc KAR的SDS-PAGE电泳图谱Fig.1 SDS-PAGE analysis of recombinant expression of Lp KAR,Lc KAR,Sc KAR,Kl KAR and Ec KAR
2.2水相中不对称合成2-羟基-3-苯基丙酸
按照实验1.4的方法不对称还原PPA,反应12 h后分析转化率及对映选择性。来源于L.casei的重组酮酸还原酶Lc KAR表现出对PPA较高的比活力,纯酶活力为0.32 U/mg,且对映选择性大于99%,是理想的后续研究对象。来源于酵母菌的两个酮酸还原酶Sc KAR和Kl KAR倾向于不对称合成(S)-PLA,而其余的菌株倾向于不对称合成 (R)-PLA,在不对称还原过程中遵循Prelog规则。虽然Kl KAR活性不高(约0.11 U/mg),但对映选择性较高(>99%ee)。与此相反,来源于L.plantarum的酮酸还原酶Lp KAR虽然具有较高的活性(0.31 U/mg),但对映选择性较低(10.7%ee)。
2.3酮酸还原酶序列分析
对分别来源于Lactobacillus plantarum(Lp KAR,PDBID:3EVT_A),Lactobacilluscasei(Lc KAR,AEA57175),Pediococcuspentosaceus(Pp LDH,ABJ67935)[11],Pediococcusacidilactici(Pa LDH,ABJ67935)[12],Lactobaciiius bulgaricus(Lb LDH,PDB ID:1J4A)[13]的酮酸还原酶的序列进行一致性分析。结果显示,Lc KAR与Lp CR,Pp LDH,Pa LDH,Lb LDH的氨基酸序列同源性分别为 43.37%、19.77%、21.93%、19.13%。然后使用ESPript工具对上述5个酮酸还原酶的氨基酸序列进行比对,见图2。发现Lc KAR,Lp CR,Pp LDH,Pa LDH,Lb LDH属于酮酸还原酶家族,NADH依赖型。且保守序列Arg234是羧基或羰基底物的结合位点,可促进NADH与其相邻的辅酶结合位点结合,保守序列Val77和Gly78是底物结合位点[14]。有研究表明,第52位和第299位氨基酸通常位于底物结合位点,这两个位点的长链氨基酸突变为短链氨基酸可以大大增加底物的转化效率[6]。
2.4E.coli BL21(DE3)/pET28a-Lc KAR发酵产酶条件的优化
2.4.1发酵培养基的优化培养基的成分大致可分为碳源、氮源、无机盐、生长因子等,对微生物生长的不同阶段的新陈代谢及异源蛋白质的表达提供原料。碳源是为微生物提供能源,组成细胞成分的碳架。氮源是构成菌体细胞物质,并为微生物提供能源及合成含氮代谢产物。无机盐为微生物生长提供必需的矿质元素,这些元素可以参与酶的合成,构成酶活性基团,激活酶活性,维持细胞渗透压等。因此培养基的组成和配比合适与否,对微生物的生长发育、异源蛋白的表达都会产生很大的影响。考虑到生产发酵成本,作者在LB培养基的基础上,根据大肠杆菌生长发酵特性,选择了常用的、廉价的有机和无机碳氮源,通过摇瓶水平对培养基的组成进行了优化,实验设计见表3。
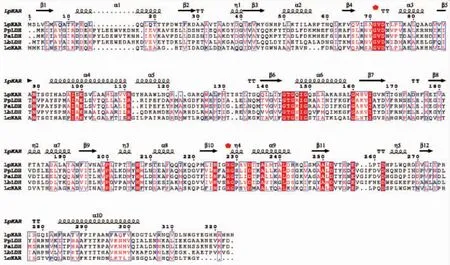
图2 α-酮酸脱氢酶的氨基酸序列对比Fig.2 Am ino acid sequence alignments of various 2-hydroxyacid dehydrogenases

表3 发酵培养基成分的优化Table 3 Optim ization of fermentation media
培养基优化结果见图3。对比1号、2号培养基可以看出,1号进口培养基的LcKAR的酶活力较高,细胞量低于国产培养基,进口培养基的丰富营养有利于外源蛋白质的表达,但是其成本较高。对比3、4号培养基,加入甘油比加入葡萄糖的培养中Lc KAR的活力更高,细胞量更多,这可能是因为与甘油相比,葡萄糖更易利用,导致细胞快速生长,但外源蛋白质的表达受到延滞,而甘油不仅可为微生物的生长提供碳源,还可以为外源蛋白质的合成提供重要的碳原料等。对比2号、6号发现,加入蛋白胨的培养基比加入比玉米浆的培养基的Lc KAR的活力较高,但细胞量较少,这可能是因为动物来源的氮源比植物来源的氮源营养更丰富,有利于外源蛋白质的分泌和表达,玉米浆是玉米淀粉生产的副产物,灭菌后有大量不溶物杂质,导致离心后测定湿菌重增加。相比3号,5号柠檬酸的加入不利于菌体的生长和Lc KAR的表达。从生产成本和效益上考虑最终选择的发酵培养基的组成为:国产蛋白胨10 g/L,国产酵母粉8 g/L,氯化钠10 g/L,甘油3 g/L,K2HPO44 g/L,(NH4)2SO43 g/L。
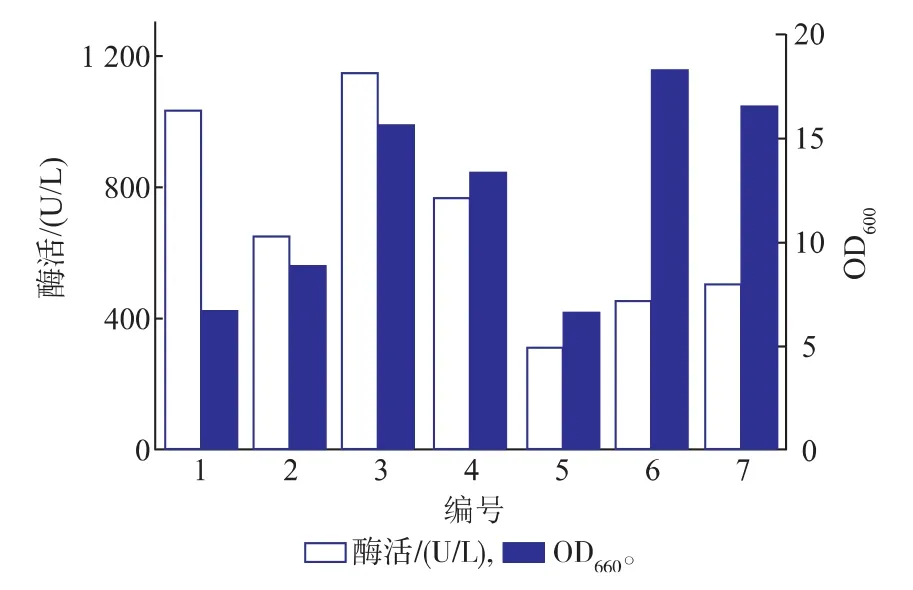
图3 不同培养基中E.coli BL21(DE3)/pET28a-LcKAR的生长和产酶对比Fig.3 Comparison of the grow th and enzyme production in differentmedium
2.4.2诱导温度及诱导剂浓度、诱导时机、诱导时间的优化发酵条件会影响菌体的生长和产酶,研究了诱导温度、诱导时间、诱导时机、诱导剂的浓度对菌株发酵产酶的影响,结果见图4。当诱导温度从16℃上升至30℃时,酶活力逐渐增大,30℃时达到最大,当诱导温度继续上升时活性反而下降;0.5~1.5 h时开始诱导,酶活力不断增加,在1.5 h(OD660约为0.6)时开始诱导的酶活力最高,此后随着诱导开始时间延长,酶活力逐渐下降。Lc KAR的酶活力随诱导时间也呈现出先增加后降低的趋势,当诱导时间为5 h时酶活力达到最高。当IPTG浓度从0.2 mmol/L上升至0.6 mmol/L时,Lc KAR的酶活力逐渐增加,在IPTG为0.6mmol/L时达到最高,然后随着IPTG的浓度的增加而降低。因此,最佳诱导温度为30℃,诱导开始时间为1.5 h,IPTG浓度为0.6 mmol/L,诱导时间为5 h,在上述条件下Lc KAR酶活力为1.42×103U/L。
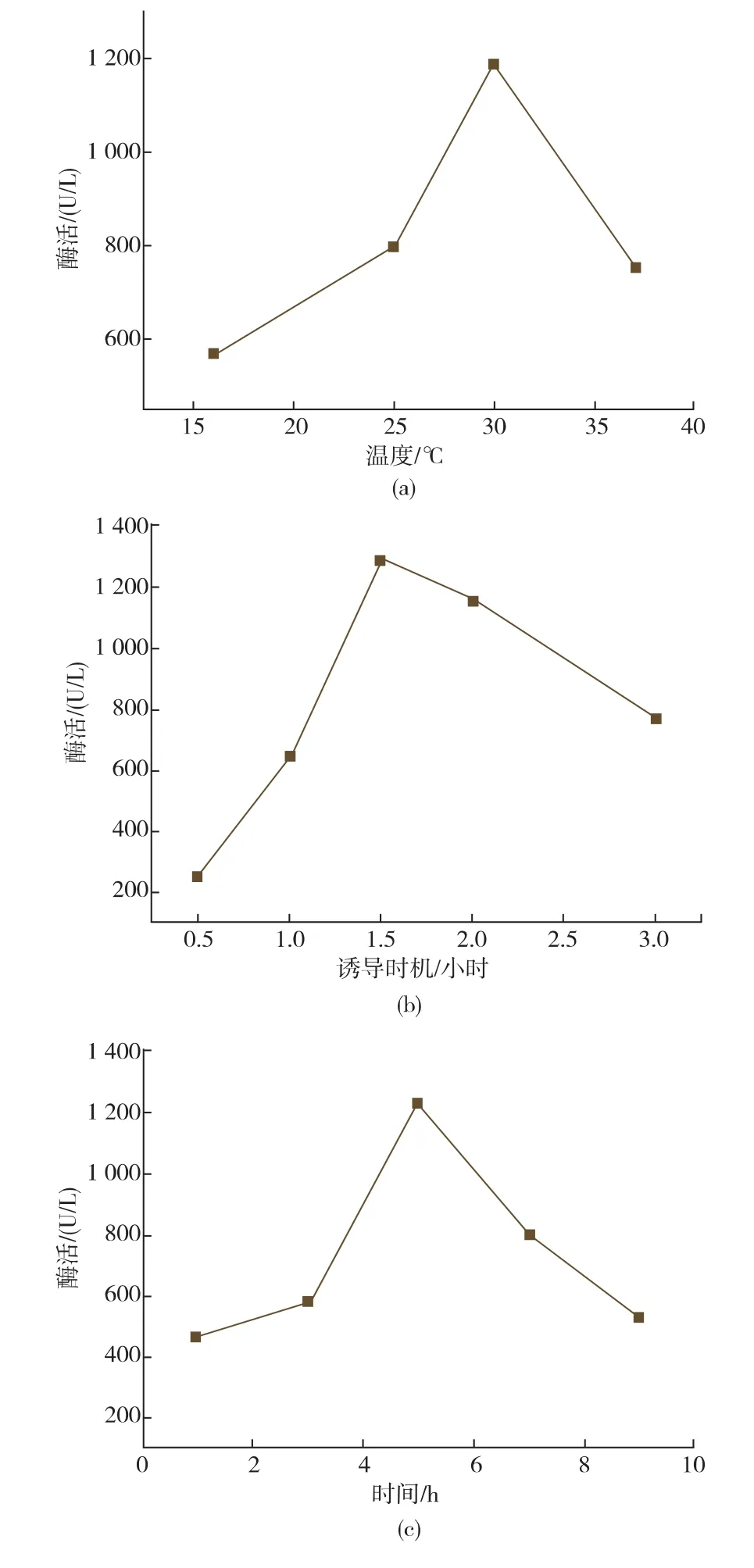

图4 诱导温度、诱导时机、诱导时间和IPTG浓度对大肠杆菌重组表达Lc KAR酶活的影响Fig.4 Effect of inducing tem perature,inducing occasion,inducing time and IPTG concentration on the activity of recombinant Lc KAR
2.4.3种龄的优化为确定最佳种龄,研究了E.coli BL21(DE3)/pET28a-LcKAR的生长曲线,见图5(a)。培养时间5~8 h,即为对数生长中后期。为了进一步确定最佳种龄,分别于种龄为2、3、4、5、6、7、8、9 h时转接,1.5 h后加入终浓度为0.6 mmol/L IPTG诱导5 h。由图5(b)可知,随着种龄的增加,Lc KAR的酶活力逐渐增大,当种龄为6 h时酶活力最大,为1.92×103U/L。当种龄继续增加时,酶活力逐渐下降。这可能是因为种龄过小,菌种还处在延缓期,转接之后菌体早期生长缓慢。而当种龄过大,有些菌体可能已经开始衰亡,因此选择最佳种龄为6 h,此时期的菌体生长活力强,移种到发酵罐后能迅速生长以缩短延滞期,且具有稳定的生产能力,外源蛋白质的合成持续稳定高产。
2.4.4接种体积分数的优化接种体积分数的大小决定了生产菌株在发酵罐中生长繁殖的速度。采用较大的接种体积分数可以缩短发酵罐中菌体适应培养基的时间,迅速生长到对数生长期。而接种体积分数过小,除了延长发酵周期外,往往还会引起其它不正常情况。因此接种体积分数对发酵产酶影响很大。采用种龄6 h和0.6 mmol/L IPTG,诱导时机1.5 h,诱导时间5 h,考察不同的接种体积分数对发酵产酶的影响,见图6。当接种体积分数为3%时,酶活力最高为1.96×103U/L,当接种体积分数低于或高于3%时,酮酸还原酶Lc KAR的活力都有所下降。因此确定最佳接种体积分数为3%。

图5 E.coli BL21(DE3)/pET28a-LcKAR生长曲线及不同种龄对Lc KAR的产酶的影响Fig.5 Grow th curve of E.coli BL21(DE3)/pET28a-LcKAR and Effect of seed ages on Lc KAR production

图6 不同接种体积分数对Lc KAR的产酶的影响Fig.6 Effect of inoculation ratio on Lc KAR production
2.4.5E.coli BL21(DE3)/pET28a-LcKAR于3 L发酵罐中的发酵培养将种龄为6 h的E.coli BL21(DE3)/pET28a-LcKAR,以3%的接种体积分数接种于3 L发酵罐 (含1 L上述优化的培养基),在上述优化的条件下进行培养,每小时取样检测其活力与OD660的变化情况,结果见图7。产酶与细胞生长是偶联型的关系,Lc KAR的表达量随着发酵时间的延长不断升高,在发酵时间为8 h时酶活力达到最大,发酵酶活为 2.17×103U/L,约是Staphylococcus haemolyticus T0l[3]的58.5倍,是来源于Bacillus coagulans[4]还原酶的2.5倍。但随时间的延长,Lc KAR的酶活力逐渐下降,这可能是因为在对数后期和平稳期时细胞内蛋白酶的积累,导致异源表达的Lc KAR的产量下降。

图7 3 L发酵罐中菌体浓度和Lc KAR酶活的时间进程曲线Fig.7 Time course of cell density and Lc KAR activity in a 3 L bioreactor
3 结语
从基因数据库中成功克隆表达了5个能不对称还原苯丙酮酸合成苯乳酸的酮酸还原酶,并筛选得到来源于Lactobacillus casei的还原酶Lc KAR,其具有较高催化活性和对映选择性(ee>99%)。对重组表达LcKAR发酵条件进行了优化,诱导温度30℃,IPTG浓度0.6mmol/L,诱导时间5 h。采用上述条件在3 L罐中发酵,发酵酶活达到2.17×103U/L。本研究为生物催化法制备光学纯苯乳酸提供了新的工具酶,为进一步利用该酶生产苯乳酸提供了理论支持。
[1]LAVERM ICOCCA P,VALERIO F,EVIDENTE A,etal.Purification and characterization of novel antifungal compounds from the sourdough Lactobacillus plantarum strain 21B[J].Applied and EnvironmentalM icrobiology,2000,66(9):4084-4088.
[2]KAMATA M,TOYOMASU R,SUZUKID,et al.D-phenyllactic acid production by Brevibacterium or Corynebacterium[P]. Japan Patent:JP86108396,1986-05-10.
[3]李德茂,李从发,刘四新,等.3-苯基乳酸的研究进展[J].药物生物技术,2004,11(5):344-347. LIDemao,LIChongfa,LIU Sixin,etal.The research progress of 3-phenyllactic acid[J].Chinese Journal of Pharmaceutical Biotechnology,2004,11(5):344-347.(in Chinese)
[4]YU S H,ZHU L J,ZHOU C,et al.Enzymatic production of D-3-phenyllactic acidby Pediococcus pentosaceus D-lactate dehydrogenase w ith NADH regeneration by Ogataea parapolymorpha formate dehydrogenase[J].Biotechnology Letters,2014,36(5):627-631.
[5]ZHENG Z J,MA C Q,XU P,et al.Efficient conversion of phenylpyruvic acid to phenyl lactic acid by using whole cells of Bacillus coagulans SDM[J].PloSONE,2011,6(4):e19030.
[6]ZHENG Z J,SHENG B B,GAO C,etal.Highly stereoselective biosynthesisof(R)-α-hydroxy carboxylic acids through rationally re-designedmutation of D-lactate dehydrogenase[J].Scientific Reports,2013,e03401.
[7]陶军华,林国强.生物催化在制药工业的应用-发现、开发与生产[M].北京:化学工业出版社,2010.
[8]KRUGERN J.The Protein ProtocolsHandbook[M].Totowa:Humana Press,2002.
[9]李振伟.重组精氨酸脱亚胺酶的异源表达、纯化及性质研究[D].无锡:江南大学,2008.
[10]WOHIGE R.Asymmetric biocatalysisw ith m icrobial enzymes and cells[J].Current Opinion in M icrobiology,2010,13(3):283-292.
[11]YU SH,YIH,JIANG B,etal.Characterization of D-Lactate dehydrogenase producing D-3-phenyllactic acid from Pediococcus pentosaceus[J].Bioscience Biotechnology and Biochem istry,2012,76(4):853-855.
[12]MU W,YU S,JIANG B,et al.Characterization of D-lactate dehydrogenas from Pediococcus acidilactici that converts phenylpyruvic acid into phenyllactic acid[J].Biotechnology Letters,2012,34(6):907-911.
[13]NATHALIE B,KEYJI J,THIERRY F,et al.NAD+-dependent D-2-hydroxyisocaproate dehydrogenase of Lactobacillus delbrueckii subsp.bulgaricus gene cloning and enzyme characterization[J].European Journal of Biochem istry,1994,224(7):439-446.
[14]UWE D,KARSTEN N,M ICHAEL K,et al.Crystal structure of a ternary complex of D-2-hydroxyisocaproate dehydrogenase from Lactobacillus casei NAD+and 2-oxoisocaproate at1.9Åresolution[J].Journal of M olecular Biolology,1997,267(35):640-660.
科技信息
澳新拟允许植物甾醇添加于部分早餐中
2016年7月28日,据澳新食品标准局(FSANZ)消息,澳新食品标准局发布通知公告20-16,拟批准A1134号申请,修订澳新食品标准法典部分要求,允许新资源食品植物甾醇添加于部分控制的谷物早餐中,其中“部分控制”是指单独包装的部分,或容易分割的部分。具体使用条件如下:谷物早餐的总纤维含量不低于3 g/50 g;早餐麦片中含有的总糖不超过30 g/100 g;总植物甾醇含量不低于0.8 g,不超过2 g。
[信息来源]厦门WTO工作站.澳新拟允许植物甾醇添加于部分早餐中 [EB/OL].(2016-8-1).http://www.xmtbt-sps. gov.cn/detail.asp?id=52182
Cloning and Expression of Ketoacid Reductase for Asymmetric Synthesis of Phenyllactic Acid
ZHANG Lingling1,2, XU Guochao1,2, NIYe*1,2
(1.School of Biotechnology,JiangnanUniversity,Wuxi 214122,China;2.Key Laboratory of Industrial Biotechnology,M inistry of Education,Jiangnan University,Wuxi214122,China)
Phenyllactic acid was one of themost important compounds w ith w ide application in pharmaceuticals and biological preservatives.Five ketoacid reductases capable of asymmetric reduction of phenylpyruvic acid(PPA)into phenyllactic acid(PLA)were obtained from genome databases,and were heterogeneously over-expressed in E.coli BL21(DE3).Among 5 enzymes,the recombinant ketoacid reductase from Lactobacillus casei(Lc KAR)displayed the best biocatalytic performance,w iththehighest specificactivityof 0.32U/mgof purifiedenzymeand enantioselectivity of>99%.This Lc KAR obeys Prelog rule in the asymmetric reduction of PPA into(R)-PLA.The fermentationmedium composition and culture conditionsof recombinant E.coli BL21(DE3)/pET28a-Lc KAR were optim ized to be seed age of 6 h,3%inoculation,induced w ith 0.6 mmol/L IPTG at30℃for 5 h.Under above optimal conditions,the Lc KAR production could reach2.17 kU/L in a 3 L bioreactor.
phenyllactic acid,ketoacid reductase,biocatalysis,asymmetric reduction,fermentation optimization
Q 93
A
1673—1689(2016)09—0950—08
2014-11-12
国家自然科学基金项目(21276112);国家973计划项目(2011CB710800);教育部新世纪优秀人才计划项目(NCET-11-0658)。
倪晔(1975—),女,江苏无锡人,理学博士,教授,博士研究生导师,主要从事生物催化和酶工程方面研究。E-mail:yni@jiangnan.edu.cn
