响应面优化菊芋菊糖的提取工艺研究
2016-11-10陈小银杨丽丽
刘 燕 陈小银 杨丽丽 谢 瑞 何 楠 张 继*
(1.西北师范大学生命科学学院,兰州 730070; 2.甘肃特色植物有效成分制品工程技术研究中心,兰州 730070)
响应面优化菊芋菊糖的提取工艺研究
刘 燕1,2陈小银1杨丽丽1谢 瑞1何 楠1张 继1,2*
(1.西北师范大学生命科学学院,兰州 730070;2.甘肃特色植物有效成分制品工程技术研究中心,兰州 730070)
利用单因素实验及响应面法优化确定菊芋块茎中菊糖的提取工艺。通过单因素实验筛选出液固比、提取时间、提取温度3个主要因素,以菊糖得率为响应值利用Design Expert V8.0中心组合试验设计,建立菊糖提取得率的二次回归方程,得到优化组合条件。响应面法分析结果表明,当液固比为18∶1(mL·g-1),提取时间41 min,提取温度86℃时,验证优化工艺得菊芋块茎中菊糖的最大提取得率40.56%,接近于模型预测值40.74%。在该工艺条件下,对菊糖进行粗制,并通过红外光谱仪对所提取的菊糖进行了结构分析。该法用于提取菊芋块茎中的菊糖,工艺简单、成本低,具有一定的应用价值。
菊芋;菊糖;响应面法;提取工艺
菊芋(HelianthustuberosusL.)又名洋姜,为菊科(Compositae)向日葵属(Helianthus)宿根性草本植物。秋季开花,长有黄色的小盘花,形如菊,生产上一般用块茎繁殖。其地下块茎可以食用,煮食或熬粥,腌制咸菜,晒制菊芋干,或作为制取淀粉和酒精原料[1~2]。地上茎也可加工作饲料,其块茎或茎叶入药具有利水除湿,清热凉血,益胃和中之功效[3]。块茎中富含菊糖,还含有淀粉、蛋白质、粗纤维等成分。菊糖是一种天然果聚糖,由D-果糖通过β(1→2)糖苷键组成,在适宜的条件下,菊糖可被水解为果糖和葡萄糖。高聚糖浆具有甜度高、冷甜性、风味的不掩盖性,溶解度高和保健型等特点,在饮料等食品工业中得到了越来越多的应用,而且可以作为特殊人群如糖尿病患者、运动员等的甜味剂和营养源,此外还可改变食物消化过程,增加饱腹感,防止肥胖[4]。菊芋的生态适应能力强,具有耐旱、抗旱、耐瘠薄、抗风沙、改善盐碱土地、繁殖力强、无病虫害、保持水土等优点[5~6]。由此可见,种植菊芋具有很客观的经济效益和广阔的开发前景。
目前,在西欧、北欧以菊芋块茎为原料,通过提取菊糖后利用菊糖酶一步催化反应生产高果糖浆已开始产业化, 发现其具有产物得率高、杂质少、对设备要求低、耗能小、产品分离纯化容易等优点[7~9]。而我国在这方面起步晚,但是对菊芋的功效和利用越来越重视。本实验利用单因素实验及响应面法优化对菊芋块茎中菊糖的提取工艺进行优化,以使得菊糖得率得到最大化,为进一步开发利用菊芋提供参考依据[10~12]。
1 材料与方法
1.1 材料与试剂
新鲜菊芋于2014年11月来自甘肃兰州,所购原材料为红皮菊芋。苯酚(AR,烟台市双双化工),浓硫酸(≧98%,北京化工),3,5-二硝基水杨酸(AR,上海中泰),无水亚硫酸钠(AR,上海硫酸厂),酒石酸钾钠(AR,宜兴化学试剂厂),柠檬酸(AR,天津福晨)磷酸氢二钠(AR,上海中泰)。
1.2 仪器与设备
HSY2-SP恒温水浴锅(北京科伟),JD500-3电子天平(沈阳龙腾),C21-SDHCB66T苏泊尔超薄电磁炉(浙江苏泊尔),UV1000紫外可见分光光度计(北京莱伯泰科),IS10傅立叶变换红外光谱仪(美国Thermo),WF-130万能粉碎机(江阴康和),DHG-9143B5电热恒温鼓风干燥箱(上海新苗)。
1.3 实验方法
1.3.1 样品的预处理
将所购新鲜菊芋洗净、切片后,在室温下阴干,用粉碎机破碎至一定粒度得菊芋干粉,60℃烘箱干燥至恒重后备用。
1.3.2 标准曲线的制作
将葡萄糖在恒温干燥箱中105℃干燥至恒重,准确称取100 mg于100 mL小烧杯中,用少量蒸馏水溶解后,移入100 mL容量瓶中用蒸馏水定容至100 mL,充分混匀得1 mg·mL-1的葡萄糖标准液,于4℃冰箱中保存待用。
总糖的测定采用苯酚-硫酸法[13]。分别吸取1 mg·mL-1葡萄糖标准溶液0、0.1、0.2、0.3、0.4、0.5 mL于6支干燥试管中,分别加蒸馏水至1.0 mL,然后缓慢加入6%苯酚3.0 mL,迅速滴加98%浓硫酸5.0 mL,振荡均匀后于室温放置30 min,490 nm处测吸光度。以葡萄糖浓度为横坐标,吸光度为纵坐标,绘制标准曲线。
还原糖测定采用3,5-二硝基水杨酸比色法[14~15]。取6支20 mL刻度试管,分别加入1 mg·mL-1葡萄糖标准溶液0、0.1、0.2、0.3、0.4、0.5 mL,分别补加蒸馏水至0.5 mL,各加入1.5 mL pH4.8磷酸缓冲液及3 mL DNS试剂,充分混合,沸水浴煮沸7 min显色,流水冷却后用蒸馏水稀释至10 mL,在波长530 nm处测吸光度。以还原糖浓度为横坐标,吸光度为纵坐标,绘制标准曲线。
1.3.3 菊芋中菊糖含量测定
菊芋中总糖含量的测定:精确量取1 mL菊糖浸提液置于50 mL容量瓶中,加蒸馏水定容至刻度;摇匀后,分别准确吸取0.1 mL溶液加入3支干燥试管,按总糖标准曲线测定方法,490 nm处测定溶液吸光度,根据标准曲线求得菊芋中总糖含量。
菊芋中还原糖含量的测定:精确量取菊糖浸提液1 mL于10 mL容量瓶中,蒸馏水定容至刻度线,混匀后吸取0.5 mL于3支试管中,按标准曲线方法处理样品后530 nm处测定吸光度,根据标准曲线求得菊芋中还原糖含量[16]。
菊糖浓度=总糖浓度-还原糖浓度
1.3.4 响应面试验
参阅文献方法比较,用热水浸提法有较多优点[17~18]。影响菊糖提取效果较为显著的因素主要是料液比、水浴温度、提取时间,分别进行单因素实验探究其对菊糖提取率的影响水平。结合单因素实验结果并在此基础上,选取影响菊芋中菊糖提取率的主要因素:料液比、水浴温度、提取时间为考察变量,以菊糖得率为评价指标,采用Design Expert V8.0进行实验设计。
1.3.5 菊糖的粗制及理化性质
菊糖提取液用氧化钙—磷酸法脱蛋白。先用Ca(OH)2溶液将提取液调至pH11,80℃水浴保温50 min,抽滤,用磷酸调至pH2,90℃水浴保温70 min,继续用Ca(OH)2溶液将提取液调至pH5。抽滤、浓缩后,取滤液按料醇比1∶3(mL·mL-1)加入无水乙醇,搅拌、静置至沉淀析出后抽滤,保留滤饼冷冻干燥。
分别取菊芋菊糖进行苯酚—硫酸反应、茚三酮反应、碘—碘化钾反应、双缩脲反应、斐林试剂反应,统计实验结果。
1.3.6菊糖的红外光谱分析[19~20]
将提取的菊芋多糖样品与KBr压片(质量比1∶100-200),用Thermo Nicolet iS10红外光谱仪扫描,波长范围400~4000 cm-1,扫描16次,分辨率为4 cm-1。
2 结果与分析
2.1 菊糖提取的单因素实验
设定提取温度为90℃,提取时间为30 min条件下,考察液固比对菊芋多糖提取率的影响。由图1(a)可以看出,随着液固比的增大,菊糖提取率呈现先增大后减小的变化趋势。当液固比为15 mL·g-1时,菊糖提取率达到最大值37.50%。原因可能是液固比较小时,不足以使菊芋中的多糖充分的溶出;液固比过大,会消耗更多的能量和时间使有效成分溶出。
设定液固比为20(mL·g-1),提取温度为90℃条件下,考察提取时间对菊芋多糖提取率的影响。由图1(b)可以看出,随着提取时间的增大,菊糖提取率呈现增大的变化趋势。当提取时间为70 min时,菊糖提取率达到最大值32.66%。在提取时间为40 min时,菊糖提取率为31.72%,随后变化趋势趋于稳定,说明在40 min菊糖基本完全溶出,40 min可作为菊糖的最佳提取时间。
设定为液固比20(mL·g-1),提取时间为30 min条件下,考察提取温度对菊芋多糖提取率的影响。由图1(c) 可以看出,随着提取温度的升高,菊糖提取率呈现先增大后减小的变化趋势。提取温度为85℃时,菊糖提取率达到最大值37.28%。这可能是高温破坏了部分糖的结构使其降解,且温度越低浸提液的颜色越深,可能是温度较低时浸提液中酚类底物的含量越多,酚类物质氧化发生褐变所致。
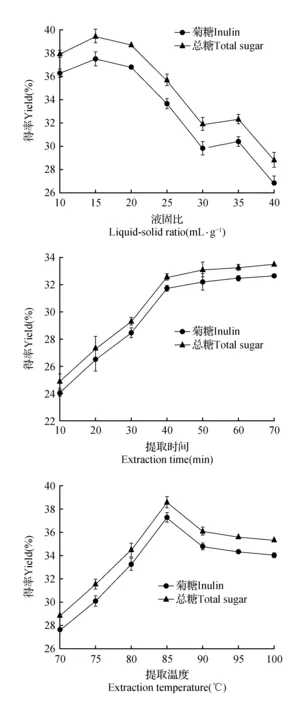
图1 液固比(a)、提取时间(b)和提取温度(c)对菊糖提取率的影响Fig.1 Effects of liquid-solid ratio(a),time(b)and temperature(c)on the extraction yield of inulin
2.2 响应面法优化菊芋多糖提取工艺
2.2.1 Design Expert V8.0设计及试验结果
根据Design Expert V8.0的中心组合试验设计原理,结合单因素实验结果,选取液固比、提取时间、提取温度这3个因素,采用3因素3水平的响应面分析方法优化提取工艺参数。响应面试验因素水平表见表1,在单因素实验的基础上,利用响应面法确定菊芋中菊糖的最佳提取工艺,设计及试验结果如表2所示。
表1响应面试验因素水平
Table1Levelsandcodeofresponsesurfaceexperiment

水平Level液固比Liquid⁃to⁃solidratio(mL·g-1)提取时间Time(min)提取温度Temperature(℃)-110308001540851205090
表2响应面实验设计结果
Table2Theresponsesurfacedesignofexperimentresults

序号No.液固比(A)Liquid⁃to⁃solidratio时间(B)Time温度(C)Temperature菊糖得率Extractionyieldofinulin(%)1-1-1020.0021-1033.813-11020.29411035.715-10-118.70610-133.087-10123.89810136.8790-1-128.211001-127.47110-1130.091201132.271300038.501400038.891500038.421600038.771700037.96
2.2.2 回归模型的建立与分析
利用Design Expert V8.0软件对表2实验数据进行回归分析,得二次回归模型方程为:
菊糖得率(%)=-1 315.572 10+9.746 90×A+2.553 97×B+28.276 24×C+8.017 46E-003×A×B-0.014 037×A×C+0.014 610×B×C-0.248 66×A2-0.048 384×B2-0.166 23×C2。
通过回归模型分析响应面的回归参数(表3~4)。由表3可以看出:模型P<0.000 1,模型极显著;失拟项P=0.160 1>0.05,失拟项不显著。表3中显示A、C、A2、B2、C2对提取率的影响较大,达到极显著P<0.000 1,其次是B、BC,达到显著P<0.05。
从表4可以看出,模型的R2=0.997 9,校正系数(R2Adj)为0.995 2,预测系数(R2Pred)为0.976 0,R2预测值与R2校正值较为接近,因而该模型拟合程度较好,可以用此模型来分析和预测菊芋中菊糖的提取工艺条件。
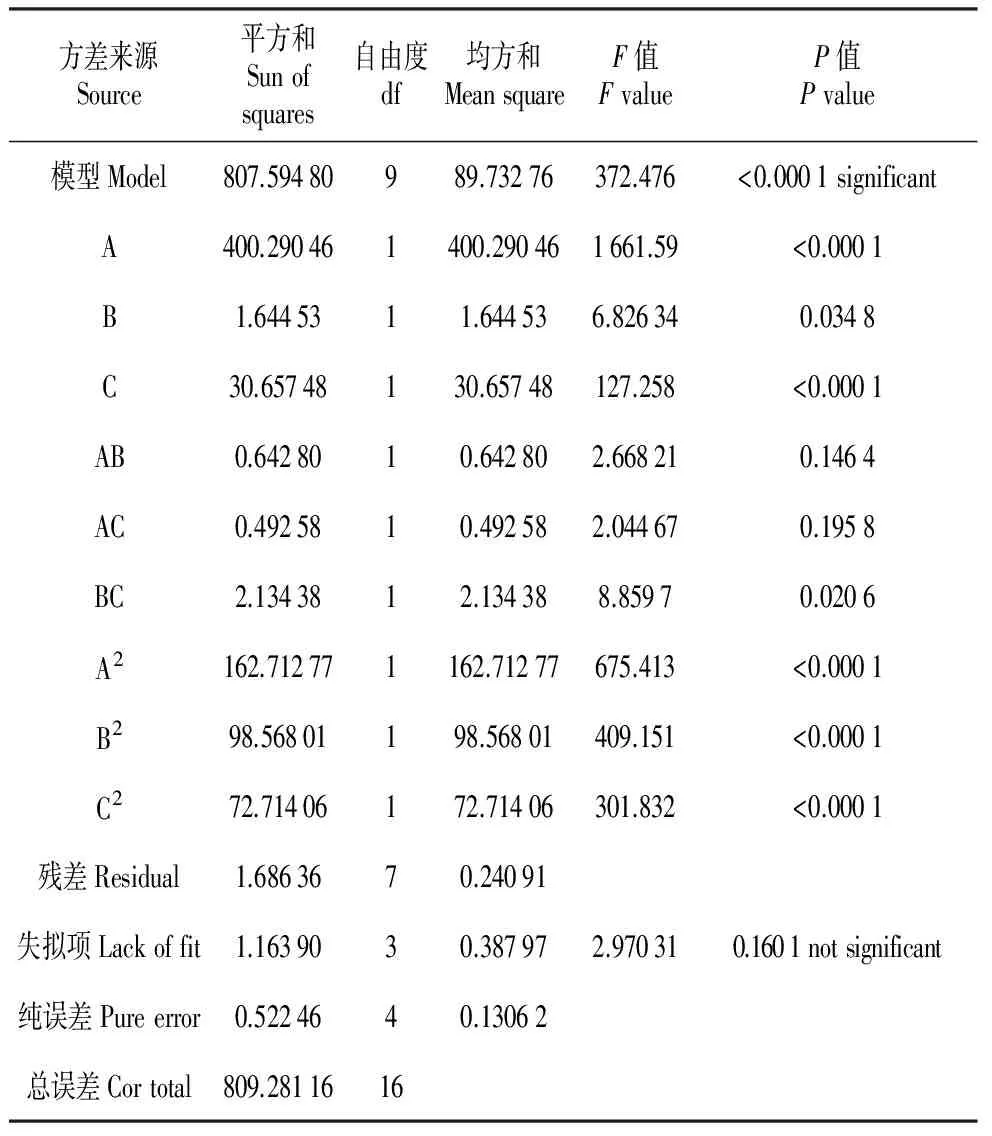
表3 模型方差分析

表4 R2综合分析
2.2.3 提取工艺的响应曲面分析与优化
根据菊糖得率的回归方程获得相应的响应面图和等高线图,如图2所示。
由图2液固比和提取时间对菊芋多糖含量的交互影响的响应面图(Ⅰ)可以看出,随着提取时间的延长,菊芋多糖得率逐渐增高,提取时间达到40min后,多糖含量趋于平衡;随着液固比的增大,菊糖在溶液中的溶出率先增大后减小;由提取温度与液固比对菊芋多糖含量的交互影响响应面图(Ⅱ)可以看出,温度升高,多糖含量增加,同时由于温度升高,多糖的降解也加剧,因此,温度过高不利于菊芋多糖的提取;由提取时间与提取温度对菊芋多糖含量的交互影响响应面图(Ⅲ)可以看出,提取时间增加,有助于提取的进行;但提取时间过长,也会引起多糖的部分降解;温度太低不利于反应的进行,太高又会造成多糖水解。
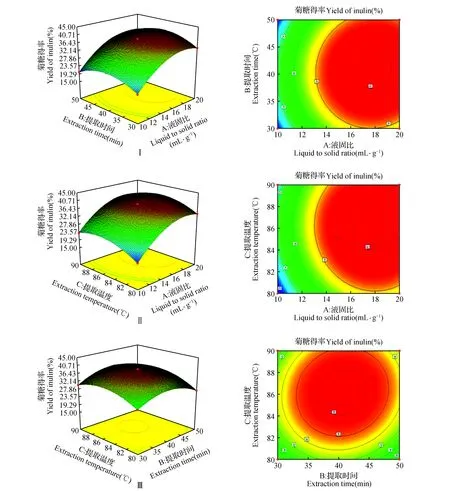
图2 因素交互作用对菊糖提取率影响的响应曲面和等高线Fig.2 Response surface plot and contour plot showing the effects of extraction conditions on extraction yield of inulin
结合图2中各组图可知,每个响应曲面均为开口向下的凸形曲面,说明响应值菊糖得率在3个因素设计范围内存在最大值。综合表3和各因素间响应曲面及其等高线图可知,各因素中液固比和提取温度对菊糖提取率的影响较大(P<0.000 1),交互效应对菊糖提取率的影响:BC>AB>AC。
2.2.4 优化提取参数及验证试验
通过软件对数据进一步分析,可得模型理论最佳条件为液固比17.83∶1(mL·g-1)、提取时间40.86 min、提取温度86.09℃,在此条件下,模型预测菊糖得率为40.74%。
为了检验响应面法的可行性,采用得到的最佳工艺参数进行菊芋中菊糖提取工艺的验证试验,同时考虑到实际操作和生产的便利,将上述优化提取条件工艺参数修正为:液固比18∶1(mL·g-1)、提取时间41 min、提取温度86℃。在此条件下对菊芋中菊糖进行热水浸提的验证实验,重复实验三次,取平均值,实际菊糖提取率为40.56 %,提取率与预测结果接近度为99.56 %,说明响应法得到的工艺参数稳定可靠,适合菊芋中菊糖的提取,有一定实践操作价值。在此优化条件下对菊芋中菊糖进行二次提取,得到二次提取液中菊糖平均含量为3.78%,为菊芋块茎中菊糖的开发与利用提供了一定的参考。
2.2.5 菊糖的理化性质
从显色反应的结果来看,苯酚—硫酸反应和斐林试剂反应成阳性,表明菊糖是还原性多糖。茚三酮反应、碘—碘化钾反应、双缩脲反应均为阴性,表明菊糖中不含蛋白质和淀粉。
2.2.6 红外光谱分析结果
以响应面法优化菊芋菊糖提取工艺所得参数对菊糖进行提取后,将所得菊糖充分干燥,扫描其红外光谱,得到图3。由图3可以看出:3 384.85 cm-1处有一个很强的吸收峰,为缔合羟基(0H)的伸缩振动吸收峰; 32 00~2 800 cm-1之间吸收峰较弱,是C—H的伸缩振动区,2 925.19 cm-1附近为亚甲基(C—H)对称伸缩振动吸收峰:1 632.42 cm-1出现了较强的吸收峰,1 400~1 200cm-1出现的吸收峰是C—H的弯曲振动吸收峰;因C—O键的极性较大,红外吸收峰较强,故在1 131.13 cm-1处为伯醇的吸收峰;环醚在1 260~780 cm-1出现两个峰,高频端为C—O—C的不对称伸缩振动,低频端为C—O—C的对称伸缩振动,故图中1 032.00 cm-1为呋喃环醚键(C—O—C)的伸缩振动,937.03 cm-1处吸收峰为果糖基呋喃环的对称伸缩振动;900 cm-1以下的指纹区还存在较多密集而复杂的吸收峰,许多峰难以归属,但可以反应具体化合物结构上的微小差别。
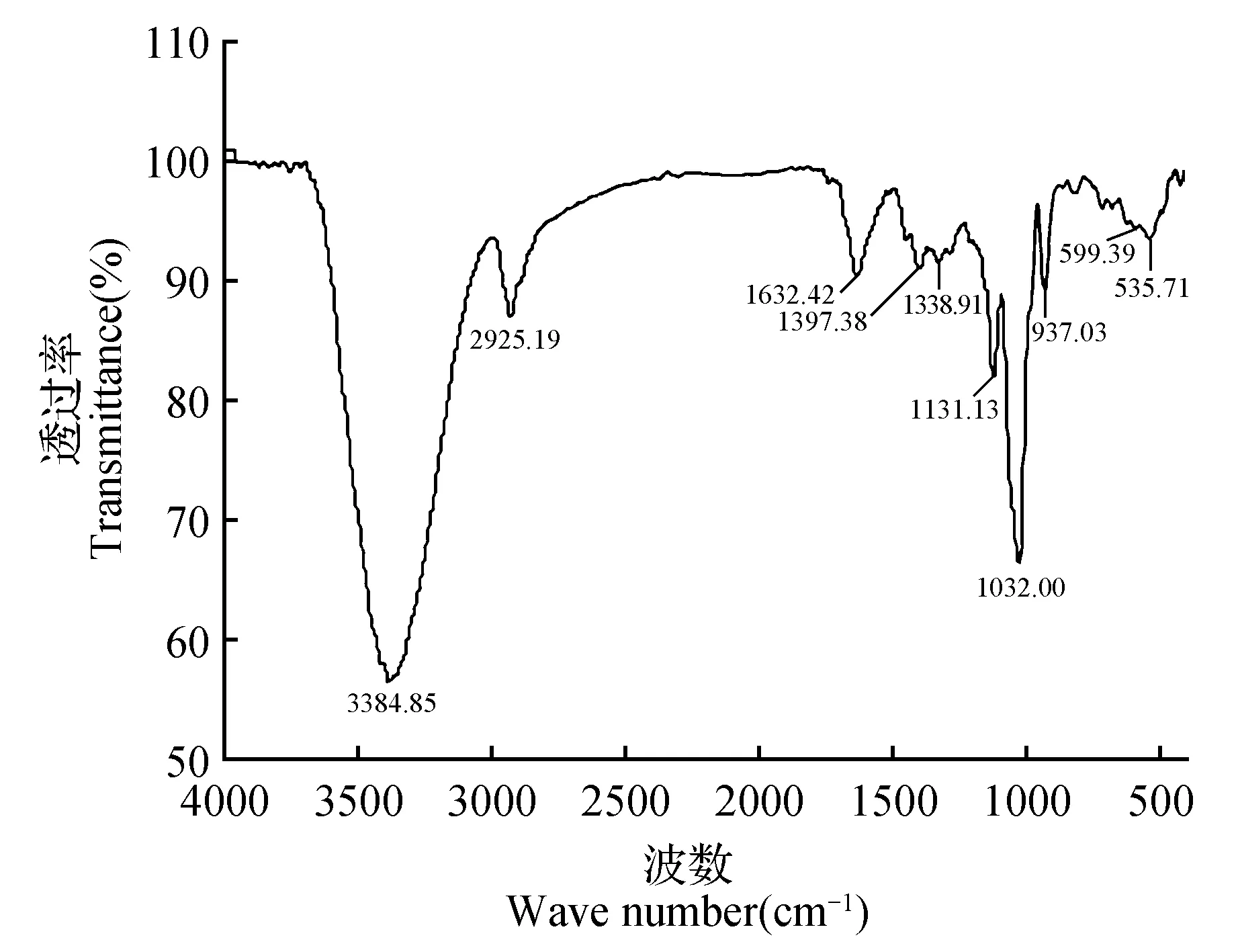
图3 菊糖的红外光谱图Fig.3 Infrared spectrum of inulin
3 结论
本实验在单因素实验的基础上,通过响应面试验设计方法考察了液固比、提取时间、提取温度对菊芋菊糖提取率的影响。根据二次回归方程优化得菊芋菊糖的最佳提取工艺为: 液固比18∶1(mL·g-1)、提取时间41 min、提取温度86℃。回归分析和实验结果表明,在该工艺条件下,提取率为40.56%,与预测值40.74%较接近。通过红外检测初步分析了菊糖的结构,包括菊糖中各种显著的官能团。利用热水浸提法提取菊芋中菊糖的方法,实验步骤少,操作简单,经济高效,可以在相关的工业生产中进行推广和应用。
1.孔涛,张楠,林凤梅,等.不同品种菊芋块茎及茎叶营养成分分析比较[J].广东农业科,2013,40(6):108-109,113.
Kong T,Zhang N,Liu F M,et al.Analysis and comparison of stem leaf and tubernutritionalcomposition in different Jerusalem artichoke[J].Guangdong Agricultural Sciences,2013,40(6):108-109,113.
2.Sarchami T,Rehmann L.Optimizing enzymatic hydrolysis of inulin from Jerusalem artichoke tubers for fermentative butanol production[J].Biomassand Bioenergy,2014,69:175-182.
3.孙纪录,贾英民,桑亚新.菊芋资源的开发利用[J].食品科技,2003,18(1):27-29.
Sun J L,Jia Y M,Sang Y X.The development and utilization ofJerusalemartichokeresource[J].Food Science and Technology,2003,18(1):27-29.
4.曾小宇,罗登林,刘胜男,等.菊糖的研究现状与开发前景[J].中国食品添加剂,2010(4):222-227.
Zeng X Y,Luo D L,Liu S N,et al.Recent advance and future trend ofinulin research and development[J].China Food Additives,2010(4):222-227.
5.巩慧玲,李善家,李志忠.不同品种菊芋总酚含量、PPO活性、POD活性及其与褐变的关系[J].中国蔬菜,2011,31(12):65-69.
Gong H L,Li S J,Li Z Z.Studies on relation between phenol content,activities of PPO and POD,and browning of different artichok cultivars[J].China Vegetables,2011,31(12):65-69.
6.张泽生,聂洪霞,王婧宜,等.菊芋为原料生产高果糖浆工艺技术的研究[J].食品工业,2011(6):61-63.
Zhang Z S,Nie H X,Wang J Y,et al.Study on production of high-fructosesyrup fromJerusalemartichokes[J].The Food Industry,2011(6):61-63.
7.Matías J,Encinar J M,González J,et al.Optimisation of ethanol fermentation ofJerusalemartichoketuber juice using simple technology for a decentralisedand sustainable ethanol production[J].Energy for Sustainable Development,2015,25:34-39.
8.Li W C,Zhang J,Yu C W,et al.Extraction,degree of polymerization determination and prebioticeffect evaluation of inulin fromJerusalemartichoke[J].Carbohydrate Polymers,2015,121:315-319.
9.Kim S,Kim C H.Evaluation of whole Jerusalem artichoke(HelianthustuberosusL.) for consolidated bioprocessing ethanol production[J].Renewable Energy,2014,65:83-91.
10.冯学花,张国升,陶阿丽,等.响应面法优化厚朴中和厚朴酚与厚朴酚的提取工艺研究[J].植物研究,2014,34(1):103-107,113.
Feng X H,Zhang G S,Tao A L,et al.Extraction of magnolol and honokiolin magnoliae cortex by response surface method[J].Bulletin of Botanical Research,2014,34(1):103-107,113.
11.朱媛,张雪松,黄小忠.响应面法优化茶多酚乙酰化工艺条件[J].天然产物研究与开发,2015,27(2):306-313.
Zhu Y,Zhang X S,Huang X Z.Optimization of acetylationconditions oftea polyphenols using response surface methodology[J].Natural Product Research and Development,2015,27(2):306-313.
12.王洪政,李媛媛,刘伟,等.响应面法优化牡丹果荚多糖提取工艺及其抗氧化活性评估[J].植物研究,2015,35(1):127-132.
Wang H Z,Li Y Y,Liu W,et al.Optimizing polysaccharide extraction from peony tree pod using response surface method and assessing its antioxidative activity[J].Bulletin of Botanical Research,2015,35(1):127-132.
13.郁玮,杨小明,刘伟民,等.苯酚—硫酸法测定无花果中多糖含量的研究[J].食品科技,2009,34(10):256-258,262.
Yu W,Yang X M,Liu W M.Assay study on content of polysaccharides inFicuscaricaby phenol-sulfuric acid method[J].Food Science and Technology,2009,34(10):256-258,262.
14.樊晓辉,赵春玲,张成军,等.3,5-二硝基水杨酸法测定枸杞提取液中多糖的含量[J].食品研究与开发,2014,35(21):77-80.
Fan X H,Zhao C L,Zhang C J,et al.Determination of polysaccharide content in extraction solution ofLycriumbarbarumwith 3,5-dinitrosalicylicacidmethod[J].Food Research and Development,2014,35(21):77-80.
15.杨贵明,蒋爱华,薛秋生.用DNS光度法测定还原糖的条件研究[J].安徽农业科学,2006,34(14):3258,3264.
Yang G M,Jiang A H,Xue Q S.Study on the determination factorof reducedsugar with DNS spectrophotometry[J].Journal of Anhui Agricultural Sciences,2006,34(14):3258,3264.
16.赵琳静,李洪森,陈婷婷,等.菊芋菊糖含量的测定[J].化工生产与技术,2010,17(4):43-45.
Zhao L J,Li H S,Chen T T,et al.Determination of inulin fromJerusalemartichoketubers[J].Chemical Production and Technology,2010,17(4):43-45.
17.陈秀枝,沈辰婷,曹未音,等.菊芋中菊糖提取方法的比较[J].江苏农业科学,2013,41(11):312-314.
Chen X Z,Shen C T,Cao W Y,et al.Comparative study on extraction methods of inulin fromJerusalemartichoke[J].Jiangsu Agricultural Sciences,2013,41(11):312-314.
18.林平,张莹,祖元刚,等.核桃楸叶片中总黄酮的最佳提取工艺研究[J].植物研究,2007,27(5):616-618.
Lin P,Zhang Y,Zu Y G,et al.Optimum extraction process of total flavonoids inJuglansmandshuricaleaves[J].Bulletin of Botanical Research,2007,27(5):616-618.
19.许福超,薛志欣,叶乃好,等.浒苔多糖的提取、提纯和分析[J].科学技术与工程,2010,10(10):2413-2415,2433.
Xu F C,Xue Z X,Ye N H,et al.Isolation,purification and analysis on the polysaccharide ofEnteromorpha[J].Science Technology and Engineering,2010,10(10):2413-2415,2433.
20.王硕,袁洪福,宋春风,等.小西瓜糖度表征与漫反射近红外检测方法的研究[J].光谱学与光谱分析,2012,32(8):2122-2125.
Wang S,Yuan H F,Song C F,et al.Sugar characterization of mini-watermelon and rapid sugar determination by near infrared diffuse reflectance spectroscopy[J].Spectroscopy and Spectral Analysis,2012,32(8):2122-2125.
National Key Technology R&D Program of the Ministry of Science and Technology of China
introduction:LIU Yan(1990—),female,master,Mainly engaged in the Development and Utilization of Plant Resources research.
date:2015-11-03
ExtractionProcessOptimizationofInulinfromHelianthustuberosusL.byResponseSurfaceMethodology
LIU Yan1,2CHEN Xiao-Yin1YANG Li-Li1XIE Rui1HE Nan1ZHANG Ji1,2*
(1.College of Life Science,Northwest Normal University, Lanzhou 730070;2.Research Center For Gansu Distinctive Plants,Northwest Normal University,Lanzhou 730070)
Single-factor tests and response surface method (RSM) were used to optimize the extraction process ofHelianthustuberosusL. inulin in tubers.In order to obtain the maximum of extraction yield of the inulin, three main factors including liquid-solid ratio, extraction times and extraction temperature were selected with the Design Expert V8.0 design, and a quadric regression equation for predicting the yield of inulin was established. The results showed that the optimum extraction conditions were as follows: liquid-solid ratio of 18∶1(mL·g-1), extraction time of 41 min and extraction temperature of 85℃. Under the conditions, the optimum extracting yield of inulin was 40.56%, which is well matched with the predictive extracting yield of 40.74%. Under the process, we carried out the rough inulin and analyzed extraction of the inulin by infrared spectrum with the simple and low cost process.
HelianthustuberosusL.;inulin;response surface methodology;extraction process
国家科技支撑计划(2012BAD20B06);国家自然基金(31200255)
刘燕(1990—),女,硕士研究生,主要从事植物资源的开发与利用方面的研究。
* 通信作者:E-mail:1156479951@qq.com
2015-11-03
* Corresponding author:E-mail:1156479951@qq.com
TS244+.1
A
10.7525/j.issn.1673-5102.2016.04.020
