H2S信号和WRKY在ABA调节根生长和气孔运动中的关系
2016-11-10孙丽敏裴雁曦刘志强
孙丽敏 裴雁曦 刘志强
(山西大学生命科学学院,太原 030006)
H2S信号和WRKY在ABA调节根生长和气孔运动中的关系
孙丽敏 裴雁曦 刘志强*
(山西大学生命科学学院,太原 030006)
气体信号分子硫化氢(H2S)和植物激素脱落酸(ABA)都可以调节植物的种子萌发、根生长、气孔运动、逆境响应等生理过程,但两者之间的关系了解非常有限。转录因子WRKY18、WRKY40和WRKY60参与拟南芥对ABA信号的响应。本文以拟南芥野生型(WT),lcd(L型半胱氨酸脱巯基酶编码基因缺失突变体),wrky18wrky40wrky60(WRKY18、WRKY40和WRKY60编码基因缺失三突变体)为实验材料,研究在幼苗根生长和气孔运动过程中,H2S与ABA信号及WRKY之间的相互作用。实验结果表明:ABA处理可诱导WT的LCD基因表达量和内源H2S含量升高;外源H2S处理WT,WRKY40表达量下降,WRKY60表达量升高;lcd中WRKY18和WRKY40表达量升高,WRKY60表达量下降。幼苗根生长和气孔运动实验表明:与WT相比,lcd根生长和气孔运动受ABA影响作用较小;H2S对wrky18wrky40wrky60根生长的促进作用明显,并促进wrky18wrky40wrky60和WT气孔关闭,但两者间无显著差异。
H2S;ABA;WRKY转录因子
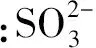
脱落酸(ABA)是一种植物激素,在20世纪60年代被人们发现,因其能促使叶子脱落而得名。ABA可以促进叶、花和果实的脱落,调节种子胚的发育,促进芽、种子休眠,抑制胚芽鞘、嫩枝、根和胚轴等器官的生长,影响性分化,调节气孔关闭[18~19];并且在植物抵御干旱、寒冷、盐碱、病害和紫外辐射等逆境胁迫的过程中起着非常重要的作用[20]。ABA受体对ABA识别是ABA信号转导的起始,Jin等报道生理浓度的外源H2S处理可以使拟南芥ABA受体编码基因表达量下降[21]。首次将H2S和ABA联系起来的Carlos GM等人推断,H2S可能与ABA相互作用共同调节植物生理代谢,增强植物抵御胁迫的能力[17]。
WRKY蛋白是植物中一类重要的转录因子,调控植物多种胁迫响应相关基因的转录[22]。WRKY转录因子不仅参与调节植物对细菌侵染、冷害、冻害、高盐、氧化损伤、干旱、高温等生物、非生物胁迫响应[23~25],而且参与胚胎发育,种皮和表皮毛发育,叶片衰老等多种生长发育过程[22,26~28]。拟南芥WRKY18、WRKY40、WRKY60可以与ABA的受体之一ABAR/LHCB相互作用,并且可以调节ABA信号中的关键基因ABI4和ABI5的转录[29~31],在这个过程中,三个WRKY转录因子互相协作,共同调节ABA信号通路[32~35]。
目前,关于H2S信号和ABA信号转导之间关系的报道较少。本研究以拟南芥野生型WT,H2S产生酶的编码基因LCD的缺失突变体lcd,WRKY18、WRKY40、WRKY60转录因子编码基因缺失三突变体wrky18wrky40wrky60为实验材料,研究H2S与WRKY基因及ABA信号通路之间的关系。
1 材料和方法
1.1 实验材料
本实验以拟南芥(Arabidopsisthaliana)野生型WT(Col-0)、H2S产生酶编码基因LCD(AT3G62130)缺失突变体lcd(stock no.SALK_082099),WRKY18(AT4G31800)、WRKY40(AT1G80840)和WRKY60(AT2G25000)编码基因缺失三突变体wrky18wrky40wrky60(由清华大学张大鹏教授馈赠)为实验材料。
1.2 培养条件与处理方法
1.2.1 幼苗生长培养条件
拟南芥的土壤培养:拟南芥野生型WT、突变体lcd、wrky18wrky40wrky60种子,4℃春化处理3 d,播种于蛭石∶营养土=2∶1(v/v)的土壤中,于16 h光照/8 h黑暗,相对湿度为60%,温度为(23±1)℃,光照强度3 000 lx条件下培养4周,进行H2S和ABA处理。
直接生长实验:取干燥的拟南芥WT、lcd种子经75%乙醇处理30 s~1 min,再用6% NaClO处理6~8 min进行表面消毒,之后用无菌水润洗种子4次。将WT、lcd种子分别点种于ABA浓度为0、0.4、0.8 μmol·L-1的1/2 MS固体培养基(表1),4℃春化处理3 d,转为16 h光照/8 h黑暗,相对湿度为60%,温度为(23±1)℃,光照强度为3 000 lx的条件下竖直放置培养12~14 d,拍照记录拟南芥幼苗根生长状况,并对其主根长度进行测量,实验重复3次。
移苗生长实验:按直接生长实验所述方法对拟南芥WT、lcd、wrky18wrky40wrky60种子进行消毒,之后将种子点种于1/2MS固体培养基,4℃春化处理3 d,转为16 h光照/8 h黑暗培养3 d。将萌发状态一致的WT、lcd、wrky18wrky40wrky60幼苗移于表2所列的1/2MS固体培养基,竖直放置培养7~10 d(培养条件同直接生长实验),拍照记录拟南芥幼苗根生长状况,并对其主根长度进行测量,实验重复3次。
1.2.2H2S和ABA处理
土壤培养中幼苗的H2S和ABA处理:外源H2S处理,生长4周的WT进行50 μmol·L-1H2S熏蒸8 h;外源ABA处理,生长4周的WT和lcd用100 μmol·L-1ABA处理8 h。
直接生长实验中幼苗的ABA和H2S处理见表1。
表1ABA和H2S对WT、lcd的处理
Table1ThetreatmentsofWTandlcdwithABAandH2S

材料Materials处理Treatments(μmol·L-1)WT0μmol·L-1ABA0.4μmol·L-1ABA0.8μmol·L-1ABAlcd0μmol·L-1ABA0.4μmol·L-1ABA0.8μmol·L-1ABAWT0μmol·L-1ABA+50μmol·L-1H2S0.4μmol·L-1ABA+50μmol·L-1H2S0.8μmol·L-1ABA+50μmol·L-1H2S
移苗生长实验中幼苗的H2S和ABA处理见表2。
表2ABA和H2S对WT、lcd、wrky18wrky40wrky60的处理
Table2ThetreatmentsofWT,lcdandwrky18wrky40wrky60withABAandH2S

材料Materials处理Treatments(μmol·L-1)WT0μmol·L-1ABA1μmol·L-1ABA2μmol·L-1ABAlcd0μmol·L-1ABA1μmol·L-1ABA2μmol·L-1ABAWT0μmol·L-1ABA+50μmol·L-1H2S1μmol·L-1ABA+50μmol·L-1H2S2μmol·L-1ABA+50μmol·L-1H2SWT0μmol·L-1H2S20μmol·L-1H2S40μmol·L-1H2S80μmol·L-1H2Swrky18wrky40wrky600μmol·L-1H2S20μmol·L-1H2S40μmol·L-1H2S80μmol·L-1H2S
1.3 RNA提取及qRT-PCR
取1.2.1和1.2.2中的植物材料,用TRIZOL试剂盒提取总RNA(Transgen Biotech),以Oligo(dT)18为引物反转录得到cDNA,以ACTIN7(AT5G09810)为内参进行qRT-PCR检测基因转录,具体实验参照孙[36]等人。所用引物序列为WRKY18:5′-AGACAACCCGTCACCT-3′和5′-GCATCGTATTATCCCTTT-3′;WRKY40:5′-CTCCCAAGAAACGCAA-3′和5′-GCAACTAACACGGACTGA-3′;WRKY60:5′-TTTTCACCGTCTTGTCT-3′和5′-ATGCTCTATCAATCTCCC-3′[30];LCD:5′-CAAGCATCAGCCAGCATT-3′和5′-AGGGATTACAGTTCACAGC-3′;ACTIN7:5′-CTCAGCACCTTCCAACAGATGTGGA-3′和5′-CCAAAAAAATGAACCAAGGACCAAA-3′[17]。以2-△Ct比较分析各个样品间基因表达水平的相对差异,实验重复3次。
1.4H2S含量的测定
H2S含量的测定参照亚甲基蓝法,按Shi[37]等人的描述并进行调整。取1.2.1和1.2.2中拟南芥组织0.2 g,加2 mL磷酸缓冲液(pH6.8,0.2 mol·L-1ASA,0.1 mol·L-1EDTA),充分研磨,得到样品匀浆,将样品匀浆置于放有500 μL 1% Zn(Ac)2小管的小三角瓶中(空白对照用磷酸缓冲液代替样品匀浆),加入1 mL 1 mol·L-1HCl启动反应,室温反应30 min,取出小三角瓶中的Zn(Ac)2小管,分别加入200 μL 20 mmol·L-1DPD和200 μL 30 mmol·L-1FeCl3,黑暗反应15 min,测定A667吸光度值,根据标准曲线计算H2S含量。
1.5 气孔开度的测定
取1.2.1中拟南芥WT、lcd、wrky18wrky40wrky60叶片,置于MES表皮条缓冲液中,于光照强度3 000 lx冷光源照射2 h,撕取叶片下表皮,用光学显微镜(OLYMPUS:CH20BIMF200)观察气孔开度并记录,再将叶片分别移于含30 μmol·L-1ABA、100 μmol·L-1H2S和不含ABA和H2S的叶片表皮条缓冲液中,继续光照1 h,再次观察气孔开度并记录,实验重复3次。
1.6 数据分析
实验数据用“平均值±标准偏差”表示,采用SPSS Statistics分析软件进行单因素方差分析,P<0.01和P<0.05分别表示差异极显著和差异显著。
2 实验结果
2.1ABA对拟南芥LCD相对表达量和内源H2S含量的影响
ABA是重要的植物激素,H2S是新兴的气体信号分子,为研究ABA和H2S之间的关系,取土壤培养4周的拟南芥WT进行外源ABA处理,测定植株LCD表达量和内源H2S含量,探究ABA对拟南芥幼苗LCD表达量和内源H2S含量的影响。qRT-PCR实验结果表明:与对照组相比,外源ABA处理诱导拟南芥WT的LCD表达量升高4.27倍(图1:A)。ABA诱导拟南芥WT的LCD表达量升高,因此对ABA处理后的WT内源H2S含量进行检测,结果表明内源H2S含量升高了22.9%(图1:B)。
2.2H2S对拟南芥WRKY18、WRKY40、WRKY60表达量的影响
拟南芥WRKY18、WRKY40、WRKY60参与ABA信号转导[30~31],而ABA调控LCD表达量和H2S含量(图1),因此对H2S处理后拟南芥WRKY18、WRKY40、WRKY60表达量进行检测。生长4周的WT和lcd,以及外源H2S(50 μmol·L-1)处理的WT植株,提取RNA后利用qRT-PCR测定WRKY18、WRKY40、WRKY60的相对表达量,结果如图2:与野生型WT相比,WRKY18表达量在lcd中显著升高,在外源H2S处理的WT中无明显变化;WRKY40表达量在lcd中明显升高,在外源H2S处理的WT中下降;WRKY60表达量在lcd中明显下降,在外源H2S处理的WT中显著升高。
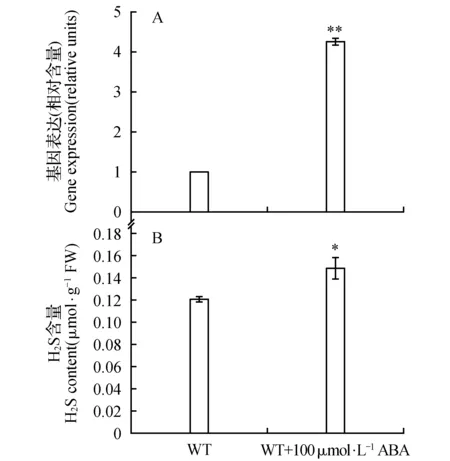
图1 ABA对LCD表达量(A)和内源H2S含量(B)的影响 A.外源ABA(100 μmol·L-1)对拟南芥野生型(WT)LCD表达量的调节;B.外源ABA(100 μmol·L-1)对拟南芥野生型(WT)内源H2S含量的调节 *P<0.05,**P<0.01,下同。Fig.1 The effect of ABA on the expression level of LCD(A) and the content of endogenous H2S(B) A. Influences of exogenous ABA(100 μmol·L-1) on the expression level of LCD in WT; B. Influences of exogenous ABA(100 μmol·L-1) on the content of endogenous H2S in WT *P<0.05,**P<0.01,the same as below.

图2 H2S对WRKY18、WRKY40、WRKY60基因表达的影响Fig.2 The effect of H2S on gene expression level of WRKY18,WRKY40 and WRKY60
2.3H2S对ABA调控拟南芥幼苗根生长和气孔运动的影响
H2S和ABA都对植物的生长有调节作用[2~3,18~20]。为研究H2S和ABA在调节拟南芥幼苗根生长过程中的相互作用,对H2S和ABA处理下的WT和lcd幼苗根生长进行观察。
2.3.1H2S对ABA调节幼苗直接生长的影响
拟南芥WT和lcd按1.2.1中直接生长实验所述进行培养,按1.2.2中表1所述进行处理,生长14 d后,观察并测定幼苗的主根长度。实验结果如图3所示,不含ABA的培养基中,H2S产生酶基因LCD表达下调的突变体lcd和50 μmol·L-1H2S熏蒸的WT与WT相比,主根生长状态有显著差异,lcd主根长度相对较短,而50 μmol·L-1H2S熏蒸的WT主根长度明显较长。在含有ABA的培养基上,随着ABA浓度升高,幼苗主根生长被逐渐抑制,而lcd与WT相比,其根生长受ABA抑制作用较弱,表现对ABA相对脱敏,差异极显著。
2.3.2H2S对ABA调节幼苗移苗生长的影响
拟南芥WT和lcd按1.2.1中移苗生长实验所述进行培养,按1.2.2中表2所述进行处理,竖直生长10 d后,观察并测定幼苗的主根长度。结果如图4所示,移至不含ABA的培养基上的WT和lcd幼苗,lcd主根短于WT;50 μmol·L-1H2S熏蒸的WT主根比WT长。移至含有ABA培养基上的WT和lcd幼苗,随着ABA浓度升高,幼苗主根生长都被逐渐抑制,但lcd表现对ABA相对脱敏的表型,差异极显著。
2.3.3H2S对ABA调节气孔运动的影响
ABA在调节植物气孔运动的过程中起着至关重要的作用,可以有效引起气孔关闭;H2S同样促进植物气孔关闭[15],因此观察拟南芥WT和lcd植株气孔对ABA的反应。
取生长4周的WT和lcd植株的叶片,按方法1.5中所述,观察ABA对拟南芥气孔运动的影响。实验结果如图5所示:未经ABA处理,WT和lcd的气孔平均开度约5 μm;30 μmol·L-1ABA处理叶片1 h后,WT和lcd的气孔开度都有所减小,但lcd的气孔开度受ABA调节作用较弱,与WT相比,表现出对ABA脱敏。

图3 H2S和ABA对幼苗直接生长的影响 A.幼苗生长情况;B.幼苗主根长度统计Fig.3 The effect of H2S and ABA on seedling growth A. The investigation of seedling growth; B. The measuration of seedling primary roots length

图4 H2S和ABA对移苗生长的影响 A.幼苗生长情况;B.幼苗主根长度统计Fig.4 The effect of H2S and ABA on postgermination growth A. The investigation of seedling growth; B. The measuration of seedling primary roots length
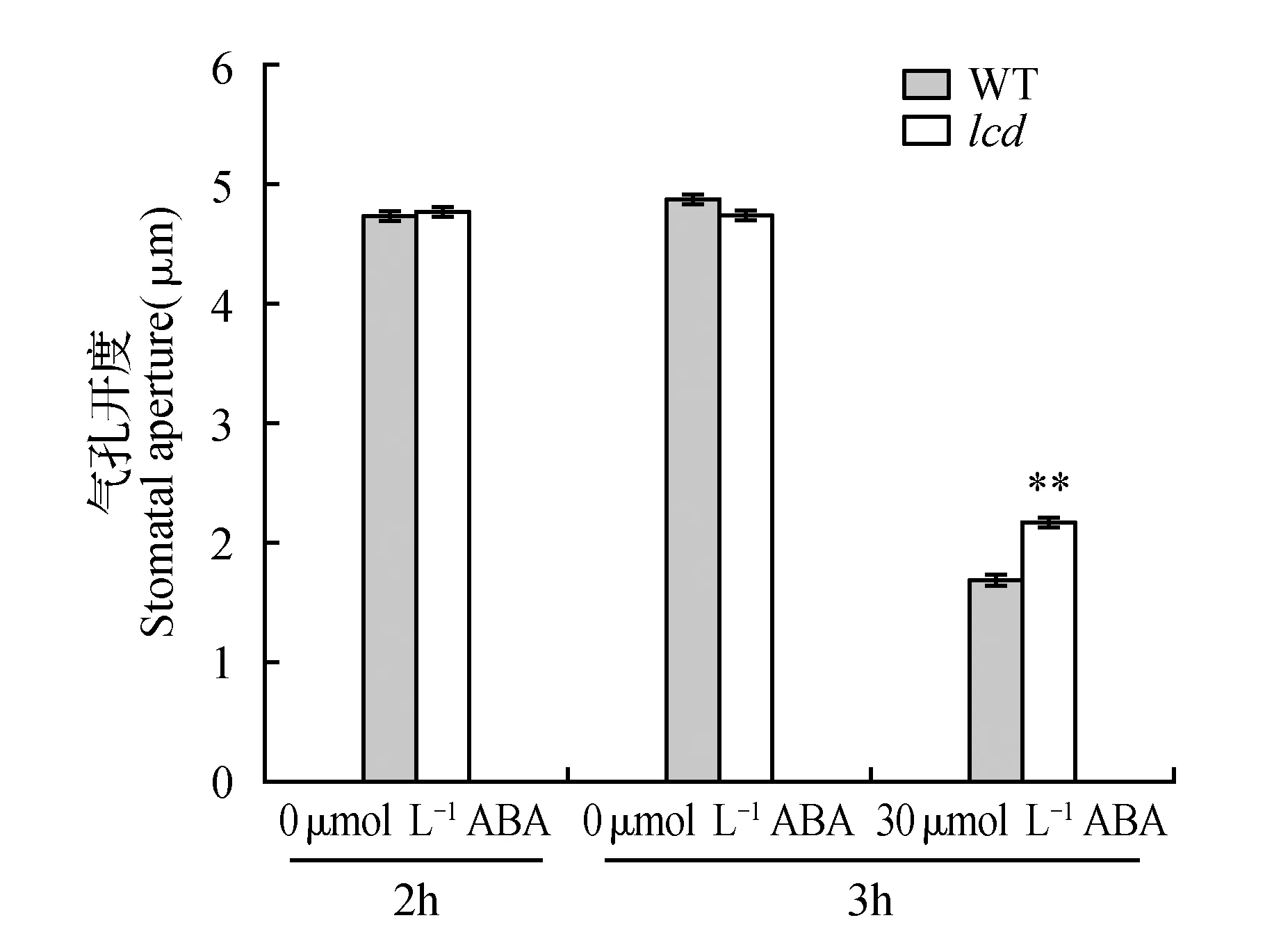
图5 外源ABA(30 μmol·L-1)对WT和lcd气孔运动的影响Fig.5 The effect of exogenous ABA(30 μmol·L-1) on stomatal movement of WT and lcd
2.4H2S对wrky18wrky40wrky60幼苗根生长和气孔运动的调节
H2S能调节拟南芥WRKY18、WRKY40和WRKY60的基因表达(图2),通过观察H2S对wrky18wrky40wrky60幼苗根生长和气孔运动的影响进一步探究H2S与WRKY转录因子之间的相互联系。拟南芥WT和wrky18wrky40wrky60按1.2.1中移苗生长实验所述进行培养,按1.2.2中表2所述进行处理,实验结果如图6所示:未经H2S熏蒸处理的WT和wrky18wrky40wrky60主根生长无显著差异;20和40 μmol·L-1H2S熏蒸处理促进WT和wrky18wrky40wrky60主根生长,40 μmol·L-1H2S对WT和wrky18wrky40wrky60主根生长的促进作用强于20 μmol·L-1H2S的促进作用,且40 μmol·L-1H2S处理对wrky18wrky40wrky60主根生长的促进作用强于WT;80 μmol·L-1H2S处理对wrky18wrky40wrky60主根生长表现出促进作用,对WT主根生长无明显影响。
取生长4周的WT、wrky18wrky40wrky60植株叶片,按方法1.5所述,观察H2S对气孔运动的影响。实验结果如图7所示:未被H2S处理的WT和wrky18wrky40wrky60的气孔平均开度约5 μm;100 μmol·L-1H2S处理叶片1 h后,WT和wrky18wrky40wrky60的气孔开度都减小,相对减小量分别为45%和49.8%,两者无显著差异。

图6 H2S对WT和wrky18wrky40wrky60幼苗根生长的影响 A.幼苗生长情况;B.幼苗主根长度统计Fig.6 The effect of H2S on seedling root growth of WT and wrky18wrky40wrky60 A. The investigation of seedling growth; B. The measuration of seedling primary roots length

图7 外源H2S(100 μmol·L-1)对WT和wrky18wrky40wrky60气孔运动的影响Fig.7 The effect of exogenous H2S(100 μmol·L-1) on stomatal movement of WT and wrky18wrky40wrky60
3 讨论
气体信号分子H2S参与植物生命活动中多个生理过程,随着研究的深入已受到越来越多的关注。目前已有文献报道,H2S可以与ABA信号通路相互作用共同调节植物的一些生理过程[15,21]。近年来关于WRKY转录因子参与ABA信号通路的多篇研究报道表明WRKY转录因子是ABA信号通路关键调控因子,参与植物多种生理调节过程[32]。
在拟南芥ABAR介导的ABA信号转导过程中,WRKY18、WRKY40和WRKY60共同调节ABI4和ABI5的转录,WRKY40在这个过程中发挥主要调节作用,WRKY18增强WRKY40对ABI4和ABI5的转录抑制作用,WRKY60对WRKY18和WRKY40有拮抗作用,ABA抑制WRKY40的转录,降低其在细胞核内的分布[29,31]。本实验发现,ABA不仅可诱导拟南芥WT的LCD表达量升高,还促使内源H2S含量显著增加(图1),这与Shi[37]等人先前的研究报道一致;外源H2S处理可抑制WRKY40表达并且诱导WRKY60升高(图2),在内源H2S含量下降的突变体lcd中,WRKY18和WRKY40的表达量升高,WRKY60的表达量下降,表明H2S对WRKY18、WRKY40、WRKY60基因表达有调节作用;据Yan[38]等人报道,外源ABA处理WT抑制WRKY18、WRKY40表达,而本实验发现,在lcd突变体中,ABA对WRKY18和WRKY40的抑制作用消失(图8),WRKY18和WRKY40表达量显著升高,推测外源ABA可能通过诱导内源H2S含量升高,然后H2S再调节这三个WRKY转录因子的转录水平,而lcd突变体由于H2S缺失而不能传递此信号,进一步表明H2S参与ABA对这三个WRKY转录因子的转录调节。
图8 外源ABA(100 μmol·L-1)对lcd中WRKY18、WRKY40、WRKY60基因表达的影响Fig.8 The effect of exogenous ABA(100 μmol·L-1) on gene expression level of WRKY18,WRKY40,WRKY60 in lcd
ABA和H2S对植物幼苗根生长有调节作用。本实验显示lcd幼苗根生长受ABA抑制作用较弱(图3~4),可能因为突变体lcd内源H2S缺失,使WRKY18、WRKY40表达量升高而抑制ABI4和ABI5转录,导致幼苗根生长表现ABA脱敏的表型。外源H2S和ABA同时处理WT,幼苗根生长没有表现出ABA超敏表型(图3~4);根据李[39]等报道,外源H2S处理可以促进植物外植体不定根数目和长度的增加,本论文对WT和wrky18wrky40wrky60幼苗进行外源H2S处理,wrky18wrky40wrky60的根生长受H2S促进作用仍然很明显(图6),wrky18wrky40wrky60没有因为WRKY18、WRKY40、WRKY60缺失引起WRKY18、WRKY40、WRKY60对ABA信号的负调节作用消失而导致幼苗生长缓慢,说明植物体内存在复杂ABA信号调节网络并保持着动态平衡,同时也体现了H2S促进植物根生长的作用。以上结果表明,H2S可能通过影响WRKY18、WRKY40、WRKY60转录表达参与ABA对幼苗根生长调节,但H2S对植物根生长的调节部分依赖于WRKY,即H2S对植物根生长的调节作用还存在有不依赖于WRKY18/40/60的途径(图9)。此外,本实验中还发现低浓度H2S可以促进植物根生长,随着H2S浓度升高,H2S促进根生长作用先增强后减弱(图6),推测高浓度H2S甚至可能会抑制植物根生长,这显现了H2S在生物体内的生理和毒理作用,在实验过程中选择合适的H2S处理浓度对实验结果有至关重要的影响。

图9 H2S、ABA和WRKY18/40/60对根生长和气孔运动的调节模式Fig.9 The regulation model of H2S,ABA and WRKY18/40/60 to root length and stomatal movement
ABA促进野生型拟南芥WT的气孔关闭,但对于lcd的气孔关闭作用明显减弱(图5),表明H2S参与了ABA对气孔运动的调节;据Shang[33]等人报道,在ABA促进气孔关闭实验中wrky18wrky40wrky60没有明显ABA相关显型,即ABA诱导wrky18wrky40wrky60气孔关闭,但与野生型WT相比,两者气孔开度的相对减小量无显著差异,wrky18wrky40wrky60没有因为WRKY18、WRKY40、WRKY60缺失引起的WRKY18、WRKY40、WRKY60对ABA信号的负调节作用消失而导致ABA超敏表型;H2S促进wrky18wrky40wrky60和WT气孔关闭,但两者间无明显差异(图7),推测H2S调节气孔运动不依赖WRKY18/40/60的途径(图9),这进一步暗示H2S参与ABA对气孔运动的调节不是通过WRKY18,WRKY40和WRKY60实现的(图9)。
综上所述,H2S和ABA两个信号分子在调节植物根生长和气孔运动等生理过程中,存在复杂而紧密的作用机制,可能不只是简单的上下游关系,还有待进一步的深入研究。
1.杨昕,黄秀榕,祁明信.内源性硫化氢一种新型气体信息分子[J].广州医学院学报,2005,33(2):65-68.
2.Zhang H,Hu L Y,Hu K D,et al.Hydrogen sulfide promotes wheat seed germination and alleviates oxidative damage against copper stress[J].Journal of Integrative Plant Biology,2008,50(12):1518-1529.
3.Zhang H,Tang J,Liu X P,et al.Hydrogen sulfide promotes root organogenesis inIpomoeabatatas,SalixmatsudanaandGlycinemax[J].Journal of Integrative Plant Biology,2009,51(12):1086-1094.
4.Chen J,Wu F H,Wang W H,et al.Hydrogen sulfide enhances photosynthesis through promoting chloroplast biogenesis,photosynthetic enzyme expression,and thiol redox modification inSpinaciaoleraceaseedlings[J].J Exp Bot,2011,62(13):4481-4493.
5.Zhang H,Hu S L,Zhang Z J,et al.Hydrogen sulfide acts as a regulator of flower senescence in plants[J].Postharvest Bio Tech,2011,60(3):251-257.
6.Garcia-Mata C,Lamattina L.Hydrogen sulfide,a novel gasotransmitter involved in guard cell signaling[J].New Phytol,2010,188(4):977-984.
7.胡树立.H2S延缓采后草莓衰老及调控植物切花保鲜的信号机制[D].合肥:合肥工业大学,2012.
8.Jin Z P,Shen J J,Qiao Z J,et al.Hydrogen sulfide improves drought resistance inArabidopsisthaliana[J].Biochem Biophys Res Commun,2011,414(3):481-486.
9.吴单华,李忠光.硫化氢供体硫氢化钠处理提高小麦对高温和干旱胁迫的综合抵抗能力[J].云南师范大学学报:自然科学版,2013,33(6):29-35.
10.Stuiver C E E,De Kok L J,Kuiper P J C.Freezing tolerance and biochemical changes in wheat shoots as affected by H2S fumigation[J].Plant Physiology & Biochemistry,1992,30(1):47-55.
11.Lai D W,Mao Y,Zhou H,et al.Endogenous hydrogen sulfide enhances salt tolerance by coupling the reestablishment of redox homeostasis and preventing salt-induced K+loss in seedlings ofMedicagosativa[J].Plant Science,2014,225(8):117-129.
12.Basharat Ali,Rafaqat A Gill,Su Yang.Hydrogen sulfide alleviates cadmium-induced morpho- physiological and ultrastructural changes inBrassicanapus[J].Ecotoxicology and Environmental Safety,2014,110(110c):197-207.
13.Fang H H,Liu Z Q,Pei Y X,et al.Hydrogen sulfide interacts with calcium signaling to enhance the chromium tolerance inSetariaitalica[J].Cell Calcium,2014,56(6):472-481.
14.Zhang H,Hu L Y,Li P,et al.Hydrogen sulfide alleviated chromium toxicity in Wheat[J].Biologia Plantarum,2010,54(4):743-747.
15.金竹萍,裴雁曦.植物H2S气体信号分子的生理功能研究进展[J].中国细胞生物学学报,2013,35(6):880-888.
16.陈娟.硫化氢的植物生理功能及其分子机制研究[D].厦门:厦门大学,2013.
17.金竹萍.气体信号硫化氢在拟南芥应答干旱胁迫过程中的作用和机制[D].太原:山西大学,2013.
18.Finkelstein R R,Gampala S,Rock C.Abscisic acid signaling in seeds and seedlings[J].Plant Cell,2002,14(1):15-45.
19.周索,王云,庞振凌.ABA在拟南芥种子萌发和幼苗发育中的作用[J].安徽农业科学,2006,34(12):2629-2630.
20.郭栋梁,李玲.ABA对植物侧根发生的调节(综述)[J].亚热带植物科学,2008,37(1):67-69.
21.Jin Z P,Xue S W,Luo Y N,et al.Hydrogen sulfide interacting with abscisic acid in stomatal regulation responses to drought stress inArabidopsis[J].Plant Physiology and Biochemistry,2013,62(1):41-46.
22.Chen L G,Song Y,Li S J,et al.The role of WRKY transcription factors in plant abiotic stresses[J].Biochimica et Biophysica Acta,2012,1819(2):120-128.
23.江文波,余迪求.拟南芥WRKY2转录调控因子可能参与调控渗透胁迫反应[J].云南植物研究,2009,31(5):427-432.
24.Eulgem T,Rushton P J,Robatzek S,et al.The WRKY superfamily of plant transcription factors[J].Trends Plant Sci,2000,5(5):199-206.
25.Pandey S P,Somssich I E.The role of WRKY transcription factors in plant immunity[J].Plant Physiology,2009,150(4):1648-1655.
26.Song Y,Ai C R,Jing S J,et al.Research progress on function analysis of riceWRKYgene[J].Rice Sci,2010,17(1):60-72.
27.Zhou X,Jiang Y,Yu D.WRKY22 transcription factor mediates dark-induced leaf senescence inArabidopsis[J].Molecules and Cells,2011,31(4):303-313.
28.Zhou X,Seemann J R,Neuman D,et al.AWRKYgene from creosote bush encodes an activator of the abscisic acid signaling pathway[J].J Biol Chem,2004,279(53):55770-55779.
29.张大鹏.始于质体/叶绿体的ABA信号通路[J].植物学报,2011,46(4):361-369.
30.尚轶.拟南芥ABA受体ABAR/CHLH调控的一个ABA信号通路[D].北京:清华大学,2010.
31.刘志强.拟南芥WRKY转录因子WRKY18/40/60协同抑制ABA响应基因ABI4和ABI5的表达[D].北京:中国农业大学,2012.
32.于和平,侯和胜.植物WRKY转录因子及其参与ABA信号转导[J].天津农业科学,2012,18(6):20-23.
33.Shang Y,Yan L,Liu ZQ,et al.The Mg-chelatase H subunit ofArabidopsisantagonizes a group of WRKY transcription repressors to relieve ABA-responsive genes of inhibition[J].Plant Cell,2010,22(6):1909-1935.
34.Rushton D L,Tripathi P,Rabara R C,et al.WRKY transcription factors:Key components in abscisic acid signaling[J].Plant Biotechnology Journal,2012,10(1):2-11.
35.Chen H,Lai Z,Shi J,et al.Roles ofArabidopsisWRKY18,WRKY40 and WRKY60 transcription factors in plant responses to abscisic acid and abiotic stress[J].BMC Plant Biology,2010,doi:10.1186/1471-2229-10-281.
36.孙美莲,王云生,杨冬青,等.茶树实时荧光定量PCR分析中内参基因的选择[J].植物学报,2010,45(5):579-587.
37.Shi H T,Ye T T,Han N,et al.Hydrogen sulfide regulates abiotic stress tolerance and biotic stress resistance inArabidopsis[J].Journal of Integrative Plant Biology,2015,doi:10.1111/jipb.12302.
38.Yan L,Liu Z Q,Zhang D P,et al.Auto- and Cross-repression of threeArabidopsisWRKY transcription factors WRKY18,WRKY40 and WRKY60 negatively involved in ABA signaling[J].Journal of Plant Growth Regulation,2013,32(2):399-416.
39.李东波,肖朝霞,刘灵霞,等.外源硫化氢对豌豆根尖及其边缘细胞的影响[J].植物学报,2010,45(3):354-362.
RelationshipbetweenH2SSignalandWRKYinABARegulatingRootGrowthandStomatalMovement
SUN Li-Min PEI Yan-Xi LIU Zhi-Qiang*
(School of life Science,Shanxi University,Taiyuan 030006)
Gaseous signal molecule hydrogen sulfide(H2S) and plant hormone abscisic acid(ABA) modulate plant seed germination, root growth, stomatal movement, stress responses and other physiological processes, but the understanding of the relation between H2S and ABA signaling is very limited. The transcription factors of WRKY18, WRKY40 and WRKY60 involve in ABA signaling inArabidopsis. We used theArabidopsisthalianawild type(WT),lcd(L-cysteine desulfhydrase enzyme encoding gene konckdown mutant) andwrky18wrky40wrky60 mutant(WRKY18, WRKY40 and WRKY60 encoding gene knockout triple mutants) to study the interactions of H2S, ABA and WRKY transcription factors in regulating seedling root growth and stomatal movement. The expression level ofLCDand the content of endogenous H2S in WT were increased by ABA treatment. The expression level ofWRKY40 was decreased andWRKY60 was increased in WT by exogenous H2S treatment. The expression level ofWRKY18 andWRKY40 were increased, andWRKY60 was decreased in thelcdmutant. Compared with WT, the effect of ABA on seedling root growth and stomatal movement inlcdwas weaker, the promoting effect of H2S on root growth was more stronger inwrky18wrky40wrky60, but there were no obvious difference between WT andwrky18wrky40wrky60 on H2S promoting the stomatal closure.
H2S;ABA;WRKY transcription factors
国家自然科学青年基金(31300236);山西省青年科技基金(2014021026-1);山西省高等学校科技创新基金( 2013103)
孙丽敏(1991—),女,硕士研究生,主要从事植物生物工程和植物生理方面的研究工作。
* 通信作者:E-mail:liuzhiqiang@sxu.edu.cn
2015-07-15
Q945
A
10.7525/j.issn.1673-5102.2016.01.014
