山里红总黄酮季节动态及其与气候因子相关性分析
2016-11-10胡娇阳宋卓悦牟璠松于雪莹琪阮祖元刚
罗 猛 胡娇阳 宋卓悦 牟璠松* 于雪莹 乔 琪阮 鑫 杨 璇 祖元刚
(1.东北林业大学森林植物生态学教育部重点实验室,哈尔滨 150040; 2.林下经济资源研发与利用协同创新中心,哈尔滨 150040)
山里红总黄酮季节动态及其与气候因子相关性分析
罗 猛1,2胡娇阳1,2宋卓悦1,2牟璠松1,2*于雪莹1,2乔 琪1,2阮 鑫1,2杨 璇1,2祖元刚1,2
(1.东北林业大学森林植物生态学教育部重点实验室,哈尔滨 150040;2.林下经济资源研发与利用协同创新中心,哈尔滨 150040)
研究山里红中总黄酮含量随季节动态变化的规律,明确影响其总黄酮含量的气候因子。采收2013年5~10月的山里红,采用超声辅助提取法从山里红中提取总黄酮,三氯化铝比色法检测总黄酮的含量,并对山里红叶总黄酮含量与气候因子进行相关性分析。山里红不同部位总黄酮含量差异较大,9月份山里红叶黄酮类成分的含量最高,其值为31.52 mg·g-1。统计九月份山里红叶总黄酮含量与气候因子之间相关性分析,结果表明总黄酮含量与温度相关性显著。综合考虑,选择9月份为山里红叶的最佳采收期。该结果可为山里红叶总黄酮的深入开发利用奠定理论基础。
山里红;总黄酮;气候因子;季节动态;相关性
山里红(CrataeguspinnatifidaBge.var.Major N.E.Br.)属蔷薇科(Rosaceae)山楂属(Crataegus)植物,是《中华人民共和国药典》(2010版) 山楂项下的原药材之一,主产于黑龙江、吉林、辽宁、河北、河南和内蒙古等地[1]。山里红具有抗氧化、降血压、降血脂、抗肿瘤、抗菌等功效,可用于心血管、消化、内分泌系统和病原微生物等疾病[2]。目前,已经从山里红中分离出170多种化学成分,其中包括酚类、黄烷及其聚合物、三萜类、糖类、含氮化合物、有机酸和一些微量元素等[3~5]。其中,原花青素和三萜类化合物主要存在于山里红的果实中,而黄酮类主要存在于叶片中。黄酮是一种具有较强清除自由基和抗氧化能力的物质,是广泛存在于植物界的天然活性成分[6]。天然植物在生长和发育过程中降水量、温度和光照时间等气候因子对植物体内的活性成分含量影响较大,尤其是总黄酮的含量[7~8]。由于山里红叶作为一种可再生的资源,因此对山里红叶中黄酮类成分进行研究以及根据山里红叶的季节动态确定采收期显得尤其重要。
三氯化铝比色法和亚硝酸钠—硝酸铝—氢氧化钠比色法是测定黄酮类含量常用的方法,主要因为铝离子会与黄酮类物质发生络合反应,反应后生成络合物而显色[9]。然后采用紫外分光光度计测定吸光度,以芦丁为标准品,绘制标准品曲线作为参照,之后求得提取物的黄酮类含量。由于亚硝酸钠—硝酸铝—氢氧化钠比色法操作相对三氯化铝比色法,对提取物浓度要求高。
本文拟采用超声法提取山里红不同部位中的总黄酮,应用三氯化铝法测定总黄酮的含量,并考察其抗氧化能力。采收生长期的山里红,比较不同季节生长期中山里红不同部位的总黄酮含量,明确哪些气候因子起主导作用,其研究结果可为山里红中总黄酮的开发利用奠定理论基础。
1 材料与方法
1.1 材料
山里红的叶采于2013年5~10月,根、茎、果实于2013年9月中旬采自黑龙江省哈尔滨市东北林业大学,其中采收茎为直径小于等于5 cm的嫩茎,采收叶为嫩茎上的叶片。样品标本存放在东北林业大学森林植物生态学教育部重点实验室。样品采收后,将每个部位分开,风干处理至恒重,使用粉碎机粉碎,过60目筛,储存以备用。
1.2 超声提取方法
精密称取10 g山里红叶粉末放入锥形瓶中,加入150 mL 40%的乙醇溶液,在超声反应器(KQ-250DE,中国昆山超声仪器有限公司)中提取30 min,温度40℃,超声功率为250 W。上述过程重复3次。过滤,合并上清液后用旋转蒸发仪在35℃时减压浓缩。山里红的根、茎、果实的提取过程同山里红叶一样。浸膏在4℃下冷藏待测。
1.3 山里红叶总黄酮含量的测定
配制浓度分别为1、0.5、0.25、0.125、0.062 5、0.031 25 mg·mL-1的芦丁标准品,绘制的芦丁标准品曲线[10]。采用三氯化铝比色法测定山里红叶的总黄酮含量,取150 μL芦丁标准品溶液或样品溶液加入到96孔板,再加入150 μL 2%的三氯化铝溶液混匀(空白组以150 μL的蒸馏水取代之),后于室温下静置10 min。在410 nm波长处测定吸光值,其中三氯化铝为显色剂。以每克试样中芦丁之相对含量(mg·g-1RE)表示总黄酮的含量[11]。每个样品做3个重复,1个空白。绘制的芦丁标准品曲线为Y=2.077 7X-0.002 9,其中R2=0.999 7。
1.4 山里红不同部位的抗氧化能力
山里红叶的抗氧化活性是通过DPPH清除自由基能力来评估的,将不同浓度的样品在50%的乙醇(100 μL)中溶解后加入50%的乙醇(1.4 mL),然后加入0.004%的DPPH(1 mL)。混合后剧烈震荡,在室温下避光放置30 min,在517 nm处测定吸光值,上述步骤重复3次。样品的DPPH自由基的抗氧化能力以IC50表示。山里红的根、茎、果实的测定过程同山里红叶一样。
1.5 数据处理
应用统计分析软件SPSS22.0,采用Pearson相关系数对山里红总黄酮含量与各气候因子进行相关性分析。
2 结果与讨论
2.1 山里红不同部位总黄酮含量
样品经处理后,通过三氯化铝比色法测定不同部位的山里红样品的总黄酮含量。从表1可以看出,在9月份,山里红根部的总黄酮含量为18.44 mg·g-1,山里红茎部的总黄酮含量为29.70 mg·g-1,山里红叶中的总黄酮含量值为31.52 mg·g-1,也是四种部位中含量最高的,山里红果实从6月开始结果,在9月的时候山里红果实的总黄酮含量为24.81 mg·g-1。
表1山里红根、茎、叶、果实的总黄酮含量
Table1TFCinC.pinnatifidaroots,twigs,leaves,fruits(mg·g-1)
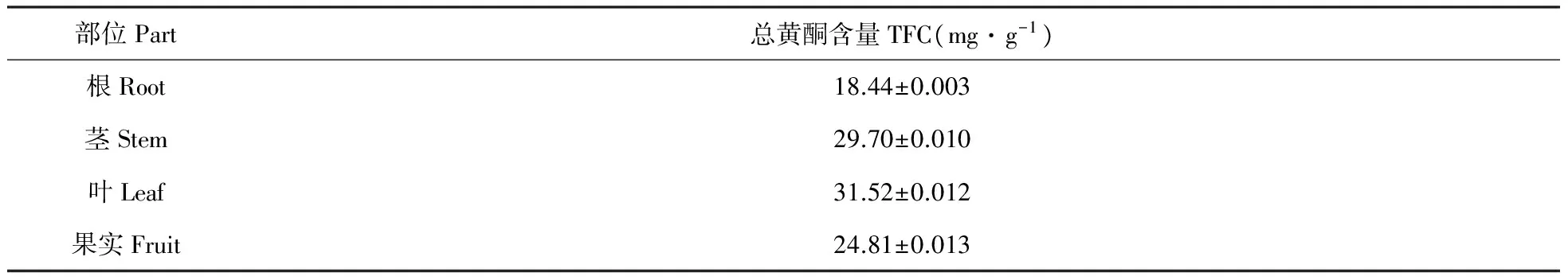
部位Part总黄酮含量TFC(mg·g-1)根Root18.44±0.003茎Stem29.70±0.010叶Leaf31.52±0.012果实Fruit24.81±0.013
通过比较不同部位山里红的总黄酮含量,我们可以发现在9月份时,山里红的叶片中总黄酮含量最高,其次是山里红的茎部、山里红的果实,最后是山里红的根部。山里红茎部的总黄酮含量和山里红叶的总黄酮含量相差不多,且同为可再生部位,但其生长缓慢,且过量采收影响植物的生长,因此可利用价值不及叶片高。同样,山里红根部也不适合当做工业生产原料。山里红的果实虽然比较适合采收,也是可再生部位,但常作为食用原料使用,且果实中的总黄酮含量低于叶片的总黄酮含量。因此,山里红叶作为山里红植物的可再生部位,在东北每年都会大量产生及脱落,适合大量采收并进行深入研究开发。
2.2 山里红叶总黄酮含量季节动态
降水量、温度和光照时间的变化对植物的光合作用以及相关的生理参数影响较大。植物的光合作用对光照的要求很高,需要有充足的阳光,植物的光合作用才能够正常的进行,因为光照是光合作用的基础[12~13]。而光合作用也在很大程度上会受到温度和降水量的影响,温度能够影响植物生理活动的快慢,光合作用的过程中发生的一些酶反应,需要适当的温度才能进行。而植物的蒸腾速率和光合速率等因素都会随着降水量的增大而增加[14]。所以,生态因素会影响山里红中的活性成分的含量,尤其是总黄酮的含量。所以本文通过比较不同时期的山里红叶的总黄酮含量,来确定最佳采收时间。不同采样期的山里红叶中总黄酮含量变化(图1)。
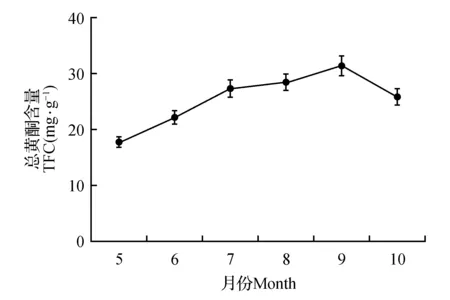
图1 山里红叶中总黄酮的含量变化Fig.1 Seasonal variations on TFC in C.pinnatifida leaves
从5月份时山里红叶总黄酮含量为17.92 mg·g-1开始,一直持续增长,到6月份总黄酮含量为22.38 mg·g-1,之后在7、8月份趋于稳定,总黄酮含量分别为27.54、28.59 mg·g-1,在9月份总黄酮含量到达最高点,值为31.52 mg·g-1。在10月份叶子脱落前,山里红叶的总黄酮含量为25.89 mg·g-1。可见,山里红叶在9月份时总黄酮含量比较高。
2.3 气候因子的对比分析
气候学上通常以每5日的平均气温作为季节的划分标准:平均气温高于22℃的时期为夏季,低于10℃则为冬季,介于二者之间的为春季和秋季。黑龙江省哈尔滨市位于亚欧大陆东部的中高纬度,在北纬44°04′~46°40′,东经125°41′~130°13′。所以根据这个季节划分的标准,从4月中下旬开始是哈尔滨的春天,气温慢慢回升,到6月份开始逐渐进入夏天,一直持续到8月末然后转入秋季,随后从12月到来年的4月是冬季[15]。从4月中下旬进入春季开始,山里红植株开始发芽,植物开始复苏,一直持续到10月份叶子和果实全部脱落。所以本研究考察了5~10月的季节动态,来评价植物的最佳采收期。
2004~2013年从5~10月哈尔滨的月平均温度,月平均降水量和月平均光照时间,如表2所示,因为采收的是2013年的山里红样品,所以比较了2013年和2004~2013年生态因子的变化。从这些变化中可以发现,2013年生态因子的变化趋势和2004~2013十年间整体的变化趋势是相吻合。2013年的月平均温度在7、8月份的时候比较高,十年内的月平均温度也是在7、8月比较高。2013年的月平均降水量从5月开始增长迅速,到7月份时达到最大值,八月开始持续下降,在九月到达一个最低值,然后十月份降水量开始增多。而2004~2013这十年间的月平均降水量从5月开始增长迅速,到7月份时达到最大值,之后一直下降。2013年的月平均光照时间从5~10月没有太显著地变化,七月份略高于其它月份;2004~2013这十年间的月平均光照时间也是如此,只是月平均值高于2013年。
2.4 山里红总黄酮含量与气候因子相关性分析
从图2可看出,气候因子是相互影响、相互制约、共同作用的,山里红叶中总黄酮含量与气候因子之间具有一定的相关性。温度与山里红叶总黄酮含量的相关系数为0.862,降水与茎中总黄酮含量的相关系数为0.855,光照时间与各部位的黄酮含量变化不显著。因此,温度对山里红叶的富集具有显著的影响(P<0.5)。
表22004~2013年5~10月哈尔滨的月平均温度、降水量和光照时间
Table2Averageoftemperature,precipitationanddaytimefromMaytoOctober2004-2013inHarbin
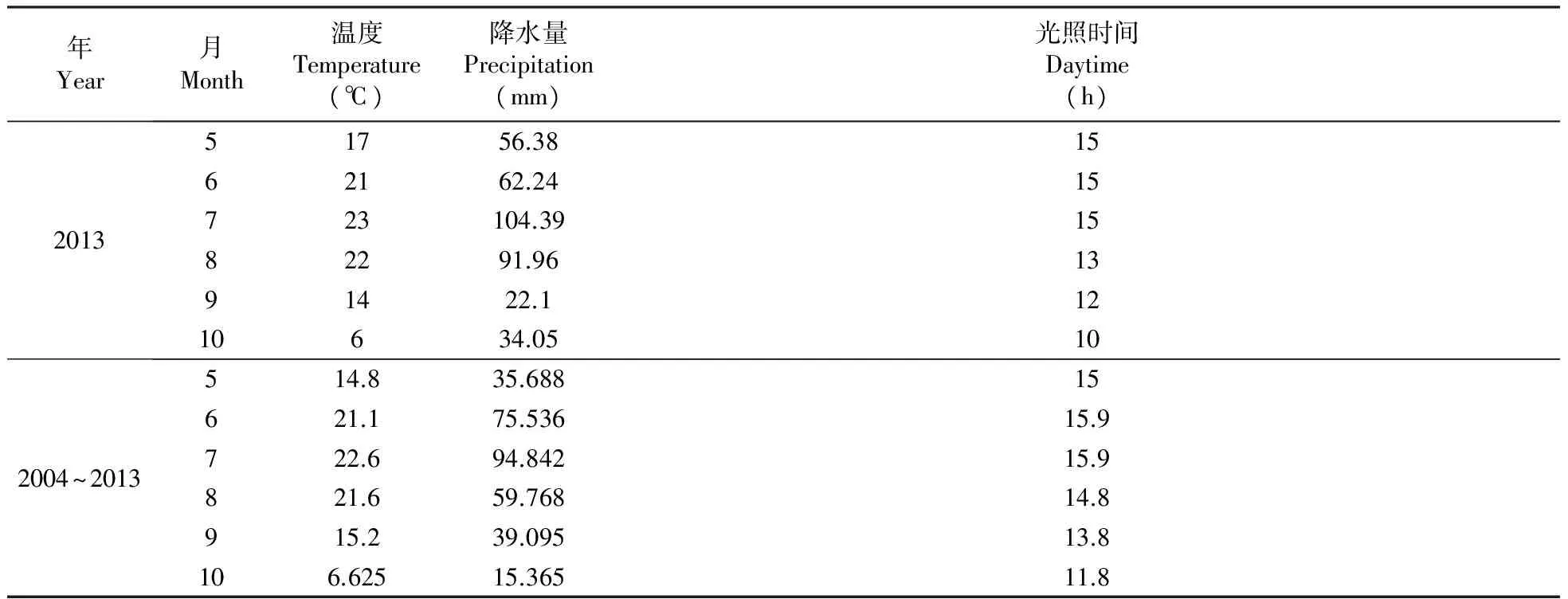
年Year月Month温度Temperature(℃)降水量Precipitation(mm)光照时间Daytime(h)201351756.381562162.2415723104.391582291.961391422.11210634.05102004~2013514.835.68815621.175.53615.9722.694.84215.9821.659.76814.8915.239.09513.8106.62515.36511.8

图2 山里红总黄酮含量与各气候因子的相关性分析Fig.2 Correlation analysis of TFC in C.pinnatifida and climatic factors
从4月中下旬开始是哈尔滨的春天,春天新叶萌发的前后,初级代谢和次生代谢变得活跃,叶子开始发芽、生长。5月份山里红叶片刚发育,光合作用强度比较弱,黄酮类化合物合成较少。从5月开始,随着叶片的不断生长发育,植物的光合作用持续增强,根部不断向其他部位输送养分,营养物质的运输、积累和转化的能力增强。在这段期间,山里红植物经过春天的复苏,夏天的积累,黄酮类成分的含量一直在持续增长,并且在9月份时到达了最高点,到达了山里红叶的成熟期。夏天温度不断升高,这些因素都加速了黄酮类物质的生物合成,植物通过增加黄酮类化合物的生物合成来保护自己[16]。随后到10月份,温度开始下降,叶子开始逐渐脱落,植物开始衰老,细胞进入程序性死亡,营养物质被输送到植物的根部,以保障植物能够度过漫长的冬季休眠期[17]。而果实到达成熟期,营养成分主要被富集在果实部分,不利于叶片中黄酮类物质的生物合成,叶片开始衰老,所以山里红叶中的总黄酮含量也开始下降,受温度气候的影响山里红叶在9月份时总黄酮含量最高。
2.5 山里红总黄酮对DPPH自由基的抑制率
DPPH自由基比较稳定,已被广泛用于评估抗氧化剂自由基清除能力,黄酮类化合物作为供电子剂,表现出明显的清除自由基的能力[18]。因此,山里红不同部位提取物的抗氧化活性通过体外抗氧化实验进行了评估。结果如图3所示,山里红的根,茎,叶,果实部位对DPPH自由基均有一定的清除能力,其中根和茎提取物的清除能力最强,其次是叶,但是由于根和茎是不可再生资源,所以可选择山里红叶作为天然活性抗氧化剂的来源。

图3 山里红不同部位的DPPH自由基抑制率Fig.3 Different parts of C.pinnatifida DPPH scavenging ability
3 结论
采收2013年9月的山里红根、茎、叶和果实,考察不同采收期山里红不同部位总黄酮的季节动态,结果表明,9月份叶中总黄酮含量最高(31.52 mg·g-1),茎和果实次之(29.7和24.81 mg·g-1),根最低(18.44 mg·g-1)。统计2013年和2004~2013年山里红叶采收期内的气候因子,包括月平均温度、月平均降水量和月平均光照时间,可以看出2013年的气候因子和十年间的平均值趋势相似,都在7、8月份较高。通过对9月山里红叶总黄酮含量与气候因子之间的相关性研究,发现总黄酮产量与温度的相关性显著。DPPH清除自由基实验表明,9月的山里红叶可作为天然抗氧化的药用植物材料。综合考虑,选择9月份为山里红叶的最佳采收期。该研究结果为山里红叶总黄酮的开发利用提供科学依据。
1.赵权.不同生长期山里红叶片绿原酸含量的变化[J].江苏农业科学,2013,41(4):39-240.
2.Wang C L,Lu B Z,Hou G L.Chemical constituent,pharmacological effects and clinical application ofCrataeguspinnatifida[J].Strait Pharmaceutical Journal,2010,22(3):75-78.
3.吴士杰,李秋津,肖学凤,等.山楂化学成分及药理作用的研究[J].药物评价研究,2010,33(4):316-319.
4.Chang Q,Zuo Z,Harrison F,et al.Hawthorn.The Journal of Clinical Pharmacology[J].2002,42(6):605-612.
5.Song S J,Li L Z,Gao P Y,et al.Terpenoids and hexenes from the leaves ofCrataeguspinnatifidac[J].Food Chemistry,2011,129(3):933-939.
6.乌兰格日乐,白海泉,翁慧.黄酮的抗氧化活性研究进展[J].内蒙古民族大学学报:自然科学版,2008,23(3):277-280.
7.向小林.不同时期山楂叶黄酮含量及抗氧化活性变化[M].秦皇岛:河北科技师范学院,2013.
8.Schmidt S,Zietz M,Schreiner M,et al.Genotypic and climatic influnces on the concentration and composition of flavonoids in kale(Brassicaoleraceavar.sabellica)[J].Food Chemistry,2010,119(4):1293-1299.
9.王晋黄,池汝安,陈少峰,等.土茯苓中提取总黄酮的工艺研究[J].植物研究,2006,26(3):370-373.
10.罗猛,宋卓悦,胡娇阳,等.超声法提取山里红叶总黄酮及其抗氧化活性研究[J].植物研究,2015,35(4):632-637.
11.赵恩泽,金时,魏作富,等.木豆叶总黄酮测定方法的比较研究[J].植物研究,2011,31(4):499-502.
12.王化楠,唐中华,祖元刚,等.人工种植长春花生物学性状和生物碱含量的季节动态[J].植物研究,2010,30(4):508-512.
13.高银祥,杨逢建,张玉红,等.南方红豆杉枝叶中6种紫杉烷类化合物含量季节变化[J].植物研究,2014,34(2):266-270.
14.Klimov S V,Burakhanova E A,Dubinina I M,et al.Suppression of the source activity affects carbon distribution and frost hardiness of vegetating winter wheat plants[J].Russian Journal of Plant Physiology,2008,55(3):308-314.
15.郑红,王艳秋,苍蕴琦.哈尔滨的四季与季节划分指标的探讨[J].黑龙江气象,2001,3:32-33.
16.Edreva A.The importance of non-photosynthetic pigments and cinnamic acid derivatives in the photoprotection[J].Agriculture Ecosystems and Environment,2005,106(2):135-146.
17.汪海峰,鞠兴荣,何广斌,等.不同海拔高度和生长季节对银杏叶中黄酮苷含量的影响[J].林产化学与工业,2002,22(4):47-50.
18.王芳,张东阳,马飞跃,等.花梨木叶中鹰嘴豆芽素A的提取工艺研究[J].植物研究,2011,31(3):367-370.
SeasonalVariationofTotalFlavonoidsfromCrataeguspinnatifidaandCorrelationAnalysisofClimaticFactors
LUO Meng1,2HU Jiao-Yang1,2SONG Zhuo-Yue1,2MU Fan-Song1,2*YU Xue-Ying1,2QIAO Qi1,2RUAN Xin1,2YANG Xuan1,2ZU Yuan-Gang1,2
(1.Key Laboratory of Forest Plant Ecology,Ministry of Education,Northeast Forestry University,Harbin 150040;2.The Development and Utilization Collaborative Innovation Center of Forest Economic Resources,Harbin 150040)
We determined the contents of total flavonoids fromCrataeguspinnatifida(C.pinnatifida) according to seasonal dynamics to find out the climate dominant climatic factors which influence the total flavonoids content(TFC) ofC.pinnatifida. We studied theC.pinnatifidafrom May to October 2013, and used ultrasound-assisted extraction(UAE) to extract TFC fromC.pinnatifida, and determined TFC by aluminum chloride colorimetric method. We analyzed the correlation between the TFC and climatic factors. TFC in different parts ofC.pinnatifidahad significant difference. TFC fromC.pinnatifidaleaves increase continuously and reach the highest point in September, with the value of 31.52 mg·g-1. A positive correlation was between the content of total flavonoid and temperature. September was the best harvest time forC.pinnatifidaleaves. Our result provides a theoretical basis for development and utilization of total flavonoids inC.pinnatifida.
Crataeguspinnatifida;total flavonoids;climatic factors;seasonal variation;correlation
中央高校基本科研业务费(2572015EA04,2572014CA08);黑龙江省博士后科研启动金(LBH-Q13003);国家自然科学基金(21403032)
罗猛(1979—),男,副研究员,主要从事植物活性成分研究。
* 通信作者:E-mail: fansong8867@nefu.edu.cn
2015-10-20
Q949.751.8
A
10.7525/j.issn.1673-5102.2016.03.023
猜你喜欢
——Take An Empty Room as an Example
