杂种落叶松(兴10×日13)再生体系的建立及优化
2016-11-10张素芳张含国
张 莉 张 磊 侯 丹 张素芳 张含国
(林木遗传育种国家重点实验室东北林业大学,哈尔滨 150040)
杂种落叶松(兴10×日13)再生体系的建立及优化
张 莉 张 磊 侯 丹 张素芳 张含国*
(林木遗传育种国家重点实验室东北林业大学,哈尔滨 150040)
以杂种落叶松(兴10×日13)成熟合子胚为外植体,通过不同培养基与激素的组合进行实验,最终形成完整落叶松植株,根据试验结果建立并优化了杂种落叶松成熟合子胚诱导植株再生的体系。结果表明:BM培养基有利于杂种落叶松不定芽的诱导,诱导率达60.7%,且在BM+1.5 mg·L-1TDZ条件下诱导率最高且为67.73%;BM培养基能促进不定芽增殖,增殖系数达4.48,且在BM+1.0 mg·L-1TDZ条件下增殖系数最高且为5.23;不定芽在1/2BM+0.5 mg·L-1TDZ伸长比率最高且为205.72%,同时,在1/2BM培养基中添加2 g·L-1的活性炭也能促进伸长;当不定芽在BM+0.05 mg·L-16-BA+0.2 mg·L-1NAA的条件下培养时,抽茎率最高,为73.96%;不定芽在1/2BM+0.5 mg·L-1IBA+1.0 mg·L-1NAA条件下诱导生根的生根率最高,为29.85%。
杂种落叶松;成熟合子胚;不定芽;组织培养
落叶松(Larch)为松科(Pinaceae)落叶松属(Pinus)的落叶乔木,是我国东北、内蒙古林区以及华北、西南的高山针叶林的主要森林组成树种,是东北地区主要三大针叶用材林树种之一,以速生、抗逆性强著称,其木材重而坚实,抗压及抗弯曲的强度大,而且耐腐朽,木材工艺价值较高,因此被大量用于建筑业、装潢业、造纸业[1]。同时,由于落叶松树势高大挺拔,冠形美观,根系十分发达,抗烟能力强。所以,又是一个优良的园林绿化树种。杂种落叶松兴10×日13(L.gmelinii10×L.kaempferi13)是落叶松属中一个非常重要的速生树种,一般具有双亲的优良特征。
通过常规育种技术进行新品种选育存在时间长、见效慢,后代性状不能够定向改良等局限性。通过转基因方法将目的基因直接导入受体系统并进行表达,可极大地缩短其育种周期,而建立高效的再生体系是转基因育种的前提条件之一。吴克贤等用长白落叶松的成熟胚、花芽和腋芽、幼嫩茎段作为外植体诱导出不定芽,但不定芽诱导分化率均较低,最高只有8.16%[2]。王伟达等用长白落叶松的成熟胚为外植体也诱导出不定芽,但是诱导率都不是太高,再加上继代过程中部分死亡最终难以应用于实际生产与实践[3]。目前在国内杂种落叶松遗传转化的研究报道甚少,通过转基因育种的方法对选育的优良杂种落叶松进行性状的定向改良可以获得具有多个优良目标性状的新品系,所以杂种落叶松再生体系的建立及优化可以为后期的研究奠定良好的基础。
本文以杂种落叶松成熟合子胚为外植体,通过调节诱导愈伤组织[4],然后诱导不定芽及其继续增殖,抽茎生根形成完整植株的基本培养基和激素配比,主要分析了不定芽诱导、增殖,抽茎、生根的体系的影响及不定芽伸长阶段激素配比与活性炭的作用,确定并获得较高分化率的不定芽,进而得到能够移栽到土壤中成活的生根组培苗的扩繁体系,对于杂种落叶松的的无性繁殖和遗传转化研究具有广泛的应用意义。
1 试验材料与方法
以采自黑龙江省牡丹江市林口县青山种子园的杂种落叶松(兴10×日13)成熟种子胚作为试验材料。
1.1 不定芽的诱导
1.1.1 基本培养基的筛选
不定芽诱导选用1/2MS、MS、1/2BM和BM四种培养基,分别添加TDZ 1.5 mg·L-1,各培养基上接3~5个外植体,且重复6~7次。3~4周统计并计算不定芽的诱导率。
1.1.2 激素组合及浓度的筛选
BM培养基上分别添加TDZ为1.0、1.5、2.0 mg·L-1,NAA为0、0.1、0.2 mg·L-1,共9个组合。每个组合上接种30个不定芽,并重复3次(以下同),3~4周统计并计算不定芽的诱导率。
1.2 不定芽的增殖
1.2.1 基本培养基的筛选
不定芽增殖选用1/2MS、MS、1/2BM和BM四种基本培养基,分别添加TDZ 1.0 mg·L-1,20 d后统计并计算不定芽的增殖系数。
1.2.2不同浓度的6-BA+NAA及TDZ+NAA组合的筛选
BM培养基上,分别添加6-BA为0.5、0.8、1.0 mg·L-1,NAA为0、0.05、0.1 mg·L-1,共9个组合;分别添加TDZ为0.5、1.0、1.5 mg·L-1,NAA为0、0.05、0.1 mg·L-1,共9个组合。20 d后统计并计算不定芽的增殖系数。
1.3 不定芽的伸长
1.3.1 不同浓度的TDZ与NAA组合的筛选
1/2BM培养基上,分别添加TDZ为0.1、0.5、1.0 mg·L-1,NAA为0、0.02、0.04 mg·L-1,共9个组合。30 d后用游标卡尺测量、统计并计算不定芽的伸长比率。
1.3.2 不同浓度活性炭的筛选
1/2BM培养基上,设置TDZ为0.5 mg·L-1,分别添加活性炭0、1、2、3、4 g·L-1。30 d后用游标卡尺测量、统计并计算不定芽的伸长比率。
1.4 不定芽的抽茎
1.4.1 基本培养基的筛选
在杂种落叶松不定芽抽茎过程中分别以BM、1/2BM、MS、1/2MS为培养基,添加30 g·L-1的蔗糖,不添加任何激素,每种处理接种10瓶,每瓶接种3~5个,重复3次,采用单因素对比试验,30 d后观察不定芽生长状况,统计不定芽抽茎率,以不定芽抽茎率均值为试验指标,选出不定芽抽茎的最适培养基。
1.4.2 激素组合及浓度的筛选
将伸长到一定程度的带有愈伤的不定芽转至添加0、0.05、0.2、1.0 mg·L-16-BA,0、0.05、0.2、1.0 mg·L-1NAA的原培养基中进行抽茎培养,3周后统计抽茎数及其比率。
1.5 不定芽的生根
将抽茎的不定芽从愈伤上切下,接种到生根培养基上进行不定芽生根诱导。生根培养基以MS、1/2MS、BM、1/2BM、DCR、1/2DCR为培养基,添加0、0.5、1.0、2.0 mg·L-1IBA,0、0.5、1.0、2.0 mg·L-1NAA,附加20 g·L-1的蔗糖,2 g·L-1的活性炭,每种培养基上接种数不少于30个不定芽,重复3次,培养2周后用相同培养基继代一次,30 d后统计生根情况。
以上培养基中均附加蔗糖30 g·L-1(生根培养基除外)、琼脂6.5 g·L-1、L-谷氨酰胺450 mg·L-1、水解酪蛋白500 mg·L-1及肌醇1 g·L-1,培养基pH值用KOH和HCl调至5.8,121℃灭菌20 min,谷氨酰胺经过滤灭菌后在培养基温度降至50℃以下加入。培养条件:光照培养,温度为24±1℃,光暗周期为16 h/8 h,光强度35 μmol·m-2·s-1左右。
1.6 再生植株的移栽
当诱导出的根长至2.0~4.0 cm时即可进行移栽,取出幼苗,洗净根部黏附的琼脂,将其移栽到疏松、排水性和透气性良好的基质中(草炭土∶蛭石∶珍珠岩=1∶1∶1)。刚移栽入盆的小苗,应经过2~3天的短期遮阴。塑料盆顶部覆盖透明塑料薄膜用以保持较高的湿度,培养室温度保持在24±1℃,光照时间16 h·d-1,光照强度35 μmol·m-2·s-1。放置2周后将塑料薄膜拿掉。移栽3个月后调查成活率。
1.7 数据处理
1.7.1 诱导率公式
a1=b1/c1×100%
(1)
式中:a1为不定芽诱导率%;b1为产生不定芽的外植体数;c1为接种外植体的总数。
1.7.2 增殖系数公式
a2=b2/c2
(2)
式中:a2为不定芽增殖系数;b2为转接后不定芽总数;c2为转接前不定芽总数。
1.7.3 伸长比率公式
a3=(b3-c3)/c3×100%
(3)
式中:a3为不定芽伸长比率/%;b3为接种30 d时不定芽长度(mm);c3为接种时不定芽长度(mm)。
1.7.4 抽茎率公式
抽茎率=(抽茎不定芽数/接种不定芽数)×100%
(4)
1.7.5 生根率公式
生根率=(生根不定芽数/接种抽茎不定芽数)×100%
(5)
将试验结果经过反正弦转化后,再使用EXCEL和SPSS16.0软件进行处理与分析。
2 结果与分析
2.1 不定芽的诱导
2.1.1 不同培养基对不定芽诱导的影响
四种培养基对不定芽诱导的结果见表1。由表1可得,不定芽的诱导率为BM>1/2MS>1/2BM>MS。在BM培养基上,愈伤组织表面有绿色的、颗粒状芽原基产生(图Ⅰ:1),且不定芽的诱导率为60.7%,标准差s值最小为0.104 5;1/2MS培养基上,愈伤组织表面有黄绿色凸起的芽原基产生(图Ⅰ:2),且不定芽的诱导率为55.0%,标准差s值为0.304 1;1/2BM和MS培养基上的诱导率皆低。因此,BM培养基最适用于杂种落叶松不定芽的诱导。
表1不同培养基对外植体不定芽诱导的影响
Table1Influenceofdifferentmediumoninductionofadventitiousbuds

培养基Culturemedium1/2MSMS1/2BMBMc1b1c1b1c1b1c1b11444041422424041423424141424434142435423240326533040327303132a1均值Mean(%)55.0ab19.4c22.6bc60.7a
注:无共享字母的均值之间具有显著差异,下同。
Note:A significant difference among meanvalue of no shared alphabet,the same as below.
2.1.2 不同浓度的激素组合对不定芽诱导的影响
不同浓度的TDZ+NAA组合对不定芽诱导的结果见表2。由表2可得,单独添加TDZ 1.5 mg·L-1时,诱导率最高为67.73%,且标准差s值为1.106,从外部形态看不定芽长势也较好(图Ⅰ:3),这说明1.5 mg·L-1TDZ诱导效果较为稳定。从处理1~6可以看出,单独使用TDZ比TDZ+NAA组合对不定芽的诱导效果好,且当TDZ与NAA组合使用时随NAA浓度的增加不定芽诱导率降低。从处理9可以看出,较高浓度的TDZ单独使用不定芽诱导率又有所下降,但高浓度的TDZ与低浓度的NAA组合使用不定芽的诱导率增大。总体上来看,TDZ与NAA组合使用时的标准差s皆比较小,说明TDZ与NAA组合使用时对不定芽的诱导效果较为稳定,而单独使用TDZ进行诱导时要比两者组合使用时更佳,这与Lin等[5]研究单独使用细胞分裂素对兴安落叶松不定芽的诱导效果较好结论相符。
2.2 不定芽的增殖
2.2.1 基本培养基对不定芽增殖的影响
不同培养基对不定芽增殖的结果见表3。在BM与MS培养基上的不定芽生长旺盛,芽点大,绿色,基生于针叶丛(图Ⅰ:4);经方差分析,这四种培养基对不定芽增殖影响的差异不显著,但BM处理的均值最大为4.48,标准差s最小为0.096,这说明BM培养基对不定芽增殖的效果更好更稳定。而1/2 MS及1/2 BM培养基在不定芽增殖时,不仅增殖系数相对较小,且不定芽的生长状况不好。因此,选BM培养基作为不定芽增殖时的最佳培养基。
2.2.2 不同浓度的激素组合对不定芽增殖的影响
不同浓度的激素组合对不定芽增殖的结果见表4。由表4可得,处理1~9为6-BA与NAA的组合,这两者组合使用时增殖系数的均值较低且大都在1.00~2.00;处理10~18为TDZ与NAA的组合,这两者组合使用时增殖系数的均值较高且大都在2.50~5.20。这说明TDZ与NAA的组合使用对不定芽增殖的效果好于6-BA与NAA的组合。在处理10~18中,增殖系数相对高的3个均值分别为5.23、4.01和3.16,对应的激素组合及浓度依次为1.0、0.5和1.5 mg·L-1TDZ。当TDZ与NAA组合使用时,随着NAA浓度的增大,增殖系数变小,此时的NAA可能对不定芽的增殖产生了抑制作用。本试验结果表明,1.0 mg·L-1TDZ对不定芽增殖的效果最佳,生长较好(图Ⅰ:6)。
表2不同激素对外植体不定芽诱导的影响
Table2Influenceofdifferenthormoneoninductionofadventitiousbuds

处理TreatmentTDZ(mg·L-1)NAA(mg·L-1)不定芽诱导率a1Inductionfrequencyofadventitiousbuda1(%)ⅠⅡⅢ均值Mean标准差s11.0055.654.356.855.57b1.25021.00.137.535.139.737.43de2.30131.00.231.327.535.231.33e3.85041.5066.768.967.667.73a1.10651.50.150.046.447.848.07c1.81561.50.247.844.345.645.90c1.76972.0045.540.143.943.17cd2.77482.00.138.137.035.236.78e1.46492.00.243.844.741.943.47cd1.429

表3 不同培养基对不定芽增殖的影响
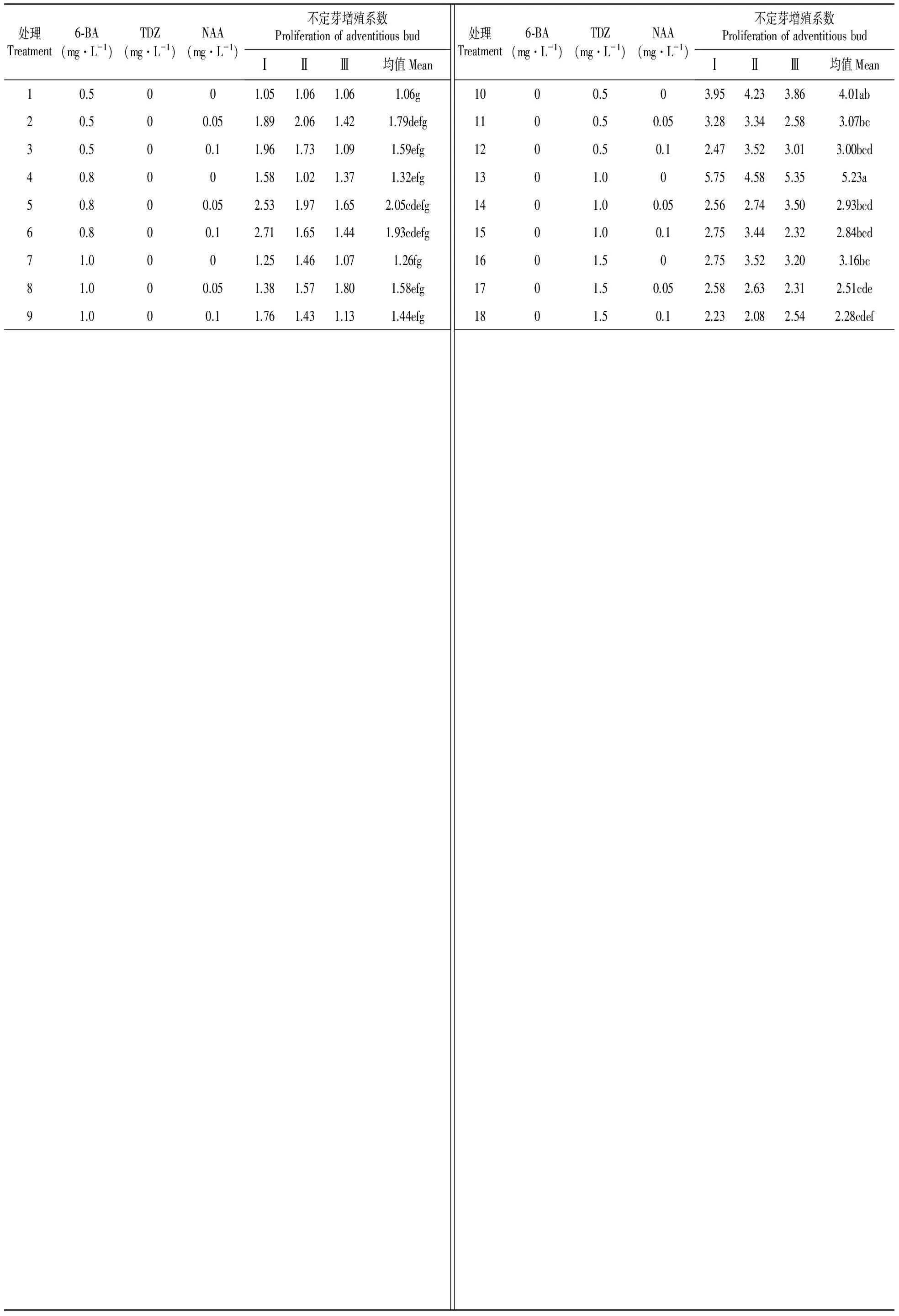
表4 不同激素对不定芽增殖的影响
2.3 不定芽的伸长
2.3.1不同浓度的激素组合对不定芽伸长生长的影响
不同浓度的激素组合对杂种落叶松不定芽伸长生长的影响结果见表5。从表5中9个处理的结果可以看出,当3个浓度梯度(0.1、0.5、1.0 mg·L-1)的TDZ单独使用时对不定芽的伸长影响都好于TDZ与NAA组合使用,且当TDZ浓度一定时,随NAA浓度的增加不定芽的伸长效果降低。当TDZ 0.1 mg·L-1、NAA 0.04 mg·L-1时,不定芽伸长效果最差,伸长比率为11.15%,生长慢(图Ⅰ:8);当TDZ 0.5 mg·L-1、NAA 0 mg·L-1时,对不定芽的伸长效果最佳,伸长比率为205.72%,生长较快(图Ⅰ:7)。从处理1、4和7的结果可以看出,单独使用TDZ时,低浓度的TDZ,对不定芽伸长的促进作用不强,随TDZ浓度的增高,促进作用逐渐增强,当进一步提高TDZ浓度时,这种促进作用反而降低。综上所述,0.5 mg·L-1TDZ单独处理对不定芽的伸长效果最佳。
表5不同激素对不定芽伸长的影响
Table5Influenceofdifferenthormoneonelongationofadventitiousbuds
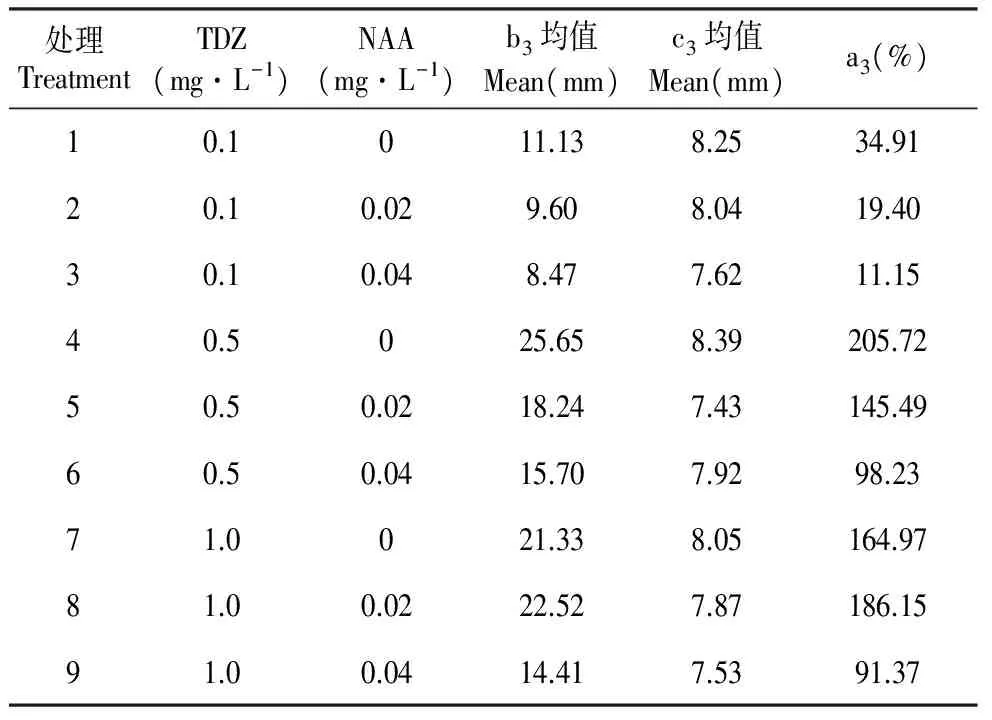
处理TreatmentTDZ(mg·L-1)NAA(mg·L-1)b3均值Mean(mm)c3均值Mean(mm)a3(%)10.1011.138.2534.9120.10.029.608.0419.4030.10.048.477.6211.1540.5025.658.39205.7250.50.0218.247.43145.4960.50.0415.707.9298.2371.0021.338.05164.9781.00.0222.527.87186.1591.00.0414.417.5391.37
2.3.2不同浓度的活性炭对不定芽伸长生长的影响
不同浓度活性炭对不定芽伸长生长的影响结果见表6。由表6可以看出,在一定范围内随活性炭含量的增加,不定芽的伸长比率增大,当活性炭为2 g·L-1时,达到最大值255.37%;随着活性炭含量继续增大,不定芽的伸长比率降低。因此,影响不定芽伸长生长的活性炭的最佳含量为2 g·L-1。
2.4 不定芽的抽茎
2.4.1 基本培养基对不定芽抽茎的影响
在针叶树组织培养中不定芽能否抽茎是关键的一步,芽能否抽茎直接关系到以后试管苗的生根状况,本试验选用BM、1/2BM、MS、1/2MS四种基本培养基,均不添加任何植物生长调节剂,蔗糖浓度为30 g·L-1,30 d后观察统计不定芽抽茎率,试验结果见表7。
表6不同浓度的活性炭对不定芽伸长生长的影响
Table6Influenceofdifferentactivatedcarbondensitiesonelongationofadventitiousbuds

活性炭含量Activatedcarboncontent(g·L-1)a3(%)0205.721220.442255.373180.924163.86
表7基本培养基对不定芽抽茎的影响
Table7Influenceofminimalmediumonpumpingstemsofadventitiousbuds
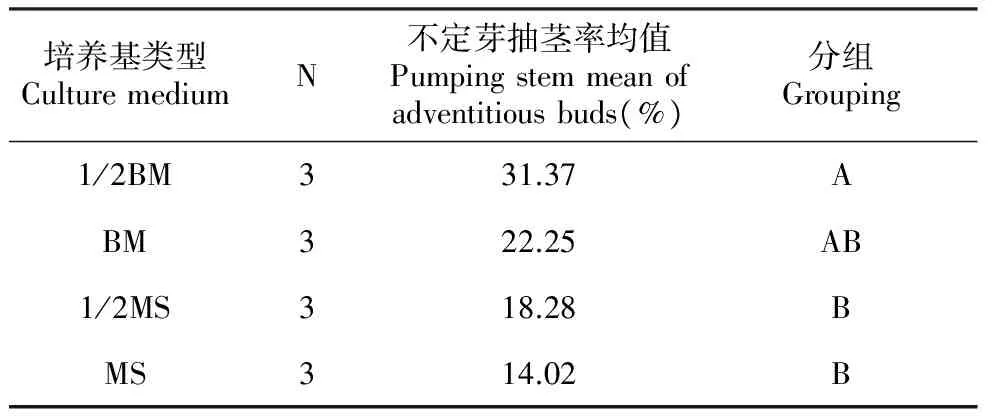
培养基类型CulturemediumN不定芽抽茎率均值Pumpingstemmeanofadventitiousbuds(%)分组Grouping1/2BM331.37ABM322.25AB1/2MS318.28BMS314.02B
从表7可以看出,基本培养基对不定芽抽茎的影响:1/2BM>BM>1/2MS>MS,在1/2BM培养基上不定芽抽芽率最高,为31.37%,在MS培养基上不定芽抽芽率最低,为14.02%。经方差分析表明,不同基本培养基对不定芽的抽茎存在极显著性差异,当基本培养基为1/2BM时,更有利于芽抽茎。进一步进行多重比较可以得出1/2BM与BM之间差异不显著,而与1/2MS、MS之间差异极显著,BM、1/2MS、MS两两之间差异不显著。因此,1/2BM为不定芽抽茎较适宜的基本培养基。
2.4.2 不同浓度的激素组合对不定芽抽茎的影响
不同浓度的激素组合对不定芽抽茎的影响见表8。由表8可得,当1/2BM+0.05 mg·L-16-BA+0.2 mg·L-1NAA时,不定芽抽茎率最高为73.96%,从外部形态看不定芽发绿、抽出的茎较为粗壮(图Ⅰ:9),不加任何激素时不定芽抽茎率最低,为4.77%,长势也一般(图Ⅰ:10)。从表8还可以看出,当细胞分裂素和生长素组合使用时,生长素的浓度高于细胞分裂素浓度不定芽抽茎率较高,反之,则会降低。若只添加细胞分裂素或生长素,不定芽抽茎率也很低,只有二者组合使用抽茎率才较高。由此可见,激素组合及其配比关系对不定芽抽茎产生一定的影响作用。
表8不同激素对不定芽抽茎的影响
Table8Influenceofdifferenthormoneonpumpingstemsofadventitiousbuds

处理Treatment6⁃BA(mg·L-1)NAA(mg·L-1)不定芽抽茎率Pumpingstemofadventitiousbuds(%)1004.77200.0511.84300.217.74401.011.3550.05018.9560.050.0531.2570.050.273.9680.051.047.9290.2021.61100.20.058.57110.20.234.09120.21.053.44131.0015.01141.00.057.55151.00.27.13161.01.039.87
2.5 不定芽的生根
2.5.1 培养基和生长素对不定芽生根的影响
不同培养基和生长素对不定芽生根的影响结果见表9~11。由表9~11可知:BM、MS、DCR培养基都不能诱导不定芽生根,可见培养基中大量元素的质量浓度对杂种落叶松不定芽的生根有一定的影响,而1/2BM、1/2MS、1/2DCR培养基中都有不定芽生根现象,可见将培养基中大量元素的质量浓度减半有利于杂种落叶松不定芽的生根。在1/2BM、1/2MS、1/2DCR培养基中单独加入适量浓度的NAA,可诱导不定芽生根,而单独加入不同质量浓度的IBA则不能诱导不定芽生根,IBA和NAA组合使用比单独添加某一种生长素诱导率高,当NAA/IBA=2∶1时,不定芽在三种培养基中的生根率都最高,1/2BM+0.5 mg·L-1IBA+1.0 mg·L-1NAA对不定芽生根的诱导率为29.85%,1/2MS+0.5 mg·L-1IBA+1.0 mg·L-1NAA对不定芽生根的诱导率为24.41%,1/2DCR+0.5 mg·L-1IBA+1.0 mg·L-1NAA对不定芽生根的诱导率为22.14%,培养基中只添加IBA而无NAA不能诱导不定芽生根,可见诱导生根的前期用适量的生长素NAA刺激不定芽,对不定芽的生根有促进作用。
表9在BM、1/2BM添加IBA、NAA对不定芽生根的影响
Table9InfluenceofthemediumBMand1/2BMwiththehormonesIBAandNAAonrootingofadventitiousbuds
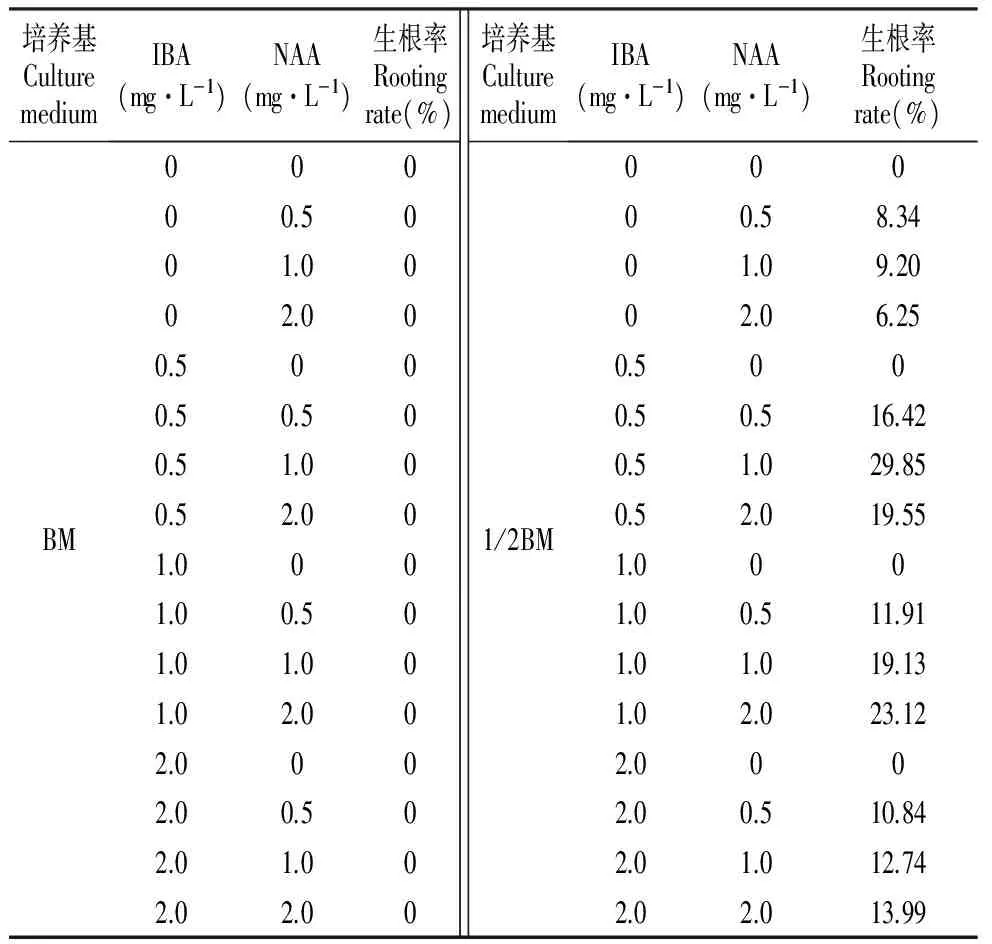
培养基CulturemediumIBA(mg·L-1)NAA(mg·L-1)生根率Rootingrate(%)BM00000.5001.0002.000.5000.50.500.51.000.52.001.0001.00.501.01.001.02.002.0002.00.502.01.002.02.00培养基CulturemediumIBA(mg·L-1)NAA(mg·L-1)生根率Rootingrate(%)1/2BM00000.58.3401.09.2002.06.250.5000.50.516.420.51.029.850.52.019.551.0001.00.511.911.01.019.131.02.023.122.0002.00.510.842.01.012.742.02.013.99
表10在MS、1/2MS上添加IBA、NAA对不定芽生根的影响
Table10MS、1/2MSandIBA、NAAonrootingofadventitiousbuds

培养基CulturemediumIBA(mg·L-1)NAA(mg·L-1)生根率Rootingrate(%)MS00000.5001.0002.000.5000.50.500.51.000.52.001.0001.00.501.01.001.02.002.0002.00.502.01.002.02.00培养基CulturemediumIBA(mg·L-1)NAA(mg·L-1)生根率Rootingrate(%)1/2MS00000.57.0801.08.1202.05.210.5000.50.514.820.51.024.410.52.018.401.0001.00.511.251.01.017.701.02.020.242.0002.00.59.172.01.011.912.02.012.50
表11在DCR、1/2DCR上添加IBA、NAA对不定芽生根的影响
Table11InfluenceofthemediumDCRand1/2DCRwiththehormonesIBAandNAAonrootingofadventitiousbuds

培养基CulturemediumIBA(mg·L-1)NAA(mg·L-1)生根率Rootingrate(%)DCR00000.5001.0002.000.5000.50.500.51.000.52.001.0001.00.501.01.001.02.002.0002.00.502.01.002.02.00培养基CulturemediumIBA(mg·L-1)NAA(mg·L-1)生根率Rootingrate(%)1/2DCR00000.56.7001.07.7402.05.000.5000.50.513.990.51.022.140.52.017.501.0001.00.510.841.01.016.671.02.018.132.0002.00.58.342.01.011.252.02.011.67
2.5.2 蔗糖质量浓度对生根的影响
针叶树在根的诱导中,通常需要进一步降低培养基中蔗糖的质量浓度,本试验以1/2BM+0.5 mg·L-1IBA+1.0 mg·L-1NAA为培养基,分别附加5、10、20、30、40 g·L-1的蔗糖,将高1~2 cm的不定芽接入培养基中进行根的诱导,30 d后统计不定芽的生根情况(图1)。由图1可以看出:培养基中的蔗糖质量浓度对不定芽的生根产生一定的影响,当蔗糖质量浓度为20 g·L-1时,不定芽生根诱导率最高,达25.00%,诱导形成的不定根数为2~4条(图Ⅱ:1),最长的不定根达4.0~5.0 cm左右;当蔗糖质量浓度大于20 g·L-1时,随着蔗糖质量浓度的增大,不定芽生根诱导率又降低。可见,在不定芽诱导生根时,适当的降低培养基中蔗糖的质量浓度有利于杂种落叶松不定根的诱导,但质量浓度过低对根的诱导产生抑制作用。图Ⅱ:2为杂种落叶松在离体培养条件下获得的再生小植株。

图1 不同质量浓度的蔗糖对不定芽生根诱导的影响Fig.1 Influence of different concentrations of sucrose on rooting of adventitious buds
2.6 再生植株的移栽
由于刚移栽的组培苗比较幼嫩,针叶的光合作用和根系的吸收能力较弱,需在移植之前对组培苗进行提高其适应能力的锻炼(通常为一周左右为宜),使植株生长粗壮,增强小苗体质以提高移苗成活率。初期应该保持较高的空气湿度(20 d左右),在保证空气湿度足够大的同时,尽量确保移栽基质良好的透气状况。1个月左右重新伸出新的顶芽,则组培苗成活。本试验共移栽48株成活30株,成活率为62.5%,成活植株多数生长旺盛,表现为针叶嫩绿,茎杆粗壮(图Ⅱ:3~4),部分植株长势较弱。
3 讨论
本文在不定芽诱导中,单独使用TDZ诱导杂种落叶松不定芽时效果较好,也曾有人研究表明,TDZ对芽的诱导具有一定的效果[6~7]。任如意等研究表明,TDZ作为一种植物生长调节剂,有很强的细胞分裂素活性,可以在芽的诱导中起一定的作用[8]。Mante等人用5~12.5 μm的TDZ诱导李子子叶、樱桃子叶及桃子子叶[9],Fiola等用5 μm的TDZ诱导悬钩子子叶[10],均诱导出不定芽;欧洲落叶松、挪威云杉、苏格兰松[11]、美国榆树、欧洲楸树、黑洋槐[12]、梨[13]的组织培养证明了低浓度的TDZ能通过抑制顶端优势的发生,从而诱导不定芽和侧芽萌发;TDZ也被单独使用在诱导黄芩外植体产生愈伤组织中[14];目前研究表明TDZ能引起类似细胞分裂素作用,活性强于6-BA[15],这种高活性的分裂素通常用来离体培养的建立和有难度物种的增殖,有效的提高愈伤组织、不定芽或者胚的形成[16]。
在本试验中发现,BM培养基对不定芽的增殖效果最好,不定芽增殖系数也最高,且不定芽生长旺盛,嫩绿色,芽点较大,有效芽多。这可能是由于BM培养基中无机盐含量和有机物含量对于落叶松不定芽的增殖比较适宜,再加上此培养基中加有含量较高的肌醇,也促进了不定芽的分化;MS培养基的增殖效果次之,不定芽生长也较快,但与BM培养基中的不定芽相比较细小些;在1/2BM和1/2MS培养基上培养的不定芽生长状况较差,不定芽细小且尖端黄褐色,出现失绿症状,这可能是由于二者培养基中铁盐含量降低影响了叶绿色的形成[17]。因此可知,基本培养基中无机盐的种类及浓度,以及有机物的种类及含量,对不定芽增殖有较大影响。本试验所用的各种TDZ浓度下不定芽的增殖效果较好,与6-BA相比有明显的优势,这与何俊蓉、Bonga[18~19]的研究结果不同。Bonga等人的试验表明各种TDZ浓度下增殖的芽苗,其增殖效果一般,与6-BA相比并没有明显的优势,这可能是由于在不定芽的增殖培养阶段,不同的植物对不同的细胞分裂素的敏感程度不同,因此,造成不定芽增殖所需的最适细胞分裂素种类有所不同;也有人研究表明,低浓度TDZ或许仅仅促进芽的增殖,而高浓度的TDZ可能既促进芽增殖又提高芽的再生能力[20~21];极低的TDZ浓度能较好的诱导尤加树(E.grandis×E.tereticornis)芽的增殖,而较高的TDZ浓度会产生含水较好的嫩茎[22]。
松属树种器官发生的不同阶段对培养基中附加成分会有不同要求。一般而言,为使已分化的不定芽伸长生长,要将芽连同原组织转移到无激素的培养基上或含低浓度激素的培养基上[23]。本试验中将TDZ含量降到0.5 mg·L-1时,伸长效果较为明显。在一定程度上,TDZ可促进针叶的伸长生长,而且增加了单株针叶的数目,但造成植株纤细,这是由于TDZ具有生长素和细胞分裂素双重作用的特殊功能[24]。而这种过于纤细的植株不利于以后落叶松的生根诱导。为了得到健壮植株、克服生根难问题,还有待于进一步研究探讨。本研究得出,在1/2BM培养基中附加适量浓度的活性炭能显著促进杂种落叶松不定芽的伸长,这与方利娟等的研究相符[25]。
对于大多数针叶树种而言,其组培苗生根比较困难,并已成为某些针叶树种成功快繁的主要障碍。影响杂种落叶松不定芽生根的因素很多,如基因型、基本培养基、植物激素等。本文对不定芽的生根进行了初步探讨,研究了MS、1/2MS、BM、1/2BM、DCR、1/2DCR培养基对不定芽生根诱导的影响,结果表明,1/2MS、1/2BM、1/2DCR培养基都能诱导出不定芽生根,MS、BM、DCR培养基中无不定芽生根现象,这说明低盐浓度的培养基有利于杂种落叶松不定芽的生根。植物激素的种类及其浓度对器官发生具有调控作用,本试验结果表明,单独加入适量浓度的NAA,可诱导不定芽生根,而单独加入不同质量浓度的IBA则不能诱导不定芽生根,IBA和NAA组合使用比单独添加某一种生长素诱导率高,培养基中只添加IBA无NAA不能诱导不定芽生根,可见诱导生根的前期用适量的生长素NAA刺激不定芽,对不定芽的生根有促进作用,而这一结论与施翔对杂交松的研究中发现:IBA更适合杂交松不定根的诱导,NAA的存在则会阻碍根的形成这一结论相反[26]。本试验中不定芽生根诱导率最佳组合为:1/2BM+0.5 mg·L-1IBA+1.0 mg·L-1NAA,其诱导率为30%左右。基于不定芽生根率低这一问题还有待于进一步研究。
组培苗长期在弱光、恒温、高湿的环境下生长,其形态、解剖以及生理特性和大田生长的植株不同,为适应移栽后的较低湿度以及较高的光强,因此本试验在对幼苗移栽前先进行了炼苗。本试验杂种落叶松移栽成活率为62.5%,成活植株多数生长旺盛,表现为针叶嫩绿,茎杆粗壮。
1.Lewandoski A,Burczyk J,Mejnartowicz L.Genetic structure and the mating system in an old stand of Polish larch[J].Silvae Genet,1991,40:75-79.
2.吴克贤,李伟,徐妙珍,等.长白落叶松组织培养的研究[J].林业科学,1996,32(2):125-132.
3.王伟达,李成浩,张含国,等.长白落叶松愈伤组织诱导与不定芽分化[J].东北林业大学学报,2008,36(2):6-7.
4.张莉,张磊,张素芳,等.杂种落叶松愈伤组织诱导培养基的建立和优化[J].安徽农业科学,2014,42(32):11243-11246.
5.Lin X F,Zhang W B,Takano H,et al.Efficient plant regeneration and micropropagation from callus derived from mature zygotic embryo ofLarixgmelinii[J].Plant Biotechnology,2004,21(2):159-163.
6.连霞,马锋旺,陈登文,等.TDZ对仙客来不同外植体再生的影响[J].西北农林科技大学学报:自然科学版,2006,34(4):39-42.
7.胡钠梅,韩素英,梁国鲁,等.TDZ诱导中间锦鸡儿植株再生[J].北方园艺,2009(8):204-205.
8.任如意,王书臻,司徒琳莉,等.噻重氮苯基脲对文冠果愈伤组织诱导与分化的影响[J].北方园艺,2011(06):127-129.
9.Mantes,Scorza R,Cordts J M.TDZ:a potent cytokinin for woody plant tissue culture[J].Plant Cell Tiss Org Cult,1989,19:1-11.
10.Fioal J A,Hassan M A,Swaita H J,et al.Melatonin in feverfew and other medicinal plants[J].Plant Cell Tiss Org Cult,1990,20:223-228.
11.Chalupa,in vitro propagation ofLarix,Picea,Pinus,Quercus,Fagusand other species using adeninetype cytokinins and thidiazron,commun inst for cech,1985,14:65-90.
12.Chalupa,Effect of benzylaminopurine and thidiazuron on in vitro shoot proliferation ofTiliacordataMill.,SorbusaucupariaL. andRobiniapseudoccaciaL.[J].Boil Plant,1987,29:425-429.
13.Chevreau E,Skirvin R M,Abu-Qaoud H A,Korban SS,Sullivan jg (1989) Adventitous shoot regeneration from leaf tissue of three pear(Pyrussp.) cultivars.Plant cell rep7: 688-691.
14.Ledbetter Donna,I Preece John E.Thidiazuron stimulates adventitious shoot production fromHydrangeaquercifoliaBartr leaf explants[J].Scientia horticulturae,2004,101(7):121-126.
15.Huetteman C A,Preece J E.Thidiazuron:a potent cytokinin for woody plant tissue culture[J].Plant Cell Tiss Org Cult,1993,33:105.
16.Hutchinson M J,Saxena P K.Role of purine metabolism in thidiazuron-induced somatic embryogenesis of geranium(Pelargonium×hortorumBailey) hypocotyl culture[J].Physiol Plant,1996,98(3):517.
17.何俊蓉,吴洁,袁宁,等.彩色马蹄莲组培快繁的研究[J].西南农业学报,2008,21(3):775-778.
18.Bonga,J M.Pond S E.Adventitious shoot formation in cultures of 30 year-oldL.decidua,L.teptolepis,L.eurolepisandL.laruinatrees[J].Plant Cell Tissue and Organ Culture,1991,26(1):45-51.
19.Patel,K.R.Kim,H.and Thorpe,T.A.Plantlet formation in pitch pine(PinusrigidaMill) by Tissue culture methods[J].Forest Ecology and Management,1986,15:147-160.
20.Chapupa V.Biol.Plant(Praha),1988,30:414-421.
21.Van Nieunkerk S P,Zimmerman R H.Ford haml[J].Hortscience,1986,21:516-518.
22.Marcia marria de lima.Effect of Thidiazuron on in vitro shoot multiplication of Eucalyptus grandisXeucalyptustereticornis[J].Scientia forestalis,1998,53:49-56.
23.邢世岩.松属树种细胞、组织和器官培养名录[J].植物生理学通讯,1990,1:75-79.
24.徐晓峰,黄学林.TDZ一种有效的植物生长调节剂[J].植物学通报,2003,20(2):227-237.
25.方利娟.杂交松组织培养技术研究[D].南宁:广西大学,2006.
26.施翔.杂交松组织培养技术研究[D].南京:南京林业大学,2005.

图版Ⅰ 1. 25 d时BM上诱导出的芽原基;2. 25 d时1/2MS上诱导出的芽原基;3. BM培养基上TDZ1.5 mg·L-1时诱导出的不定芽;4. BM上增殖的不定芽;5. MS上增殖的不定芽;6. BM培养基上TDZ1.0 mg·L-1时增殖的不定芽;7. BM上添加0.5 mg·L-1TDZ伸长的不定芽;8. BM上添加0.1 mg·L-1TDZ+0.04 mg·L-1NAA伸长的不定芽;9. BM上添加0.05 mg·L-16-BA+0.2 mg·L-1NAA抽茎的不定芽;10. BM上不添加任何激素抽茎的不定芽PlateⅠ 1. 25 d shoot primordium on BM medium; 2. 25 d shoot primordium on1/2MS medium; 3.The adventitious buds on the medium of BM with 1.5 mg·L-1TDZ; 4.The proliferation of adventitious buds on BM medium; 5.The proliferation of adventitious buds on MS medium; 6.The proliferation of adventitious buds on the medium of BM with 1.5 mg·L-1 TDZ; 7.The elongation of adventitious buds on the medium of BM with 0.5 mg·L-1 TDZ; 8.The elongation of adventitious buds on the medium of BM with 0.5 mg·L-1 TDZ and 0.04 mg·L-1NAA; 9.The pumping stems of adventitious buds on the medium of BM with 0.05 mg·L-1 6-BA and 0.2 mg·L-1 NAA; 10.The pumping stems of adventitious buds on the medium of BM with no hormone

图版Ⅱ 1. 1/2BM上添加0.5 mg·L-1IBA+1.0 mg·L-1NAA不定芽诱导的出根苗;2.离体条件下的再生植株;3.移栽20 d时生长旺盛的再生植株;4.移栽35 d时成活的再生植株Plate Ⅱ 1.The rooting of adventitious buds on the medium of 1/2BM with 0.5 mg·L-1 IBA and 1.0 mg·L-1 NAA; 12.The regenerated plants in vitro condition; 13.Regenerated plants with vigorous growth after 20 d being transplanted; 14.Survival regeneration plant after 35 d being transplanted
EstablishmentandOptimizationofplantregenerationofHybridlarch(L.gmelinii10×L.kaempferi13)
ZHANG Li ZHANG Lei HOU Dan ZHANG Su-Fang ZHANG Han-Guo*
(State Key Laboratory of Tree Genetics and Breeding,Northeast Forestry University,Harbin 150040)
With the mature zygotic embryos of hybrid larch(L.gmelinii10×L.kaempferi13), by combining different culture medium and hormone, we established and optimized hybrid larch mature zygotic embryos induction and plant regeneration. BM medium was suitable for adventitious bud induction of hybrid larch with the induction rate of 60.7%. Under the condition of combination BM and1.5 mg·L-1TDZ, induction rate was the highest, 67.73%. BM medium could promote the proliferation of adventitious buds with the value-added coefficient of 4.48, when it was cultured on BM+1.0 mg·L-1TDZ with the coefficient of 5.23. The active carbon could promote the elongation at the level of 2 g·L-1. When the adventitious buds were cultured under BM+0.05 mg·L-16-BA+0.2 mg·L-1NAA, the pumping stems rate was the highest, up to 73.96%, and the highest rooting rate was 29.85% under 1/2BM+0.5 mg·L-1IBA+1.0 mg·L-1NAA.
hybrid larch;the mature zygotic embryos;adventitious buds;tissue culture
国家高技术研究发展计划(863计划)(2013AA102704)
张莉(1988—),女,硕士研究生,主要从事落叶松分子育种的研究。
* 通信作者:E-mail:hanguozhang1@sina.com
2015-10-27
S791.22
A
10.7525/j.issn.1673-5102.2016.03.018
