内生真菌ZPRa-R-1对红景天中关键信号分子及主要次生代谢物的影响
2016-11-10王梦亮田俊生崔晋龙王俊宏
王梦亮 焦 晋,2 邢 婕 田俊生 崔晋龙* 王俊宏
(1.山西大学应用化学研究所,太原 030006; 2.山西大学生物技术研究所,太原 030006; 3.山西大学中医药现代研究中心,太原 030006)
内生真菌ZPRa-R-1对红景天中关键信号分子及主要次生代谢物的影响
王梦亮1焦 晋1,2邢 婕3田俊生3崔晋龙1*王俊宏1
(1.山西大学应用化学研究所,太原 030006;2.山西大学生物技术研究所,太原 030006;3.山西大学中医药现代研究中心,太原 030006)
研究内生真菌ZPRa-R-1对大花红景天组培苗中信号分子NO,SA和H2O2,及主要次生代谢物酪醇(p-tyrosol)和红景天苷(salidroside)积累的影响。分别采用Greiss试剂法、RP-HPLC荧光法、硫酸钛法检测NO,SA和H2O2等信号分子;采用分光光度法检测关键酶PAL和CA4H的活性;采用RP-HPLC检测酪醇和红景天苷。ZPRa-R-1接种于红景天,首先引起宿主信号分子NO含量增高,其次是SA和H2O2,它们达到最大值的时间分别是共生后第8,10和12 d,含量分别为0.193 μmol·g-1,0.062 μg·g-1,0.092 μmol·g-1;关键酶PAL和CA4H活性最大值分别为166.400 U·g-1和0.625 U·g-1·h-1,分别是对照组的8和1.5倍,最终引起酪醇和红景天苷的积累效应,在第8和10 d达到最大值,含量分别为8.656和0.498 mg·g-1,是对照组的7和2.8倍。研究结果表明内生真菌ZPRa-R-1能通过诱导激活宿主信号分子网络系统,引起关键酶活性的变化,进而调控酪醇和红景天苷等次生代谢物的积累。
红景天;内生真菌;信号分子;酪醇;红景天苷
大花红景天(Rhodiolacrenulata)是我国《药典》收录的中药红景天指定的唯一基原植物,其主要功效为“益气活血,通脉平喘”,用于治疗“气虚血瘀,胸痹心痛,中风偏瘫,倦怠气喘”[1];也是近年来用于具有“适应原性”化妆品、保健食品的新兴植物药[2]。
自从1993年Stierle等[3]首次报道了从短叶紫杉(Taxusbrevifolia)树皮中得到一株能够产生紫杉醇的内生真菌(Taxomycesandreanae)以来,内生真菌的功能多样性引起了国内外研究人员的高度关注。近年来,大量研究开始通过真菌诱导子处理植物细胞培养物,调控并提高目标产物含量,并研究诱导子的作用机制。文献表明,内生真菌与植物相互作用的过程中,能够激活许多与信号转导有关的生理生化反应,如离子跨膜运输、活性氧(ROS)合成、蛋白质磷酸化和脱磷酸化以及茉莉酸(JA)和水杨酸(SA)合成等[4~5];进而选择性地诱导植物特定基因表达、激活代谢过程中的关键酶的活性,最终导致次生代谢途径中某些产物积累的变化[6]。这个代谢过程中,各种信号分子对植物次生代谢物合成的调控过程并非完全独立,而是通过特定的应答(cross-talk)机制,形成复杂的协调关系,最终以特定的信号转导网络形式介导外界因子诱发次生代谢物的生物合成[7]。本实验采用前期筛选出的内生真菌ZPRa-R-1与宿主大花红景天共培养,研究宿主中主要信号分子NO,SA和H2O2含量,关键酶PAL和CA4H活性及主要活性成分酪醇和红景天苷积累的变化规律,为利用生物因子改善红景天活性成分积累提供理论基础。
1 实验材料与仪器
1.1 材料与试剂
红景天组培苗为山西大学应用化学研究所建立的大花红景天组培苗繁殖体系。内生真菌ZPRa-R-1经本课题组鉴定为瓶头霉属(Phialocephalasp.)真菌[8],其ITS序列提交至GenBank数据库(http://www.ncbi.nlm.nih.gov/),编号为KJ542299。此菌保藏于中国普通微生物菌种保藏中心(CGMCC No.9347)和山西大学应用化学研究所生物化工实验室。真菌培养基:PDA培养基。酪醇对照品(美国Accu Standard Inc,批号501-94-0);红景天苷对照品(中国药品生物制品检定所,批号110818-201005);水杨酸标准品(中国食品药品检定研究院,批号100106-201104);甲醇(美国Fisher公司,色谱纯);其余试剂均为分析纯。
1.2 主要仪器
Agilent1200高效液相色谱仪(手动进样器,四元泵,DAD二极管阵列检测器,荧光检测器,在线脱气机,美国Agilent公司);UV2450型紫外-可见分光光度计(日本岛津公司);arium@Pro UF纯水系统(德国Sartorius公司);SW-CJ-IFD双人单面净化工作台(苏州净化设备有限公司)。
2 实验方法
2.1 内生真菌与红景天组织苗共生培养
无菌条件下,打取直径为0.5 cm的ZPRa-R-1菌块,接种于与红景天组培苗接触的培养基(MS+0.5 mg·L-1TDZ+0.5 mg·L-1NAA)上,光照培养(光14 h,暗10 h;对应温度28℃,22℃;光照强度30 μmol·m-2·s-1;湿度70%~75%),不接菌的红景天组培苗作为对照,每2 d取样1次,周期为20 d,重复3次。
医药卫生研究事业的发展是建立在大量的临床实验数据基础上的,只有经过大量实验证明药物的有效性,该药物才能应用到医院患者的治疗中。医院进行相关药物使用情况的反应、疗效等数据,对于药物改良、药效提升等都具有重要意义,能够为医药卫生事业发展提供数据支撑。
2.2 NO含量的测定
采用Greiss试剂法[9]。精确称取1 g新鲜红景天组培苗,加入3 mL蒸馏水和少许石英砂,研磨至匀浆,转入1.5 mL离心管,4 000 r·min-1下离心20 min,移液枪吸取上清液即为样品提取液。将样品提取液:Greiss试剂=1∶1(V∶V),振荡混匀,室温下静置30 min,于550 nm处测定吸光值,在NaNO2标准曲线中计算NO含量。
2.3 SA含量的测定
参照陶金华[9]的方法提取SA,用HPLC荧光检测法测定含量。精确称取1 g新鲜红景天组培苗,匀浆,加入1 mL 90%甲醇,漩涡混合器振荡1 min,10 000×g离心15 min,上清液转入1.5 mL离心管,下层沉淀用0.5 mL 100%甲醇按上述方法重新提取,合并2次上清液,冷冻干燥、浓缩,加入0.5 mL 5%三氯乙酸溶解,振荡2 min。用0.8 mL醋酸乙酯与环己烷的混合液(1∶1,V∶V)萃取2次,合并有机相,冷冻干燥、浓缩。加入0.6 mL液相流动相溶解,用0.22 μm微孔滤膜过滤,滤液即为待测样品,4℃保存,待测。
色谱条件:色谱柱为Thermo-C18柱(250 mm×4.6 mm,5 μL);柱温25℃;进样体积为10 μL;流速为0.5 mL·min-1;流动相为0.2 mol·L-1乙酸钠缓冲液-甲醇(9∶1,V∶V),pH5.5。荧光检测器激发波长:294 nm,发射波长:426 nm。
2.4H2O2含量的测定
采用硫酸钛法[7]。精确称取1 g新鲜红景天组培苗,加入5 mL于4℃下预冷丙酮,冰浴条件下迅速匀浆,在4℃ 10 000 r·min-1下离心20 min。吸取2 mL上清液,加入0.5 mL 5%硫酸钛,充分混匀,再加入2 mL浓氨水,混匀,在4℃ 10 000 r·min-1下离心15 min,弃上清。用5 mL 2 mol·L-1浓硫酸溶解沉淀,于波长415 nm处测定吸光度。根据吸光度值,利用H2O2标准曲线计算H2O2含量。
2.5 苯丙氨酸解氨酶(PAL)活性的测定
2.6 肉桂酸-4-羟化酶(CA4H)活性的测定
称取新鲜红景天组培苗0.5 g,冰浴研磨后加入5 mL磷酸缓冲液(200 mmol·L-1,pH7.5,2 mmol·L-1β-巯基乙醇),在4℃下以10 000 r·min-1离心15 min。取上清液即为CA4H粗酶提取液。
酶反应液组成为:0.2 mL酶提液,4.8 mL磷酸缓冲液(50 mmol·L-1;2 mmol·L-1反式肉桂酸,0.5 mmol·L-1氧化型辅酶钠盐NADP,2 mmol·L-1巯基乙醇)。37℃下反应1 h后,加入0.1 mL 6 mmol·L-1HCL终止反应,取上清液在290 nm比色。对照为不加酶提取液(加入0.8 mL ddH2O)。酶活性表示为U·g-1·h-1,重复3次。
2.7 次生代谢物含量的测定
采用HPLC检测次生代谢物含量。将红景天组培苗在40℃烘干。精确称取质量后置于具塞锥形瓶,按料液比为1∶10(m∶v)加入甲醇溶液浸泡30 min,超声提取20 min,滤纸过滤。滤渣按上述方法重复提取2次,合并上述滤液,于40℃旋转蒸发,浓缩,得浓缩物。用色谱级甲醇定容至一定体积,用0.45 μm尼龙微孔滤膜过滤,置于4℃保存,备用。
色谱条件:色谱柱Thermo-C18柱(250 mm×4.6 mm,5 μL);柱温30℃;进样10 μL;流速0.8 mL·min-1;流动相为甲醇-水(32∶68,V∶V)。紫外检测波长277 nm。
3 结果与分析
3.1 内生真菌对红景天组培苗中信号分子的影响

图1 ZPRa-R-1对红景天组培苗中三种信号分子含量的影响Fig.1 Effects of ZPRa-R-1 on the singnaling molecules in Rhodiola tissue culture seedling inoculated()
内生真菌ZPRa-R-1与组培苗作用不同时间后,对红景天组培苗中NO,SA和H2O2含量的影响分别如图1所示。内生真菌诱导子在特定时间段内可以诱导红景天组培苗中NO,SA和H2O2含量的增加,但三者产生最高峰的时间不同。红景天组培苗中NO含量在第8 d达到第一个最高峰,含量为0.193 μmol·g-1,此时对照组NO含量为0.115 μmol·g-1,处理组NO含量约为对照组的1.6倍。组培苗中SA在第10 d达到高峰,含量为0.062 μg·ml-1,是同时期对照组的2.5倍左右。红景天组培苗中H2O2在第12 d达到最大值,含量达到0.092 μmol·g-1,对照组H2O2释放量为0.028 μmol·g-1,前者为后者的3倍。结果表明,真菌接种红景天,三种主要信号分子响应顺序为NO,SA和H2O2,它们在接种真菌后第4 d达到一个低值,之后含量升高到一个峰值,随之逐渐降低并趋于稳定,这可能是宿主对外来刺激的一种防御反应。
3.2内生真菌对红景天组培苗中PAL和CA4H活性的影响
红景天组培苗与内生真菌ZPRa-R-1共生20 d后,其关键酶PAL与CA4H活性表现出一定规律性(图2)。结果表明,接入内生真菌后,组培苗中合成红景天苷和酪醇代谢途径的关键酶PAL及CA4H活性逐渐增加,分别在第10和14 d达到最大值,且均高于对照组,达到166.400 U·g-1和0.625 U·g-1·h-1,分别是对照组的8和1.5倍。随着时间的延长,两种关键酶的活性又逐步降低。
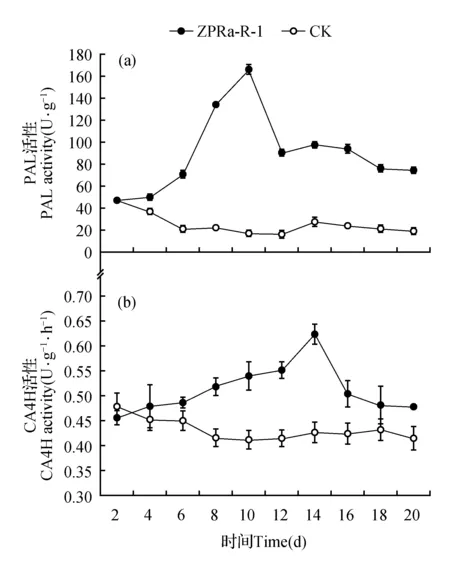
图2 ZPRa-R-1对红景天组培苗中关键酶活性的影响Fig.2 Effects of ZPRa-R-1 on the activities of key enzymes in Rhodiola tissue culture seedling inoculated()
3.3内生真菌对红景天组培苗中主要次生代谢物积累的影响
内生真菌ZPRa-R-1接种于红景天组培苗,能够引起宿主红景天主要成分的积累效应。结果表明,主要次生代谢物酪醇和红景天苷含量发生了规律性的变化(图3)。经内生真菌处理后,酪醇含量在第8 d达到最大值8.656 mg·g-1,而对照组为1.174 mg·g-1,处理组含量约为对照组的7倍;红景天苷含量在第10 d达到最大值0.498 mg·g-1,此时对照组为0.177 mg·g-1,前者约为后者的2.8倍。这表明内生真菌ZPRa-R-1能影响红景天中红景天苷和酪醇的积累,在某些时间段内具有正向调节作用。
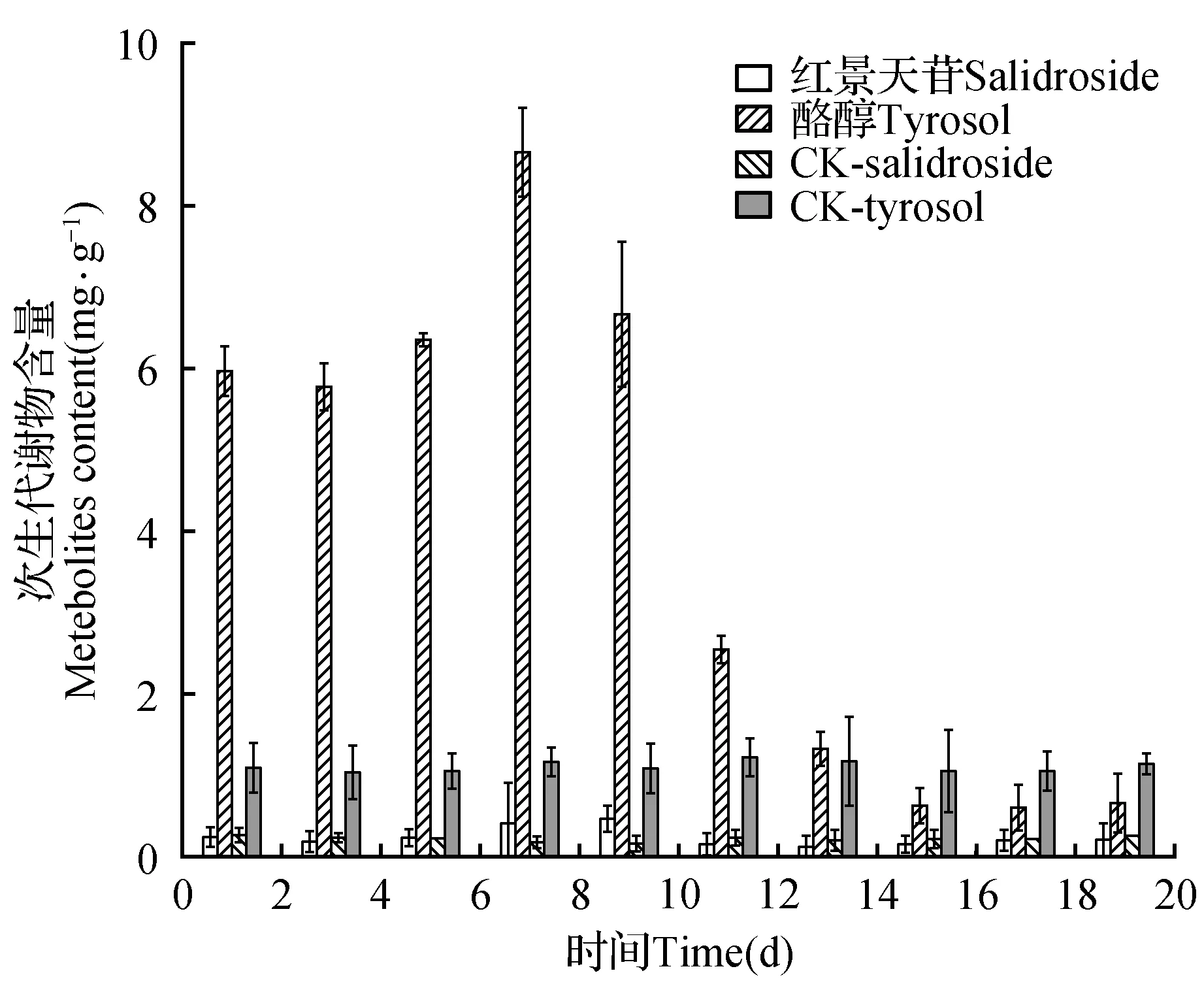
图3 ZPRa-R-1对红景天中红景天苷和酪醇含量的影响Fig.3 Effects of ZPRa-R-1on the main secondary metabolites in Rhodiola tissue culture seedling inoculated(n=3,±s)
4 讨论
研究表明,内生真菌诱导子并不直接参与植物次生代谢物的合成,它是通过激发植物细胞内相关信号网络的转导机制,进而调控植物次生代谢物的合成。其中,NO和H2O2被认为是真菌诱导子诱发植物防御反应的主要信号分子[10~11]。近年来研究发现,NO多为上游信号分子,是信号网络中所有信号分子调控的关键节点[12],并且是介导微生物诱导子诱发植物防御反应所必须的信号分子之一。本实验结果表明,内生真菌ZPRa-R-1可以在特定时间段显著影响红景天组培苗中NO,SA和H2O2等信号分子含量的变化,同时发现,NO的变化总是优先于后两者,同时产生酪醇和红景天苷次生代谢途径的关键酶PAL和CA4H活性也显著提高,而后,引起关键代谢产物酪醇和红景天苷积累的变化。根据试验的数据结果,人们可以在特定的时间范围内,利用内生真菌ZPRa-R-1与宿主红景天相互作用,激活并调控关键酶基因表达,进而获得较高含量的红景天苷和酪醇。目前为止,人们对此过程中NO的合成及转换机制、作用机制和作用靶点尚不清楚,诱导子如何实现信号转导,并进一步促进植物积累次生代谢物等问题都有待于进一步研究。
目前,限制药用植物细胞培养工业化生产的关键问题之一是细胞培养中次生代谢物含量偏低的问题。而内生真菌用于促进药用植物次生代谢产物的积累以及产生新的活性成分,具有繁殖快、生物量大、可塑性强,成为当前医学和生物学领域研究的热点[13]。例如,添加内生真菌诱导子对茅苍术悬浮细胞的生长及挥发油积累均有促进作用,其中β-桉叶醇的量是对照的2.22倍[14]。大戟内生真菌诱导子对大戟中异大戟素的积累有明显促进作用,在内生真菌诱导子处理的第4 d达到高峰,且是对照组异大戟素含量的2.4倍[15]。这些研究为内生真菌对药用植物活性成分积累的调控作用提供了实践基础,为改良和驯化药用植物提供了新的思路。
1.中华人民共和国药典(2010一部)[S].北京:中国医药科技出版社,2010:144-144.
2.Khanum F,Bawa A S,Singh B.Rhodiola rosea:A versatile adaptogen[J].Comprehensive Reviews in Food Science and Food Safety,2005,4:55-62.
3.Stierle A,Strobel G,Stierle D.Taxol and taxane production byTaxomycesandreanae,an endophytic fungus of Pacific yew[J].Science,1993,260:214-216.
4.Dietrich A,Mayer J E,Hahlbrock K.Fungal elicitor triggers rapid,transient,and specific protein phosphorylation inParsleycell suspension cultures[J].Journal of Biological Chemistry,1990,265:6360-6368.
5.Nurnberger T,Colling C,Hahlbrock K,et al.Perception and transduction of an elicitor signal in culturedParsleycells[J].Biochemical Society Symposium,1994,60:173-182.
6.Li P Q,Yan M,Shan T J,et al.Effects of polysaccharide elicitors from endophytic Fusarium oxysporium Dzf17 on growth and diosgenin production in cell suspension culture ofDioscoreazingiberensis[J].Molecules,2011,16(11):9003-9008.
7.陶金华,汪冬庚,濮雪莲,等.一氧化氮和水杨酸依次介导内生真菌诱导子促进苍术细胞中苍术素生物合成的信号转导[J].中草药,2014,45(5):701-708.
8. Cui J L,Guo T T,Ren Z X,et al.Diversity and Antioxidant Activity of Culturable Endophytic Fungi from Alpine Plants ofRhodiolacrenulata,R.angustaandR.sachalinensis[J].Plos One,2015,10(3):1-16.
9.杜研.诱导子对黄芪愈伤组织生长及代谢的影响[D].长春:吉林农业大学生命科学学院,2007.
10.Neill S J,Desikan R,Hancock J T.Nitric oxide signaling in plants[J].New Phytologist,2003,159:11-12.
11.Delledonne M,Zeier J,Marocco A,et al.Signal interaction between nitricoxide and reactive oxygen intermediates in the plant hypersensitive disease resistance response[J].Proceedings of the National Academy of Science,USA,2001,98:13454-13459.
12.徐茂军.一氧化氮:植物细胞次生代谢信号转导网络可能的关键节点[J].自然科学进展,2007,17(12):1622-1630.
13.刘颖,魏希颖.内生真菌对植物次生代谢产物的转化[J].天然产物研究与开发,2014,26:300-303.
14.方芳,戴传超,张波.茅苍术悬浮细胞系建立及内生真菌诱导子对其挥发油积累的影响[J].中草药,2009,40(3):452-455.
15.Gao F K,Ren C G,Dai C C.Signaling Effects of Nitric Oxide,Salicylic Acid,and Reactive Oxygen Species on Isoeuphpekinensin Accumulation inEuphorbiapekinensisSuspension Cells Induced by an Endophytic Fungal Elicitor[J].Journal of Plant Growth Regulation,2012,31:490-497.
EffectsofEndophyticFungiZPRa-R-1ontheKeySingnalMoleculesandtheMainSecondaryMetabolitesinRhodiolacrenulata
WANG Meng-Liang1JIAO Jin2XING Jie3TIAN Jun-Sheng3CUI Jin-Long1*WANG Jun-Hong1
(1.Insititute of Applied Chemistry,Shanxi University,Taiyuan 030006;2.Insititute of Biotechnology, Shanxi University,Taiyuan 030006;3.Modern Research Center for Traditional Chinese Medicine,Shanxi University,Taiyuan 030006)
We studied the effects on the key signal molecules and the main secondary metabolites's content in tissue culture ofRhodiolacrenulatainoculated with endophic fungi ZPRa-R-1. We selected Greiss method, RP-HPLC and Titanium sulfate method to detect the contents of NO, SA and H2O2, respectively, and detected the key enzymes, PAL and CA4H by spectrophotometry.p-Tyrosol and salidroside inRhodiolaseedling co-cultured with fungi were evaluated by RP-HPLC. The content of NO increased firstly, followed by SA and H2O2after thatRhodiolaseedling inoculated with endophic fungi. The maximum contents of NO, SA and H2O2were detected at 8, 10 and 12 d, and they were 0.193 μmol·g-1, 0.062 μg·g-1and 0.092 μmol·g-1, respectively. The maximum contents of PAL and CA4H were 166.400 U·g-1, 0.625 U·g-1·h-1, and were 8 and 1.5 times as much as that of control, repectively. The contents ofp-tyrosol and salidroside were accumulated, and the time of each of them reaching the maximum content was on 8 and 10 d, and the contents were 8.656 and 0.498 mg·g-1, and were 7 and 2.5 times as much as that of control, respectively. Therefore, ZPRa-R-1 has the capacity of regulating signals and promoting the activities of PAL and CA4H, and finally promoted accumulation ofp-tyrosol and salidroside in co-culturing seedling of fungi andRhodiola.
Rhodiolacrenulata;endophytic fungi;signal molecule;p-tyrosol;salidroside
国家自然科学基金(31270383);山西省自然科学基金(2014011029-1);高等学校博士学科点专项科研基金(20121401120001);林业公益性行业科研专项(201304326)
王梦亮(1966—),男,教授,博士,主要从事生物转化及药物中间体的合成的研究。
* 通信作者:E-mail:CJL717@163.com
2015-09-29
S567
A
10.7525/j.issn.1673-5102.2016.03.015
