1341例疑似肺孢子菌肺炎非HIV阳性患者病原学诊断分析
2016-11-10李晶晶安亦君齐志群李小丽黄敏君
李晶晶,邹 洋,安亦君,齐志群,李小丽,王 磊,黄敏君
1341例疑似肺孢子菌肺炎非HIV阳性患者病原学诊断分析
李晶晶,邹洋,安亦君,齐志群,李小丽,王磊,黄敏君
目的 探讨六亚甲基四胺银(gomori’s methenamine silver, GMS)染色镜检法和聚合酶链式反应(polymerase chain reaction, PCR)法检测肺孢子菌肺炎(pneumocystis pneumonia, PCP)患者标本的阳性率,为临床提供更有利的实验室支持依据。方法 采集1341例疑似PCP患者的深部诱导痰或支气管肺泡灌洗液(broncho-alveolar lavage fluid, BALF)标本,GMS镜检法和 PCR法相结合检测肺孢子菌,任何一种方法检测阳性,即判断为PCP。 结果 共285例诊断为PCP,其中114例为GMS染色镜检法阳性,282例为PCR法检测阳性,111例为2种检测方法双阳性,3例为GMS染色镜检法单独阳性(均为肾移植术后BALF样品),171例为PCR方法单独阳性。深部诱导痰标本中,GMS染色镜检法和PCR法阳性检出率分别为5.1%和16.2%(P<0.05);而BALF标本二者的阳性检出率分别为23.3%和42.2%(P<0.05)。未知原因发热合并肺炎患者和器官移植后接受免疫抑制剂治疗者有更高的阳性检出率。结论 PCR法检测PCP阳性率高于GMS染色镜检法,PCR法检测与GMS染色镜检法结合诊断PCP对临床具有较高指导价值。
肺孢子菌肺炎;病原学;六亚甲基四胺银染色;聚合酶链式反应
肺孢子菌是机会致病菌,由肺孢子菌引起的肺孢子菌肺炎(Pneumocystis pneumonia, PCP)是一种间质性浆细胞性肺炎,常见于艾滋病患者,是目前常见的机会感染与致死的病因之一[1]。近年来,由于器官移植、肿瘤放化疗和免疫抑制剂使用增加等原因所致获得性免疫功能缺陷者的增多,PCP的发生率呈逐年上升趋势[2]。为探讨PCP的六亚甲基四胺银(gomori’s methenamine silver, GMS)染色镜检法和聚合酶链式反应(polymerase chain reaction, PCR)法检测PCP患者标本的阳性率,为临床提供更有利的实验室支持依据,本研究回顾性分析2011年1月—2014年10月由其他医疗机构送检我所的1341例疑似PCP的实验室诊断结果,现总结报告如下。
1 对象与方法
1.1对象 为2011年1月—2014年10月由其他医疗机构送到北京友谊医院热带医学研究所进行PCP病原学检测的标本,选取可追踪其基础疾病并采样规范的1341例疑似PCP非HIV阳性患者的深部诱导痰或支气管肺泡灌洗液(broncho-alveolar lavage fluid, BALF)标本,回顾性分析GMS染色镜检法和PCR法的检测结果。
1.2PCP的诊断 由于PCP缺少特异的临床症状,诊断非常困难。临床医师对考虑免疫功能受损患者出现发热、干咳、呼吸急促和呼吸困难等症状,并且胸部X线片双肺呈典型碟形毛玻璃样改变或迷雾状阴影的患者高度怀疑为PCP,此类患者的深部诱导痰、BALF找到肺孢子菌包囊则确诊为PCP,PCR法检测到DNA阳性为PCP的辅助诊断方法[2-3]。本研究中1341例病例均存在发热、干咳、呼吸急促和呼吸困难等症状,且胸部X线片或CT显示为毛玻璃样改变。
1.3仪器及试剂 1N NaOH溶液、0.9%氯化钠溶液、无水甲醇、5%过碘酸钠、GMS染液等,TIANGEN植物基因组DNA提取试剂盒(DP305-02),TaKaRa Ex Tag酶 (DRR006A),5×Loading Buffer (GENEray, GR0205)。 PCR仪(型号PTC.200,Bio-Rad,美国)。
1.4检测方法
1.4.1GMS染色镜检法 将BALF或液化后的深部诱导痰液2 ml,分装在2个1.5 ml Ep管中,8000 rpm 离心5 min后得沉淀,加入0.9%氯化钠溶液,混匀后8000 rpm 离心5 min,清洗沉淀一次。另一管沉淀用于基因组DNA的提取。将沉淀与少量0.9%氯化钠溶液混匀后,滴于涂有小牛血清的玻片上,晾干,经无水甲醇固定。5%过碘酸钠氧化,室温孵育15 min,蒸馏水冲洗数秒,晾干。涂片置GMS染液染缸,60 ℃温箱孵育90 min至标本转为黄褐色,蒸馏水冲洗。晾干涂片,2%硫代硫酸钠分化及亮绿复染2 min,蒸馏水冲洗数次,油镜镜检。由2名技术员复核。
1.4.2PCR法检测 按植物基因组DNA提取试剂盒提取标本DNA,PCR引物为肺孢子菌线粒体大亚基rRNA(mtLSU rRNA)中的2个片段pAZ102E(5’-GATGGCTGTTTCCAAGCCCA-3’)和pAZ102H(5’-GTGTACGTTGCAAAGTACTC-3’),由中国SBS公司合成。PCR反应使用25 μl反应体系:10× buffer 2.5 μl,10 M 4×dNTPs 2.0 μl,10 μmol/L引物各0.5 μl,Ex Taq酶0.125 μl(购自Takara公司),DNA模板5 μl,无菌去离子水补齐至25 μl。共设3个对照。阳性对照:1 μl(人源肺孢子菌分离株Ptl DNA),其余用无菌去离子水补齐;阴性对照:5 μl阴性患者标本DNA;空白对照:5 μl无菌双蒸水。反应条件:变性 94 ℃ 30 s,退火55 ℃ 30 s,延伸 72 ℃ 1 min,进行35个循环;最后72 ℃延伸8 min。取8 μl扩增产物进行琼脂糖凝胶电泳,100 mA电流电泳,35 min后停止电泳,取出凝胶置于凝胶成像系统进行扫描并保存图像。PCR产物片段长约346 bp。
1.5统计学处理 用SPSS13.0进行统计分析。2组率的比较用四格表χ2检验,多组率的比较用R×Cχ2检验。P<0.05表示差异有统计学意义。
2 结 果
2.11341例标本总体阳性率 1341例标本中,2种方法共检出阳性标本285例,阳性率为21.3%。其中111例为2种检测方法双阳性,3例为GMS染色镜检法单独阳性(均为BALF样品,且均为肾移植术后),171例为PCR法单独阳性。PCR法阳性率为21.0%(282/1341),GMS染色镜检法阳性率为8.5%(114/1341)。以GMS染色镜检法为金标准,PCR法的灵敏度为97.4%(111/114)。
2.22种标本用不同方法检测的阳性率
2.2.12种标本检测阳性率 1092例深部诱导痰标本采用GMS染色镜检法和PCR检测方法,共检测阳性177例,阳性率为16.2%;249例BALF标本采用2种方法检测阳性108例,阳性率为43.4%。BALF标本检测阳性率高于深部诱导痰标本(χ2=89.403,P=0.000)见表1。
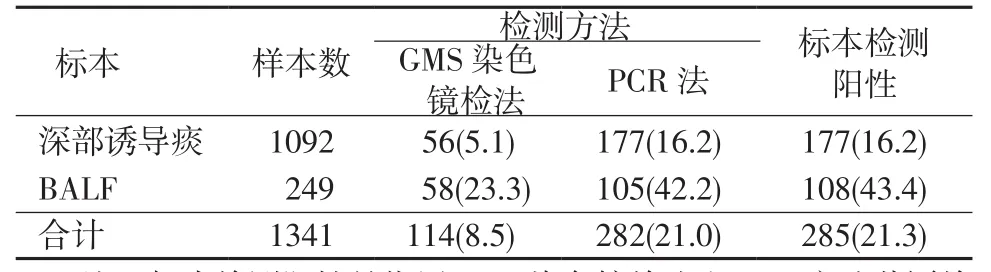
表1 2种标本用2种方法检测结果[ 例(%)]Table 1 Results of GMS staining and PCR assay in sputum and BALF specimens[ cases(%)]
2.2.22种标本用2种方法检测的阳性率 用GMS染色镜检法,249例BALF 标本检测阳性58例,阳性率为23.3%;1092例深部诱导痰标本检测56例,阳性率为5.1%。BALF 标本阳性率大于深部诱导痰标本(χ2=86.014,P=0.000)。采用 PCR法检测,249例BALF阳性标本105例,阳性率为42.2%;1092例深部诱导痰阳性标本177例,阳性率为16.2%。BALF 标本阳性率高于深部诱导痰标本(χ2=82.283,P=0.000)。见表1。
2.35种疾病标本用2种方法检测结果 对1341例标本按照患者原发病归纳为5种:恶性肿瘤继发性免疫缺陷(恶性肿瘤组),器官移植后接受免疫抑制剂治疗(器官移植组),自身免疫性疾病接受免疫抑制剂治疗(自身免疫性疾病组),高龄患有慢性病(老年慢性病组),未知原因发热合并肺炎(未知原因肺炎组)。分析5组检测阳性率。
GMS染色镜检法检测各疾病组阳性率为6.6%~13.1%,但各组差异无统计学意义(χ2=9.3575,P=0.0528)。PCR法检测各疾病组阳性率为10.1%~28.9%,未知原因肺炎组和器官移植组阳性率分别为28.9%和26.6%,高于其他疾病组,差异有统计学意义(χ2=49.8271,P=0.000)。见表2。

表2 5种疾病标本用2种方法检测结果[ 例(%)]Table 2 Results of GMS staining and PCR assay in 5 kinds of diseases[ cases(%)]
3 讨 论
由于肺孢子菌不能被培养,在病原学检测中镜下找到肺孢子菌包囊是诊断PCP的金标准[4]。但其准确性受很多因素限制。第一是标本来源,病原学检测所采用的标本主要为深部诱导痰和(或)BALF。实验室研究发现深部诱导痰虽然具有获取简单以及无创等优点,且送检样本较多,但荷菌量低,容易出现假阴性;而支气管肺泡灌洗是一种侵袭性操作,获取困难,是标本来源上限制PCP准确诊断的因素。第二,检验人员的技术和经验影响对镜检结果的判定[5-6]。第三,肺孢子菌生活史阶段为滋养体和包囊,比例为10∶1,以哪种形态存在与其生存环境关系密切,应用仅使包囊着色的GMS染色镜检法作为病原学检测手段来诊断PCP,会造成假阴性增加[7-9]。 因此仅靠病原学检测很难得出正确的诊断。目前PCR法检测肺孢子菌DNA片段被广泛应用于PCP的诊断。对多拷贝基因的检测,如mtLSU rRNA或msg,使得PCP诊断的敏感性大大提高[4,6]。一些荷菌量很低无法通过病原学检测查获肺孢子菌的患者,也可通过PCR法完成实验室诊断[5]。经过综合考虑,我所采用病原学检测与PCR法检测相结合的方法进行实验室PCP诊断。
由于GMS染色镜检法本身受到诸多因素影响,阳性率不高,所以本文虽然以GMS染色镜检法为金标准计算了PCR法检测PCP的灵敏度,但是无法计算特异度。
已有文献表明,针对HIV感染者PCP病例,咳痰标本的病原检出率仅为6%~30%,雾化吸入深部诱导痰液法能将检出率提高到60%~72%;而选取BALF的病原检出率可提高到98%~100%[10]。 本文的研究数据表明,采用GMS染色镜检法检测深部诱导痰液和BALF标本,阳性检出率都比较低,但相比而言,BALF 标本更有利于肺孢子菌的检出。同时,我们的实验室数据分析也表明,采用PCR法检测在不同送检样本类型中均具有相对较好的检出率。因此将GMS染色镜检法和PCR法检测相结合,更有利于PCP的实验室诊断。这提示,临床一线医务人员考虑患者PCP可能时,采集BALF比采集深部诱导痰得到的标本更有利于PCP的实验室检测。
随着HIV感染者PCP预防性用药措施的实施,该类人群在PCP发病率有所下降,目前PCP患者主要为非HIV感染者,如恶性肿瘤、器官移植或自身免疫性疾病等高危人群[5]。本文的送检样本中涉及到5类患者人群中,实验室采用GMS染色镜检法和PCR法相结合的检测阳性率,未知原因肺炎和器官移植患者阳性率分别高达28.9%和26.6%。该数据对临床医生敲响了警钟,不明原因发热的诊断本就是目前医学界的一个难题,在病因不明的情况下,机体免疫状况发生改变合并PCP,将使得该类患者病因学诊断更加困难重重。因此,在非HIV阳性患者中,接受免疫抑制剂治疗的患者(特别是器官移植患者)继发不明原因肺炎时,要考虑到PCP的可能。而对于未知发热合并肺炎患者,实验室提供的肺孢子菌的检测依据可能在患者诊断及救治中发挥重要作用。
PCP是接受化疗的肿瘤患者和接受器官移植等细胞免疫功能低下患者最常见的感染性疾病[11]。随着人口老龄化以及器官移植的广泛开展,PCP发病率逐年增多[5]。我国大多数地区的医生及检验人员对PCP的了解甚少,易误诊为细菌性、病毒性、结核性或真菌性感染。因此,当免疫功能受损患者或高龄慢性病患者出现发热、干咳、呼吸困难且症状与体征不相符时,临床医师应注意有无合并PCP的可能。对免疫功能正常的肺部感染但原因待查的患者也应注意鉴别PCP,及早进行镜检和(或)DNA检测。
总之,实验室开展PCP检测技术和结果判定对临床医师诊断和制定PCP的治疗方案至关重要。目前肺孢子菌无法进行体外培养,也限制其诊断方法的发展[12]。我们将PCR法与GMS染色镜检法相结合,提高了PCP的实验室诊断技术和水平,为PCP的临床诊断提供实验室参考依据,为该类患者能够得到及时救治提供实验室支持。
[1] Stringer JR, Beard CB, Miller RF, et al. A new name (Pneumocystis jiroveci) for Pneumocystis from humans[J]. Emerg Infect Dis,2002, 8(9):891-896.
[2] Calderon EJ, Gutierrez-Rivero S, Durand-Joly I, et al. Pneumocystis infection in humans: diagnosis and treatment[J]. Expert Rev Anti Infect Ther, 2010, 8(6):683-701.
[3] Thomas CF, Jr, Limper AH. Pneumocystis pneumonia[J]. N Engl J Med, 2004, 350(24):2487-2498.
[4] Huang L, Cattamanchi A, Davis JL, et al. HIV-associated Pneumocystis pneumonia[J]. Proc Am Thorac Soc, 2011,8(3):294-300.
[5] Sokulska M, Kicia M, Wesolowska M, et al. Pneumocystis jirovecii--from a commensal to pathogen: clinical and diagnostic review[J]. Parasitol Res, 2015, 114(10):3577-3585.
[6] Limper AH, Offord KP, Smith TF, et al. Pneumocystis carinii pneumonia. Differences in lung parasite number and inflammation in patients with and without AIDS[J]. Am Rev Respir Dis, 1989,140(5):1204-1209.
[7] Nassar A, Zapata M, Little JV, et al. Utility of reflex Gomori methenamine silver staining for Pneumocystis jirovecii on bronchoalveolar lavage cytologic specimens: a review[J]. Diagn Cytopathol, 2006, 34(31):719-723.
[8] Rifkind D . Pneumocystis carinii pneumonia in renal transplant recipients[J]. Natl Cancer Inst Monogr, 1976, 43:49-54.
[9] Procop GW, Haddad S, Quinn J, et al. Detection of Pneumocystis jiroveci in respiratory specimens by four staining methods[J]. J Clin Microbiol, 2004, 42(7):3333-3335.
[10] Bustamante EA, Levy H. Sputum induction compared with bronchoalveolar lavage by Ballard catheter to diagnose Pneumocystis carinii pneumonia[J]. Chest, 1994, 105(3):816-822.
[11] McKinnell JA, Cannella AP, Kunz DF, et al. Pneumocystis pneumonia in hospitalized patients: a detailed examination of symptoms, management, and outcomes in human immunodeficiency virus (HIV)-infected and HIV-uninfected persons[J]. Transpl Infect Dis, 2012, 14(5):510-518.
[12] Li MC, Lee NY, Lee CC, et al. Pneumocystis jiroveci pneumonia in immunocompromised patients: delayed diagnosis and poor outcomes in non-HIV-infected individuals[J]. J Microbiol Immunol Infect, 2014, 47(1):42-47.
(2016-05-12收稿 2016-07-05修回)
(责任编委 曲 芬 本文编辑 张云辉)
Etiological analysis of 1341 suspected cases without HIV positive of Pneumocystis pneumonia
LI Jing-jing , ZOU Yang*, AN Yi-jun, QI Zhi-qun, LI Xiao-li, WANG Lei, HUANG Min-jun
Division of Parasitic Disease of Beijing Tropical Medicine Research Institute,Beijing Friendship Hospital Affiliated Capital Medical University, Beijing 100050, China
, E-mail: zouyang1027@163.com
Objective To discuss the positive rate of Pneumocystis pneumonia (PCP) patients specimens detected by gomori’s methenamine silver (GMS) staining and polymerase chain reaction (PCR) used so as to provide more supportable laboratory basis for clinical practice. Methods A total of 1314 cases of suspected PCP patients with deep induced sputum or broncho-alveolar lavage fluid (BALF) specimens were collected. GMS staining microscopy and PCR method were combined to detect pneumocystis, it could be identified as PCP in the event of any method showing positive. Results A total of 285 patients were diagnosed as PCP, 114 of whom were GMS staining microscopic staining positive, 282 cases were PCR positive, 111 cases were double positive detected by 2 methods, 3 cases were GMS positive staining microscopic alone (all BALF after renal transplantation), and 171 cases of samples were PCR positive alone. In deep induced sputum specimens, GMS staining microscopy and PCR positive rates were 5.1% and 16.2% respectively (P<0.05 and BALF); And in BALF specimens, the positive rates were 23.3% and 42.2% respectively (P<0.05). Patients with unknown cause fever complicated with pneumonia and organ transplant patients receiving immunosuppressive therapy had higher positive detection rate. Conclusions The positive rate of PCP detected by PCR method is higher than that by GMS staining microscopy, and the detection of PCP by the combination of PCR method and GMS staining microscopy has higher diagnostic value for clinical guidance.
pneumocystis pneumonia; etiology; GMS staining; PCR
R519.8
A
1007-8134(2016)05-0272-04
10.3969/j.issn.1007-8134.2016.05.004
北京市医院管理局临床技术创新项目(XMLX201502)
100050,首都医科大学附属北京友谊医院 北京热带医学研究所寄生虫病研究室(李晶晶、邹洋、安亦君、齐志群、李小丽、王磊、黄敏君);热带病防治研究北京市重点实验室(李晶晶、邹洋、安亦君、齐志群、李小丽、王磊、黄敏君)(李晶晶和邹洋同为第一作者)
邹洋,E-mail: zouyang1027@163.com
