干露对日本海神蛤稚贝生长和存活的影响
2016-11-10肖友翔霍忠明张学开范超李壮杨凤闫喜武
肖友翔,霍忠明,张学开,范超,李壮,杨凤,闫喜武
(大连海洋大学水产与生命学院,辽宁省贝类良种繁育工程技术研究中心,辽宁大连116023)
干露对日本海神蛤稚贝生长和存活的影响
肖友翔,霍忠明,张学开,范超,李壮,杨凤,闫喜武
(大连海洋大学水产与生命学院,辽宁省贝类良种繁育工程技术研究中心,辽宁大连116023)
为研究不同时间和温度下干露对日本海神蛤Panopea japonica稚贝生长和存活的影响,以两种规格(S组壳长为1.70 mm±0.31 mm,L组壳长为5.04 mm±0.63 mm)的日本海神蛤稚贝为材料,在0、10、20℃条件下,分别干露4、8、12 h,测量并统计干露后恢复3、6、9 d时稚贝的存活率和生长情况。结果表明:在相同干露条件下,L组稚贝的抗干露能力显著高于S组(P<0.05);在相同干露时间内,稚贝在不同温度下干露的存活率依次为10℃>20℃>0℃;0℃下S组稚贝干露后恢复6、9 d时的存活率急剧下降,分别为30.22%±6.48%、19.78%±7.70%,与其他各组有显著性差异(P<0.05)。研究表明,经干露处理后,S组日本海神蛤稚贝瞬时生长率显著高于其对照组(P<0.05),存在补偿生长现象。
日本海神蛤;干露;生长;存活率;补偿生长
日本海神蛤Panopea japonica俗称小象拔蚌或象牙蚌,隶属于软体动物门Mollusca、双壳纲Bivalvia、海螂目Myoidae、缝栖蛤科Hiatellidae、海神蛤属Panopea(Adams,1949),是埋栖型贝类,栖息底质以泥砂为主,生活水深为15~50 m,主要分布于中国黄渤海北部及日本北海道、韩国、朝鲜海域[1]。日本海神蛤水管肥大粗壮,成体壳长一般为8~15 cm,湿质量为200~600 g,两壳白色或略带青黑色,如图1、图2所示。目前,国内外日本海神蛤均以自然捕捞为主,难以满足市场需求,价格逐年上涨,市场潜力巨大。
近年来,有关干露对贝类生长和存活影响的研究报道较多,主要集中在长牡蛎Crassostrea gigas[2]、海湾扇贝Argopecten irradians irradians[3]、大沽全海笋Barnca davidi[4]、美洲帘蛤Mercenaria mercenaria[5]、波纹巴菲蛤Paphia undulata[6]、西施舌Coelomactra antiquata[7]、菲律宾蛤仔Ruditapes philippinarum[8-9]、墨西哥湾扇贝Argopecten irradians concentricus[10]、橄榄蚶Estellarca olivacea[11]等。研究表明,贝类离水后能在一定时间内维持生命力,此段时间的长短会对其生长和存活产生不同影响[12]。干露时间越长,贝类存活率越低;干露温度越是偏离贝类的适宜温度,贝类存活率越低[2-12]。一般来说,贝类不同时期对干露的耐受性依次为成贝>眼点幼虫>壳顶中期幼虫>幼贝>稚贝>D形幼虫[2]。目前,关于干露对日本海神蛤稚贝生长及存活的影响研究尚无报道。本试验中进行了不同时间和温度下干露对日本海神蛤稚贝存活和生长的影响研究,旨在为日本海神蛤苗种运输及滩涂养殖提供理论依据。
1 材料与方法
1.1 材料
以2015年獐子岛原良种场培育的日本海神蛤两种规格苗种为试验材料,即S组壳长为(1.70± 0.31)mm,L组壳长为(5.04±0.63)mm,每组试验稚贝数量为3000粒。
1.2 方法
1.2.1 干露温度、时间和恢复时间的设置 干露试验温度控制采用恒温培养箱,温度分别设定为0、10、20℃,每个温度设定3个干露时间,分别为4、8、12 h,干露后恢复时间分别为3、6、9 d,共9个试验组,每组100枚稚贝。经干露处理后的稚贝,分别置于100 L聚乙烯桶中继续培育。培育水温为23℃,海水盐度为32,每日全量换水2次,连续充气,每次换水后按1∶1比例投喂球等边金藻Isochrysisgalbana和小球藻Chlorella sp.,投饵量为40 000 cells/(mL·d)。每日检查1次稚贝存活情况,并挑出死亡个体。每3日统计1次稚贝个数。试验设置未经干露处理的对照组,各试验组设3个重复组。
1.2.2 壳长的测定及稚贝死亡鉴定 干露恢复后每3天统计1次稚贝存活及壳长生长情况。将稚贝放于培养皿中,置于低倍显微镜下观察,如果稚贝鳃丝不摆动,双壳张开不能闭合,则鉴定稚贝已死亡。使用游标卡尺测量稚贝的壳长,精确至0.02 mm。
1.2.3 瞬时增长率及存活率的计算 干露恢复后稚贝壳长的瞬时生长率(IGR)和存活率(SR)分别按以下公式计算[13-16]:

其中:TN和T0分别为终末和初始试验时间(d);LN和L0分别为终末和初始试验稚贝的平均壳长(mm);SN和S0分别为终末和初始试验稚贝数量。
瞬时生长率的测定分为4个时间段:初始~3 d、3~6 d、6~9 d和初始~9 d。
1.3 数据处理
使用SPSS 19.0软件对数据进行单因素方差分析,用Duncan法进行组间多重比较,显著性水平设为0.05。
2 结果与分析
2.1 干露对稚贝存活率的影响
从图3可见,干露后恢复3 d时,L组各试验组稚贝的存活率显著高于S组(P<0.05),L组各试验组的存活率与L对照组(98.00%±2.00%)相近。S组各试验组的存活率均显著低于S对照组(99.33%±1.15%),在不同干露时间下,S组存活率差异较大,存活率从高到低依次为4 h>8 h>12 h;干露4 h和8 h时,S组在0℃下存活率最高,分别为94.67%±2.31%和93.33%±2.31%,在20℃下的存活率最低,分别为89.33%±2.31%和64.00%±2.00%;干露12 h时,S组稚贝在10℃下的存活率最高(72.00%±4.00%),在20℃下的存活率依然最低(51.33%±5.03%)。
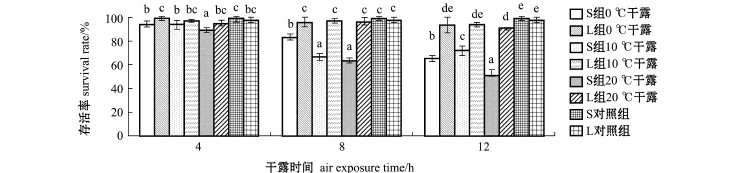
图3 恢复3 d时日本海神蛤稚贝在不同干露条件下的存活率Fig.3 Survival rates of spat geoduck Panopea japonica 3 days after recovered from air exposure under various conditions
从图4可见,干露后恢复6 d时,L组各试验组稚贝的存活率均显著高于S组(P<0.05),L组在0℃和20℃下干露12 h的存活率与L对照组有显著差异性(P<0.05),分别为88.00%±3.46%和86.00%±0.00%,其他各试验组与L对照组(96.67%±1.15%)无显著性差异(P>0.05)。S组各试验组的存活率显著低于S对照组(92.67%±4.16%)(P<0.05),S组在0、10、20℃下干露后的平均存活率分别为30.22%±6.48%、 67.78%±3.01%、56.00%±10.97%;不同干露时间下,S组在0℃下干露后的存活率显著低于其他两个温度组(P<0.05),在10℃下干露后的存活率最高,干露4 h时与20℃试验组无显著性差异(P>0.05),干露8 h和12 h时与其他两组有显著性差异(P<0.05);S组干露4、8、12 h的平均存活率依次为58.89%±18.69%、47.56%±18.07%、47.56%±21.77%,干露4 h存活率高于其他两试验组,干露8 h与12 h的平均存活率接近。
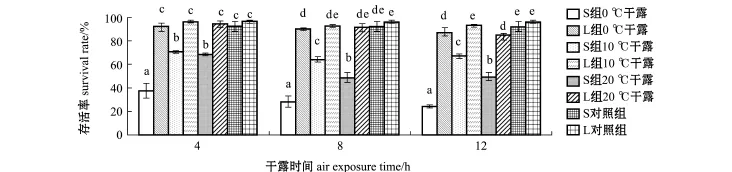
图4 恢复6 d时日本海神蛤稚贝在不同干露条件下的存活率Fig.4 Survival rates of spat geoduck Panopea japonica 6 days after recovered from air exposure under various conditions
从图5可见,干露后恢复9 d时,L组各试验组稚贝在0℃下干露8、12 h和在20℃下干露12 h的存活率分别为82.67%±3.06%、85.33%± 1.55%和78.00%±2.00%,显著低于L对照组(94.00%±2.00%)(P<0.05)。S组各试验组的存活率均显著低于S对照组90.67%±3.06%(P< 0.05),S组在0、10、20℃下的平均存活率分别为19.78%±7.70%、64.44%±1.02%和46.22%± 14.15%;不同干露时间下,S组在0℃下干露后的存活率显著低于其他两个干露温度组(P<0.05),在10℃下干露的存活率均高于其他两个干露温度组。2.2 干露对稚贝生长的影响

图5 恢复9 d时日本海神蛤稚贝在不同干露条件下的存活率Fig.5 Survival rates of spat geoduck Panopea japonica 9 days after recovered from air exposure under various conditions
S组各试验组稚贝在初始~3 d内,0℃下干露4 h和10℃下干露8 h的瞬时生长率均高于S对照组(5.55%±1.05%),分别为6.50%±2.70%和5.80%±1.71%,20℃下干露4 h和10℃下干露12 h的瞬时生长率与S对照组无显著性差异(P>0.05),其余5个试验组的瞬时生长率均显著低于对照组(P<0.05)(图6)。
S组各试验组稚贝在3~6 d内,0℃下干露8 h,10℃下干露4 h、12 h和20℃下干露12 h的瞬时生长率均高于S对照组(3.84%±1.40%),分别为8.84%±4.25%、6.91%±2.44%、4.58%± 3.09%和6.30%±1.85%,0℃下干露12 h、10℃下干露8 h和20℃下干露4 h与S对照组无显著性差异(P>0.05),其余2个试验组的瞬时生长率显著低于S对照组(P<0.05)(图7)。
S组各试验组稚贝在6~9 d内,0℃下干露4、12 h和20℃下干露8 h的瞬时生长率高于S对照组(4.91%±1.13%),分别为5.99%±1.33%、9.58%±1.44%和7.56%±1.94%,0℃下干露8 h和20℃下干露4 h的瞬时生长率与S对照组无显著性差异(P>0.05),其余4个试验组的瞬时生长率均显著低于S对照组(P<0.05)(图8)。
S组各试验组稚贝在初始~9 d内,0℃下干露8、12 h的瞬时生长率均显著高于S对照组(4.77%±0.22%)(P<0.05),分别为5.19%± 0.69%和5.35%±0.99%,0℃下干露4 h的瞬时生长率为4.76%±0.79%,与S对照组无显著性差异(P>0.05),其余6个试验组的瞬时生长率均显著低于S对照组(P<0.05)(图9)。
L组各试验组稚贝的瞬时生长率与S组的瞬时生长率呈不相同的变化趋势,数值不大且常出现负值,总体增长不明显(图6~图9)。
3 讨论

图6 初始~3 d内日本海神蛤稚贝在不同干露条件下的瞬时生长率Fig.6 First 3 day instantaneous grow th rates of spat geoduck Panopea japonica under different air exposing conditions
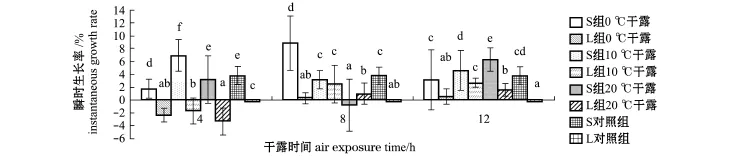
图7 3~6 d内日本海神蛤稚贝在不同干露条件下的瞬时生长率Fig.7 3-6 day instantaneous grow th rates of spat geoduck Panopea japonica under different air exposing conditions

图8 6~9 d内日本海神蛤稚贝在不同干露条件下的瞬时生长率Fig.8 6-9 day instantaneous grow th rates of spat geoduck Panopea japonica under different air exposing conditions
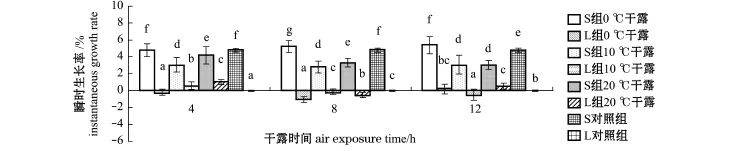
图9 初始~9 d内日本海神蛤稚贝在不同干露条件下的瞬时生长率Fig.9 First 9 day instantaneous grow th rates of spat geoduck Panopea japonica under different air exposing conditions
3.1 干露对日本海神蛤存活的影响
日本海神蛤与菲律宾蛤仔、牡蛎等双壳贝类不同,其双壳不能完全闭合,干露时间长时,体内水分蒸发比其他双壳贝类多,干露会明显影响日本海神蛤的成活率,其原因可能是由于在干露状态下贝类呼吸循环系统受到影响,不能从周围环境中获得足够的氧气,并排出二氧化碳,从而造成血液的pH值失衡,最终引起窒息死亡[12]。
贝类耐干露时间的长短与种类、个体大小、温度有关[12]。本研究中发现,大规格日本海神蛤的稚贝比小规格稚贝更耐干露。这可能是由于日本海神蛤各发育期耐干露的生理及生态幅度不同,因而成活率表现出一定的差异[17]。L组的软体部较大,其中的含水量也较多,抗干露能力强[3],在相同的干露条件下,其存活率显著高于S组。由于L组抗干露能力强于S组,不同干露条件下存活率的变化幅度也明显小于S组。
温度对日本海神蛤存活率有显著的影响。本试验结果表明,日本海神蛤稚贝的存活率随干露时间的延长而降低。此结果与梁玉波[18]对海湾扇贝的试验结果一致。在相同干露时间下,稚贝存活率随干露温度改变而变化,不同温度下的存活率依次为10℃>20℃>0℃。这个结果与杨凤等[9]、于瑞海等[2-3]的试验结果基本一致。杨凤等[9]对菲律宾蛤仔的试验结果表明,干露温度为8~10℃时的存活率高于20~22℃;于瑞海等[2-3]对太平洋牡蛎和海湾扇贝的试验研究结果表明,干露温度为8~10℃时的存活率高于20~22℃。本试验中设置3个温度条件,比较了0、10、20℃下日本海神蛤稚贝在干露情况下的存活率。10℃时日本海神蛤稚贝干露后存活率高于20℃,这可能是由于10℃下稚贝的呼吸代谢慢,能量消耗低所致;而把稚贝放入0℃的恒温箱中,低温降低了稚贝生理活性及机体内抗氧化酶的活性,加之干露导致的缺氧使得抗逆反应能维持的时间相对较短,无法修复或减轻氧化应激伤害,使稚贝出现大量死亡[19]。此结果与An等[20]对魁蚶及刘超等[19]对施氏獭蛤的试验结果一致。
稚贝干露后恢复3、6、9 d的存活率大多呈稳定下降趋势,只有S组稚贝在0℃下干露4、8、12 h这3个试验组,在恢复3 d后存活率较高,到恢复6 d时存活率骤降,到恢复9 d时,存活率只有在10℃下干露的3个试验组的50%,甚至更低。S组稚贝在干露处理后,有部分活力不好,放入水中恢复,无法恢复的S组稚贝并非完全在短时间内死亡,有的则在其后陆续死亡。Blaxter等[21]在1963年首次提出了“不可逆点”,饥饿鱼在抵达不可逆点时尽管还可以存活较长的一段时间,但已经虚弱得不能再恢复摄食和生长的能力。由此推测,0℃下干露对日本海神蛤1~2 mm稚贝的损伤要大于在10℃和20℃下干露对其的损伤,低温导致部分稚贝受到的伤害到达不可逆点,无法恢复,从而大量死亡。L组则因抗性强,未发生大量死亡,但0℃下干露的L组稚贝存活率仍低于10℃下干露的组。因此,日本海神蛤苗种的运输过程中,温度并非越低越好,10℃为适宜运输温度。
3.2 干露对日本海神蛤生长的影响
由于自然界中季节交替、环境剧变或食物分布不均匀等原因,水产动物普遍存在周期性缺食或营养匮乏的现象,作为生理生态学上的一种适应,水产动物能够通过降低基本代谢水平及消耗自身组织储存的营养物质,从生理、生化和行为等方面提高对食物不足甚至饥饿胁迫的忍受能力,此后若充分摄食,则正常生理机能可能恢复,生长也可能出现补偿性现象[22]。这种因缺食或营养匮乏的水产动物在食物恢复正常后表现出来的一定的快速生长,被称为补偿生长(compensatory growth)或获得性生长(catch-up growth)[23]。干露对于贝类本来就是一种环境胁迫,贝类无法摄食,而温度直接影响水产动物机体代谢与同化速率,尤其是蛋白质合成过程具有“温度补偿作用”[21]。本试验表明,S组9个试验组中的8个组,均在0~3 d、3~6 d、6~9 d这3个阶段中的至少一个阶段,瞬时生长率超过S对照组,而20℃下干露4 h组,在每个阶段瞬时生长率均与S对照组无显著性差异(P>0.05)。本试验结果符合补偿生长的定义[23]。
水产动物对食物的限制及非生物环境胁迫有一定的承受范围,超出这一范围存活率迅速下降,不但不能恢复体质量,甚至会导致持续性生长阻滞[24]。本试验结果中,在0℃下干露处理的3个试验组存活率均显著低于其他试验组,而瞬时生长率却高于其他试验组,这并非是补偿生长明显,而是较小的稚贝到达不可逆点,大多死亡,只有较大的稚贝因抗性较强而存活,造成瞬时生长率高的表象。因此,日本海神蛤稚贝在一定的干露程度后恢复到正常饲养环境,存在补偿生长现象。
[1] 齐钟彦,马绣同,王祯瑞,等.黄渤海的软体动物[M].北京:农业出版社,1989:228-229.
[2] 于瑞海,王昭萍,孔令锋,等.不同发育期的太平洋牡蛎在不同干露状态下的成活率研究[J].中国海洋大学学报,2006,36(4):617-620.
[3] 于瑞海,辛荣,赵强,等.海湾扇贝不同发育阶段耐干露的研究[J].海洋科学,2007,31(6):6-9.
[4] 魏利平,马明正,唐芳,等.大沽全海笋生物学习性及人工育苗技术[J].水产学报,1997,21(3):296-302.
[5] 李忠泓,王国栋.硬壳蛤稚贝对淡水浸泡、干露和低温的耐受能力[J].水产科学,2004,23(6):14-16.
[6] 陈坚,柯爱英,范景水,等.波纹巴非蛤生物学性状及生态习性的初步观察[J].浙江海洋学院学报:自然科学版,2007,26(3):343-346.
[7] 刘德经.西施舌养殖生物学及人工养殖发展前景[J].齐鲁渔业,2004,21(2):15-18.
[8] Numaguchi K.Preliminary experiments on the influence of water temperature,salinity and air exposure on the mortality of Manila clam larvae[J].Aquaculture International,1998,6(1):77-81.
[9] 杨凤,谭文明,闫喜武,等.干露及淡水浸泡对菲律宾蛤仔稚贝生长和存活的影响[J].水产科学,2012,31(3):143-146.
[10] 陆彤霞,龙仲杰,陈清建.酸碱度和干露对墨西哥湾扇贝幼虫和稚贝的影响[J].水产科学,2003,22(2):6-8.
[11] 周化斌,张永普,肖国强,等.几种环境因子对橄榄蚶成贝存活的影响[J].温州大学学报:自然科学版,2010,31(2):30-35.
[12] 蔡英亚.贝类学概论[M].2版.上海:上海科学技术出版社,1995.
[13] 宋超,庄平,章龙珍,等.不同温度对西伯利亚鲟幼鱼生长的影响[J].海洋渔业,2014,36(3):239-246.
[14] 张沛东,张倩,张秀梅,等.底质类型对中国明对虾存活、生长及行为特征的影响[J].中国水产科学,2014,21(5):1079-1086.
[15] 杨明,臧维玲,戴习林,等.不同底质对罗氏沼虾幼虾生长的影响[J].水产科技情报,2008,35(3):105-108.
[16] Caill-Milly N,Bru N,MahéK,et al.Shell shape analysis and spatial allometry patterns of Manila clam(Ruditapes philippinarum)in a Mesotidal Coastal Lagoon[J].Journal of Marine Biology,2012,28(6):1-11
[17] 王如才,王昭萍,张建中.海水贝类养殖学[M].青岛:青岛海洋大学出版社,1993:156-166.
[18] 梁玉波.海湾扇贝苗运输环境条件的研究[J].海洋环境科学,1996,15(2):44-50.
[19] 刘超,郭景兰,彭张明,等.施氏獭蛤稚贝对高温和干露的耐受性研究[J].水产科学,2015,34(3):169-173.
[20] An M I,ChoiC Y.Activity of antioxidantenzymes and physiological responses in ark shell,Scapharca broughtonii,exposed to thermal and osmotic stress:effects on hemolymph and biochemical parameters[J].Comparative Biochemistry and Physiology.Part B:Biochemistry and Molecular Biology,2010,155(1):34-42.
[21] Blaxter JH S,Hempel G.The influence of egg size on herring larvae(Clupea harengus L.)[J].ICES Journal of Marine Science,1963,28(2):211-240.
[22] 殷帅文,林学群,陈洁辉.谈谈鱼类的补偿生长[J].生物学通报,2003,38(3):10-11.
[23] Miglavs I,Jobling M.Effects of feeding regime on food consumption,growth rates and tissue nucleic acids in juvenile Arctic charr,Salvelinm alpinus,with particular respect to compensatory growth[J].Journal of Fish Biology,1989,34(6):947-957.
[24] 胡云飞.水产动物补偿生长的研究概述[J].水产养殖,2012,33(10):29-34.
Effects of exposure to air on grow th and survival of spat geoduck clam Panopea japonica
XIAO You-xiang,HUO Zhong-ming,ZHANG Xue-kai,FAN Chao,LIZhuang,YANG Feng,YAN Xi-wu
(College of Fisheries and Life Science,Engineering Research Centre of Shellfish Culture and Breeding in Liaoning Province,Dalian Ocean University,Dalian 116023,China)
In this study,the growth and survival rates were studied in spat geoduck clam Panopea japonica with shell length of 1.70 mm±0.31 mm(group S)and 5.04mm±0.63mm(group L)exposed to air for 4,8,and 12 h,and recovered in 3,6 and 9 days at temperatures of0,10 and 20℃to evaluate the effects of exposure and desiccation on growth and survival of spat geoduck clam.The results showed that there was significantly stronger tolerance to exposure to air in spats in group S than in group L in same condition(P<0.05).In the same duration of desiccation,however,the order of survival rate at different temperatureswas expressed as10℃>20℃>0℃.The spats exposed to air at 0℃in group S had lower survival rate when they were revered for 6 days(30.22%± 6.48%)and 9 days(19.78%±7.70%),with significantly different from the other groups(P<0.05).There was higher specific growth rate in spats exposed to air in group L than that in the control group in a certain period in suitable condition,which may be involved in compensatory growth.
Panopea japonica;air exposure;growth;survival rate;compensatory growth
S968.31
A
10.16535/j.cnki.dlhyxb.2016.05.003
2095-1388(2016)05-0482-06
2016-01-14
国家现代农业产业技术体系建设专项(CARS-48);大连市科技计划项目(2015B11NC073)
肖友翔(1990—),男,硕士研究生。E-mail:138199056@qq.com
霍忠明(1983—),男,博士,讲师。E-mail:houzm@dlou.edu.cn
