Paraconiothyrium variabile GHJ-4产漆酶发酵培养基优化及酶学性质研究
2016-11-09高绘菊王凤娟王维乐李伟庆黄露牟志美
高绘菊,王凤娟,王维乐,李伟庆,黄露,牟志美
山东农业大学林学院,山东泰安271018
Paraconiothyrium variabile GHJ-4产漆酶发酵培养基优化及酶学性质研究
高绘菊,王凤娟,王维乐,李伟庆,黄露,牟志美*
山东农业大学林学院,山东泰安271018
为了提高木质素降解子囊菌Paraconiothyrium variabile GHJ-4产漆酶的能力,采用响应面分析法优化其产酶培养基。最优的发酵培养基组成为:麸皮30 g·L-1,可溶性淀粉58.08 g·L-1,牛肉浸膏3.39 g·L-1,NaNO31 g·L-1,KH2PO43 g·L-1,CuSO40.554 g·L-1。采用该优化培养基,GHJ-4菌株的漆酶酶活达到410.04 U·mL-1,比优化前提高9.5倍。以愈创木酚为底物,该菌株纯化漆酶的最适反应温度为50°C,最适反应pH为5.0,米氏常数Km为62.07µmol·L-1,最大反应速度Vmax为68.97 mmol·(L·min)-1;该漆酶在55°C以下、pH3.5~6.5的范围内较为稳定,Cu2+、Mg2+、Zn2+对漆酶酶活有明显促进作用,而Hg2+、Fe3+、Ag+对漆酶酶活有显著抑制作用。结果表明,Paraconiothyrium variabile GHJ-4是一株高效的漆酶产生菌株,具有潜在的工业化应用前景。
Paraconiothyrium variabile GHJ-4;漆酶;培养基优化;酶学性质
漆酶(Laccases,EC1.10.3.2)是一类可降解木质素的含铜多酚氧化酶,属于蓝色多铜氧化酶家族。自1883年日本学者吉田(Yoshida)首次发现漆酶以来,由于其对木质素或与木质素前体物质分子结构相似的许多环境污染物具有优良的降解性能,在林产品加工、生物制浆、纸浆漂白、污水处理、纤维改性、生物修复和生物燃料电池的阴极反应等方面显示出良好的应用潜力[1-8],一直是生物学、医学、化学、环境污染治理等领域十分活跃的研究热点,受到广泛关注和高度重视。
目前,国内外报道的产漆酶菌株基本上都是担子菌中的白腐菌[9],对在自然界木质素降解过程中发挥不可忽视作用的子囊菌产漆酶的研究报道相对较少,且主要集中在青霉属、镰刀霉属和曲霉属的菌种。Paraconiothyrium sp.是Verkley等于2004年建立的一个新的木腐降解菌属[10],Damn等[11]依据所分离菌种的形态学特征、培养性状和5.8 SrDNA序列等确立了该属的新种—Paraconiothyrium variabile。Faramarzi等[12]利用该菌纯化漆酶合成了Au纳米粒子(AuNPs),Forootanfar等[13]发现该菌纯化漆酶对孔雀绿、氨基黑、RB亮蓝等合成染料具有较好的脱色效果,显示了该子囊菌漆酶良好的应用前景,是一种极具研究价值和开发潜力的真菌漆酶。除此之外,国内外尚未见其它关于该菌株漆酶的研究报道。
Paraconiothyrium variabile GHJ-4是本实验室从泰山脚下一腐朽柳木中分离到的一株子囊菌(GenBank注册号为GQ331986)[14]。本研究以Paraconiothyrium variabile GHJ-4为发酵菌株,选择培养基成分为自变量,以漆酶酶活为响应值,采用响应面法优化GHJ-4产漆酶的发酵培养基,同时研究其纯化漆酶的酶学特性,以期为今后该菌株漆酶的工业化生产和应用提供理论依据。
1 材料与方法
1.1试验材料
1.1.1菌种Paraconiothyrium variabile GHJ-4,由本实验室从一腐朽柳木中分离获得。
1.1.2培养基初始发酵培养基:麸皮30 g·L-1,蛋白胨2 g·L-1,KH2PO43 g·L-1,MgSO40.5 g·L-1,VB10.02 g·L-1,CaCl20.01 g·L-1,1×105Pa灭菌30 min。
1.2试验方法
1.2.1GHJ-4菌株的液体发酵将预培养4 d的GHJ-4菌株种子液按5%(V/V)接种量接种于50 mL初始发酵培养基中,28°C、150 r·min-1振荡培养6 d,发酵液4°C、9500 r·min-1离心5 min,取上清用于酶活测定。
1.2.2漆酶酶活测定参照Gao等人[14]的方法,将每µmol/min愈创木酚被氧化所需酶量为l U。
1.2.3发酵培养基优化试验设计在单因素分析的基础上,选取可溶性淀粉(X1)、牛肉浸膏(X2)和CuSO4(X3)为响应面的自变量,建立以漆酶酶活(Y)为响应值的多元性回归模型方程。利用Design-Expert 7.0和SAS 9.1.3统计分析软件进行试验设计与数据分析。
1.2.4漆酶的分离纯化取发酵上清液加入80%饱和度的硫酸铵,4°C静置过夜,离心弃上清,沉淀用少量缓冲液溶解,透析除盐,然后进行DEAE-sepherose Fast Flow阴离子交换柱层析和Sephadex G-75凝胶过滤层析,收集漆酶活性组分经SDS-PAGE检测为单一条带后,用于酶学性质的测定。
1.2.5漆酶的酶学性质测定
1.2.5.1最适反应温度和热稳定性的测定将酶液分别在25~90°C下测定酶活力,确定最适反应温度。将酶液在25~90°C下保温1 h,测定剩余酶活,以酶活最高者为100%计算相对酶活力。
1.2.5.2最适反应pH和pH稳定性的测定选用不同pH值的醋酸缓冲液作为缓冲体系,在50°C下测定酶活力,确定最适反应pH。将酶液加入不同pH值的醋酸缓冲液,常温下维持1 h,测定剩余酶活,以酶活力最高者为100%计算相对酶活力。
1.2.5.3金属离子对酶活力的影响在反应体系中分别加入不同的金属离子,使其终浓度为5 mmol·L-1,测定酶活,以不加入金属离子前的酶活作为100%计算相对酶活力。
1.2.5.4反应动力学参数的测定调节反应底物愈创木酚浓度范围为0.05~2 mmol·L-1,在50°C、0.02 mol·L-1pH5.0的醋酸缓冲液中测定酶活力,根据Lineweaver-Burk作图法,求取米氏常数Km和最大反应速度Vmax。
2 结果与分析
2.1中心组合试验结果及响应面分析
采用3因素5水平的中心组合实验设计(CCD)对影响GHJ-4产漆酶各因子进行了优化,试验设计及结果见表1。利用Design Expert 7.0软件对试验数据进行响应面回归分析,得到以漆酶酶活为响应值的多元回归二次拟合模型:Y=405.44822+5.31052X1+6.5444X2+1.67431X3+7.50625X1X2-10. 57875X1X3-7.34875X2X3-16.65787X12-17.44269 X22-12.32854X32。

表1 中心组合试验设计及其结果Table 1 Experimental design and results of central composite design

表2 回归模型系数的显著性检验Table 2 Significance test for regression coefficients

表3 回归模型方差分析Table 3 ANOVA of quadratic polynomial model
回归模型方差分析结果见表2、表3。模型Pr<0.0001,说明在α=0.01水平上回归极显著;Pr失拟=0.9836,说明在α=0.1水平上失拟不显著;复相关系数R2=0.9516,表明相关性很好,校正相关系数Adj R2=0.9081,说明模型可以解释90.81%试验所得漆酶酶活的变化,表明方程拟合较好。
由回归方程所作出的响应面立体分析图1显示,X1、X2、X3存在极值点,利用SAS 9.1.3对Y进行分析,可以得到曲面的极大值,所对应的3个因子最优试验点(X1、X2、X3)的代码值(0.260、0.269、-0.127)。即培养基中可溶性淀粉为5.808%、牛肉浸膏为0.339%、CuSO4为0.0554%时,漆酶活力达到最高,预测值达407.57 U·mL-1。
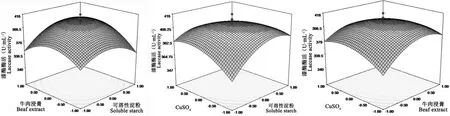
图1 可溶性淀粉、牛肉浸膏和CuSO4对漆酶产量交互影响的响应面图Fig.1 Response surface plot of the mutual effect on laccase production versus soluble starch,beef extract and CuSO4
2.2验证试验
以2.1确定的主要因素浓度配制发酵培养基,分6次发酵,漆酶酶活分别为403.43、408.48、424.64、406.22、410.39、407.14 U·mL-1,平均酶活力为410.04 U·mL-1,约为发酵培养基优化前酶活(43.16 U·mL-1)的9.5倍。与模型预测值误差<1%,表明该模型能很好地预测实际发酵情况。
2.3GHJ-4漆酶的酶学性质
2.3.1最适反应温度与热稳定性分别在不同温度下测定漆酶的酶活力,结果如图2。漆酶作用的最适温度为50°C,在45~60°C之间均有较高酶活力。将漆酶分别放在不同温度下保温1 h后测定酶活力,结果表明50°C以下漆酶相对稳定,酶活均在95%以上;50~65°C酶活性快速的下降;高于70°C保温1 h后,酶活性基本上全部丧失。

图2 GHJ-4漆酶的最适反应温度和温度稳定性Fig.2 The optimum temperature and the temperature stability of GHJ-4 laccase
2.3.2最适反应pH与pH稳定性分别在50°C、不同pH反应体系条件下测定GHJ-4漆酶的酶活力,结果如图3所示。该漆酶最适反应pH为5.0,且在pH为3.5~7.0范围内均有较高酶活力。pH4.5~5.5之间酶稳定性较好,酶活性可保持在80%以上,而当pH大于7.0时,漆酶活性迅速降低(图3)。

图3 GHJ-4漆酶的最适反应pH和pH稳定性Fig.3 The optimum pH and the pH stability of GHJ-4 laccase
2.3.3金属离子对酶活的影响分别在pH 5.0、终浓度为5 mmol·L-1的各种金属离子缓冲液中加入漆酶,反应30 min,测定酶活,结果如表4。Mg2+、Zn2+、Cu2+对该漆酶有激活作用;Li+、Ca2+、Ba2+、Hg2+、Fe3+、Ag+对酶活均有不同程度的抑制作用,其中Hg2+、Fe3+、Ag+对酶活影响最大,试验中未检测到酶活,K+、Na+对酶活影响最小。

表4 不同金属离子对酶活的影响Table 4 Effect of metal ions on the activity of laccase
2.3.4漆酶的反应动力学参数在不同浓度0.1、0.2、0.4、0.6、0.8、1.0、1.2、1.4、1.6 mmol·L-1的反应底物条件下,测定漆酶酶活力,分别以1/[S]和1/V为横、纵坐标作Lineweaver-Burk图,求得该漆酶催化愈创木酚的Km为62.07µmol·L-1,Vmax为68.97 mmol·(L·min)-1(图4)。

图4 以愈创木酚为底物的Lineweaver-Burk双倒数作图Fig.4 Lineweaver-Burk map-making using guaiacol as substrate
3 结论与讨论
发酵培养基的优化是一种多因素多水平试验,若采用单因素试验和正交试验工作量大且难以得到理想的结果。响应面分析法可以快速、有效地从影响产酶的因子中筛选出主要影响因素,避免非主要因素可能造成的时间和资源的浪费,并且可实现条件优化,该统计学方法已被成功的应用于白腐菌漆酶发酵培养基的优化[15-19]。本文将Plackett-Burman设计与响应面分析法相结合,优化得出木质素降解子囊菌Paraconiothyrium variabile GHJ-4产漆酶的最佳发酵培养基配方为:麸皮30 g·L-1,可溶性淀粉58.08 g·L-1,牛肉浸膏3.39 g·L-1,NaNO31 g·L-1,KH2PO43 g·L-1,CuSO40.554 g·L-1。在此优化培养基下经摇瓶培养试验验证,酶活力的平均值为410.04 U·mL-1,与预测值407.57 U·mL-1之间误差小于1%,说明预测模型可靠性高,表明响应面法优化发酵培养基也是提高子囊菌Paraconiothyrium variabile GHJ-4漆酶酶活力的有效途径之一,研究结果为该菌株漆酶的继续扩大培养和最佳生产发酵工艺的确定奠定了基础。
多数白腐菌漆酶的最适反应温度在30~60°C,最适反应pH在4~6之间。本文试验结果表明,GHJ-4纯化漆酶的最适反应温度和pH分别为50°C和5.0,该酶在55°C以下、pH4.5~5.5范围内较为稳定;Cu2+、Mg2+、Zn2+对酶活有激活作用,而Hg2+、Fe3+、Ag+对酶活有显著抑制作用。以愈创木酚为底物时,该酶的Km为62.07µmol·L-1,Vmax为68.97 mmol·(L·min)-1,与大多数白腐菌漆酶的酶学性质基本一致[20-22]。该研究结果不仅为今后Paraconiothyrium variabile GHJ-4漆酶的工业化应用提供了重要的理论依据,也为利用基因工程手段构建高效表达GHJ-4漆酶的基因工程菌提供了可能,同时还可以进行GHJ-4漆酶的蛋白质工程研究,使漆酶获得某些新的理化性质,以满足不同的工业化生产和应用需求,相关研究正在进行中。
[1]司静,闫志辉,崔宝凯,等.绒毛栓孔菌菌丝体在无营养条件下对偶氮染料刚果红的脱色作用[J].微生物学通报,2014,41(2):218-228
[2]靖德军,黄剑波,杨洲平,等.粗毛栓菌漆酶的诱导及其对中性染料和有机磷农药的降解[J].应用生态学报,2011,22(12):3300-3306
[3]司静,李伟,崔宝凯,等.真菌漆酶性质、分子生物学及其应用研究进展[J].生物技术通报,2011(2):48-55
[4]张爱萍,秦梦华,徐清华.漆酶在制浆造纸中的应用研究进展[J].中国造纸学报,2004,19(2):161-165
[5]Abadulla E,Tzanov T,Costa S,et al.Decolorization and detoxication of textile dyes with a laccase from Trametes hirsuta[J].Applied and Environmental Microbiology,2000,66(8):3357-3362
[6]Camarero S,Ibarra D,Martínez T,et al.Paper pulp delignification using laccase and natural mediators[J].Enzyme and Microbial Technology,2007,40(5):1264-1271
[7]Petit-Conil M,Semar S,Niku-Paavola ML,et al.Potential of laccases in softwood-hardwood high-yield pulping and bleaching[J].Progress in Biotechnology,2002,21:193-201
[8]Susana RC,José LTH.Industrial and biotechnological applications of laccase:a review[J].Biotechnology Advances,2006(24):500-513
[9]陈香碧,苏以荣,何寻阳,等.亚热带两种森林土壤担子菌漆酶基因多样性比较[J].应用生态学报,2011,22(10):2699-2704
[10]Verkley GJM,Silva M,Wicklow DT,et al.Paraconiothyrium,a new genus to accommodate the mycoparasite Coniothyriumminitans,anamorphsof Paraphaeosphaeria,and four new species[J].Studiesin Mycology,2004(50):323-335
[11]Damm U,Verkley GJM,Crous PW,et al.Novel Paraconiothyrium species on stone fruit trees and other woody hosts[J].Persoonia,2008,20:9-17
[12]Faramarzi MA,Forootanfar H.Biosynthesis and characterization of gold nanoparticles produced by laccase from Paraconiothyrium variabile[J].Colloids and Surfaces B:Biointerfaces,2011(87):23-27
[13]Forootanfar H,Faramarzi MA,Shahverdi AR,et al.Purification and biochemical characterization of extracellular laccase from the ascomycete Paraconiothyrium variabile[J].Bioresource Technology,2011,32(2):59-65
[14]Gao HJ,Wang YW,Mu ZM,et al.Isolation,identification and application in lignin degradation of an ascomycete GHJ-4[J].African Journal of Biotechnology,2011,10(20):4166-4174
[15]孙巍,许玫英,孙国萍.毛云芝菌利用糖蜜酒精废水产漆酶培养基优化[J].微生物学通报,2011,38(4):516-522
[16]Gao HJ,Chu X,Wang YW,et al.Media Optimization for Laccase Production by Trichoderma harzianum ZF-2 Using Response Surface Methodology[J].Journal of Microbiology and Biotechnology,2013,23(12):1757-1764
[17]刘文华,蔡宇杰,范晶晶,等.毛栓菌产漆酶条件优化及该酶对合成染料脱色的特性[J].微生物学通报,2013,40(5):727-738
[18]Hasan C,Senol K,Nahit A,et al.An approach for prediction of optimum reaction conditions for laccase-catalyzed biotransformation of 1-naphthol by response surface methodology[J].Bioresource Technology,2008,99(6):2025-2031
[19]Liu LH,Lin ZW,Zheng T,et al.Fermentation optimization and characterization of the laccase from Pleurotus ostreatus strain 10969[J].Enzyme and Microbial Technology,2009,44(7):426-433
[20]Shin KS,Lee YJ.Purification and characterization of a new member of the laccase family from the white rot basidiomycete Coriolus hirsutus[J].Archives of Biochemistry and Biophysics,2000,384(1):109-115
[21]Zhang BB,Zhao M,Lu L,et al.Characterization and decolorization ability of a laccase from white rot fungus Cerrena unicolor LS0547[J].Mycosystema,2009,28(5):737-743
[22]Wu YR,Luo ZH,Chow RKK,et al.Purification and characterization of an extracellular laccase from the anthracene degrading fungus Fusarium solani MAS2[J].Bioresource Technology,2010,101(24):9772-9777
Medium Optimization and Characterization of Laccase Production by Paraconiothyrium variabile GHJ-4
GAOHui-ju,WANGFeng-juan,WANGWei-le,LIWei-qing,HUANGLu,MUZhi-mei*
College of Forestry/Shandong Agricultural Univesity,Taian 271018,China
In order to enhance laccase production in Paraconiothyrium variabile GHJ-4,the fermentation medium for laccase production was optimized by response surface methodology.The optimal medium components were as follows(g·L-1):wheat bran 30,soluble starch 58.08,beef extract 3.39,NaNO31,KH2PO43,CuSO40.554.Using this optimized fermentation method,the activity of laccase increased 9.5 times at 410.04 U·mL-1compared with the laccase production with an unoptimized medium.The optimum temperature and pH of the purified Laccase were 60°C and 2.6,respectively in catalytic reaction of oxidizing guaiacol.Kmvalues and Vmaxvalues of the enzyme for guaiacol were 62.07µmol·L-1and 68.97 mmol·(L·min)-1.The enzyme activity was stable under 55°C and pH 3.5-6.5.The activity of enzyme was enhanced by the metal ions Cu2+,Mg2+and Zn2+;whereas it was inhibited by Hg2+,Fe3+and Ag+.The results showed that Paraconiothyrium variabile GHJ-4 was highly-efficient laccase-producing fungi and had good industrial application prospects.
Paraconiothyrium variabile GHJ-4;laccase;medium optimization;enzyme characterization
S718.81
A
1000-2324(2016)05-0641-06
2015-04-15
2015-04-20
国家自然科学基金项目(31200450);中国博士后科学基金项目(2013M541944);山东省现代农业产业技术体系蚕桑产业创新团队建设资助项目(SDAIT-18-05)
高绘菊(1975-),女,副教授,主要从事应用微生物研究.E-mail:ghj@sdau.edu.cn
Author for correspondence.E-mail:zmeimu@sdau.edu.cn
