白桦MYB家族基因序列及表达分析
2016-11-09刘慧子
刘慧子 孙 丹 于 颖 张 楠 王 超
(东北林业大学林木遗传育种国家重点实验室,哈尔滨 150040)
* 通信作者:E-mail:nefuwangchao@yahoo.com
白桦MYB家族基因序列及表达分析
刘慧子 孙 丹 于 颖 张 楠 王 超*
(东北林业大学林木遗传育种国家重点实验室,哈尔滨 150040)
MYB转录因子家族是植物重要的转录因子家族之一,其成员在植物的生长、发育、细胞壁形成及胁迫反应等多方面发挥重要作用。从白桦(BetulaplatyphyllaSuk.)中鉴定了17条MYB家族基因,与拟南芥家族基因进行系统进化分析结果表明,17个白桦MYB基因分属不同亚家族的不同亚类,其中10条属于1R/4R型亚家族,其余7条属于2R型亚家族。BplMYB13与已知的次生细胞壁合成相关基因AtMYB46聚为一组,BplMYB15和BplMYB26分别与胁迫响应和非生物胁迫应答相关MYB聚为一组,BplMYB23与硫代葡萄糖苷合成相关MYB聚为一组,BplMYB9、21和22与苯丙烷生物合成相关MYB聚为一组。利用Real time RT-PCR分析白桦MYB家族基因在白桦形成层和木质部组织一个生长季不同发育时期及人工弯曲处理6 h的表达模式。结果显示17个MYB基因在5月中旬至7月中旬白桦形成层活动旺盛,木质部迅速形成期表达量较高,其中BpMYB13在全生长季形成层和新生木质部中都有较高的表达水平,推测该基因与次生细胞壁的形成相关;在白桦茎干人工弯曲处理6 h时,与直立木和对应木相比,14条基因在应拉木中上调表达;与直立木相比,7条基因在对应木中上调表达。说明这些基因对人工弯曲处理和重力刺激具有应答反应,可能在白桦木质部发育和响应外力刺激等过程的生理变化中起重要作用。
白桦;MYB基因家族;序列分析;表达分析
最近的分子遗传学研究表明,转录调节在调控导管分子和纤维的次生细胞壁合成程序中起着重要做用[1]。无论是植物基因的诱导性表达还是组成型表达,均依赖于转录因子对其表达的激活。相对于结构基因而言,转录因子趋向于调控多步代谢反应或整条代谢通路,在利用基因工程改良植物复杂代谢途径中,转录因子是一个新型的,强有力的工具,改变转录因子的表达,往往可导致植物中该转录因子所控制性状的较大改变。研究转录因子基因在木质部形成过程中的表达模式,鉴定调控次生细胞壁合成途径的转录因子,不止能够帮助我们理解次生细胞壁形成的发育机制,也能为我们按照需要进行材性改良提供了有利的工具,对林木分子生物学具有潜在的重要价值[2]。
MYB(v-myb avian myeloblastosis viral oncogene homolog)类转录因子是最大的植物转录因子家族成员之一,以其结构上都有一段保守的DNA结合区-Myb结构域而得名。MYB类转录因子广泛存在于植物中,几乎参与了植物发育和代谢的各个方面,如细胞分化、细胞周期的调节、激素和环境因子应答,并对植物次生代谢以及叶片等器官形态建成具有重要的调节作用[3]。在植物中存在最多的是2个MYB区(R2和R3)的MYB蛋白,根据C端保守氨基酸序列的不同,R2R3-MYB可分为22个亚类,同一亚类的基因往往具有相对保守的功能[4~5]。迄今MYB转录因子对植物基因表达的调控机制还远未阐述清楚。不过有一点明确的是,相当数量的MYB转录因子均参与植物次生代谢(特别是苯丙酸代谢)的调控[6]。拟南芥MYB46和其同源基因AtMYB83是三种主要次生细胞壁组分(包括纤维素,木聚糖和木质素)合成的关键调节因子,受其上游的SND1及其同源基因的直接调控。过表达AtMYB46或者AtMYB83能够激活木质素,纤维素和木糖的合成,导致次生细胞壁的异常沉积[6]。
白桦(BetulaplatyphyllaSuk.)是东北地区主要的造林树种之一,培育优质、速生的纸浆材新品种是白桦育种的重要目标。目前,对于白桦木材形成过程的基因调节研究主要集中在纤维素和木质素生物合成关键调控基因上,而对上游的转录因子基因的研究尚未深入。因此,本文在鉴定白桦中MYB转录因子家族基因并研究它们表达模式的同时,寻找和次生生长相关的MYB基因,为研究其在木材形成过程中的作用机制奠定基础,以期利用该基因进行白桦生长和材性的分子改良研究。
1 实验材料和方法
1.1 植物材料
于2013年5月初形成层开始活动,树皮逐渐离皮开始,选取东北林业大学林木遗传育种实验基地内4年生健康白桦植株,每隔半个月左右取其发育中的形成层及新生木质部组织,直至生长季将近结束,树皮开始护皮为止,共9个发育时间点,即5月初,5月中,6月初,6月中,7月初,7月中,8月初,8月中,9月初,每个时间点取3次重复;人工模拟重力处理4年生白桦植株,使其与水平面弯曲45°,处理6 h后,取应拉木、对应木及直立木分生木质部,每个处理取3次重复,以上材料均经液氮处理,置于-80℃冰箱中保存。
1.2 白桦MYB基因的鉴定和系统进化分析
1.2.1 白桦MYB基因的鉴定
本实验室前期工作建立了多个白桦各种处理的转录组,经序列拼接获得转录组拼接结果(实验室内部数据,未发表)。对获得的unigenes进行BLASTX和BLASTN分析,根据功能注释结果,并去掉较短的序列,以获得不同的MYB基因全长和部分cDNA序列,通过ORF founder(http://www.ncbi.nlm.nih.gov/gorf.html)程序,综合BLASTX比对结果确定其开放读码框。
1.2.2 白桦MYB基因的系统进化分析
根据文献报道[7],在TAIR网(https://www.arabidopsis.org/)上下载137条拟南芥MYB蛋白序列,包括1R、2R、3R和4R各种亚家族已知功能的蛋白,对所有17条白桦MYB蛋白和137条拟南芥MYB蛋白利用ClustalX 2.0软件进行多序列比对和系统进化分析,利用MEGA6.0程序绘制N-J分子进化树。
1.3 Real time RT-PCR分析
利用CTAB法提取白桦不同组织总RNA[8],经DNase I(Promega)消化处理,去除DNA污染。取1μg总RNA进行反转录,反转录反应体系和操作参照Primer ScriptTMRT Reagent Kit(Perfect Real Time)(Takara)。将反转录产物稀释10倍,用作Real time RT-PCR的模板。选择beta-tubulin和ubiquitin(GenBank Ac.Num.:HO112154 and FG065618)作为内参基因。内参和MYB基因的定量PCR引物如表1,为避免相近序列的干扰,定量PCR扩增片段尽量选择在序列间同源性较低的区段内。
Real time RT-PCR反应体系为20 μL,其中包括去离子水7 μL,模板2 μL,基因特异性引物1 μL和2×Power SYBR Green PCR master mix 10 μL(Toyobo Co.,Ltd,Osaka,Japan),设置3次重复。PCR反应程序为94℃预变性3 min,94℃变性12 s、58℃退火30 s、72℃延伸40 s、78.4℃读板1 s,循环45次,72℃延伸7 min。反应在Bio-Rad Hercules.CA.USA.上完成。利用-△△CT方法进行数据分析[9]。
表1RealtimeRT-PCR引物序列
Table1RealtimeRT-PCRprimerssequences

基因命名Name正向引物(5'-3')反向引物(5'-3')MYB3AGCAGGAGCACGACAAGTTTGGATTCCCAGGAACTGATGAMYB5GGCGTGGTATATCTCGCAATTGGCTTGAGAATCTCGTGTGMYB6CTTGGGGAAGCAATCTTTCAGCTCTTCCCTAGCAGCTTCAMYB8CCCCCGGAAACTTGTAATTCGGTTGGTTTCAGATGGCACTMYB9ACCAAGGCCATTAGATGCACTTATAGTCCCCACCGGCATAMYB10GGTGCTGATCAGGAAAGGAAGTGGCAGCACAGAAGATTGAMYB11CAATTGGACTTGCACCAATGTATGGCGTCTCTCAGCCTCTMYB13GGCAACAGGTGGTCTCAAATAGCTGCTGGGACGACATATTMYB14AGAGGACCGAAGTGCAATGTTCATCAAACCCATTCGACCTMYB15GCGGAAGCTAATAAGCATGGATCATGGCCTTTGAAATTCGMYB16GACCCCAGGAAAGGAAGAAGTTGCTCCCAATCATGTCAAAMYB17TGCTAAGCCTCTTGCGATTTTTGAACTTGGTGCGATCTTGMYB21GGGCGAACAGACAATGAAATGGTGACAAACCCGACGTAGTMYB22AGTTGAGGACCACCATCACCGCCGTTGCTGTATTTGAGGTMYB23AGCAGCAGCCAAACAATTCTCGTCAGCAGCCATATTTGTGMYB25TGGCAGAAAGTGGATCATCAGATGATCTTCCAACGGGCTAMYB26CGATTTGACAGCAGACGAGATCCCTGGCAGAGACAGAGTT

图1 白桦与拟南芥MYB蛋白进化分析Fig.1 The phylogenetic analysis of MYB proteins
2 结果与分析
2.1 白桦MYB家族基因系统进化分析
通过对白桦多个转录组拼接结果的比对查找,综合片段长度和序列分析信息,共获得17条MYB基因序列,都含有MYB超家族保守结构域,命名为BplMYBs。将获得的序列在白桦基因组数据库(白桦基因组网址:http://birch.genomics.cn/)中重新比对,其序列号分别为:BplMYB3:(BP019206.1);BplMYB5:(BP019448.1);BplMYB6:(BP024457.3);BplMYB8:(BP020466.1);BplMYB9:(BP013601.1);BplMYB10:(BP001656.1);BplMYB11:(BP026915.1);BplMYB13:(BP035146.1);BplMYB14:(BP004876.1);BplMYB15:(BP035588.1);BplMYB16:(BP017185.1);BplMYB17:(BP015777.1);BplMYB21:(BP007319.1);BplMYB22:(BP032772.1);BplMYB23:(BP001154.1);BplMYB25:(BP025925.2);BplMYB26:(BP019296.1)。通过与137条拟南芥家族基因进行系统进化分析,结果显示,17条MYB蛋白分属于不同类型的亚家族及不同的组。其中BplMYB3、5、11、16、10、6、25、14、8和17这10条蛋白属于1R/4R型亚家族,BplMYB6与AtMYBR1进化关系最近,BplMYB8和17与AtMYB4R1进化关系最近。其余7条属于2R型亚家族。BplMYB13与已知的次生细胞壁合成相关基因AtMYB46聚为一组,BplMYB15和BplMYB26分别与胁迫响应和非生物胁迫应答相关MYB聚为一组,BplMYB23与硫代葡萄糖苷合成相关MYB聚为一组,BplMYB9、21和22与苯丙烷生物合成相关MYB聚为一组。
2.2白桦MYB家族基因在一个生长季不同发育阶段形成层相关组织中的表达
通过Real time RT-PCR分析白桦17个MYB在一个生长季不同时间点形成层及新生木质部相关组织的表达情况,结果如图2所示,17个MYB基因在各个时间点与5月初的表达水平相比,表达水平和表达模式略有不同,但总体上均在5月中旬到7月中旬间具有相对较高的表达水平。随着生长季趋于结束,其表达水平逐渐下降。其中BplMYB13在形成层和分生木质部发育的整个生长季都具有较高的表达水平,说明其可能参与白桦木质部的发育和次生细胞壁的形成。BplMYB9和BplMYB16在生长季初期和生长季临近结束时具有较高的表达水平。以上结果说明,在形成层活动旺盛期,MYB家族基因的表达较活跃,根据表达模式及表达量的不同,推测不同的基因参与到不同的生理活动中。

图2 MYB基因在生长季不同发育时期的表达分析Fig.2 The expression analysis of MYB genes in different development periods
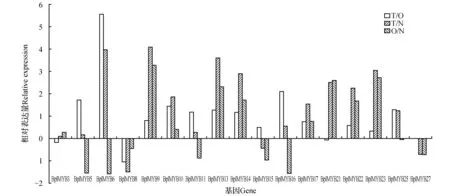
图3 白桦MYB家族基因在人工弯曲处理6 h的应拉木中表达分析Fig.3 The expression analysis of MYB genes in the xylem bended for 6 h in Birch
2.3白桦MYB家族基因在人工弯曲处理6h的应拉木中表达分析
在白桦茎干人工弯曲处理6 h后,受到重力和外力刺激下,应拉木和对应木中MYB家族基因的表达均发生显著变化。其中,与直立木和对应木相比,14条基因在应拉木中上调表达;与直立木相比,7条基因在对应木中上调表达。说明这些基因受拉力和重力刺激的诱导,在白桦应拉木形成过程中的各种生理生化变化中起到调节作用。
3 讨论
MYB家族基因根据其所含保守结构域的不同,分为1R,2R,3R和4R几个亚家族,不同的亚家族结构特征不同,往往也具有不同的功能。与拟南芥MYB家族基因进行系统进化分析结果显示,其中BplMYB6与AtMYBR1进化关系最近,BplMYB13与已知的次生细胞壁合成相关基因AtMYB46聚为一组,BplMYB15和BplMYB26分别与胁迫响应和非生物胁迫应答相关MYB聚为一组,BplMYB23与硫代葡萄糖苷合成相关MYB聚为一组,BplMYB9、21和22与苯丙烷生物合成相关MYB聚为一组。暗示这些白桦的MYB基因与拟南芥相应的基因具有相似的功能,在白桦的细胞壁形成,胁迫响应和苯丙烷生物合成等过程中起着重要作用。AtMYBR1与植物叶片的胁迫响应与衰老有关[10],因此推测BplMYB6参与白桦的胁迫响应和衰老调控。拟南芥MYB46和其同源基因AtMYB83是三种主要次生细胞壁组分(包括纤维素,木聚糖和木质素)合成的关键调节因子,过表达AtMYB46或者AtMYB83能够激活木质素,纤维素和木糖的合成,导致次生细胞壁的异常沉积[6]。因此,本研究推测BplMYB13可能参与白桦次生细胞壁的形成。苯丙烷生物合成是木质素生物合成三大步骤的第一步,本研究中BplMYB9和21与拟南芥苯丙烷生物合成相关MYB聚为一组,推测这两个基因参与了白桦苯丙烷生物合成乃至下游的木质素生物合成。
树木的形成层细胞通过分裂和分化过程形成次生木质部细胞,形成层细胞随着树木的直径和高度及季节不同也会发生变化,其基因表达的调控也随着形成层的变化而变化[11]。北京地区毛白杨形成层及木质部季节性研究结果显示,在5月中旬到6月中旬,新生木质部增长速度较初期迅速,随后下降,在8月中旬以后,形成层层数明显减少,到9月中旬以后形成层活动期末期达到最少且木质部停止分化[12~13];河北地区核桃树形成层在5月中旬至6月中旬为活动旺盛期,7月上旬至9月初形成层活动受到高温抑制[14];在9月形成层又出现了一个恢复期,形成层层数增加[15];北京地区的构树在形成层活动期即5月中旬到7月下旬,同工酶谱带最多,其中部分酶带在8月份消失,又在形成层停止活动时出现[16~17],在桉树,杨树等物种中,关于维管形成层活动的基因调控研究结果表明,大量的基因在维管形成层活动期表达量显著高于其他时期[11]。对于东北地区的树种白桦来说,因其与北京和河北等地的物候有所区别,形成层活动期略有滞后,5月初开始离皮,9月初开始护皮,在白桦形成层发育相关基因的表达研究中,结果显示和木质部发育相关的基因,主要在5月中至7月中表达[18]。在本研究中,绝大部分的MYB基因也是在形成层活动旺季,即5月中至7月中具有较高的表达水平,随后受到季节性抑制表达下降,说明这些基因参与了打破休眠,形成层发育,木质部形成等相关的生理活动。其中BplMYB6、9和16在8月份或者9月份有一个表达的恢复,这与研究中生长季结束前形成层恢复活动和同工酶恢复作用研究结果类似,暗示这些基因参与了进入休眠前生理变化的调控。BplMYB13在整个生长季的形成层和分生木质部中都具有交高的表达水平,结合系统进化分析结果,进一步显示,其可能参与白桦木质部发育和次生细胞壁的形成。
应力木系统被认为是揭示次生木质部发育过程中细胞壁生物合成和修饰机制的良好系统。此外,应力木系统也是分离细胞壁生物合成调控有效因子的重要遗传资源。Jin[19]等构建了人工倾斜处理6 h的黄杨应拉木cDNA文库,获得了5 982条cDNA序列,其中鉴定出多个次生木质部发育和细胞壁形成相关基因,包括木质部特异的木质素合成关键基因。这些木质素生物合成基因在应拉木中下调表达。Paux[20]等利用cDNA文库技术分析力桉树应拉木形成过程,鉴定了196条差异表达的基因,这基因功能涉及到次生木质部结构和成分变化的调节,如纤维素合成酶等。本研究鉴定的17个MYB基因,在白桦人工弯曲处理6 h时,其大部分基因表达明显被诱导,部分基因表达被抑制,说明这些基因参与了白桦应拉木形成过程中的生理生化变化,对进行白桦木质部发育分子调控研究具有潜在的研究价值。
1.Zhong R Q,Ye Z H.Regulation of cell wall biosynthesis[J].Plant Biology,2007,10:564-572.
2.Zhong Ruiqin,Ye Zhenghua.Transcriptional regulation of lignin biosynthesis[J].Plant Signaling & Behavior,2009,4(11):1028-1034.
3.陈清,汤浩茹,董晓莉,等.植物Myb转录因子的研究进展[J].基因组学与应用生物学,2009,28(2):365-372.
4.王希庆,陈柏君,印莉萍.植物中的MYB转录因子[J].生物技术通报,2003(2):22-25.
5.万小荣,李玲.植物的MYB蛋白[J].植物生理学通讯,2002,38(2):165-170.
6.Zhong R,Lee C,Zhou J,et al.A battery of transcription factors Involved in the regulation of secondary cell wall biosynthesis inArabidopsis[J].Plant Cell,2008,20:2763-2782.
7.Hou Xiaojin,Li Sibei,Liu Shengrui,et al.Genome-Wide Classification and Evolutionary and Expression Analyses of Citrus MYB Transcription Factor Families in Sweet Orange[J].Ploe One,2014,9(11):e112375.
8.王玉成,杨传平,姜静.紫丁香、糖槭总RNA的快速提取方法[J].东北林业大学学报,2001,29(6):90-91.
9.Livak K J,Schmittgen T D.Analysis of relative gene expression data using real-time quantitative PCR and the 2(-Delta Delta C(T)) method[J].Methods,2001,25(4):402-408.
10.Jaradat M R,Feurtado J A,Huang D,et al.Multiple roles of the transcription factor AtMYBR1/AtMYB44 in ABA signaling,stress responses,and leaf senescence[J].BMC Plant Biol.2013,28(13):192.
11.许会敏,王莉,曹德昌,等.维管形成层活动周期调控研究进展[J].科学通报,2015,07:619-629.
12.殷亚方,姜笑梅,刘晓丽.毛白杨枝条木质部细胞分化的动态变化及其与形成层活动的相互关系[J].林业科学,2004,02:119-125.
13.殷亚方,姜笑梅,魏令波.毛白杨形成层的活动周期及其POD同工酶的变化[J].林业科学,2002,01:103-110,177.
14.李杰.核桃形成层活动规律及其响应机制研究[D].保定:河北农业大学,2011.
15.李杰,李保国,齐国辉,等.核桃枝条形成层活动周期及其淀粉贮量的变化[J].河北农业大学学报,2011,01:47-50.
16.崔克明,李正理,魏令波,等.构树形成层的活动周期及其淀粉贮量的变化[J].植物学报,1995,01:53-57,88.
17.崔克明,魏令波,李绍文,等.构树形成层活动周期中过氧化物酶和酯酶同工酶的变化[J].植物学报,1995,10:800-806.
18.Wang Chao,Wang Yucheng,Diao Guiping,et al.Isolation and characterization of expressed sequence tags(ESTs) from cambium tissue of birch(BetulaplatyphyllaSuk.)[J].Plant Mol Biol Rep,2010,28(3):438-449.
19.Jin H,Do J,Moon D,Noh EW,et al.EST analysis of functional genes associated with cell wall biosynthesis and modification in the secondary xylem of the yellow poplar(Liriodendrontulipifera) stem during early stage of tension wood formation[J].Planta,2011,234(5):959-977.
20.Paux E,Carocha V,Marques C,et al.Transcript profiling of Eucalyptus xylem genes during tension wood formation[J].New Phytologist,2005,167(1):89-100.
SequenceandExpressionAnalysisofMYBFamilyGenesinBetulaplatyphyllaSuk.
LIU Hui-Zi SUN Dan YU Ying ZHANG Nan WANG Chao*
(The State-Owned Key Laboratory of The Northeast Forestry University,Harbin 150040)
The MYB transcription factor family is one of the important plant transcription factor family members, and they have the key function on the growth, development, cell wall biosynthesis and stress response in plant. We obtained the total of 17MYBgenes, and by phylogenetic analysis, 17MYBgenes of birch belong to different subfamilies and groups. Among these genes, 10 MYBs belong to the 1R/4R subfamilies, and 7 MYBs belong to the 2R subfamily. BplMYB13 is homologous to the AtMYB46 which functions in the secondary cell wall biosynthesis. BplMYB15 and BplMYB26 belong to the group which involved in the stress response. BplMYB23 is homologous to the AtMYBs involved in the glucosinolate biosynthesis. BplMYB9, 21 and 22 have homologous with the AtMYBs functioned in phenylpropanoid biosynthesis. The expression patterns analysis among the development stages of the growth season and the tension wood and opposite wood bended for 6 h, and the normal wood were performed by real time RT-PCR. 17MYBgenes had the peak express levels from the middle of May to the middle of July, and theBplMYB13 maintained the high express levels among all the growth season in the cambium and xylem. TheBplMYB13 may play the role in the cambium and xylem development. After 6 h bending, 14MYBswere up-regulated in the tension wood compare with the opposite wood or normal wood, and 7 MYBs were increased expressed in the opposite wood than those in the normal wood. Therefore, these genes response to the artificial bending and play key roles in the physiology change during the xylem development response to the bending stress.
BetulaplatyphyllaSuk.;MYB;sequence analysis;expression analysis
国家自然科学基金(31470671)
刘慧子(1989—),女,硕士研究生,主要从事林木基因工程研究。
2015-10-23
Q943.2
A
10.7525/j.issn.1673-5102.2016.02.014
