支气管哮喘患者治疗前后血清IL-2、IL-4及外周全血T细胞亚群水平动态变化的研究*
2016-11-09张晶赖飞梁小亮
张晶,赖飞,梁小亮
(福建省厦门市第二医院1.检验科,2.输血科,福建 厦门 361021)
新进展研究
支气管哮喘患者治疗前后血清IL-2、IL-4及外周全血T细胞亚群水平动态变化的研究*
张晶1,赖飞2,梁小亮1
(福建省厦门市第二医院1.检验科,2.输血科,福建 厦门 361021)
目的通过检测不同严重程度支气管哮喘患者治疗前后血清白细胞介素-2(IL-2)、IL-4及外周全血CD4+、CD8+T细胞亚群水平变化,探讨上述指标对支气管哮喘患者诊断、治疗及病情变化的临床意义。方法用流式细胞仪检测支气管哮喘患者治疗前后血清IL-2、IL-4、干扰素-γ(IFN-γ)及外周全血CD4+、CD8+、CD3+T细胞亚群水平,并同时检测正常人上述指标的水平,将治疗前后结果进行统计分析,并分别与正常人结果进行比较。结果治疗前后血清IL-2、IL-4、IFN-γ水平比较,差异有统计学意义(P<0.01);外周全血CD4+T细胞水平治疗前后,以及与正常人水平比较,差异有统计学意义(P<0.05);治疗前后外周全血CD8+T细胞水平与正常人水平比较,差异无统计学意义(P>0.05);轻、中度哮喘患者治疗前后外周全血CD3+T细胞水平比较,差异无统计学意义(P>0.05),而重度哮喘治疗前后外周全血CD3+T细胞水平比较,差异有统计学意义(P>0.05)。结论动态测定IL-2、IL-4及CD4+、CD8+T细胞亚群水平是判断支气管哮喘病情变化的有效指标,对哮喘的诊断、治疗有一定的意义。
支气管哮喘;白细胞介素-2;白细胞介素-4;CD4+T细胞;CD8+T细胞
支气管哮喘(以下简称哮喘)是一种气道慢性炎症性疾病,过去10年其发病率急剧增加,给全球健康,特别是西方国家[1],带来极大的负担,现已成为全世界重点关注的疾病之一。其是由多种细胞,特别是肥大细胞、嗜酸粒细胞和T淋巴细胞参与的慢性气道炎症反应,气道高反应性和支气管平滑肌痉挛是该病的两大特征[2]。有研究表明,发作期哮喘患者存在CD4+和CD8+T细胞数量和功能的异常[3-6],即哮喘患者细胞免疫功能紊乱与哮喘的发作有关。本实验直接检测CD3、CD4、CD8水平,了解T细胞亚群的变化。研究发现,哮喘发病机制复杂,Th1/Th2免疫应答失衡已被认为是哮喘发病的主要机制之一[7-8]。Th1细胞分泌白细胞介素-2(Interleukin-2,IL-2)、干扰素-γ(Interferon-γ,IFN-γ)、IL-12等细胞因子,介导细胞免疫反应;Th2细胞分泌IL-4、IL-5、IL-6、IL-10等细胞因子,诱导抗体产生,介导体液免疫反应。王俊等[9]研究发现,IL-4活性可作为Th2功能指标,IL-2活性作为Th1功能指标,可间接反映Th1/Th2变化。本课题针对性的选择IL-4、IL-2做为细胞因子的代表,通过IL-4/IL-2反映Th1/Th2变化。在哮喘患者不同程度、不同发作频率时,分别检测其水平,同时与T细胞亚群联合检测,进一步达到监测病情,随诊观察评估的目的。
1 资料与方法
1.1一般资料
1.1.1研究对象根据我国2013年修订的支气管哮喘防治指南标准,选择轻、中、重度支气管哮喘患者各30例做为哮喘组。其中,男性20例,女性10例;年龄30~60岁,平均(42.32±10.12)岁;体重(56.23± 12.78)kg,治疗前后留取外周血及血清标本。哮喘组分为:①中、轻度支气管哮喘的入选标准为日间症状≤2 d/周,发作间歇无症状,夜间症状≤2次/月;②中度支气管哮喘的入选标准为日间症状>2 d/周,但非每天有症状,夜间症状3~4次/月;③重度支气管哮喘的入选标准为日间症状≥1次/d,夜间症状> 1次/周,每晚有或无症状。选择健康体检者30例作为对照组。其中,男性20例,女性10例;年龄30~60岁,平均(44.56±9.32)岁;体重(58.12±12.76)kg,均无呼吸系统疾病和过敏性疾病史。
1.1.2主要实验试剂与仪器美国BD公司流式细胞仪,型号为Calibur型。美国BD公司Human IL-2 Flex Set试剂盒,美国BD公司Human IL-4 Flex Set试剂盒,美国BD公司人类白细胞分化抗原CD4/CD8/ CD3检测试剂盒。
1.2实验方法
1.2.1标本收集空腹静脉采血2管,1管为抗凝全血2~3 ml,1管为不抗凝血2~3 ml,抗凝全血当天上机检测,不抗凝血离心后分离血清,置于-80℃冰箱冷冻保存。同一患者在治疗前和病情进入缓解期后各采血1次,对照组在检测前2~3d集中采血。
1.2.2IL-2、IL-4及CD3+CD4+、CD8+T细胞亚群水平测定采用流式细胞术检测,试剂盒购自由美国BD公司,严格按试剂盒说明书进行操作。
1.3统计学方法
采用SPSS 13.0统计软件进行数据分析,计量资料用均数±标准差(x±s)表示,多组间的比较用重复测量方差分析,两两比较用LSD检验,P<0.05为差异有统计学意义。
2 结果
2.1支气管哮喘患者治疗前后血清IL-2、IL-4及IFN-γ水平
轻、中、重度哮喘患者治疗前后3个指标整体比较,经重复测量方差分析,血清IL-2各组间比较,差异有统计学意义(F=32.456,P=0.000);血清IL-4各组间比较,差异有统计学意义(F=22.765,P=0.000);血清IFN-γ各组间比较,差异有统计学意义(F= 16.413,P=0.000)。各组间两两比较用LSD检验,轻度哮喘患者血清IL-2治疗后与对照组比较,差异有统计学意义(t=-9.445,P=0.001);治疗前后比较,差异有统计学意义(t=-12.484,P=0.001)。轻度哮喘患者血清IL-4治疗后与对照组比较,差异有统计学意义(t=23.174,P=0.000);治疗前后比较,差异有统计学意义(t=-50.878,P=0.000)。轻度哮喘患者血清IFN-γ治疗后与对照组比较,差异有统计学意义(t= 2.754,P=0.001);治疗前后比较,差异有统计学意义(t=3.456,P=0.001)。中度哮喘患者血清IL-2治疗后与对照组比较,差异有统计学意义(t=-14.590,P= 0.001);治疗前后比较,差异有统计学意义(t=-19.595,P=0.000)。中度哮喘患者血清IL-4治疗后与对照组比较,差异有统计学意义(t=32.233,P=0.000);治疗前后比较,差异有统计学意义(t=-71.445,P=0.000)。中度哮喘患者血清IFN-γ治疗后与对照组比较,差异有统计学意义(t=3.742,P=0.000);治疗前后比较,差异有统计学意义(t=4.532,P=0.001)。重度哮喘患者血清IL-2治疗后与对照组比较,差异有统计学意义(t=-20.438,P=0.000);治疗前后比较,差异有统计学意义(t=-26.925,P=0.000)。重度哮喘患者血清IL-4治疗后与对照组比较,差异有统计学意义(t=29.644,P=0.000);治疗前后比较,差异有统计学意义(t=-70.794,P=0.000)。重度哮喘患者血清IFN-γ治疗后与对照组比较,差异有统计学意义(t=6.431,P=0.001);治疗前后比较,差异有统计学意义(t= 1.321,P=0.000)。见表1和图1。
表1 各组治疗前后IL-2、IL-4及IFN-γ水平比较(n=30,pm/ml±s)
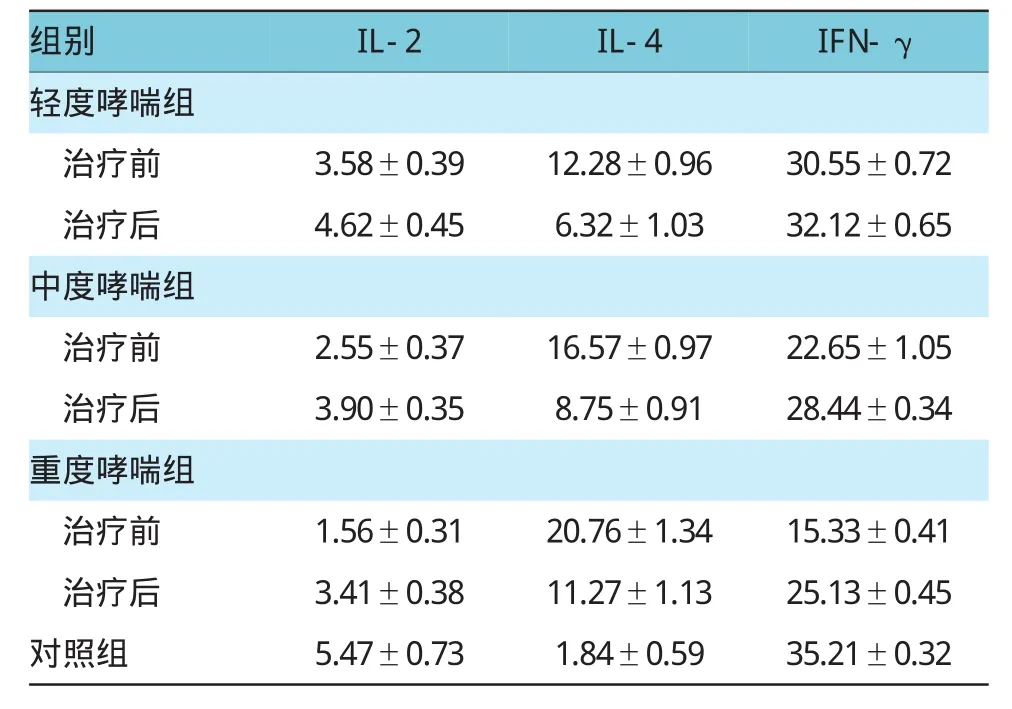
表1 各组治疗前后IL-2、IL-4及IFN-γ水平比较(n=30,pm/ml±s)
?
图1 血清IL-2、IL-4流式分析图
表2 各组治疗前后T细胞亚群水平比较(n=30,%s)
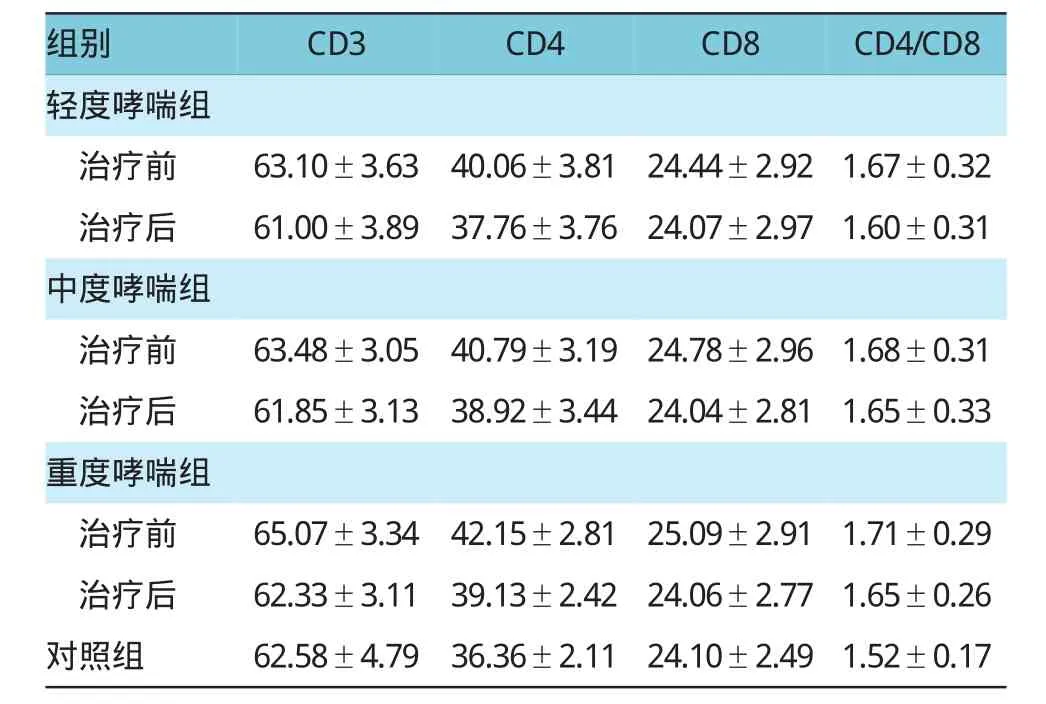
表2 各组治疗前后T细胞亚群水平比较(n=30,%s)
组别CD3CD4CD8CD4/CD8轻度哮喘组治疗前63.10±3.6340.06±3.8124.44±2.921.67±0.32治疗后61.00±3.8937.76±3.7624.07±2.971.60±0.31中度哮喘组治疗前63.48±3.0540.79±3.1924.78±2.961.68±0.31治疗后61.85±3.1338.92±3.4424.04±2.811.65±0.33重度哮喘组治疗前65.07±3.3442.15±2.8125.09±2.911.71±0.29治疗后62.33±3.1139.13±2.4224.06±2.771.65±0.26对照组62.58±4.7936.36±2.1124.10±2.491.52±0.17
2.2支气管哮喘患者治疗前后血清T细胞亚群水平
轻、中、重度哮喘治疗前后3个指标整体比较,经重复测量方差分析,外周全血CD3+T细胞各组间比较,差异有统计学意义(F=12.304,P=0.000);外周全血CD4+T各组间比较,差异有统计学意义(F= 22.432,P=0.000);外周全血CD8+T各组间比较,差异无统计学意义(F=3.542,P=0.082);CD4+/CD8+比值在各组哮喘患者组间比较,差异有统计学意义(F= 17.675,P=0.000)。各组间两两比较用LSD检验,CD3+T细胞在轻、中度支气管哮喘患者治疗前后比较,差异无统计学意义(轻度:t=-0.469,P=0.641;中度:t=-0.869,P=0.388),而在重度哮喘治疗前后比较,差异有统计学意义(t=-2.334,P=0.023);各组哮喘患者治疗后与对照组比较,差异有统计学意义(轻度:t=2.151,P=0.036;中度:t=2.050,P=0.045;重度:t= 3.292,P=0.002)。CD4+T细胞在轻、中、重度支气管哮喘患者治疗前后比较,差异有统计学意义(轻度:t= -4.661,P=0.000;中度:t=-6.37,P=0.000;重度:t= -9.038,P=0.000);各组哮喘患者治疗后与对照组比较,差异有统计学意义(轻度:t=2.358,P=0.022;中度:t=2.203,P=0.032;重度:t=4.474,P=0.000)。CD8+T细胞在轻、中、重度支气管哮喘患者治疗前后比较,差异无统计学意义(轻度:t=-0.497,P=0.621;中度:t=-0.973,P=0.335;重度:t=-1,419,P=0.161);各组哮喘患者治疗后与对照组比较,差异无统计学意义(轻度:t=0.489,P=0.627;中度:t=0.990,P=0.326;重度:t=1.404,P=0.166)。CD4+/CD8+比值在各组哮喘患者治疗前后比较,差异有统计学意义(轻度:t= -2.234,P=0.029;中度:t=-2.410,P=0.019;重度:t= -3.080,P=0.003);各组哮喘患者治疗后与对照组比较,差异无统计学意义(轻度:t=0.853,P=0.397;中度:t=0.328,P=0.774;重度:t=0.820,P=0.416)。见表2和图2。
图2 外周全血CD3+T细胞、CD4+T细胞、CD8+T细胞流式分析图
3 讨论
哮喘是由多种细胞和细胞组分参与的气道慢性炎症性疾病[10-11],其发病机制十分复杂,尚未完全清楚,可概括为免疫-炎症反应、神经机制、气道高反应及相互作用[12]。吴健等[13]研究发现,Th1/Th2细胞功能的异常或失衡是引起过敏性疾病如支气管哮喘等多种免疫性疾病的根源。HEATON等[14]2005年研究发现,哮喘发病机制复杂,Th1/Th2免疫应答失衡被认为是哮喘发病的主要机制之一。T淋巴细胞是人体内免疫功能最重要的一大细胞群,在T淋巴细胞分类中,CD3+代表总T淋巴细胞,CD4+代表T辅助细胞,而CD8+代表T抑制细胞和T杀伤细胞[15]。CD4+T细胞的主要功能是增强和扩大免疫应答过程,其功能受损会影响B淋巴细胞活化,从而使免疫球蛋白G、免疫球蛋白A等抗体产生减少,抗感染能力将受到很大影响[16]。CD8+T细胞功能低下,机体可能会发生过强的免疫应答[17-20],使嗜酸性粒细胞产生过多免疫球蛋白E,导致某些免疫性疾病,如自身免疫性疾病和超敏反应等。本研究表明。在轻、中、重度哮喘患者外周全血中,CD4+T细胞水平升高,治疗前后比较差异有统计学意义,并且与对照组比较差异有统计学意义;而CD3+T细胞只在重度哮喘患者治疗前后比较,差异有统计学意义;CD8+T细胞治疗前后变化比较,差异无统计学意义,与对照组比较差异无统计学意义,说明CD4+T细胞对于研究哮喘患者病情、治疗等方面可以起到一定的作用。
目前认为肥大细胞为哮喘发生的始动效应细胞,而激活细胞启动哮喘发病机制的主要细胞是T淋巴细胞,其所释放的细胞因子,在哮喘炎症机制中发挥重要作用。其中IL-2主要由Th1细胞产生,对嗜酸性粒细胞具有趋化作用。IL-2生物学功能必须通过细胞膜上的IL-2R介导,才能发挥作用。IL-2在哮喘方面的研究报道较多。LAI等[21]报道,发作期哮喘患者外周血可溶性白细胞介素-2受体明显高于对照组,病情缓解后受体有所下降。本研究证实,治疗前轻、中、重度哮喘患者的血清IL-2水平降低,并且与治疗后比较差异有统计学意义。
IL-4和IFN-γ是Th1、Th2产生重要免疫效应的细胞因子,在一定程度上反映Th1、Th2细胞亚群的功能状态[22]。IL-4是CD4+T细胞和CD8+T细胞转化为Th2的关键细胞因子[23],能促进Th0细胞分化为Th2细胞。采用敲除IL-4基因的小鼠,T细胞及其亚群发育虽然正常,但不能诱导Th2型细胞因子的产生,故IL-4被认为是Th2转化的必需因子,而IFN-γ可促使Th0细胞向Th1方向分化,并抑制Th2克隆分化,能够显著提高巨噬细胞的抗原呈递能力,并抑制IL-4mRNA的表达,同时还抑制IL-4介导的B细胞表达Fc受体和分泌sFc受体,从而抑制IL-4诱导的免疫球蛋白E的合成过程,发挥抗炎作用[24]。本研究表明,哮喘患者血清中IL-4水平较对照组增高,而哮喘患者血清中IFN-γ水平低于对照组,提示哮喘患者血清中以IL-4增高为特征的Th2功能亢进和以IFN-γ水平降低为标志的Th1功能降低,同时由于IFN-γ水平降低,导致Th0向Th1方向分化受阻,从而加剧Th2功能亢进状态[25]。
血清IL-2、IL-4及外周血CD4+T细胞水平可能是哮喘发病的重要因素,联合检测血清IL-2、IL-4及外周血CD4+T细胞水平有助于支气管哮喘患者诊断、判断病情变化等。本研究立足于临床实际,针对支气管哮喘患者的检测、诊断及治疗现状,寻求一种更加有效、准确、便捷、经济的辅助诊疗方案。
[1]KIM J H,ELLWOOD P E,ASHER MI.Diet and asthma:looking back,moving forward[J].Respir Res,2009,10(1):49.
[2]TAKAHASHI A,KUROKAWA M,KONNO S,et al.Osteopontin is involved in migration of eosinophils in asthma[J].Clin Exp Allergy,2009,39(8):1152-1159.
[3]SHIOTA Y,ARIKITA H,HORITA N,et al.Intracellular IL-5 and T-lymphocyte subsets in atopic and nonatopic bronchial asthma[J].J Allergy Clin Immunol,2002,109(2):294-298.
[4]SHI H Z,SUN J J,PAN H L,et al.Alterations of T-lymphocytesubsets,soluble IL-2 receptor,and IgE in peripheral blood of children with acute asthma attacks[J].J Allergy Clin Immunol, 1999,103(3Pt1):388-394.
[5]GEMOU-ENGESAETH V,FAGERHOL M K,TODA M,et al. Expression of activation markers and cytokine mRNA by peripheral blood CD4 and CD8 T cells in atopic and nonatopic childhood asthma:effect of inhaled glucocorticoid therapy[J].Pediatrics,2002,109(2):24.
[6]LEE S Y,KIMIM S J,KWON S S,et al.Distribution and cytokine production of CD4 and CD8 T-lymphocyte subsets in patients with acute asthma attacks[J].Ann Allergy Asthma Immunol, 2001,86(6):659-664.
[7]JI X,LI J,XU L,et al.IL-4 and IL-17A provide a Th2 /Th17-polarized inflammatory milieu in favor of TGF-β1to induce bronchial epithelial-mesenchymal transition(EMT)[J].Int J Clin Exp Pathol,2013,6(8):1481-1492.
[8]SHI Y H,SHI G C,WAN H Y,et al.An increased ratio of Th2/Treg cells in patients with moderate to severe asthma[J]. Chin Med J(Engl),2013,126(12):2248-2253.
[9]王俊,韩晓华,杨柏松.肺炎支原体肺炎患儿血清及诱导痰中IL-4及IFN-γ的测定[J].中国实用儿科杂志,2005,20(9):543-545.
[10]TSELIOU E,BAKAKOS P,KOSTIKAS K,et al.Increased levels of angiopoietins 1 and 2 in sputum supernatant in severe refractory asthma[J].Allergy,2012,67(3):396-402.
[11]MAKINDE T O,AGRAWAL D K.Increased expression of angiopoietins and Tie2 in the lungs of chronic asthmatic mice[J]. Am J Respir Cell Mol Biol,2011,44(3):384-393.
[12]中华医学会呼吸病学分会哮喘学组.支气管哮喘防治指南[J].中华结核与呼吸杂志,2008,31:165-172.
[13]吴健,徐军,钟南山.BCG与变应性哮喘Th1/Th2平衡[J].国外医学:呼吸系统分册,2001,21(3):151.
[14]HEATON T,ROWE J T S,AALBERSE R C.et al.An immunoepidemiological approach to asthma:identification of in-vitro T-cell response patterns associated with different wheezing phenotypes in children[J].Lancet,2005,365:142-149.
[15]MA C,MA Z,LIAO X L,et al.Immunoregulatory effects of glycyrrhizic acid exerts anti-asthmatic effects via modulation of Th1/Th2 cytokines and enhancement of CD4(+)CD25(+)Foxp3+regulatory T cells in albumin-sensitized mice[J].J Ethnopharmacol,2013,148(3):755-762.
[16]杨晶,邝相如.CD4+T细胞亚群失衡在慢性阻塞性肺疾病中的临床意义[J].中国现代医学杂志,2015,25(1):46-49.
[17]EUSEBIO M,KRASZULA L,KUPCZYK M,et al.The effects of interleukin-10 or TGF-beta on anti-CD3/CD28 induced activation of CD8+CD28-and CD8+CD28+T cells in allergic asthma[J].J Biol Regul Homeost Agents,2013,27(3):681-692.
[18]VISEKRUNA A,RITTER J,SCHOLZ T,et al.Tc9 cells,a new subset of CD8(+)T cells,support Th2-mediated airway inflammation[J].Eur J Immunol,2013,43(3):606-618.
[19]DAKHAMA A,COLLINS M L,OHNISHI H,et al.IL-13-pro-ducing BLT1-positive CD8 cells are increased in asthma and are associated with airway obstruction[J].Allergy,2013,68(5): 666-673.
[20]MATHIAS R A,WEINBERG A,BOGUNIEWICZ M,et al. Atopic dermatitis complicated by eczema herpeticum is associated with HLA B7 and reduced interferon-γ-producing CD8+T cells[J].Br J Dermatol,2013,169(3):700-703.
[21]LAI C K,RABE K F,ADACHI M,et al.Worldwide severity and control of asthma in children and adults:the global asthmainsights and realitysurveys[J].J Allergy ClinImmunol,2004, 114:40-47.
[22]张蕾,刘英宇,王红阳.Tfh细胞以及Bcl-6蛋白在哮喘小鼠中的表达以及氨茶碱的干预作用[J].中国现代医学杂志,2014,24(23): 30-35.
[23]BERENQUER A G,CAMARA R A,BREHM A D,et al.Distribution of polymorphisms IL-4 590 C/T and IL-4 PR2 in the human populations of madeira,azores,portugal,cape verde and guinea-bissau[J].Int J Mol Epidemiol Genet,2012,3(2):179-183.
[24]STOTT B,LAVENDER P,LEHMANN S,et al.Human IL-31 is induced by IL-4 and promotes TH2-driven inflammation[J].J Allergy Clin Immunol,2013,132(2):446-454.
[25]KIM Y M,KIM Y S,JEON S G,et al.Immunopathogenesis of allergic asthma:more than the Th2 hypothesis[J].Allergy Asthma Immunol Res,2013,5(4):189-196.
(童颖丹编辑)
Dynamical changes of serum IL-2,IL-4 and T lymphocyte subsets in peripheral blood of patients with bronchial asthma before and after treatment*
Jing Zhang1,Fei Lai2,Xiao-liang Liang1
(1.Clinical Laboratory;2.Blood Transfusion Room,the Second Hospital of Xiamen,Xiamen,Fujian 361021,China)
Objective To investigate the changes of IL-2,IL-4 and T lymphocyte subsets levels in peripheral blood of patients with different severity of bronchial asthma and their clinical significance for the diagnosis,therapy and changes in patients'conditions.Methods In this study 30 healthy adults and 90 bronchial asthma patients were selected.Peripheral blood mononuclear cells were stained with monoclonal antibodies(anti-CD45,anti-CD4,anti-CD8 and anti-CD3)and evaluated using flow cytometry.T lymphocyte subsets were identified as CD3+CD4+and CD3+CD8+T cells.The serum levels of IL-2,IL-4 and IFN-γ were tested with BD Cytometric Bead Array(CBA)human soluble protein master buffer kit and evaluated using flow cytometry.The data were compared between the asthma patients and the healthy controls before treatment and after treatment.Results There were significant differences in IL-2,IL-4 and IFN-γ levels before and after treatment(P<0.01).There were significant differences in CD4+T cell subsets before and after treatment and between the controls and the bronchial asthma patients(P<0.05).There were no significant differences in CD8+T cell subsets before and after treatment or between the controls and the bronchial asthmapatients(P>0.05).There were no significant differences in CD3+T cell subsets in the moderate or mild bronchial asthma patients before and after treatment(P>0.05),but there were significant differences in the severe bronchial asthma patients before and after treatment(P<0.05).Conclusions Dynamical detection of IL-2,IL-4,and CD4+and CD8+T lymphocyte subsets is beneficial to estimation of the changes in disease condition of bronchial asthma patients and has clinical significance in diagnosis and treatment for bronchial asthma.
bronchial asthma;interleukin-2;interleukin-4;CD4+T lymphocyte;CD8+T lymphocyte
R 562.25
B
10.3969/j.issn.1005-8982.2016.19.014
1005-8982(2016)19-0069-06
2015-11-10
福建省卫计委青年课题基金(No:2012-2-90)
梁小亮,E-mail:xmeylxl@sina.com;Tel:13606906648
