超高效液相色谱法测定人体血清中伏立康唑药物浓度*
2016-11-09杨婷陈璐璐胡伟朱熙刘丽萍杨雅茹
杨婷,陈璐璐,胡伟,朱熙,刘丽萍,杨雅茹
(安徽医科大学第二附属医院药剂科,安徽 合肥 230601)
超高效液相色谱法测定人体血清中伏立康唑药物浓度*
杨婷,陈璐璐,胡伟,朱熙,刘丽萍,杨雅茹
(安徽医科大学第二附属医院药剂科,安徽 合肥 230601)
目的采用超高效液相色谱法测定人血清中伏立康唑(VR C)浓度,并用于临床上该药的血药浓度监测。方法以地西泮为内标,色谱柱为Agilent Poroshell 120 EC-C18(4.6×100mm,2.7μm),流速1ml/min,流动相为乙腈-0.2%甲酸水溶液(45∶55),检测波长254nm,进样量10μl,柱温40℃。结果VR C及地西泮的保留时间分别为2.52和4.06min;血清中VR C线性范围为0.12~12.0μg/ml(r=0.9999),定量下限为0.12μg/ml,日内精密度相对标准偏差(R SD)均<1.9%,日间精密度R SD均<2.1%,低、中、高3个浓度方法回收率为98.39%、101.16%和96.63%。结论该方法用于VR C的血药浓度检测,具有操作简便、稳定性良好,节约时间等优点。
伏立康唑;超高效液相色谱法;血药浓度监测
近年来,随着广谱抗生素的广泛使用、器官移植手术和侵入性诊疗手段的开展,侵袭性真菌感染的发病率正迅速增长,尤其是曲霉菌和念珠菌是最常见的致病菌。伏立康唑(Voriconazole,VRC)作为一种三唑类广谱抗真菌药,对于曲霉菌及念珠菌均有良好的抗菌作用,临床使用较为广泛[1]。但有研究发现,患者在给予相同剂量的伏立康唑时,体内血药浓度差异较大[2]。这可能与伏立康唑的药动学特点、药物间相互作用,以及药物代谢酶基因多态性等因素相关[3]。而血药浓度的巨大差异往往会影响疗效,引发不良反应。有文献报道,伏立康唑的安全浓度范围为1.0~5.5mg/L。当血药浓度>5.5mg/L时,不良反应如肝功能损害、视觉变化的发生率将大大增加。而血药浓度<1 mg/L时,可能出现治疗失败[4]。为提高伏立康唑临床应用的安全性及有效性,实现个体化给药,本实验建立超高效液相色谱法(ultra performance liquid chromatography,UPLC)检测伏立康唑的血清药物浓度,为临床用药提供参考。
1 资料与方法
1.1实验仪器与试剂
Waters UPLC H-CLASS超高效液相色谱仪,双量程电子天平,超纯水器,高速离心机,振荡器。伏立康唑对照品(中国药品食品检定研究院,批号:100862-201402,含量约99.7%),地西泮对照品(批号:171225-200903,含量为99.9%),甲醇、乙腈、甲酸均为色谱纯。
1.2色谱条件
色谱柱:Agilent Poroshell 120 EC-C18(4.6× 100mm,2.7μm),流速1ml/min,流动相为乙腈,0.2%甲酸水溶液(45∶55),进样量10μl,检测波长254nm,柱温40℃。
1.3溶液的配制
精密称取伏立康唑对照品2.4 mg,用50%甲醇水溶液定容到10 ml容量瓶中,制成240.0μg/ml伏立康唑储备液。然后依次稀释成伏立康唑标准曲线浓度点的储备液,浓度分别为120.0、60.0、24.0、12.0、6.0、2.4和1.2μg/ml。再取一定量的伏立康唑储备液稀释为质控样品的储备液,浓度分别为80.0、40.0和3.0μg/ml。
精密称取地西泮标准品1.0mg,用50%甲醇水溶液定容于1 ml容量瓶中,制成1 000μg/ml地西泮储备液,吸取该储备液150μl,加入50%甲醇水至10ml,得到15μg/ml内标溶液,备用。
1.4血清样品的处理
精密量取血清220μl,加入20μl内标地西泮溶液(15μg/ml),涡旋30 s,加入3 ml乙酸乙酯,震荡涡旋1 min,4 000 r/min离心10 min。精密吸取上层清液2.7 ml,40℃氮气吹干,加入50%甲醇水溶液250μl复溶,过0.22μm滤膜,10μl进样。
2 结果
2.1标准曲线和定量下限
取空白血清200μl,分别加入伏立康唑各标准曲线的储备液20μl及内标储备溶液20μl,配制成伏立康唑浓度分别为0.12、0.24、0.60、1.20、2.40、6.00和12.00μg/ml的系列标准血清样品,按1.4的方法操作,以色谱图中伏立康唑峰面积与内标峰面积的比值作为纵坐标(Y),伏立康唑浓度为横坐标(X),得到线性回归方程:Y=0.1553X+0.0116,r2= 0.99997,线性范围为0.12~12.0μg/ml,定量下限为0.12μg/ml。
2.2方法专属性
分别取不同来源的空白血清、对照品血清及患者服药后血清样本各6份,按1.4方法操作。色谱峰分离良好,不受血清内源性杂质峰干扰,伏立康唑和地西泮的保留时间分别为2.52和4.06min。见附图。
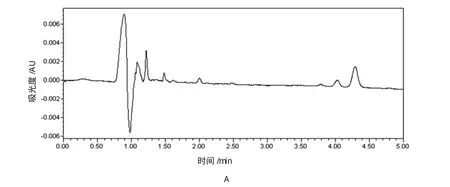
2.3精密度试验
配制伏立康唑低、中、高3个浓度的血清样品,浓度分别为0.3、4.0和8.0μg/ml,每个浓度配制6份,按1.4方法操作,得到该方法的日内精密度。连续检测3d,得到该方法的日间精密度。见表1。

附图 UPLC图谱

表1 UPLC法检测伏立康唑血药浓度的精密度
2.4回收率试验
配制伏立康唑低、中、高3个浓度的血清样品,浓度分别为0.3、4.0和8.0μg/ml,每个浓度配制6份,按1.4方法操作。另外取同等量的3个不同浓度的伏立康唑对照品溶液直接进样,将前者与后者的峰面积比较,计算提取回收率。根据当日标准曲线求得实测浓度,并与理论浓度进行比较作为方法回收率。见表2。
2.5稳定性试验
2.5.1室温稳定性配制伏立康唑为0.3、4.0和 8.0μg/ml的低、中、高3个浓度的血清样品,室温放置6h后按1.4方法操作。将测得结果与0h进行比较,结果表明血清样品室温放置6h保持稳定。
2.5.2进样室放置稳定性方法同2.5.1,配制伏立康唑3个浓度的血清样品,按1.4方法处理,进样室放置20 h后检测,结果表明血清样品处理后进样室放置20h保持稳定。
2.5.3冻融条件下血清样品的稳定性方法同2.5.1,配制伏立康唑3个浓度的血清样品,置于-80℃冰箱冷冻后,取出在室温下解冻,反复冻融3次,然后按1.4方法操作,将测得结果与未冻融样品进行比较,结果表明,血清样品反复冻融3次仍保持稳定。
表2 伏立康唑浓度分析方法的提取回收率和方法回收率(n=6,%s)

表2 伏立康唑浓度分析方法的提取回收率和方法回收率(n=6,%s)
理论浓度提取回收率方法回收率0.3μg/ml94.32±0.0198.39±0.02 4.0μg/ml83.07±0.01101.16±0.02 8.0μg/ml100.12±0.0196.63±0.02
2.5.4长期稳定性配制伏立康唑浓度为0.3、4.0和8.0μg/ml的低、中、高3个浓度的血清样品,在-80℃冰箱冷冻20 d后,取出在室温下解冻,按1.4方法操作,测得结果表明血清样品长期冰箱中放置仍保持稳定。见表3。

表3 伏立康唑浓度分析方法的稳定性(n=6)
2.6方法学应用
应用该方法对本院10例患者进行伏立康唑血药浓度测定,具体过程为患者连续使用伏立康唑,达稳态血药浓度时,于次日早晨用药前采血,4000r/min离心10 min,精密量取血清220μl,根据1.4方法处理,依据标准曲线定量。从监测结果来看,除7号外,其他血药浓度均在有效治疗浓度范围内(0.25~6.00mg/L)。7号和9号为同一患者血样,7号给予常规剂量药物,血药浓度超出有效浓度范围,9号为给药剂量较前一次减半后测得的血样,测得浓度降低至有效浓度范围。见表4。

表4 患者临床资料及伏立康唑血药浓度
3 讨论
多项研究结果表明,伏立康唑的血药浓度与其疗效及安全性相关[4-5]。有文献报道,伏立康唑的代谢呈非线性药动学特性[6],且在不同人体内的代谢快慢有明显差异,与本研究结果相符。由于患者血药浓度个体差异大,因此对伏立康唑进行血药浓度监测,可以更好地指导临床用药,对实现个体化给药意义重大。目前,测定伏立康唑的血药浓度常用方法有高效液相紫外检测法[7-9]、高效液相荧光检测法[10]和液质联用法[11-13]。本研究采用的是超高效液相色谱法,与高效液相检测方法比较,其检测速度快,每个样本仅需5 min即可得出结果,大大节省时间,满足临床检测需求;与液质联用法比较,其具有操作简便、成本低、重复性好的优点。BOEIRA等[14]也曾报道,使用超高效液相色谱法检测伏立康唑的血药浓度,相比较而言,该法优化液相条件,流动相中不含有缓冲盐溶液,延长色谱柱的寿命。同时,该法内标为地西泮,简单易得,便于实际操作。本实验中分别应用0.05%、0.10%、0.30%和0.20%甲酸水溶液作为水相,前3种溶液导致色谱图基线漂移,并且连续进样稳定性差,0.20%甲酸水溶液作为水相避免上述情况的出现。在选择血清样品处理方法时,分别使用甲醇、乙腈、高氯酸、三氯乙酸等试剂沉淀蛋白,离心后吸取上清液过滤直接进样的方法,回收率较低且杂质干扰较大。尝试使用乙酸乙酯提取的方法,实验结果表明,该方法样品回收率高且杂质干扰小,待测物峰形良好,适用于临床伏立康唑血药浓度测定。
本研究建立的方法实用性强,操作简便、数据准确、灵敏度高、重复性好,可以作为伏立康唑血药浓度日常监测方法,为临床合理安全用药提供有力的依据。
[1]SAN DHERRM,MASCHMEYERG.Pharmacologyand metabolism of voriconazole and posaconazole in the treatment of invasive aspergillosis:review of the literature[J].Eur J Med Res, 2011,16(4):139-144.
[2]何高丽,张菁.伏立康唑治疗药物浓度监测的探讨[J].中国感染与化疗杂志,2014,14(1):77-81.
[3]SUAN D,O’CONNOR K,BOOTH D R,et al.Voriconazole toxicity related to polymorphisms in CYP2C19[J].Intern Med J, 2011,41(4):364-365.
[4]PASCUAL A,CALANDRA T,BOLAYS,et al.Voriconazole therapeutic drug monitoringin patients with invasive mycoses improves efficacy and safety outcomes[J].Clin Infect Dis,2008, 46(2):201-211.
[5]DOLTON MJ,RAY J E,CHEN S C,et al.Multicenter study of voriconazole pharmacokinetics and therapeutic drug monitoring[J]. Antimicrob Agents Chemother,2012,56(9):4793-4799.
[6]武晓捷,董晓易.伏立康唑治疗药物浓度监测方法的建立[J].中国感染与化疗杂志,2009,9(2):118-122.
[7]王超,张弋.RP-HPLC法测定肾移植术后患者血浆中伏立康唑的浓度[J].中国药房,2014,25(18):1668-1669.
[8]黄娟,冯仕银,杜晓琳,等.HPLC法测定人血浆中伏立康唑浓度[J].解放军药学学报,2013,29(1):32-34.
[9]张燕青,林雪玉,朱金平.高效液相色谱法测定人血清中伏立康唑的质量浓度[J].中国药业,2014,23(23):6-8.
[10]肖翔林,银雪艳,孟冬梅.伏立康唑血药浓度的测定与方法学考察[J].抗感染药学,2014,11(4):292-294.
[11]付双双,熊歆,段京莉.伏立康唑患者血药浓度的监测[J].中国临床药理学杂志,2013,29(8):622-624.
[12]曲彩红,周凤丽,黄建华.高效液相色谱-串联质谱法测定侵袭性真菌感染患者伏立康唑的血药浓度[J].中国医院药学杂志, 2013,33(1):19-23.
[13]冯仕银,雍小兰,杜晓琳.LC-MS/MS法测定人血浆及唾液中伏立康唑浓度[J].中国新药杂志,2012,21(16):1908-1911.
[14]BOEIRA P,ANTUNES MV,ANDREOLLA H F,et al.Ultraperformance liquid chromatographic method for measurement of voriconazole in human plasma and oral fluid[J].Journal of the Brazilian Chemical Society,2012,23(1):148-155.
(童颖丹编辑)
Determination of serum Voriconazole concentration by ultra performance liquid chromatography*
Ting Yang,Lu-lu Chen,Wei Hu,Xi Zhu,Li-ping Liu,Ya-ru Yang
(Department of Pharmacy,the Second Hospital of Auhui Medical University,Hefei,Anhui 230601,China)
ObjectiveTodeterminatetheconcentrationofVoriconazoleinhumanserumbyultra performance liquid chromatography(UPLC).Methods Chromatography was performed on Agilent Poroshell 120 EC-C18(4.6×100 mm,2.7 μm),the internal standard was Diazepam.The flow rate was 1 ml/min,the mobile phase was acetonitrile-water(0.2%formic acid)(45:55),and the detection wavelength was 254 nm.Injection volume was 10 μl and the column temperature was 40℃.Results The retention time of Voriconazole and the internal standard Diazepam was 2.52 min and 4.06 min,respectively.The calibration curve was linear over the concentration range of 0.12-12.0 μg/ml(r=0.9999)with the lower limit of quantitation(LLOQ)at 0.12 μg/ml. Intra-and inter-day RSD was below 1.9%and 2.1%,respectively.The extraction recovery rate of the low,medium and high concentrations was 98.39%,101.16%and 96.63%,respectively.Conclusions The UPLC is a simple,highly selective and sensitive method for determining serum level of Voriconazole.
Voriconazole;ultra performance liquid chromatography;therapeutic drug monitoring
R 969.1
A
10.3969/j.issn.1005-8982.2016.19.008
1005-8982(2016)19-0037-05
2016-05-11
安徽医科大学第二附属医院博士科研启动基金(No:2012BKJ022);安徽医科大学科学研究基金(No:2015xkj020)
胡伟,E-mail:ay2fyhuwei@qq.com;Tel:13856086475
