氧化还原反应问题解题规律归纳
2016-11-08安徽省灵璧黄湾中学华雪莹
安徽省灵璧黄湾中学 华雪莹
氧化还原反应问题解题规律归纳
安徽省灵璧黄湾中学华雪莹
氧化还原反应是中学化学中的一种重要反应类型。正确理解和准确把握氧化还原反应中的有关规律并能熟练运用,是学好这一知识点的关键。下面我们就一起来梳理氧化还原反应中的有关规律,希望同学们能够熟记并能正确运用。
一、守恒律
1.电子得失守恒
在氧化还原反应中,氧化剂得到电子的总数与还原剂失去电子的总数相等(或者说化合价升高总数与化合价降低总数相等)。
应用1计算氧化剂、还原剂、氧化产物、还原产物的多少。
例1KI与KIO3在酸性条件下可发生反应生成单质碘,问该反应中被氧化的碘元素与被还原的碘元素的质量之比是多少。
应用2确定氧化产物或还原产物中元素的价态。
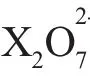
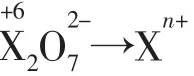
应用3配平氧化还原方程式
例3配平方程式:____P+___CuSO4+___H2O→__Cu3P+___H3PO4+___H2SO4。该反应中160 g CuSO4可氧化P的质量是________。
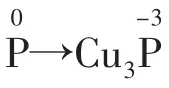
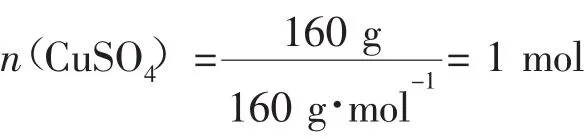
2.电荷守恒在氧化还原反应中,反应前后,阴、阳离子所带电荷的代数和相等。
3.原子守恒氧化还原反应与一般的反应一样,遵守质量守恒定律。
应用配平氧化还原方程式;进行氧化还原反应的有关计算;求某一反应中被氧化与被还原的原子数之比,或氧化剂与还原剂分子数之比,或氧化产物与还原产物分子数之比。
二、物质转换规律
在氧化还原反应中,氧化剂具有氧化性,在反应中得到电子被还原,发生还原反应,生成还原产物;还原剂具有还原性,在反应中失去电子被氧化,发生氧化反应,生成氧化产物。可用“双线桥法”表示氧化还原反应中电子的转移情况。
应用用于分析氧化还原反应中的氧化剂、还原剂及氧化产物、还原产物。
三、性质表现律(价态律)
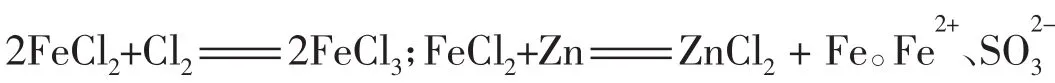
4.化合物含有多种元素,其性质是各种价态的元素性质的综合体现。如HCl中H处于最高价态+1价,遇金属等还原剂时可表现氧化性;其中的Cl处于最低价态-1价,遇到KMnO4、MnO2、KClO3、Ca(ClO)2等强氧化剂时表现还原性。
应用判断元素或物质的氧化性与还原性的有无。
四、价态转化规律
同一氧化还原反应中,有元素化合价升高的同时,必有元素化合价降低。根据这一规律,歧化反应中反应物价态应介于两产物价态之间,而归中反应中产物价态应介于两反应物价态之间。
应用判断氧化还原反应中元素化合价的高低。
1.邻位转化律在氧化还原反应中,元素相邻价态间的转化最容易进行。
(1)元素处于最低(或最高)价态,遇一般氧化剂(或还原剂)时转变至相邻价态。例如:
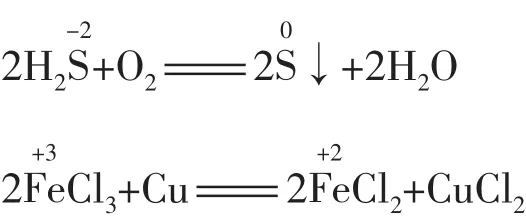
(2)元素处于中间价态,遇强氧化剂(或强还原剂)被氧化(或被还原)至相邻的高价态(或低价态)。例如:
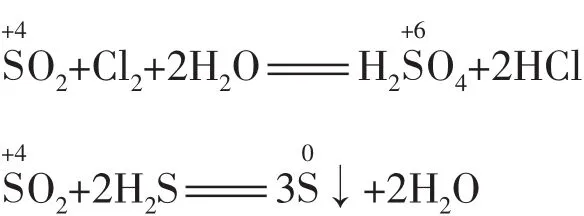
(3)元素处于中间价态时可发生歧化反应,且一般发生邻位转化(即歧化律)。例如:
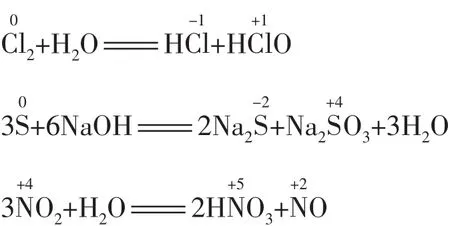
2.跳位转化律
(1)元素处于较低(或较高)价态时,遇强氧化剂(或强还原剂)发生跳位转化。例如:
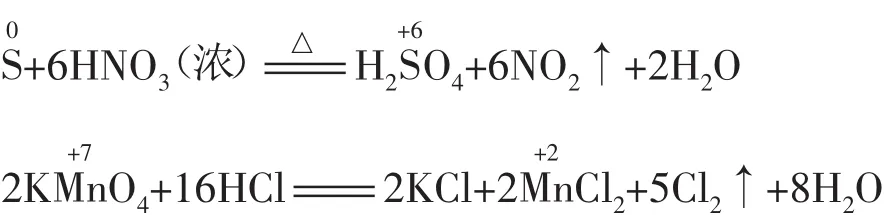
(2)当加剧反应条件(如升高温度、使用催化剂、增大反应物的浓度、增强酸性、增大反应物的量等)时,可发生跳位转化。例如:
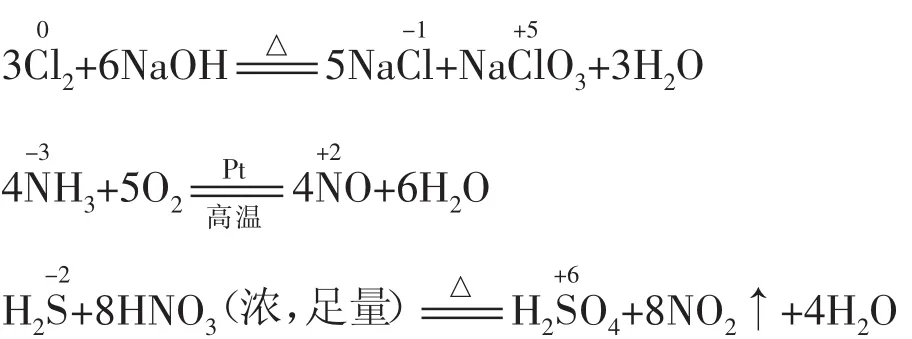
例4G、W、X、Y、Z均为含氯的化合物,它们在一定条件下具有如下的转化关系(方程式未配平且氯元素一定有价态变化)。
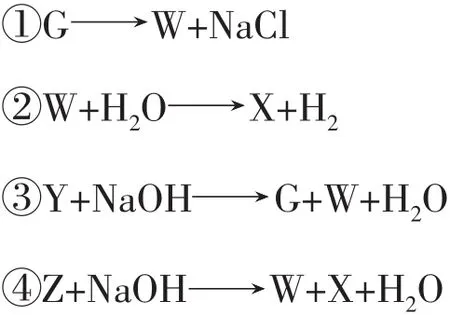
请判断G、W、X、Y、Z中氯元素化合价的高低。
3.互不交叉和换位规律
同种元素不同价态的物质之间发生反应(不考虑其他元素之间的反应,下同)时,产物的价态必介于两反应物的价态之间,且其变化是不交叉的。
(1)同种元素的相邻价态间不相互转化。例如:C与CO、CO与CO2、Fe与Fe2+、Fe2+与Fe3+,或S与H2S、S与SO2、SO2与H2SO4等均不反应(因此可用浓H2SO4干燥SO2)。
(2)同种元素不同价态的物质之间发生反应时,生成中间价态的物质,且只靠拢不交叉。也就是说,氧化产物与还原产物中该元素的化合价可能为同一中间价态,也可能不为同一价态,但一定介于氧化剂与还原剂中该元素的化合价之间(即归中律)。例如:
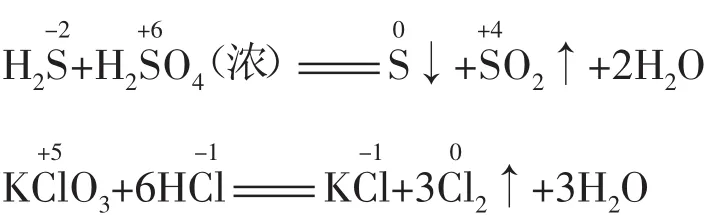
应用判断氧化还原反应能否发生、物质的变化以及预测反应的产物,判断氧化产物、还原产物及转移电子数。
川矢喝退刁德恒后,迅速换上一副笑脸,又叽哩呱啦地说了一通。庄槐翻译说:“尊敬的百里香阁下,因为刁队长的愚蠢和粗鲁,让您受到了莫大的污辱,在下深表不安和歉意!我将以此为戒,严惩不殆!”
五、性质强弱律(性质递变律)
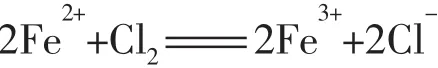
应用1判断反应能否发生。
例6判断下列反应能否进行,并说明原因。
(1)Fe2++CuFe+Cu2+
_______________________________________________。
(2)2Fe3++Cu2Fe2++Cu2+
________________________________________________。
解析 (1)因为氧化性Fe2+2+<Cu2+,还原性Cu<Fe,该反应不符合氧化还原反应的条件,所以该反应不能发生。
(2)因为氧化性Fe3+>Cu2+,还原性Cu>Fe2+,该反应符合氧化还原反应的条件,所以该反应能够发生。
应用2判断氧化性、还原性的强弱。
例7已知反应:
(1)I2+SO2+2H2OH2SO4+2HI
(2)2FeCl2+Cl22FeCl3
(3)2FeCl3+2HI2FeCl2+I2+2HCl
试判断I2、SO2、Cl2、FeCl3四种物质氧化能力的强弱。
解析根据氧化性:氧化剂>氧化产物,由反应(1)可得出:I2>H2SO4>SO2;由反应(2)可得出:Cl2>FeCl3;由反应(3)可得出:FeCl3>I2。综上所述可知四种物质氧化能力的强弱顺序为Cl2>FeCl3>I2>SO2。
2.在相同条件下,总是氧化性或还原性最强的微粒优先发生反应。例如:向含有Br-和I-的溶液中滴加氯水,则I-将优先被氧化;向含有Cu2+和Ag+的溶液中加入铁粉,则Ag+将优先被还原。
应用判断混合溶液中离子发生反应的顺序。
例8写出下列反应的离子方程式:
(1)FeBr2溶液中通入少量Cl2_______________________________,通入过量Cl2_______________________________。
(2)FeI2溶液中通入少量Cl2______________________________,通入过量Cl2_______________________________。
解析因Fe2+、Br-、I-都具有较强的还原性。当通入过量Cl2时,Fe2+、Br-、I-都可被Cl2所氧化,此时两溶液中反应相似,离子方程式分别为
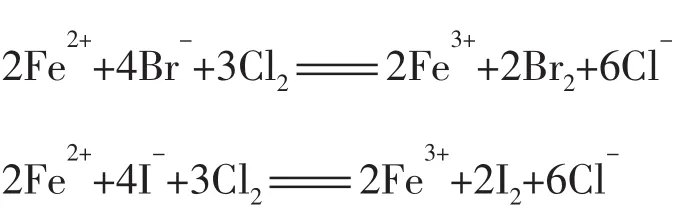
当通入少量Cl2时,由于还原性I->Fe2+>Br-,FeBr2溶液中只有Fe2+被氧化,离子方程式为
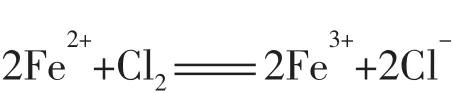
FeI2溶液中只有I-被氧化,离子方程式为
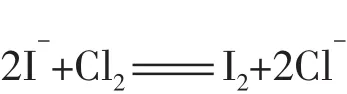

4.一般来说,酸性越强、浓度越大、温度越高,氧化剂的氧化性或还原剂的还原性越强。例如:KMnO4在酸性溶液中氧化性最强、中环境次之、碱环境中最弱;浓盐酸具有还原性,而稀盐酸没有;浓硫酸具有强氧化性,而稀硫酸没有;温度越高,碳的还原性越强等。
应用比较物质间氧化性或还原性的强弱;选择适宜条件下用氧化性较强的物质制备氧化性较弱的物质,或用还原性较强的物质制备还原性较弱的物质。
六、反应先后律(难易律)
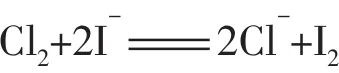
应用判断物质的稳定性及反应顺序。
七、反应方向律
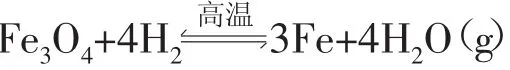
应用用于预测反应的可能性。
