干旱胁迫对小麦花药培养的影响
2016-11-08王剑虹罗俊杰欧巧明叶春雷
王 炜,王剑虹,罗俊杰,陈 琛,欧巧明,叶春雷
(1.甘肃省农业科学院生物技术研究所,甘肃兰州 730070; 2.兰州职业技术学院生物工程系,甘肃兰州 730070)
干旱胁迫对小麦花药培养的影响
王 炜1,王剑虹2,罗俊杰1,陈 琛1,欧巧明1,叶春雷1
(1.甘肃省农业科学院生物技术研究所,甘肃兰州 730070; 2.兰州职业技术学院生物工程系,甘肃兰州 730070)
为拓宽抗旱春小麦花培育种的亲本资源,明确干旱胁迫对小麦花药培养的影响,对甘肃省主栽的7个抗旱春小麦品种的花药培养特性进行了研究,并对筛选出的兼具较强抗旱性和优良花药培养特性的品种陇春27号及其他三个优良花培材料,通过诱导培养基中添加120 mg·L-1的PEG及旱地种植,进而进行花药培养。结果表明,供试的4个小麦基因型材料的愈伤组织诱导均受到抑制,但受抑制的程度不同,其抗旱系数排序在两种干旱胁迫处理下高度一致;田间抗旱性鉴定结果表明,4个基因型材料的抗旱性强弱不同;其愈伤组织的抗旱系数与抗旱性之间显著相关。
小麦;花药培养;干旱胁迫;抗旱性
小麦是干旱和半干旱地区的主要作物。近年来由于气候变暖、环境恶化等原因导致我国干旱天气频发,对小麦生产造成巨大损失[1]。选育抗旱品种是应对干旱胁迫最为经济有效的手段[2]。目前小麦抗旱育种多采用常规杂交方法。小麦花培育种具有快速获得纯系材料、缩短育种周期等优点。自1973年成功获得花药单倍体植株以来,国内外相关研究者利用该技术相继育成了多个小麦品种和一大批种质材料,目前已成为常规育种方法的重要补充[3]。然而,花药培养技术在小麦抗旱育种中的应用仍然比较欠缺,原因之一在于小麦花药培养具有显著的基因型依赖性[4-5],兼具较强抗旱性和优良花药培养特性的材料较少,配制杂交组合时相对受限,进一步限制了该技术在小麦抗旱育种中的应用[6]。
供试材料的生理状态也是影响小麦花药培养效果的重要因素[7-8]。供试材料的生理状态主要受温度、光照、土壤水分等因素影响[5]。目前的研究一般认为,未受逆境胁迫条件下种植的供试材料其花药发育良好,有利于提高花药培养效率[9-10];对于小麦抗旱品种(系)而言,大部分材料的株高较高,若采用与水地材料一样的常规田间管理或所受的干旱胁迫程度较轻,则往往因为植株倒伏导致花药发育不良或取材困难,花药培养效果反而较差。PEG作为一种渗透胁迫物质,广泛用于模拟水分胁迫进行植物萌发期的抗旱性鉴定,以及离体胁迫诱导和抗旱植株筛选。研究表明,在小麦的花药培养中,诱导培养基中加入低浓度的PEG溶液能够显著提高花药愈伤组织诱导率,加入高浓度的PEG则具有明显的抑制作用,且这种低促高抑的作用和幅度与供试材料的抗旱性有关[11-12]。许多研究表明,在小麦、大麦等作物的离体培养中,组织细胞对逆境胁迫的反应与植株水平上的反应往往存在一致性[13-16]。这种一致性为利用离体胁迫培养方法改良作物相关抗逆性状提供了理论依据。基于以上原因,本研究通过研究甘肃省主栽抗旱春小麦品种的花药培养特性,以筛选兼具优良抗旱性及优良花药培养特性的基因型;同时,以4个抗旱性不同的春小麦基因型为材料,分别研究诱导培养基中添加PEG溶液及田间干旱胁迫种植条件对小麦花药培养的影响,并进一步研究植株水平的抗旱性与小麦花药培养的反应水平之间的相关性,旨在为促进花药培养方法在抗旱育种中的应用以及进行抗旱性离体鉴定和筛选提供依据。
1 材料与方法
1.1供试材料
2014年进行抗旱春小麦花药培养特性鉴定试验。供试材料为陇春22号、陇春27号、西旱2号、定西35号、定西38号、定西41号、定西42号,由甘肃省农业科学院小麦研究所、生物技术研究所以及定西市农业科学院等单位提供。这些材料均被以往的研究证明具有较强的抗旱性,且大部分为近年来甘肃省中部干旱和半干旱地区主栽的抗旱春小麦品种。
2015年进行干旱胁迫对小麦花药培养影响的研究,以及植株水平的抗旱性与小麦花药培养的反应水平之间相关性的研究。供试材料为陇春27号、陇春31号、4-8、9614。这4份材料均具有优良的花药培养特性,其中,陇春27号为2014年试验中所筛选的材料;陇春31号、4-8、9614为本实验室使用多年的优良花培材料,在以往的田间试验中观察到这四份材料抗旱性强弱不同。当年将上述材料种植于甘肃省农业科学院小麦细胞工程育种试验田(兰州),5行区,行长1.2 m,每行均匀点播126粒,行距0.20 m,随机区组设计,3次重复。将其分设为旱地处理和灌水处理(对照)。旱地处理全生育期完全依靠自然降水。甘肃兰州地区2015年3月-7月春小麦生育期内降水量约为146.1 mm,属于较为干旱的年份;灌水处理于分蘖期、灌浆期各灌溉1次,共2次。
1.2方 法
挑选每个材料中花药大小一致且其中绝大多数小孢子处于单核后期的小麦幼穗,在4 ℃冰箱中低温处理2 d,接种之前用75%的酒精喷雾进行表面消毒,无菌水冲洗3次。取麦穗中部至2/3之间的小穗,将其花药接种于诱导培养基上;置培养箱中32 ℃处理7 d后调至24 ℃进行暗培养,待愈伤组织大小约2~3 mm时转至分化培养基上,置24 ℃、光16 h/暗8 h条件下分化培养。每份材料接种5瓶,每瓶接种60枚花药,重复3次。诱导培养基:W14+2,4-D(2.0 mg·L-1)+KT(0.5 mg·L-1)+AGP(400 mg·L-1)+蔗糖(90.0 g·L-1);分化培养基:MS+ KT(2.0 mg·L-1)+IAA(0.15 mg·L-1)+蔗糖(30.0 g·L-1)。
PEG胁迫试验:取灌水处理下种植材料的花药进行培养,诱导培养基为上述诱导培养基中添加PEG(120 mg·L-1);田间干旱胁迫试验:取旱地处理下种植材料的花药进行培养。两个试验中所用的对照相同,均取灌水处理下种植材料的花药进行培养。
1.3统计指标
愈伤组织诱导率=产生的愈伤组织块数/接种花药数×100%
(1)
绿苗分化率=分化绿苗数/转分化愈伤数×100%
(2)
绿苗生产率=分化绿苗数/接种花药数×100%
(3)
抗旱系数:PI=Xs/Xr
(4)

(5)

1.4数据统计与分析
采用Excel 2003和SPSS 19.0软件进行数据统计分析。方差齐性检验用Duncan法检测,非齐性检验用Tamhane’s T2法检测[5]。
2 结果与分析
2.1抗旱春小麦品种的花药培养特性
7个抗旱春小麦品种花药培养的结果表明,除定西35号外,其余6个品种均可诱导出愈伤组织,其中陇春27号的诱导率最高,其余依次分别为陇春22号、定西42号、定西38号、定西41号和西旱2号。在分化培养中,3个品种分化出绿苗,其中陇春22号的绿苗分化率最高,其次为陇春27号,但两者没有显著性差异;定西42号最低。绿苗生产率是反映花药培养效率的重要指标,陇春27号依然最高(9.11%),并与陇春22号和定西42号之间具有显著性差异(P<0.05)。赵林姝等[17]在小麦花药培养研究中将同时在愈伤组织诱导率、绿苗分化率和绿苗生产率上分别达到12%、21%及8%以上的材料认为具有高花药培养力。以此作为参考标准,可以看出,在供试的7个品种中,仅有陇春27号达到这一标准。

表1 抗旱春小麦品种的花药培养特性Table 1 Anther cultural characteristics of spring wheat varieties with drought resistance
数值后的不同字母表示品种间存在显著差异(P<0.05)。下同
Different letters mean significant difference among varieties at 0.05 level.The same as below
2.2干旱胁迫对春小麦花药培养的影响
由表2可见,在正常种植环境下,4份供试材料的花药愈伤组织诱导率从高到低依次分别为陇春31号、9614、4-8和陇春27号,且相互之间具有显著差异,这进一步证明了小麦花药培养的基因型依赖性。无论是在诱导培养基中添加120 mg·L-1的PEG,还是采集旱地条件下供试材料的花药进行培养,其愈伤组织诱导率较对照均有不同程度的下降,并且在后一种条件下降的整体幅度更大。本试验中这两种环境均达到了适度干旱胁迫的目的,也显示出不同基因型对干旱胁迫的花药培养反应水平亦不相同。在两种干旱胁迫条件下,4个基因型材料愈伤组织抗旱系数排序完全一致,由高到低均依次分别为陇春27号、4-8、陇春31号和9614。
2.3春小麦品种(系)的田间抗旱性
抗旱系数和抗旱指数被公认为是小麦抗旱性鉴定最重要的指标。本研究对4个春小麦品种(系)的抗旱性鉴定结果(表3)表明,供试材料的产量抗旱系数与抗旱指数排序一致,以陇春27号的抗旱性最强,其次为4-8,陇春31号再次之,9614最弱。这与多年田间观察的表现基本一致。
2.4春小麦品种(系)的田间抗旱性与花药培养特性的相关性
结合表2和表3可以看出,4个供试品种(系)的愈伤组织抗旱系数与产量抗旱指数或抗旱系数的排序高度一致。相关分析结果(表4)表明,诱导培养基中加入120 mg·L-1PEG胁迫下愈伤组织抗旱系数与产量抗旱系数呈极显著相关(P<0.01),与产量抗旱指数呈显著相关(P<0.05);而在旱地处理下愈伤组织抗旱指数与产量抗旱系数和抗旱指数均呈显著相关(P<0.05)。这说明在本试验小麦花药培养中对干旱胁迫的反应水平可以较准确地反映供试材料的抗旱性。
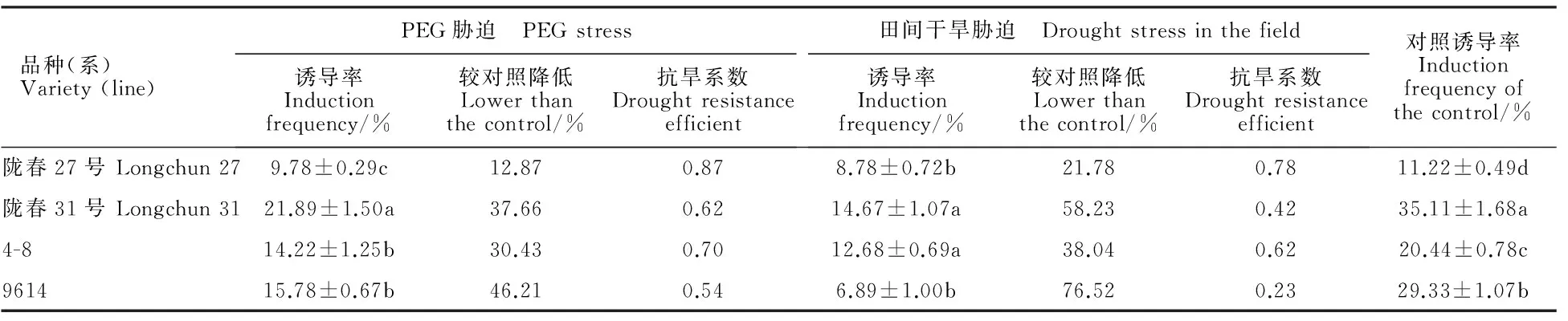
表2 干旱胁迫对春小麦花药愈伤组织诱导的影响Table 2 Effects of drought stress on the anther callus induction in spring wheat

表3 春小麦品种(系)的产量及田间抗旱性Table 3 Grain yield and drought reisitance in spring wheat varieties(lines)
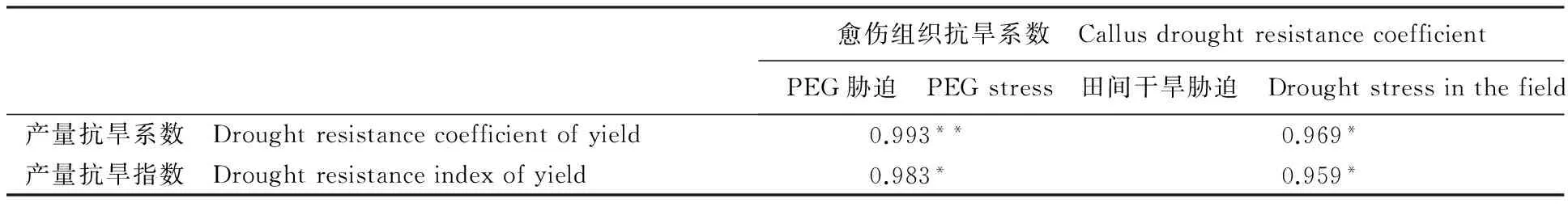
表4 春小麦抗旱性与花药培养特性的相关性Table 4 Correlation between drought resistance and callus drought resistance coefficient in spring wheat
*表示显著相关(P<0.05);**表示极显著相关(P<0.01)
* means the correlation is significant at 0.05 level; ** means the correlation is significant at 0.01 level
3 讨 论
3.1优良花药培养特性抗旱春小麦种质的鉴定
国内外的研究普遍认为,小麦的花培育种中亲本的选配是获得成功的关键因素之一;双亲或亲本之一需要具备优良的花药培养特性[6,18]。因此,鉴定和筛选优良花药培养特性的基因型是小麦花培育种中的基础性工作。目前,尽管相关研究者已鉴选出一大批具备优良花药培养特性的基因型材料[19-21],然而其中抗旱性较强的材料为数甚少。本研究对近年来甘肃省中部干旱和半干旱地区主栽的7个抗旱春小麦品种(系)的花药培养特性进行了研究,结果表明这些材料总体花药培养效果较差,愈伤组织诱导率最高为12.89%,而且其中4份材料的愈伤组织均未分化出绿苗。倪胜利等[22]研究结果表明,14份抗旱小麦中,愈伤组织诱导率最高的也仅为8.12%。由此可见,综合性状优良且兼具抗旱性强和花药培养特性优良的材料是较为稀缺的。本研究筛选出的陇春27号具有优良的花药培养特性,该品种综合性状优良、抗旱性强,是目前西北地区最具潜力的旱地春小麦接班换代品种[23],因此可作为重要的亲本材料在今后的抗旱小麦花培育种及构建抗旱DH永久作图群体中应用。
3.2干旱胁迫对小麦花药培养的影响
利用培养基中的渗透胁迫模拟干旱胁迫是离体筛选抗旱材料的一种常用方法,在体细胞无性系变异及小麦花药培养中均有应用[24-25]。本研究结果表明,诱导培养基中添加120 mg·L-1的PEG在不同程度上抑制了4个基因型材料愈伤组织的产生,这与刘桂茹等[11]、杨 雪等[12]的研究结果并不十分一致,在他们的研究中该浓度下的PEG仍然可以促进部分材料愈伤组织的产生。其原因可能在于供试材料的基因型及培养条件的差异所致。本研究还表明,在旱地处理(雨养)种植条件下,所有材料的愈伤组织诱导均受到抑制,不同基因型受抑制的程度不同,这说明本研究中的种植环境对小麦花药培养而言已构成了一定程度的干旱胁迫。
供试的4个基因型材料的愈伤组织抗旱系数尽管在两种干旱胁迫环境下的排序高度一致,然而应当属于不同水平对干旱胁迫的反应。PEG胁迫试验中,小麦花药愈伤组织的形成与花药中小孢子细胞对干旱胁迫的耐受力相关;而田间干旱胁迫试验中,愈伤组织的形成则与孕穗期花药组织对干旱胁迫的耐受力相关。对旱地处理(雨养)条件下采集的麦穗和花药形态观察初步表明(结果未列出),与对照(灌溉)相比,总体供试材料的小穗数减少、花药变小,花药发育阶段提前。因此可以推测,田间干旱胁迫导致的花药发育不良是该环境下愈伤组织诱导率降低的主要原因之一。花药培养对不同干旱胁迫环境的响应的一致性原因或许是两种干旱胁迫对供试材料花药培养的影响程度较为吻合。
3.3愈伤组织抗旱系数与春小麦抗旱性的相关性
作物的抗旱性是一种复杂的数量性状,可以在多个阶段和多个层面表现出来,而在最终产量中得到综合体现。本研究结果表明,在两种干旱胁迫环境下,不同基因型小麦材料在花药愈伤组织水平上对干旱胁迫的耐受力存在明显差异,而这种耐受力可以通过愈伤组织抗旱系数得到体现。相关分析表明,供试基因型材料的愈伤组织抗旱系数与其抗旱性之间显著相关。这与刘桂茹等[11]在小麦上的研究及张艳敏等[26]在水稻上的研究结果相似。由于本研究中田间干旱胁迫反映的是供试基因型孕穗期的抗旱性,而籽粒产量的抗旱指数和抗旱系数反映的是全生育期的抗旱性[27],因而本研究结果进一步表明小孢子细胞对干旱胁迫的培养反应与供试基因型孕穗期及全生育期的抗旱能力相关。其确切的机理,还需要从生理生化及分子水平上深入研究。
[1]赵 慧,张 玮,王 静,等.外源基因导入改良小麦抗旱性的研究进展 [J].中国生态农业学报,2013,21(3):267-273.
Zhao H,Zhang W,Wang J,etal.Research progress on improving wheat drought tolerance via exotic gene introduction [J].ChineseJournalofEco-Agriculture,2013,21(3):267-273.
[2]周永斌.转W16小麦回交株系基因表达特性及其抗旱机制研究 [D].杨凌:西北农林科技大学,2012.
Zhou Y B.The expression of W16 in the backcross lines of transgenic bread and its relation with drought tolerance [D].Yangling:Northwest A&F University,2012.
[3]Xin Z Y,He Z H,Ma Y Z,etal.Crop breeding and biotechnology in China [J].JournalofNewSeeds,1999,1(1):67-80.
[4]白延红,刘 莉,李春莲,等.蔗糖、激素及基因型对小麦花药培养的影响 [J].麦类作物学报,2006,26(3):67-70.
Bai Y H,Liu L,Li C L,etal.Effect of sucrose and hormone on culture characteristics of wheat anthers [J].JournalofTriticeaeCrops,2006,26(3):67-70.
[5]韩晓峰,陶丽莉,殷桂香,等.基因型和环境条件对小麦花药培养效果的影响 [J].作物学报,2010,36(7):1209-1215.
Han X F,Tao L L,Yin G X,etal.Effect of genotype and growing environment on anther culture in wheat [J].ActaAgronomicaSinica,2010,36(7):1209-1215.
[6]康明辉,海 燕,黄冰艳,等.从花培品种的选育谈小麦花培育种策略 [J].麦类作物学报,2009,29(3):548-551.
Kang M H,Hai Y,Huang B Y,etal.Breeding strategy for wheat variety derived by anther culture [J].JournalofTriticeaeCrops,2009,29(3):548-551.
[7]王 培,陈玉蓉.冬小麦的不同生育条件对其花粉植株诱导频率的影响 [J].遗传学报,1980,7(1):64-70.
Wang P,Chen Y R.Effects of growth conditions of anther-donor plants on the production of pollen plants in wheat anther culture [J].ActaGeneticaSinica,1980,7(1):64-70.
[8]Maluszynski M,Kasha K J,Forster B P,etal.Doubled Haploid Production in Crop Plants:A Manual[M].Dordrecht:Kluwer Springer,2003.
[9]隋新霞,樊庆琦,李根英,等.小麦花药培养研究进展 [J].麦类作物学报,2005,25(4):923-927.
Sui X X,Fan Q Q,Li G Y,etal.Review on wheat anther culture [J].JournalofTriticeaeCrops,2005,25(4):923-927.
[10]Cistué L,Kasha K J.Gametic Embryogenesis inTriticum:a Study of Some Critical Factors in Haploid(Microspore) Embryogenesis [M]//In:Mujib A,amaj J.Somatic Embryogenesis.Berlin Heidelberg:Springer-Verlag,2006:321-342.
[11]刘桂茹,葛淑俊,王静华,等.PEG对小麦花药出愈率的影响 [J].河北农业大学学报,2001,24(4):25-27.
Liu G R,Ge S J,Wang J H,etal.The effect of PEG on the initiating rate of the anther culture in wheat [J].JournalofAgriculturalUniversityofHebei,2001,24(4):25-27.
[12]杨 雪,刘春雷,王 丁,等.低温预处理和聚乙二醇处理对小麦花药出愈率的影响 [J].河南农业科学,2015,44(4):49-51.
Yang X,Liu C L,Wang D,etal.Effects of low temperature pretreatment and PEG on callus induction rate of wheat anther [J].JournalofHenanAgriculturalSciences,2015,44(4):49-51.
[13]侯建华,耿庆汉,胡荣海.水分胁迫对冬小麦愈伤组织的影响 [J].华北农学报,1992,7(4):52-56.
Hou J H,Geng Q H,Hu R H.The effect of water stress upon callus of winter wheat [J].ActaAgriculturaeBoreali-Sinica,1992,7(4):52-56.
[14]邵艳军,李广敏,辛春艳.水分胁迫对不同抗旱性冬小麦愈伤组织的影响 [J].华北农学报,2000,15(1):47-52.
Shao Y J,Li G M,Xin C Y.Effect of water stress on the winter wheat callus [J].ActaAgriculturaeBoreali-Sinica,2000,15(1):47-52.
[15]孙月芳,陆瑞菊,王亦菲,等.大麦花药离体诱变及铝胁迫下的培养反应 [J].核农学报,2005,19(2):95-98.
Sun Y F,Lu R J,Wang Y F,etal.Response of anther culture in vitro to irradiation of spike and culturing with Al stress in barley [J].JournalofNuclearAgriculturalSciences,2005,19(2):95-98.
[16]陆瑞菊,陈志伟,何 婷,等.两份大麦品种单倍体细胞与植株水平耐盐性的关系 [J].核农学报,2011,25(2):226-230.
Lu R J,Chen Z W,He T,etal.Relationship of NaCl tolerance between haploid cell level and plant level in two barley cultivars [J].JournalofNuclearAgriculturalSciences,2011,25(2):226-230.
[17]赵林姝,刘录祥,郭会君,等.三个高花药培养力小麦材料培养力性状的配合力分析 [J].麦类作物学报,2012,32(3):427-430.
Zhao L S,Liu L X,Guo H J,etal.Combining ability analysis on anther culture traits of three wheat genotypes with high regeneration ability [J].JournalofTriticeaeCrops,2012,32(3):427-430.
[18]Zhao L S,Liu L X,Wang J,etal.Development of a new wheat germplasm with high anther culture ability by using a combination of gamma-ray irradiation and anther culture [J].JournaloftheScienceofFoodandAgriculture,2015,95(1):120-125.
[19]姜秀芳,郑继周,邓春霞,等.小麦花培材料的筛选和利用 [J].中国农学通报,2005,21(2):62-64.
Jiang X F,Zheng J Z,Deng C X,etal.Usage and selection of wheat anther culture response materials [J].ChineseAgriculturalScienceBulletin,2005,21(2):62-64.
[20]吕学莲,白海波,蔡正云,等.小麦花药培养的基因型效应及优良基因型筛选 [J].中国农学通报,2011,27(33):13-17.
Lü X L,Bai H B,Cai Z Y,etal.Effect of genotype on wheat anther culture and selection of choiceness genotype [J].ChineseAgriculturalScienceBulletin,2011,27(33):13-17.
[21]刘宁涛.小麦花药培养效率改进和基因型筛选研究 [D].北京:中国农业科学院,2013.
Liu N T.Study on the improvement of culture efficiency and genotypes screening in the anther culture of wheat [D].Beijing:Chinese Academy of Agricultural Sciences,2013.
[22]倪胜利,李 唯,李 胜,等.影响旱作小麦高效花药培养的因素 [J].甘肃农业大学学报,2004,39(2):141-145.
Ni S L,Li W,Li S,etal.Factors influencing on high efficiency anthers culture of wheat in dryland [J].JournalofGansuAgriculturalUniversity,2004,39(2):141-145.
[23]杨文雄,刘效华,杨芳萍,等.抗旱丰产小麦新品种陇春27号选育研究 [J].干旱地区农业研究,2010,28(6):136-141.
Yang W X,Liu X H,Yang F P,etal.Study on breeding of a new spring wheat variety Longchun 27 with drought resistance and high yield [J].AgriculturalResearchintheAridAreas,2010,28(6):136-141.
[24]许凤芹.小麦花药幼胚离体培养筛选抗旱无性系的研究 [D].保定:河北农业大学,2005.
Xu F Q.Studies oninvitroculture anther and immature embryo of wheat to select drought resistance asexuality line[D].Baoding:Hebei Agricultural University,2005.
[25]Sharma S,Chaudhary H K,Sethi G S.Invitroandinvivoscreening for drought tolerance in winter×spring wheat doubled haploids derived though chromosome elimination [J].ActaAgronomicaHungarica,2010,58(3):301-312.
[26]张艳敏,高润红,李 梁,等.水稻花药水分胁迫培养反应与植株水平抗旱性间的关系 [J].植物生理学报,2011,47(12):1188-1194.
Zhang Y M,Gao R H,Li L,etal.Relationship between anther culture response and plant drought tolerance of rice(OryzasativaL.) under water stress [J].PlantPhysiologyJournal,2011,47(12):1188-1194.
[27]周国雁,伍少云.不同云南小麦种质资源的全生育期抗旱性及与主要农艺性状的相关性 [J].华南农业大学学报,2013,34(3):309-314.
Zhou G Y,Wu S Y.Drought resistance of diverse wheat germplasm response during whole growing period in Yunnan province and relativity with main agricultural traits [J].JournalofSouthChinaAgriculturalUniversity,2013,34(3):309-314.
Effect of Drought Stress on Wheat Anther Culture
WANG Wei1,WANG Jianhong2,LUO Junjie1,CHEN Chen1,OU Qiaoming1,YE Chunlei1
(1.Bio-technology Institute,Gansu Academy of Agricultural Sciences,Lanzhou,Gansu 730070,China;2.Bioengineering Department of Lanzhou Vocational Technology College,Lanzhou,Gansu 730070,China)
In order to broaden the genotypes of crossing parents potentially used in the anther culture breeding spring wheat with drought resistance and expore the effects of drought stress on wheat anther culture,the anther culture characteristics of seven wheat varieties cultivated in Gansu were evaluated and the one (Longchun 27) with both strong drought reisistance and elite anther characteristics was selected and then with simulating the drought stress by adding 120 mg·L-1PEG into the induction medium and the donor materials (Longchun 27 and other three elite anther culture materials) growing in the condition of drought stress in the field,the anthers were cultured and the effects of drought stress on anther culture were studied.The result showed that the callus induction inhibited in all of the four donor genotypes,but the extent of inhibition was not identical in these genotypes. The rank of callus drought resistance coefficient in the two drought stress conditions was highly consistent. Drought resistance of the four genotypes was evaluated in the field and it was not identical for each of these materials. Correlation analysis of callus drought resistance coefficient and drought resistance showed significant correlation between them.
Wheat; Anther culture; Drought stress; Drought resistance
时间:2016-05-10
2015-11-10
2015-12-08
甘肃省农科院农业科技创新基金项目(2013GAAS27);甘肃省农业生物技术研究与应用开发项目(GNSW-2014-15);甘肃省农科院科技创新工程学科团队项目(2014GAAS06;2015GAAS02)
E-mail:haploidbreeding@163.com
叶春雷(E-mail:ycl_81@sina.com)
S512.1;S311
A
1009-1041(2016)05-0641-06
网络出版地址:http://www.cnki.net/kcms/detail/61.1359.S.20160510.1625.030.html
