GST融合蛋白活性测定条件的优化*
2016-11-08梁斌,谢琦
梁 斌,谢 琦
(桂林医学院生物技术学院,广西桂林 541004)
技术方法
GST融合蛋白活性测定条件的优化*
梁斌,谢琦△
(桂林医学院生物技术学院,广西桂林541004)
谷胱甘肽硫转移酶;分光光度法;活性测定
谷胱甘肽硫转移酶(GST,EC2.5.1.18)是一种广泛分布于动植物和微生物体内,具有多种生理功能的同工酶家族。在医学研究中,由于它是生物体内重要的解毒酶系,其在体内活性的高低与代谢环境致癌物和化疗药物能力之间的关系受到人们的关注[1]。在基因工程研究中,GST的基因已被克隆和表达,GST可被作为一种融合表达蛋白来提高重组蛋白的可溶性表达,与GST融合的重组蛋白很容易利用GST标签,通过亲和层析进行纯化,所以各种带有GST标签的重组蛋白被大量表达。在各种与GST相关的研究中,都涉及到GST酶活性的测定。目前,建立的GST酶活性测定方法有分光光度法、荧光底物法、滴定法、重叠氮法、氰化物法、对硝基酚法等。张丹参等[2]比较了上述方法后认为,以1-氯-2,4-二硝基苯(CDNB)和还原型谷胱甘肽(GSH)为底物的分光光度法具有操作简便,灵敏度高,稳定性好的优势。我学院在参照Habdous等[3-4]建立的以CDNB和GSH为底物的分光光度法的基础上,针对基因工程研究中大量使用的带有GST标签的融合蛋白的酶活测定条件进行了优化。
1 材料与方法
1.1材料大肠杆菌BL21(DE3)[PGEX-4T-1],携带重组胸腺肽Tα1-TP5基因, 由本实验室构建[5]。CDNB(1-氯-2,4-二硝基苯), 购自SIGMA公司。GSH(还原型谷胱甘肽),购自上海生工。大肠肝菌培养基:酵母粉2.4%,蛋白胨1.2%,甘油0.4%,磷酸二氢钾17mmol/L,磷酸氢二钾72mmol/L,硫酸镁1mmol/L,高压灭菌时磷酸盐和硫酸镁与其它组分分开,待溶液冷却至60℃以下后混合。
1.2实验方法
1.2.1GST-Tα1-TP5融合蛋白的粗提:500ml三角瓶装大肠杆菌培养基100ml,接种量0.5%,37℃、250r/ min摇床培养,2.5h后加终浓度1g/L乳糖诱导,继续培养6h后离心收集菌体。用0.1mol/LPBS重悬菌体,冰浴超声破碎10min(工作30s,间歇30s),破碎后在14000r/min下冷冻离心10min,所得上清中含有GST-Tα1-TP5融合蛋白,即为粗酶液。
1.2.2GST活性测定:
1.2.2.1酶活测定步骤:样品管和空白管分别配底物溶液4ml,混匀,在设定的温度中保温5min; 样品管加入酶样20μl,立刻计时,空白管加入PBS 20μ l,5min 时分别向样品管、空白管加入终止剂后混匀。用1cm的石英比色杯于340nm处测定样品管和空白管的OD值,计算差值△OD。
1.2.2.2GST活性计算:在特定条件下,每分钟催化1μmol/L的CDNB与GSH结合的GST的量为 GST活力。
GST活力(U/L)=(△OD/t)×TV×106/(ε×d×SV)
上式中,t:反应时间(min); TV:反应总体积(ml);106:摩尔分子换算成微摩尔分子;ε:产物在340nm处摩尔吸光系数为9.6×103mol/cm;d:比色杯光径(cm);SV:样品量(ml)。
1.2.3GST酶活测定反应条件优化:
1.2.3.1酶促反应终止方法的选择:根据GST酶促反应的机制,催化反应的第一步是GSH的去质子化,生成H+和GS-,酸性条件可抑制GSH的去质子化,不利于反应的进行,而且在pH值较小的情况下,GST酶变性失活,酶促反应终止。因此采用加酸的方法终止酶促反应:选择5mol/L的盐酸和5mol/L的硫酸作为酶促反应终止剂,按1.2.2.1的方法,在酶促反应5min后加入5μ l,10μ l,15μ l,20μ l,40μ l,100μ l的盐酸或硫酸,30min内每隔30秒测定吸光值的变化情况。
1.2.3.2底物浓度的选择:根据1.2.3.1的结果,终止剂选择5mol/L的盐酸,加入量为40 μl。以下实验采用此条件。反应体系采用0.1mol/L,pH6.5的PBS缓冲液,反应温度30℃,固定酶量和固定一个底物浓度,另一个底物的浓度分别选择1.0、1.5、2.0、2.5 mmol/L,按1.2.2.1的方法测定酶活,观察不同底物浓度与酶活性的关系。
1.2.3.3反应温度的选择:按1.2.2.1的方法,采用最佳的底物浓度,单因素改变反应温度,分别为25℃、30℃、37℃、45℃,观察不同反应温度与酶活性的关系。
1.2.3.4 pH的选择:按1.2.2.1的方法,采用以上实验确定的最优反应条件,单因素改变PBS缓冲液的pH,分别为6.5、7.0、7.5,观察不同反应pH条件与酶活性的关系。
1.2.3.5反应体系缓冲液浓度的选择:按1.2.2.1的方法,采用以上实验确定的最优反应条件,单因素改变反应体系缓冲液的终浓度,分别为0.05、0.1、0.2、0.3、0.4 mol/L,观察反应体系的离子强度与酶活性的关系。
1.2.3.6反应条件优化前后GST酶活测定结果的比较:文献[2-5]中采用以CDNB和GSH为底物的分光光度法测定GST酶活的反应条件各有不同,其中常用的反应条件是:底物浓度CDNB和GSH均为1mmol/L,缓冲溶液采用pH=6.5,0.1mol/L磷酸盐缓冲液,温度采用30℃,反应时间5min。本实验也是在此基础上进行优化。取两份酶样,分别用上述反应条件和优化后的反应条件测定,比较测定结果。
2 结果与分析
2.1酶促反应终止方法的选择在4ml的反应体系中,当加入5mol/L的盐酸≧40μl或5mol/L的硫酸≧20μl后,反应体系的吸光值基本保持不变,且在30min内保持稳定,说明当反应体系的pH小于1后,CDNB与GSH混合后发生的不论是自发反应还是酶促反应均有效终止。在340nm处,硫酸和盐酸的光吸收近似为零,对产物的测定无影响。考虑到应尽量不往反应体系里增加新的离子或基团,因此选择盐酸为终止剂。
2.2最适底物浓度:通过对两种底物在不同浓度下进行交叉实验发现,GSH浓度与CDNB浓度越大对应的GST酶活力也越大,但是当CDNB浓度>3mmol/L时,反应体系开始变浑浊。当CDNB的浓度为2.5mmol/L,GSH浓度>3mmol/L时,样品与空白对应的吸光度的差值△OD不再稳定,而当GSH浓度与CDNB浓度各为2.5mmol/L时,对应的GST酶活性值最大且稳定。因此,最适底物浓度为GSH 2.5mmol/L,CDNB 2.5mmol/L。实验结果见图1。

图1 底物浓度对GST酶活的影响
2.3最适反应温度在25℃-37℃范围内,随着温度升高,GST酶的活性也随之升高,45℃时由于酶失活速率加快等因素,酶活性下降,选择该酶的最适反应温度为37℃。结果见图2。

图2 温度对GST酶活的影响
2.4最适pH通过测定pH为6.5、7.0、7.5时对应的样品与空白实验的吸光值,发现随着pH值的增大,不论是自发反应还是酶促反应,反应速率都随之增大。但二者的吸光度的差值在pH7.0时最大,可见,pH7.0为本实验所用酶的最适反应pH。结果见图3。

图3 pH对GST酶活的影响
2.5PBS缓冲液浓度的选择反应体系的离子强度是影响酶促反应速率的因素之一。通过测定在酶活性测定的时间内反应体系的pH,发现当PBS缓冲液的浓度大于0.05 mol/L时,反应体系的pH保持不变。本实验通过改变磷酸盐缓冲液的浓度,研究反应体系的离子强度对酶促反应速率的影响,PBS缓冲液的浓度为0.1mol/L时最优。结果见图4:

图4 离子强度对GST酶活的影响
2.6反应条件优化前后GST酶活测定结果的比较取两份酶样,分别用优化前后两种反应条件进行酶活测定。从实验结果可知,在优化后的酶活测定条件下,测定结果的酶活性要高于优化前3-4倍,可提高检测结果的灵敏度。结果见图5。
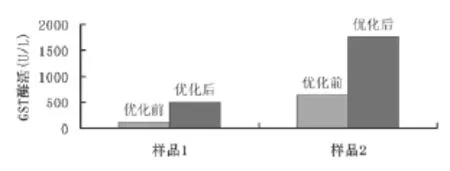
图5 优化前后酶活测定结果的比较
3 讨论
谷胱甘肽硫转移酶广泛存在于各种生物组织细胞液中,是一个具有多种同工酶的超基因Ⅱ相代谢酶家族,参与外来化学物质,包括致癌物、致突变物和药物等的代谢,具有多种生理功能。人们对不同来源的GST酶展开了各种研究,对其活性进行测定是研究的重要组成部分。由于不同来源的GST酶具有不同的理化性质,可表现出不同的催化特性,在催化以CDNB和GSH为底物的反应时,最适反应条件也会有差异。因此,不同的研究人员在研究如:人的血清[3]、海洋双壳类动物[6]、大鼠的肝脏[2]等来源的GST酶时,优化后的最适反应条件是各不相同的。
本实验研究的是在基因工程领域被广泛应用的GST融合表达载体,携带的是日本血吸虫GST基因,其表达的GST融合蛋白具有完全的GST酶活。通过实验优化了GST融合蛋白活性测定的反应条件,提高了测定的灵敏度。本实验测定酶活时采用的是固定时间法,通过添加一定量的盐酸来终止反应,与连续动态测定法相比,优点是操作简单,对仪器设备要求不高。优化后的酶活性测定方法具有简便、快速、灵敏、稳定等特点,为GST融合蛋白的进一步系统研究奠定了方法学基础。
[1]蔡群芳,邬强.谷胱甘肽转移酶的研究进展[J].海南医学院学报,2 011,17(12):1735-1738.
[2]张丹参,张天泰,李韶菁,等.谷胱甘肽转移酶抑制剂的高通量筛选[J].药学学报,2008,43(1):108-112.
[3]Habdous M, Vincent-Viry M, Visvikis S, et al. Rapid spectrophotometric method for serum glutathione S-transferases activity(1 items) [J]. Clin Chim Acta, 2002,326(1-2):131-142.
[4]蔡俊,邱雁临,马辉文.含谷胱甘肽硫转移酶基因工程菌表达条件研究[J].微生物学杂志,2004,24(4):18-22.
[5]谢琦,李娟,王凤山.乳糖诱导胸腺融合肽Ta1-TP5在大肠杆菌中的表达[J].中国生化药物杂志,2012,33(3):229-232.
[6]陈颖,陈荣.海洋双壳类谷胱甘肽S-转移酶活性测定条件的优化[J].海洋环境科学,2007,26(4):386-389.
Q78
A
1004-6879(2016)05-0413-03
*广西教育厅高校科研基金资助项目(200103YB091)
△
(2016-01-15)
