膜分离应用于花生根中白藜芦醇初级纯化
2016-11-08宋国辉张丽霞黄纪念
芦 鑫,宋国辉,张丽霞,孙 强,黄纪念,*
(1.河南省农科院农副产品加工研究所,河南郑州 450002;2.河南省农产品生物活性物质工程技术研究中心,河南郑州 450002)
膜分离应用于花生根中白藜芦醇初级纯化
芦鑫1,2,宋国辉1,2,张丽霞1,2,孙强1,2,黄纪念1,2,*
(1.河南省农科院农副产品加工研究所,河南郑州 450002;2.河南省农产品生物活性物质工程技术研究中心,河南郑州 450002)
为利用花生根中白藜芦醇资源,将膜分离应用于花生根提取液中白藜芦醇的初级纯化,以膜通量和膜渗透性、白藜芦醇和水溶性糖截留率为评价指标,考察由超滤和纳滤组成膜分离系统的工艺参数与影响因素。结果如下:超滤膜UE030和纳滤膜NF4适宜于花生根提取液中白藜芦醇的分离纯化;提取液pH会显著影响纳滤膜对白藜芦醇的截留能力;操作压力会显著影响纳滤膜通量和渗透性,但对白藜芦醇和水溶性糖的截留率无显著影响;最佳膜分离工艺为花生根提取液经过1 MPa、400 r/min、UE030超滤后,透过液调节至pH6.0,采用3 MPa,400 r/min搅拌,NF4纳滤后,水溶性糖浓度从(1.1832±0.0718) mg/mL下降到(0.0475±0.0007) mg/mL,白藜芦醇浓度为(4.4730±0.0129) μg/mL,回收率为55.84%±0.16%。以上结果证明,膜分离可用于白藜芦醇的初级分离纯化,促进从花生根中制备白藜芦醇的工业化发展。
超滤,纳滤,花生根,白藜芦醇
白藜芦醇(又名芪三酚),化学名为3,4′,5-三羟基二苯乙烯(3,4′,5-trihydroxyl-trans-stilbene),是含有芪类结构的非黄酮多酚类化合物,具有抑制癌细胞、降低血脂、预防心血管疾病、抗氧化、延缓衰老等有益功能,具有开发价值[1]。研究发现,花生中白藜芦醇含量较高,且在根、茎、壳、果、叶均有分布,其中根中含量最高[2]。我国花生资源丰富,2015年我国花生产量为1700万t,进而会产生大量的花生根、茎、壳、叶等加工副产物,目前,花生加工副产物加工程度低,仅作为饲料、燃料使用,浪费资源且污染环境。因此,已有从花生根、茎中提取白藜芦醇的研究[3]。较从虎杖、桑葚、买麻藤、野鲜槐等植物中提取分离白藜芦醇,从花生根茎中提取白藜芦醇具有成本低、原料充足、不与药争源、附加值高,更具产业化开发潜力[4]。
虽然从花生根中制备白藜芦醇取得了一定进展[5],但是提取液中白藜芦醇浓度低,如何在温和条件下,高效、快捷、廉价、规模化的分离浓缩白藜芦醇是亟待解决的问题[6]。人们尝试采用大孔树脂吸附花生根中提取液中白藜芦醇,该种方法具有处理量大、操作简单等优点,但是白藜芦醇回收率较低且使用有机溶剂,仍需进行改进[6-7]。
膜分离是指在分子水平上不同粒径分子的混合物在通过半透膜时,实现选择性分离的技术,它包括微滤、超滤、纳滤和反渗透。由于膜分离兼有分离、浓缩、纯化的功能,且高效、节能、环保、条件温和、易于放大与控制等优点,因此,已应用于食品中蛋白、多糖、功能成分的浓缩、分离、纯化[8-10]。目前,尚未有文献报道采用膜分离初步分离纯化花生根提取液中白藜芦醇,因此,本研究以白藜芦醇截留率、水溶性糖截留率和膜通量为评价指标,分析多种超滤膜、纳滤膜在分离纯化花生根中白藜芦醇的表现,以便为花生根中白藜芦醇提取分离提供新方法,推动花生加工副产物的精深加工发展。
1 材料与方法
1.1材料与仪器
花生根2014年10月采于河南省农业科学院实验田,清洗、干燥后,粉碎过40目筛,低温避光保存;白藜芦醇纯度>99%,沃凯化学试剂有限公司;甲醇色谱纯,美国VBS公司;冰乙酸优级纯,阿拉丁试剂;甲醇、硫酸、苯酚等分析纯,购自国药集团化学试剂有限公司;UE001、UE003、UE005、UE010、UE020、UE030、UE050、NF3、NF4、NFM平膜购自中科瑞阳膜技术有限公司。
Ultimate 3000高效液相美国戴安公司;CTXNW-10B超声波循环提取仪北京弘祥隆公司;Testcell C-70平膜装置日本东电公司;UV-6300双光束紫外可见分光光度计上海美谱达仪器有限公司;DL-5-B离心机、TGL-16A离心机上海安亭科学仪器厂;XS205电子天平梅特勒-托利多仪器有限公司;UW420H电子天平日本岛津仪器有限公司。
1.2实验方法
我是多么厌恶这些伪装成白天鹅的长舌妇。这时,在我眼里倏地闪过一道奇异的光彩:“是的,你可以相信我,我和他们不一样。”
1.2.1花生根中白藜芦醇提取称取一定量花生根,按1∶12(w/v)加入70%(v/v)的甲醇溶液后,倒入超声波循环提取仪中,设定温度40 ℃,800 r/min搅拌30 min,随后采用40 kHz,功率强度1200 W的发散型超声波和20 kHz、功率为1200 W的聚能型超声波共同作用90 min,超声作用方式为间歇式,即每次作用10 min后,两次超声处理间中止20 min。超声提取完毕后,将提取液通过300目筛网过筛除去花生根,将提取液倒入棕色瓶中,低温备用。
花生根提取液的pH为6.28,密度为0.825 g/mL,白藜芦醇浓度为(6.7885±0.0562) μg/mL,水溶性糖浓度为(1.1832±0.0718) mg/mL。
1.2.2膜分离处理花生根提取液膜分离处理花生根提取液的工艺由先超滤后纳滤组成。在超滤阶段,选择合适的处理条件达到白藜芦醇透过超滤膜,杂质被截留;在纳滤阶段,选择合适的条件实现白藜芦醇被截留浓缩。因此,需要筛选出适宜的超滤膜、纳滤膜,并确定操作条件。
1.2.2.1膜过滤的操作流程参照Lai的方法,称取165 g花生根提取液,装入平膜装置的腔体内,随后装入直径为7.5 cm的平膜片,旋紧密封螺丝后,放置到磁力搅拌器上,连接高压氮气瓶,并将透过液接收瓶放置到电子天平上,该天平已经连接至计算机,以每隔1 min的速度记录透过液质量变化,以便计算膜通量和膜渗透性(见公式1和2)。打开氮气瓶阀门,调节操作压力,将搅拌速度设定为400 r/min,开始膜过滤,当透过液质量达到140 g时,终止膜过滤,分别从透过液和截留液中取5 mL溶液用于检测白藜芦醇与水溶性糖,计算截留率(见公式3)和回收率(见公式4)[11]:
JA=M×A-1×(t2-t1)-1
(1)
PM=JA/P
(2)
式(1)中,JA为膜通量(kg·m-2·h-1),A为有效膜面积(m2),M为累积质量(kg),t1为透过液质量达到0.01 kg的时刻(h),t2为透过液质量达到0.02 kg的时刻(h)。式(2)中PM为膜渗透性(kg·m-2·h-1·bar-1),P为操作压力(bar)。
(3)
R=[(Cp×Vp)/Cf×Vf]×100
(4)
式(3)和(4)中,Ro和R分别为某种物料成分的截留率和回收率,Cp和Cf分别为透过液和料液中某种物料成分浓度,Vp和Vf分别为透过液与料液体积。
1.2.2.2超滤膜的确定以白藜芦醇和水溶性糖截留率、膜通量、渗透性为评价指标,采用操作压力为1 MPa,浓缩率85%(透过液质量与原料液质量百分比),搅拌速度400 r/min,观察UE001、UE003、UE005、UE010、UE020、UE030、UE050超滤膜表现,确定最佳的超滤膜。
1.2.2.3纳滤膜的确定以超滤膜的透过液为原料液,采用操作压力为3 MPa,浓缩率85%,搅拌速度400 r/min,观察NF3、NF4、NFM纳滤膜表现,确定最佳的纳滤膜。
1.2.2.4纳滤料液pH的确定料液pH和操作压力也是影响纳滤膜表现重要因素,因此需要对料液pH和操作压力对纳滤膜截留白藜芦醇的影响进行分析。固定操作压力为3 MPa,搅拌速度为400 r/min,调节提取液pH到4.0、5.0、6.0、7.0、8.0、9.0、10.0,考察pH对纳滤膜NF4的截留白藜芦醇的影响。
1.2.2.5纳滤操作压力的确定固定pH为6.0,搅拌速度为400 r/min,调节操作压力1、2、3 MPa,考察操作压力对纳滤膜NF4表现的影响。
1.2.3白藜芦醇的高效液相测定参考Xiong等人[6]的方法,采用C18反相柱(250 mm×4.6 mm,5 μm)的Ultimate 3000色谱仪进行检测,流动相为甲醇-水-乙酸(27∶70∶3,v/v/v),流速为1.0 mL/min,柱温设定为30 ℃,进样量为10 μL,303 nm进行检测。以5.44~380.8 μg/mL白藜芦醇标准品溶液做标线,建立工作曲线为y=0.8645x-1.6139(R2=0.9999),式中x为白藜芦醇浓度,y为峰面积。检测花生根提取液中白藜芦醇时,采用0.45 μm微滤膜进行过滤后,转移入色谱样品瓶进行检测。
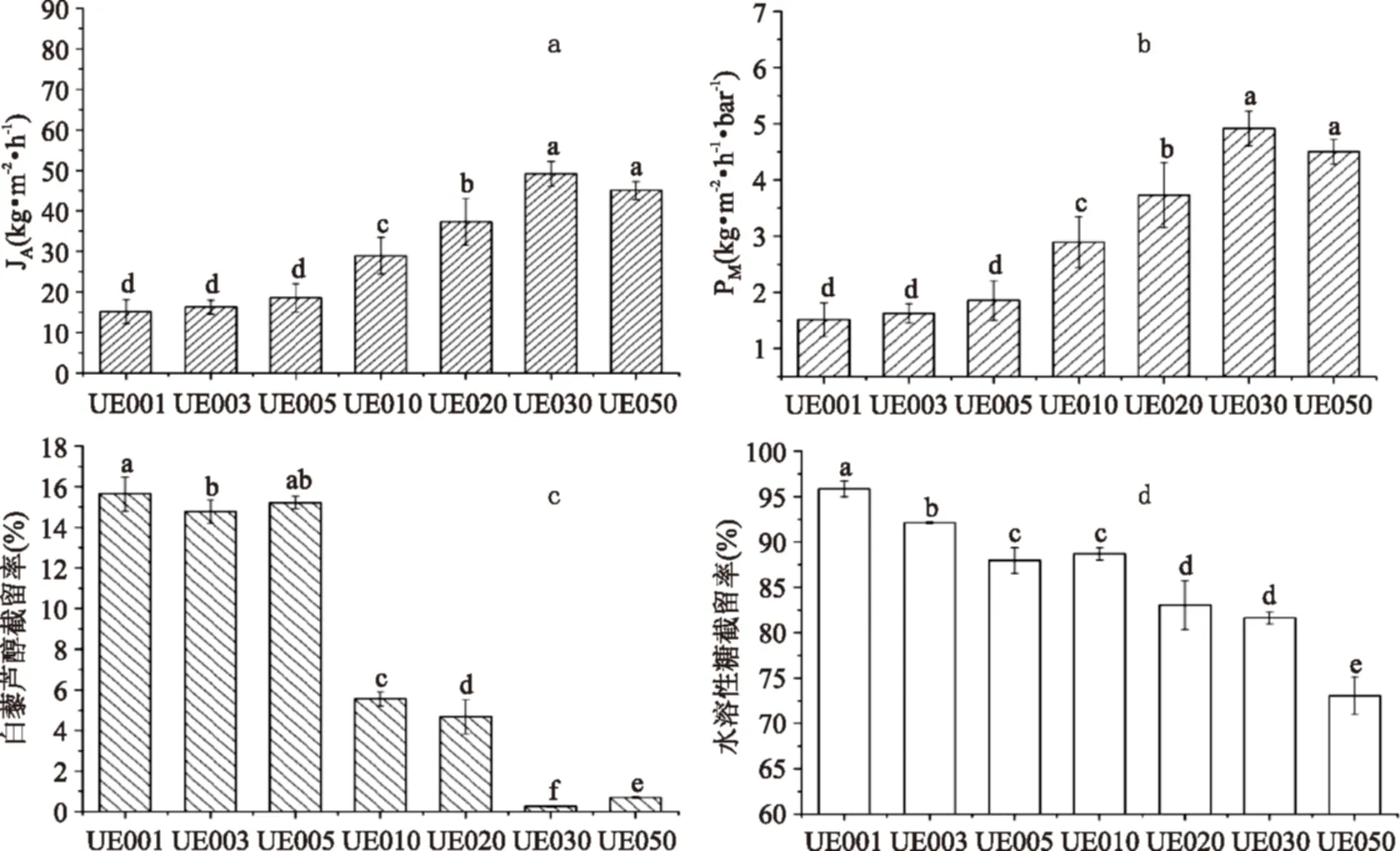
图1 不同超滤膜处理花生根提取液的表现图Fig.1 The performance of various ultrafiltration membranes in treating extract of peanut roots
1.2.4水溶性糖测定提取液中水溶性糖测定采用硫酸苯酚法,以葡萄糖为标品,测定波长为490 nm。
1.2.5数据处理无特殊说明,所有实验平行测定3次,采用SAS9.2进行Duncan算法的单因素方差分析,显著水平为0.05,高度显著水平为0.01。图中同一曲线上或表中同一行带有相同小写字母的数据在0.05水平上无显著差异。
2 结果与讨论
2.1超滤膜种类对分离白藜芦醇的影响
不同孔径的超滤膜分离花生根提取液中白藜芦醇情况如图1所示。膜通量是反映膜过滤料液的重要指标,高膜通量的膜可以在单位时间内处理更多的料液,从而缩短工艺时间,提高生产效率。膜渗透性是表示相同压力差驱动下,膜过滤料液能力的指标。高膜渗透性的膜可以在降低操作压力下,实现料液的高效处理,这不但有利于延长膜寿命,也有利于降低设备投资。超滤膜UE001至UE050膜孔径逐渐增加,即截留分子量逐渐增加(截留分子量从1000增加到50000),其膜通量与膜渗透性总体呈逐渐增加趋势,但膜UE030和UE050无显著性差异,产生以上现象的原因是:UE系列超滤膜的膜通量是在水溶液体系下测定,而本实验中花生根提取液是甲醇溶液,溶液极性会影响膜表面性质,导致膜孔径发生变化,这可能造成UE030与UE050在膜通量上无显著差异的原因。由图1(a)和(b)可知,UE030具有最高的膜通量与膜渗透性。
分析白藜芦醇截留率发现,从UE001到UE030伴随膜孔径增加,白藜芦醇截留率逐渐下降;而从UE030到UE050,白藜芦醇截留率稍有上升。超滤分离纯化的机理是以压力差为推动力,利用物质大小差异,通过膜孔径筛分实现大分子溶质与小分子溶质的分离[12]。这就是伴随着膜孔径增加,白藜芦醇更容易通过超滤膜进入透过液,白藜芦醇截留率下降的原因。
观察水溶性糖截留情况发现,UE系列超滤膜可以有效除去花生根提取液中的水溶性糖。伴随着膜孔径增加,水溶性糖截留率从UE001的95.86%±0.8871%下降到UE050的73.0629%±2.0592%。以上结果表明,花生根提取液中的水溶性糖以多糖为主,目前尚无相关报道,其性质有待后续研究。
综合膜通量、膜渗透性、白藜芦醇和水溶性糖截留率,UE030适宜作为一级超滤花生根提取液的工具膜,当采用操作压力1 MPa,搅拌速度为400 r/min,浓缩80%,UE030膜通量、膜渗透性、白藜芦醇截留率、水溶性糖截留率分别为(49.1662±3.0722) kg·m-2·h-1,(4.9166±0.3072) kg·m-2·h-1·bar-1,0.26%±0.02%,81.62%±0.65%,其透过液中,白藜芦醇浓度为(6.7794±0.0131) μg/mL,水溶性糖浓度为(0.3187±0.0244) mg/mL,白藜芦醇回收率为84.64%±0.16%。
2.2纳滤膜种类对分离白藜芦醇的影响

表1 不同纳滤膜处理花生根提取液情况
纳滤膜材质不同会影响溶质的分离效果,因此本实验中考察3种纳滤膜处理一级超滤膜的透过液,其膜透过性与对白藜芦醇和水溶性糖分离效果。如表1所示,NFM具有最高的膜通量与膜渗透性,而NF3与NF4无显著差异。三种膜对水溶性糖都具有较高截留率,其中NF3和NF4对水溶性糖的截留率为84%以上,而三种膜在白藜芦醇的截留率上存在显著差异,其中NF3的截留率最高,而NF4截留率最低,产生以上差异的原因与纳滤分离机理有关,纳滤膜的分离效果受孔径的分子筛作用与膜电荷性共同决定[12]。在提取液体系中,水溶性糖是非电解质,而白藜芦醇会受体系pH的影响发生解离,形成白藜芦醇离子,因此,水溶性糖的截留主要受纳滤膜孔径的分子筛效应的影响,而白藜芦醇除受分子筛作用外,还与膜电荷性质的影响。膜电荷性会产生Donnan效应,且高膜电荷性会引起强Donnan效应。Donnan抑制溶液中离子通过膜,从而阻碍白藜芦醇的进入透过液[11]。由此推断,NF3具有较强的Donnan效应阻碍白藜芦醇进入透过液。
综合膜通量、膜渗透性、白藜芦醇和水溶性糖截留率,NF4适宜作为二级超滤花生根提取液的工具膜,当采用操作压力3 MPa,搅拌速度为400 r/min,浓缩85%时,透过液中白藜芦醇和水溶性糖浓度分别为(4.2010±0.1150) μg/mL和(0.0481±0.0007) mg/mL,白藜芦醇回收率为52.51%±1.34%。
2.3pH对纳滤膜NF4分离白藜芦醇的影响
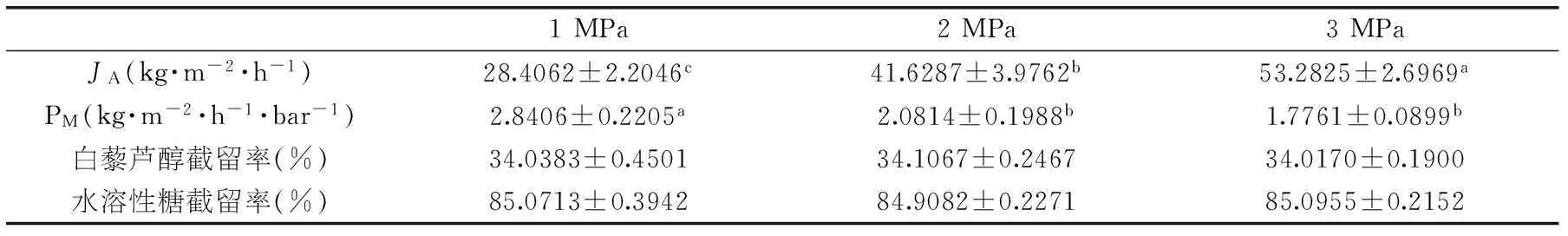
表2 压力对纳滤膜NF4分离花生根提取液的影响
由于纳滤膜的活性表面由聚酰胺或聚酰胺与其他物质组成的混合物构成,因此纳滤膜是两性化合物,存在等电点(pI),纳滤膜的等电点取决于材料中氨基与羰基的比例,一般在4~6之间[13-14]。当溶液pH低于膜的pI,膜电荷为正,反之为负;并且随着pH远离pI,膜电荷强度增加[14-15]。伴随着膜表面电荷强度增加,相同电荷间排斥力增加,造成孔径增加,膜结构变得疏松,从而导致pH10时有高膜通量与膜渗透性。同理由于孔径增加造成水溶性糖截留率在pH8~10下降。白藜芦醇通过纳滤膜受分子筛与膜电荷的共同作用,因此截留率变化比较复杂。当pH4~6,由于接近膜的pI值,膜表面电荷接近中性,Donnan效应减弱,有利于白藜芦醇的透过;而当pH继续增加时,膜表面负电荷浓度增加,而白藜芦醇也解离成为白藜芦醇负离子,由于同性相斥,阻碍白藜芦醇通过纳滤膜,导致截留率增加。
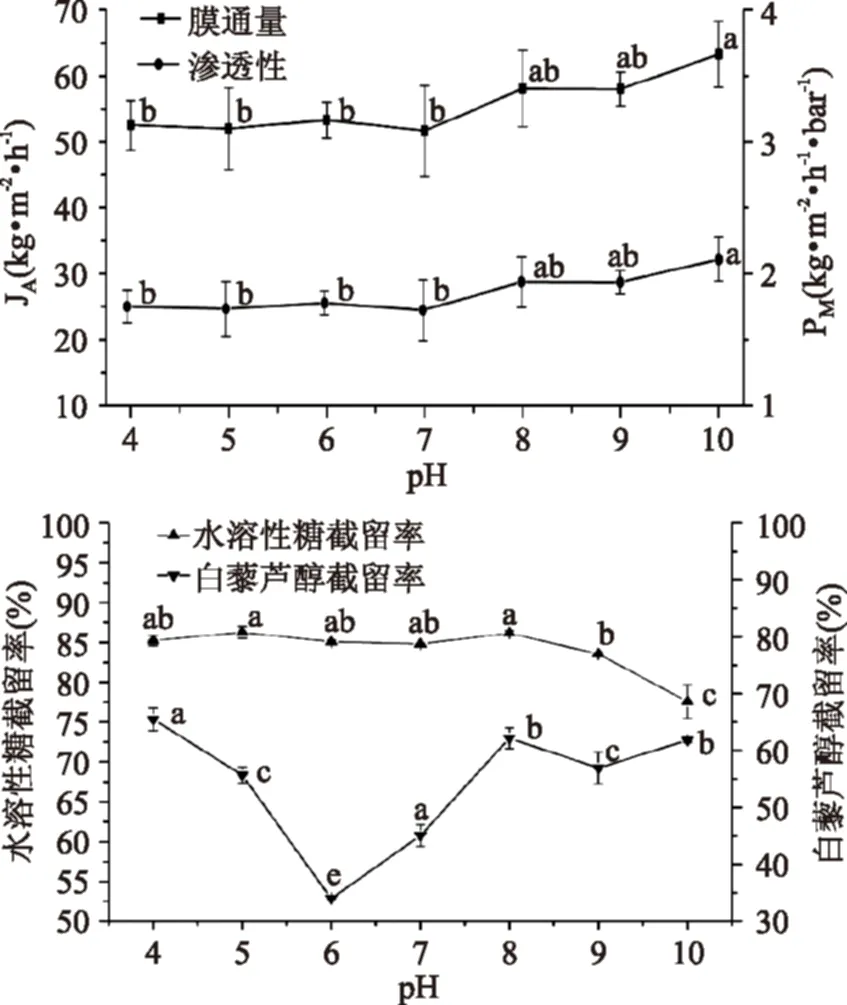
图2 pH对纳滤膜NF4分离花生根提取液的影响Fig.2 The effect of pH on separating extract of peanut roots by nanofiltration membrane NF4
为减少白藜芦醇损失,适宜的处理条件为pH6,在此条件下,白藜芦醇的截留率和回收率为34.02%±0.19%和55.92%±0.27%,透过液中白藜芦醇和水溶性糖浓度分别为(4.4730±0.0129) μg/mL和(0.0475±0.0007) mg/mL。
2.4压力对纳滤膜NF4分离白藜芦醇的影响
压力是驱动纳滤进行的驱动力,压力低不利于推动溶液通过纳滤膜,导致膜通量较低,降低膜处理能力;压力过高虽然会产生高膜通量,但会破坏膜结构,降低膜寿命,因此需要采用适当压力。由表2所示,伴随压力增加,NF4膜的膜通量逐渐增加,渗透性逐渐减小,而白藜芦醇和水溶性糖截留率无显著变化。由于水溶性糖截留率无显著变化,初步判断操作压力1~3 MPa不会影响膜孔径。为获得较高的膜通量,操作压力以3 MPa为宜。
3 结论
本研究表明,膜技术可以应用于花生根中白藜芦醇分离纯化工艺中,该方法较传统分离方式,具有条件温和、工艺简单、节能绿色且处理量大的优点。花生根提取液经过1 MPa,400 r/min,UE030超滤后,透过液调节至pH6.0,采用3 MPa,400 r/min搅拌,NF4纳滤后,水溶性糖浓度从(1.1832±0.0718) mg/mL下降到(0.0475±0.0007) mg/mL,白藜芦醇浓度为(4.4730±0.0129) μg/mL,白藜芦醇回收率为55.84%±0.16%,这为白藜芦醇的后续分离纯化提供高品质原料。
目前,该工艺的不足有两点:白藜芦醇回收率较低,主要原因是部分白藜芦醇存在于二级纳滤的截留液中;纳滤透过液的白藜芦醇浓度低,需要进行浓缩处理。针对以上问题,未来研究可以探索增加浓缩率、循环纳滤、更换其他纳滤膜等方法以提高回收率,将反渗析应用于纳滤透过液中白藜芦醇的浓缩中。另外,为推动膜分离花生根中白藜芦醇的工业化应用,卷式膜分离条件也会进行研究。
[1]田立荣,廖伯寿,黄家权,等. 花生白藜芦醇研究进展[J]. 中国油料作物学报,2008,30(4):522-528.
[2]薛晓丽,张红霞. 花生不同部位白藜芦醇RP-HPLC含量分析[J]. 吉林农业科技学院学报,2012,21(3):7-10.
[3]张初署,禹山林,刘阳,等. 微波辅助提取花生根中白藜芦醇工艺[J]. 食品科学,2009,30(24):30-33.
[4]张初署,禹山林,潘丽娟,等. 花生植株白藜芦醇提取工艺优化[J]. 农业工程学报,2009,25:148-152.
[5]黎继烈,励建荣,李忠海,等. 超声波辅助提取花生白藜芦醇工艺研究[J]. 中国粮油学报,2009,24(6):118-121.
[6]Xiong Q P,Zhang Q H,Zhang D Y,et al. Preliminary separation and purification of resveratrol from extract of peanut(Arachishypogaea)sprouts by macroporous adsorption resins[J]. Food Chemistry,2014,145(7):1-7.
[7]黄卫文,黎继烈,姜瑞清,等. 大孔吸附树脂纯化花生根中白藜芦醇工艺及其动力学研究[J]. 中国粮油学报,2009,24(11):120-126.
[8]陈婷,余群力,赵莉,等. 超滤膜分离技术回收乳清蛋白工艺研究[J]. 食品工业科技,2010,31(4):226-228.
[9]马利华,秦卫东,陈学红,等. 膜技术分离纯化牛蒡多糖的研究[J]. 食品工业科技,2009,30(1):231-234.
[10]张孝友,陈文良,周云,等. 膜分离技术分离纯化朝鲜蓟叶中洋蓟素的工艺研究[J]. 食品工业科技,2011,32(4):255-257.
[11]Lai DQ,TagashiraN,Hagiwara S,et al. Application of nanofiltration to recover Benzoic acid from cranberry juice[J]. Food Science and Technology Research,2012,18(1):7-15.
[12]杨座国. 膜科学技术过程与原理[M]. 广州:华东理工大学出版社,2009:68,94-95.
[13]TanninenJ,MänttäriM,NyströmM. Effect of electrolyte strength on acid separation with NF membranes[J]. Journal of Membrane Science,2007,294(1-2):207-212.
[14]MänttäriM,PihlajamäkiA,NyströmM. Effect of pH on hydrophobicity and charge and their effect on the filtration efficiency of NF membranes at different pH[J]. Journal of Membrane Science,2006,280(1-2):311-320.
[15]Braghetta A,DiGianoFA,William PB. Nanofiltration of natural organic matter:pH and ionic strength effects[J]. Journal of Environmental Engineering,1997,123(7):628-641.
Application of membrane separation on preliminary purification of resveratrol from extract of peanut root
LU Xin1,2,SONG Guo-hui1,2,ZHANG Li-xia1,2,SUN Qiang1,2,HUANG Ji-nian1,2,*
(1.Institute of Agricultural Processing,Henan Academy of Agricultural Sciences,Zhengzhou 450002,China;2.Henan Engineering Research Centre of Bioactive Substances in Agricultural Products,Zhengzhou 450002,China)
To utilize resveratrol resource in peanut roots,membrane separation had been employed in the preliminary separation of resveratrol in crude extract of peanut roots. Process parameters and influencing factors of a sequential membrane separation system consisting of ultrafiltration and nanofiltration were investigated through comprehensively considering performances of permeate flux,permeability,rejections of resveratrol and soluble sugar. Results showed that ultrafiltration membrane UE030 and nanofiltration membrane NF4 were suitable to separate resveratrol from crude extract of peanut root. pH of extract of peanut root had a significant influence to the performance of nanofiltration membrane on rejection of resveratrol. Operational pressure would remarkably affect permeate flux and permeability of nanofiltration membrane,but insignificantly affect rejections of resveratrol and soluble sugar. The optimal process of membrane separation was as follows:crude extract of peanut root was firstly ultrafiltrated by UE030 under 1 MPa,400 r/min,then the permeate of ultrafiltration was nanofiltrated by NF4 under 3 MPa,400 r/min,finally the concentration of soluble sugar decreased from(1.1832±0.0718) mg/mL to(0.0475±0.0007) mg/mL,the concentration and recovery of resveratrol were(4.4730±0.0129) ug/mL and(55.84%±0.16%),respectively. It could be concluded that membrane separation manages to preliminarily separate and purify resveratrol from peanut roots,which promoted the development of commercial production of resveratrol from peanut roots.
ultrafiltration;nanofiltration;peanut root;resveratrol
2016-03-04
芦鑫(1981-),男,博士研究生,助理研究员,研究方向:油料蛋白加工研究,E-mail:xinlu1981@foxmail.com。
黄纪念(1971-),男,研究员,研究方向:农产品加工,E-mail:hjinian@sina.com。
河南省资助留学回国人员科研项目;UNU-Krin奖学金项目。
TS229
B
1002-0306(2016)18-0282-05
10.13386/j.issn1002-0306.2016.18.045
