阻燃电解液改善钛酸锂电池体系热稳定性研究
2016-11-08冯丽华王青松孙金华
冯丽华,王青松,孙金华
(中国科学技术大学火灾科学国家重点实验室,合肥,230026)
阻燃电解液改善钛酸锂电池体系热稳定性研究
冯丽华,王青松*,孙金华
(中国科学技术大学火灾科学国家重点实验室,合肥,230026)
为了提高锂离子电池安全性,将碳酸亚乙烯酯、亚硫酸丙烯酯与二甲基乙酰胺加入到1.0 mol/L LiPF6/碳酸乙烯酯+碳酸二乙酯(1∶1wt%)的基准电解液中,配制成阻燃电解液。运用C80微量量热仪对钛酸锂负极(放电至1.0 V)与基准电解液共存体系、钛酸锂负极(放电至1.0 V)与阻燃电解液共存体系进行热稳定性测试,并计算得到热力学参数。对Li /基准电解液/ Li4Ti5O12和Li /阻燃电解液/ Li4Ti5O12半电池进行充放电循环测试、循环伏安测试与SEM扫描电镜测试。实验结果表明,钛酸锂负极与阻燃电解液体系反应放出的热量较钛酸锂负极与基准电解液体系减少了35.4%,且具有更高的活化能,提高了钛酸锂电池体系的热稳定性;同时电化学测试结果表明,阻燃电解液与钛酸锂负极有良好的相容性,可以应用到钛酸锂电池体系。
锂离子电池;钛酸锂;阻燃电解液;热稳定性
0 引言
锂离子电池具有能量密度大、输出功率高、充放电寿命长、放电平稳等诸多优点,已经进入一个高速商业化发展阶段,被认为是最有发展前景的储能设备。然而,锂离子电池中含有易燃的有机电解液,电池在某些滥用的情况下,可能会导致火灾或爆炸[1-4]。由于锂离子电池的火灾爆炸事故,索尼、戴尔、苹果等全球著名的公司曾大规模召回其产品。而对于容量更大,功率更高的动力型锂离子电池,如用于电动汽车和混合动力汽车的动力电池,其充放电电流大,散热条件差,电池内部温度极易升高,电池发生燃烧或爆炸的可能性很大。因此,锂离子电池的安全问题已成为制约其快速发展的一个重大阻碍。为了提高锂离子电池的安全性,很多阻燃添加剂被应用到锂离子电池电解液中。这些添加剂可以提高电解液的阻燃性,但会影响锂离子电池的电化学性能[5-7]。
二甲基乙酰胺(DMAC)是一种强极性非质子溶剂,具有良好的热稳定性,可被当做电解液溶剂使用[8]。碳酸亚乙烯酯(VC)与亚硫酸丙烯酯(PS)作为成膜添加剂可以提高锂离子电池的循环特性[9]。将VC、PS、DMAC作为添加剂加入到1.0 mol/L LiPF6/碳酸乙烯酯(EC)+ 碳酸二乙酯(DEC)(1∶1wt%)基准电解液中,配制成阻燃电解液。在我们之前的研究中已经发现[10],相较于基准电解液,阻燃电解液的燃烧速率有所下降,电导率有所提高;在热稳定性测试中,其反应热减少了45.6%,放热峰的峰值温度推迟了42.8℃,具有良好的热稳定性。但是,在实际的锂离子电池中,电解液与电极材料是共存的。因此,提高共存体系的热稳定性才能改善电池的安全性。本文运用C80微量量热仪研究了钛酸锂与基准电解液体系、钛酸锂与阻燃电解液体系的热稳定性,求解比较了两种体系的热动力学参数,并且测试了Li /阻燃电解液/ Li4Ti5O12电池的电化学性能。
1 实验部分
1.1 实验样品
实验中将1.0 mol/L LiPF6/碳酸乙烯酯(EC)+ 碳酸二乙酯(DEC)(1∶1wt%)电解液作为基准电解液。在氩气氛围的手套箱内,将碳酸亚乙烯酯(VC)、亚硫酸丙烯酯(PS)、二甲基乙酰胺(DMAC)按照特定比例添加到基准电解液中,配制成阻燃电解液。根据阻燃电解液体积添加适当的六氟磷酸锂(LiPF6),使阻燃电解液中锂盐含量为1.0 mol/L。
钛酸锂电极由84%的Li4Ti5O12、8%的乙炔黑和8%的聚偏氟乙烯(PVDF)构成。电极材料调浆后,分别用200 μm和400 μm厚的刮刀在铝箔上拉膜,在110℃下隔夜烘干、轧平,然后利用冲片机将集流体制成直径14 mm的圆形极片。将极片转移到氩气手套箱中,使用钛酸锂做正极,锂金属片做负极,组装成CR2032纽扣电池,其中200 μm厚的极片组装成的电池用于充放电循环,400 μm厚的极片组装成的电池用于C80热稳性定性测试。
1.2 实验仪器
C80微量量热仪是法国Setaram公司在20世纪80年代初开发的新一代热分析仪,适用于化学反应的热特性测定。本实验使用等规格的参比池和反应池,池的内径为15 mm,体积均为8.5 cm3,C80测试样品在氩气手套箱内把材料装入高压反应池,密封后取出进行实验。升温范围设为30℃~300℃,升温速率为0.2℃/min。
Neware-BTS-610电池充放电循环仪可对电池进行多种不同工步的设定。为了测试阻燃电解液在钛酸锂电池中的电化学性能,用电池循环仪对组装好的CR2032电池,即Li /基准电解液/ Li4Ti5O12和Li /阻燃电解液/ Li4Ti5O12半电池,在0.1 C倍率下,先放电至1.0 V,再充电至2.5 V,依此循环35次。
电化学分析仪可完成电位滴定、电流滴定、交流阻抗法、循环伏安法、交流伏安法等测量。本实验中使用电化学分析仪对Li /基准电解液/ Li4Ti5O12和Li /阻燃电解液 /Li4Ti5O12半电池进行循环伏安测试。其中循环伏安测试的扫描速率为0.1 mV/s,扫描电压为1.0 V~2.5 V。
2 结果与讨论
2.1 钛酸锂负极与电解液共存体系的热稳定性
对钛酸锂负极进行嵌锂后,将钛酸锂分别与基准电解液、阻燃电解液共存体系在氩气氛围下,进行C80热稳定性测试。图1为两种体系的C80热流曲线。从图1中可以看出,钛酸锂与基准电解液共存体系的热流曲线,从40.0℃开始放热,在63.5℃处达到第一个放热峰峰值,在104.8℃处结束放热,该过程放出的热量为-90.0 J/g。经历了几段波动极小的放热过程后,又从211.1℃处开始放热,并在253.2℃处达到第二个放热峰的峰值,281.6℃以后,有一段微弱的吸热过程,这两个过程的放热量为-170.3 J/g。钛酸锂与基准电解液共存体系在30℃~300℃过程中放出的热量为-260.3 J/g。
钛酸锂与阻燃电解液共存体系的热流曲线与前者相似,也经历了两个放热过程和结束时的吸热过程。该体系从47.0℃开始放热,于65.0℃处达到第一个放热峰的峰值,在105.0℃处结束放热。第二个放热峰与前者相似,从211.1℃处开始放热, 242.0℃达到峰值,到272.3℃处放热结束,进入一段吸热过程。钛酸锂与阻燃电解液共存体系在30℃~300℃过程中放出的热量为-168.2 J/g。
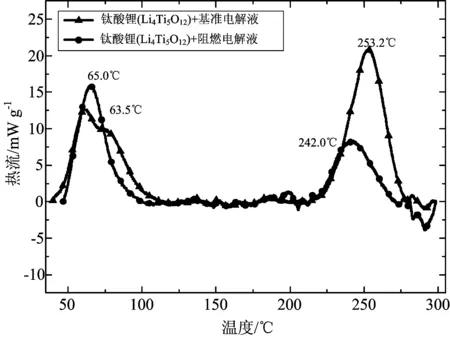
图1 钛酸锂与基准电解液体系、钛酸锂与阻燃电解液体系氩气氛围下的C80热流曲线Fig.1 C80 Heat flow curves of Li4Ti5O12-baseline electrolyte and Li4Ti5O12-flame-retardant electrolyte system in argon filled vessel
钛酸锂表面亚稳态物质的形成与材料表面的形貌以及比表面积密切相关。当制备钛酸锂的锂源为LiOH时,钛酸锂拥有较小的晶粒和更大的比表面积,反应活性更高,在1 V~3 V的循环过程中,其表面会形成亚稳态物质[11]。通过以上对比可以发现,两种体系分别在63.5℃和65.0℃处有一放热峰,这两个放热峰即为钛酸锂表面亚稳态物质的分解。由以上的分析可以发现,钛酸锂与阻燃电解液共存体系的第一个放热峰放出的热量稍多,阻燃电解液中含有VC、PS两种成膜添加剂[9],促使钛酸锂负极表面形成更多的亚稳态物质,因此分解后放出更多的热量。
文献[12]中研究了钛酸锂在电解液中循环后,钛酸锂活性物质单独的热流曲线,其放热峰的峰值温度为223.5℃。在我们之前的研究中[13],已经得到基准电解液与阻燃电解液主要放热峰的峰值温度分别为201.4℃和244.2℃。图1中,两条热流曲线的第二个放热峰峰值温度分别为253.2℃和242.2℃。可以发现,这些放热峰的峰值温度是接近的,因此,图1中两条热流曲线的第二个放热峰,应该是钛酸锂负极活性物质本身的热分解、电解液的热分解以及钛酸锂负极活性物质与电解液的化学反应。值得注意的是,如果在低温阶段产生的热量没有及时释放,就会使锂离子电池温度升高,引起热失控的发生。

图2 VC、PS与DMAC在氩气氛围下的C80热流曲线Fig.2 C80 Heat flow curves of VC, PS, and DMAC in argon filled vessel
图2为VC、PS、DMAC在氩气氛围下的C80热流曲线。三种添加剂的反应开始温度非常接近,都在85.3℃附近,分别于182.5℃、186.4℃、199.3℃处达到吸热峰的峰值。三者的热流曲线都只经历了一个吸热过程,没有放热反应的发生,因此钛酸锂与阻燃电解液共存体系放出的热量更少,较钛酸锂与基准电解液共存体系减少了35.4%,放热量显著降低。这大大提高了Li /阻燃电解液/ Li4Ti5O12锂离子电池体系的热稳定性与安全性。
2.2 钛酸锂负极与电解液共存体系热力学参数分析
基于钛酸锂负极与电解液共存体系在升温下的热流数据,可计算得到样品发生放热分解反应的化学热力学参数和活化能。假设电极材料的热分解以及与电解液之间的反应均遵循Arrhenius定律,且反应级数为1,依据升温热流数据,反应速率方程为:
(1)
式中:A为指前因子,s-1;E为反应活化能,J/mol;R为气体常数,J/(K·mol);T为系统温度,K;n为反应级数;t为时间,s。另外,M为任意时刻反应物质量,g;M0为反应物初始质量,g。
在反应的初始阶段,可以忽略反应物的消耗,因而M近似于M0,即可取M=M0。引入反应热ΔH,化学反应的放热方程为:
(2)
对式(2)取自然对数,可得:
(3)


图3 Li4Ti5O12与基准电解液共存体系的曲线Fig.electrolyte system
从该直线的斜率可以求得钛酸锂与基准电解液共存体系的活化能为170.0 kJ/mol。用同样的方法,可得到钛酸锂与阻燃电解液共存体系的活化能,如表1所示,表中添加了文献[12]中,钛酸锂在电解液中循环后,钛酸锂活性物质单独存在时的反应热与活化能。
实验中,钛酸锂与两种电解液的质量比均为2∶1,钛酸锂与电解液共存体系的单位质量反应热基于二者的质量之和计算得到。根据表1中的数据可以计算得到,钛酸锂与基准电解液体系放出的热量为15.5 J,钛酸锂与阻燃电解液体系放出的热量为7.3 J。假设,共存体系的放热量是二者单独存在时,各自放出热量的叠加,则钛酸锂与基准电解液放出的热量之和为8.7 J,钛酸锂与阻燃电解液放出的热量之和为4.3 J。通过对比可以发现,15.5 J > 8.7 J,7.3 J > 4.3 J,这说明钛酸锂与电解液共存体系放出的热量并非二者放出热量的简单叠加,而是相互促进,使得体系放出更多的热量,同时也说明钛酸锂电极与电解液共存时,放出的热量更多,其危险性也更高。活化能的大小代表了反应物要达到活化状态时所需的能量,该能量越大,反应越难进行。对比表1中的活化能E,可以发现,电极材料与电解液单独存在时,其活化能均高于共存体系的活化能。并且阻燃电解液的活化能高于基准电解液的活化能,钛酸锂和阻燃电解液体系的活化能高于钛酸锂和基准电解液体系的活化能。
由以上分析结果可以发现,钛酸锂和电解液共存体系,较二者单独存在时,更易发生化学反应,且二者相互促进,放出更多的热量。钛酸锂和阻燃电解液体系的活化能较大,这说明阻燃电解液提高了钛酸锂电池体系的热稳定性,使体系不易发生化学反应而放热。

表1 钛酸锂-电解液体系反应热与热力学参数
2.3 Li /阻燃电解液/ Li4Ti5O12电池的电化学性能
图4为Li /基准电解液/ Li4Ti5O12和Li /阻燃电解液/ Li4Ti5O12半电池的第一次循环比容量-电压曲线,即第一次充放电过程。从图4中可以看出两种电池的充放电电压平台基本一致,充电电压平台均保持在1.6 V左右,放电电压平台均保持在1.5 V左右。从图4中可以明显看出,含有阻燃电解液的电池,其第一次充放电的电池容量(162.8 mAh/g),高出含有基准电解液的电池容量(140.6 mAh/g)的15.8%。

图4 Li /基准电解液/ Li4Ti5O12和Li /阻燃电解液/ Li4Ti5O12半电池第一次循环比容量-电压曲线Fig.4 First specific capacity-voltage plots of Li /baseline electrolyte/ Li4Ti5O12 and Li /flame-retardant electrolyte/ Li4Ti5O12 half cells
图5为Li /基准电解液/ Li4Ti5O12和Li /阻燃电解液/ Li4Ti5O12半电池的循环效率曲线。从图5可以看出,含有阻燃电解液的电池循环效率维持在100%左右,与基准电解液电池的循环效率相当。通过计算,基准电解液电池与阻燃电解液电池,二者的循环效率平均值分别为98.7%和98.6%。同时还计算了二者循环效率的标准差。标准差又称均方差,它能反映一组数据在其平均值周围的离散波动程度。基准电解液电池与阻燃电解液电池的标准差分别为1.2和1.1。因此,阻燃电解液对钛酸锂电池的循环效率几乎没有影响。
图6为Li /基准电解液/ Li4Ti5O12和Li /阻燃电解液/ Li4Ti5O12半电池的循环次数-比容量曲线图。电池的放电比容量是根据电极表面活性物质钛酸锂的质量计算的。从图6中可以看出,在整个循环过程中,阻燃电解液的电池容量始终高于基准电解液电池容量,在第25次之后,二者的放电比容量逐渐接近。这说明,阻燃电解液使电池的循环容量依旧可以保持在较高的水平,并没有造成不可接受的衰减。
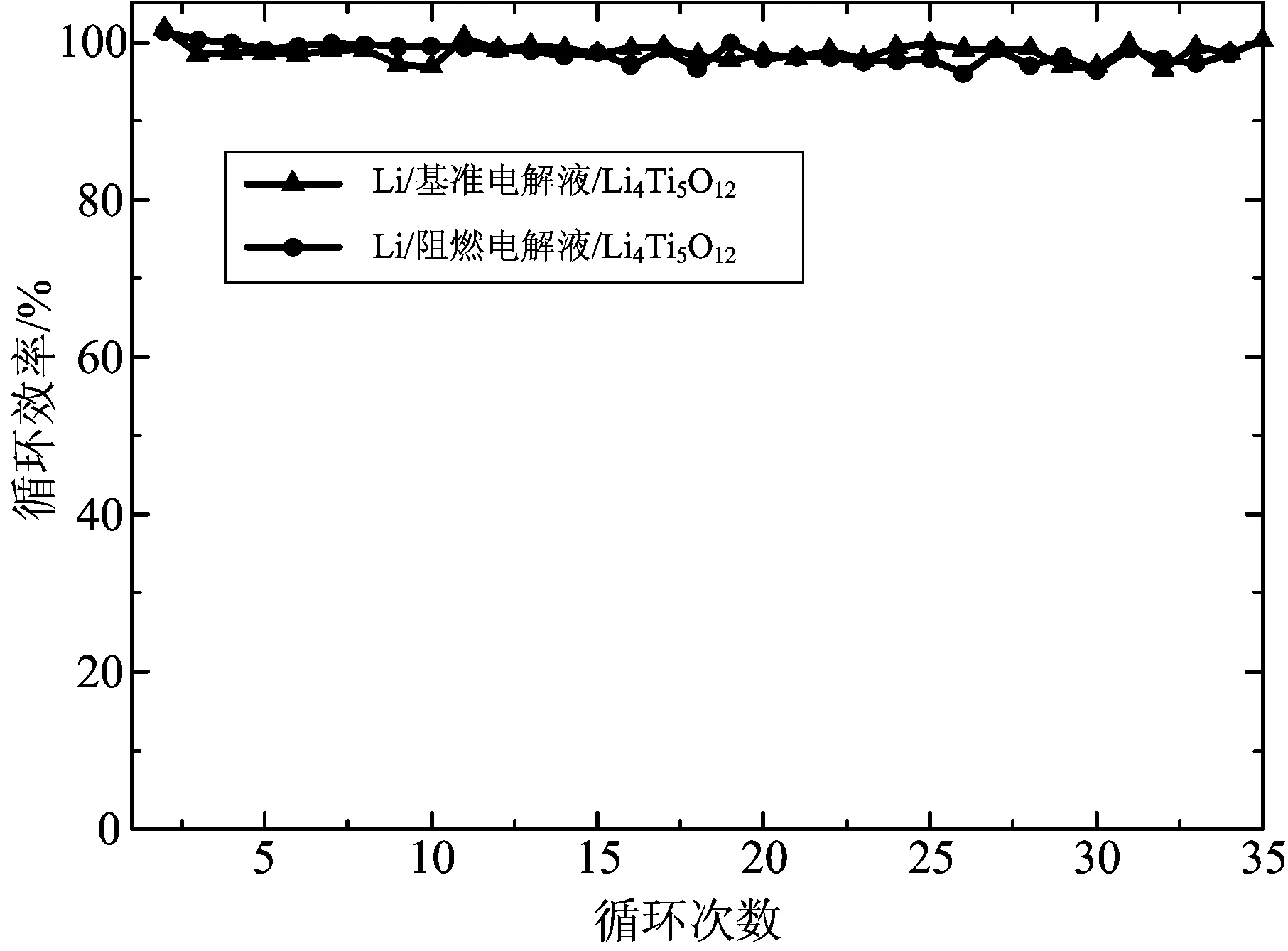
图5 Li /基准电解液/ Li4Ti5O12和Li /阻燃电解液/ Li4Ti5O12半电池循环效率Fig.5 Cycle efficiency of Li /baseline electrolyte/ Li4Ti5O12 and Li /flame-retardant electrolyte/ Li4Ti5O12 half cells

图6 Li /基准电解液/ Li4Ti5O12和Li /阻燃电解液/ Li4Ti5O12半电池循环次数-比容量Fig.6 Cycle performance of Li /baseline electrolyte/ Li4Ti5O12 and Li /flame-retardant electrolyte/ Li4Ti5O12 half cells

图7 Li /电解液/ Li4Ti5O12半电池循环伏安曲线 (a)Li /基准电解液/ Li4Ti5O12,(b)Li /阻燃电解液/ Li4Ti5O12Fig.7 Cyclicvoltammograms of Li /electrolyte/ Li4Ti5O12 half cells (a) Li /baseline electrolyte/ Li4Ti5O12, (b) Li /flame-retardant electrolyte/ Li4Ti5O12
图7为Li /基准电解液/ Li4Ti5O12和Li /阻燃电解液/ Li4Ti5O12电池前六次的循环伏安曲线。通过循环伏安法,可以判断电极氧化还原反应的可逆程度,以及在测试的电压范围内有没有新的氧化还原反应发生。由图7(a)、图7(b)两幅图可以看出,每条曲线都有一对氧化还原峰,分别对应着锂离子在电极表面的嵌入和脱出,并且在阻燃电解液电池的循环伏法曲线中,并没有出现新的氧化还原峰,说明在1.0 V~2.5 V的电压范围内,阻燃电解液与钛酸锂没有发生新的氧化还原反应。钛酸锂的氧化还原反应过程如(4)式和(5)式所示[14]:
(4)
(5)
钛酸锂需经过3个或3个以上的循环,才能在其表面形成完整稳定的亚稳态物质[11]。对比图7(a)和图7(b)可以发现,两种电池的前三个循环,其还原峰的峰值电压不稳定,且均有双峰出现。从第四次循环开始,两种电池的还原峰峰值电压稳定,且没有双峰出现。这说明在前三个循环中,钛酸锂表面的亚稳态物质在不断形成,经过三个循环后,钛酸锂表面形成了完整稳定的亚稳态物质,两种电池循环伏安曲线的氧化还原峰重复性良好。在进入第四个循环之后,阻燃电解液电池的循环伏安曲线中的氧化还原峰更加对称,且氧化还原反应过程的电压范围更大,这说明该电池的氧化还原反应的可逆程度更高。氧化还原反应的峰值电压之差越大,则电池的性能越差。在含有基准电解液的电池中,第一个循环和第二个循环峰值的电压差分别为0.59 V和0.30 V;在含有阻燃电解液的电池中,第一个循环和第二个循环峰值的电压差分别为0.45 V和0.35 V,阻燃电解液的还原峰峰值电压差更小。由以上的分析可以得到,阻燃电解液与钛酸锂负极材料有着良好的相容性。
3 结论
本文研究了阻燃电解液对钛酸锂负极热稳定性的改善;求解了钛酸锂和基准电解液体系、阻燃电解液体系的热力学参数;测试了Li /基准电解液/ Li4Ti5O12和Li /阻燃电解液/ Li4Ti5O12半电池的电化学性能,得出以下结论:
(1)钛酸锂与阻燃电解液共存体系放出的热量更少,较钛酸锂与基准电解液共存体系减少了35.4%,放热量显著降低。
(2) 钛酸锂和阻燃电解液体系的活化能E,比钛酸锂与基准电解液体系的活化能E高出了50.3%,因此该体系的放热反应更难进行。
(3)Li /基准电解液/ Li4Ti5O12半电池和Li /阻燃电解液/ Li4Ti5O12半电池的电化学性能测试表明,阻燃电解液与钛酸锂负极材料有着良好的相容性。
以上结论说明,阻燃电解液提高了钛酸锂电池体系的热稳定性,安全性更高,并且与钛酸锂负极相容性良好。因此,可将阻燃电解液应用在钛酸锂锂离子电池中,以提高其热稳定性,减小锂离子电池发生热失控的概率,提高锂离子电池的安全性。
[1] Wrodnigg GH, et al. Propylene sulfite as film-forming electrolyte additive in lithium ion batteries[J]. Electrochemistry Communications, 1999, 1(3): 148-150.
[2] Wrodnigg GH,et al. Cyclic and acyclic sulfites: new solvents and electrolyte additives for lithium ion batteries with graphitic anodes?[J]. Journal of Power Sources, 2001, 97: 592-594.
[3] Isken P, et al. High flash point electrolyte for use in lithium-ion batteries[J]. Electrochimica Acta, 2011, 56(22): 7530-7535.
[4] Schmitz R, et al. Methyl tetrafluoro-2-(methoxy) propionate as co-solvent for propylene carbonate-based electrolytes for lithium-ion batteries[J]. Journal of Power Sources, 2012, 205: 408-413.
[5] Wang QS, et al. 4-Isopropyl phenyl diphenyl phosphate as flame-retardant additive for lithium-ion battery electrolyte[J]. Electrochemical and Solid-State Letters, 2005,8(9):A467-A470.
[6] Wang QS, et al. Cresyl diphenyl phosphate effect on the thermal stabilities and electrochemical performances of electrodes in lithium ion battery[J], Journal of Power Sources. 2011,196(14):5960-5965.
[7] Wang QS, et al. Enhancing the thermal stability of LiCoO2 electrode by 4-isopropyl phenyl diphenyl phosphate in lithium ion batteries[J]. Journal of Power Sources, 2006,162(2):1363-1366.
[8] Liu FH, et al. Hydrogen-bonding and dielectric response of N,N-dimethylacetamide aqueous solutions under E/M fields using molecular dynamics[J]. Journal of Molecular Liquids, 2014, 197: 100-105.
[9] Foster DL, et al. The effect of various electrolyte additives on reversible Li-graphite intercalation[J], Journal of Power Sources, 2000, 85(2): 299-301.
[10] Feng L,et al. The effect of multi-component electrolyte additive on LiFePO4 based lithium ion batteries[J]. Accepted by 10th AOSFST, 2015.
[11] 柳明. 钛酸锂与电解液界面反应活性研究[D]. 北京: 清华大学, 2013.
[12] 伍科, 等. 镍钴锰/钛酸锂电池体系的热稳定性[J]. 材料研究学报, 2015, 29(1):75-80.
[13] 孙金华,丁辉. 化学物质热危险性评价[M] 北京: 科学出版社, 2005.
[14] Ohzuku T, Ueda A. Why transition metal (di) oxides are the most attractive materials for batteries[J]. Solid State Ionics, 1994, 69(3):201-211.
Flame-retardant electrolyte to improve the thermal stability of Li4Ti5O12battery
FENG Lihua,WANG Qingsong,SUN Jinhua
(State Key Laboratory of Fire Science, University of Science and Technology of China, Hefei 230026, China)
To improve the safety of lithium ion battery, vinylene carbonate, 1,3-propylene sulfite and dimethylacetamide are used in the baseline electrolyte (1.0mol/L LiPF6/ ethylene carbonate + diethyl carbonate (1:1 wt%)). The electrolyte with the additives added is named as flame-retardant electrolyte. The thermal stabilities of fully discharged Li4Ti5O12mixed with the baseline electrolyte and flame-retardant electrolyte, respectively, are investigated using a C80 micro calorimeter, and the thermodynamics parameters are calculated. The electrochemical performances of the Li /baseline electrolyte/ Li4Ti5O12and Li /flame-retardant electrolyte/ Li4Ti5O12half cells are evaluated using glavanostatic charge/discharge, cyclic voltammetry and SEM. The experimental results demonstrate that the fully discharged Li4Ti5O12-flame-retardant electrolyte system releases less heat, with a reduction of 35.4%, with higher activation energy, which can improve the thermal stability of Li4Ti5O12battery. Moreover, the flame-retardant electrolyte has a good stability and compatibility on the Li4Ti5O12anode electrode, and hence, it can be used in the Li4Ti5O12battery.
Lithium ion battery;Li4Ti5O12;Flame-retardant electrolyte;Thermal stability
2016-03-14;修改日期:2016-04-25
国家自然科学基金(51176183);中科院-欧盟地平线H2020匹配项目(211134KYSB20150004);中央高校基本科研业务费专项资金(WK2320000034)。
冯丽华(1991-),女,中国科学技术大学火灾科学国家重点实验室在读硕士,主要从事锂离子电池安全性方面的研究。
王青松,E-mail:pinew@ustc.edu.cn
1004-5309(2016)-00100-07
10.3969/j.issn.1004-5309.2016.02.07
TM 912.9; X915.5
A
