实时荧光PCR法鉴定食品中双歧杆菌
2016-11-07肖其胜杨捷琳杨惠琴丁卓平何宇平
肖其胜,杨捷琳,杨惠琴,丁卓平,何宇平,
(1.上海海洋大学食品学院,上海 201306;2.上海出入境检验检疫局,上海 200135)
实时荧光PCR法鉴定食品中双歧杆菌
肖其胜1,2,杨捷琳2,杨惠琴2,丁卓平1,何宇平2,*
(1.上海海洋大学食品学院,上海 201306;2.上海出入境检验检疫局,上海 200135)
根据双歧杆菌属16S rRNA基因的保守区序设计特异性引物和探针,建立一种鉴定食品中双歧杆菌属的实时荧光聚合酶链式反应(polymerase chain reaction,PCR)检测方法。对方法的特异性、灵敏度、重复性和体系抗干扰能力进行验证,最后采用该方法对市售25 份标示含双歧杆菌样品进行检测。结果表明:该检测方法可特异性检测双歧杆菌属细菌,对近缘的乳杆菌属、链球菌属及食品中常见菌群包括大肠杆菌、金黄色葡萄球菌、沙门氏菌等均无扩增。双歧杆菌DNA检测绝对灵敏度可达到2 pg,相对灵敏度可达到104CFU/mL。重复性测试表明相对标准偏差小于1%。同时进行了杂菌干扰检测实验,在培养物水平和纯基因组DNA水平上将青春双歧杆菌ATCC15703与大肠杆菌ATCC25922混合进行检测,检出Ct值较纯菌检测时无显著影响,表明建立的荧光PCR方法抗干扰能力良好。对25 份市售实际样品进行测试,有5 份标识含有“双歧杆菌”的样品未检测出双歧杆菌成分。本研究所建立的实时荧光PCR法能准确、快速检测食品中双歧杆菌属细菌。
实时荧光聚合酶链式反应;双歧杆菌;16S核糖体RNA;鉴定
双歧杆菌是一类存在于人体中非常重要的专性厌氧菌,于1899年首先在母乳喂养的健康婴儿粪便中发现并分离,研究证实双歧杆菌具有平衡肠道菌群、降胆固醇、延缓衰老及抗肿瘤等生理功能,是人体益生菌群的主要组成[1-4]。因此,添加双歧杆菌的微生态制剂开发研究已成为一大热点,广泛应用于食品、保健和医疗等领域[5-7]。
在双歧杆菌等益生菌制剂需求大增的同时,不断有报道指出国内外市场上双歧杆菌微生态制剂标示名称混乱,很多国家市场上双歧杆菌制品假冒代替现象严重[8]。由于没有相关法规,也没有一套完整的体系进行监控,一些酸奶品牌包装上虽然标示含有高科技益生菌群成分,但到底有无添加都是厂家自说自话,实际上可能与普通酸奶并无多大差异,甚至出现在双歧杆菌发酵乳制品中检验不出双歧杆菌的以假乱真现象[9-10]。为防止名不副实、以次充好现象的发生,建立基于物种分子特征性序列的双歧杆菌特异性检测鉴定方法至关重要。
目前基于DNA的检测方法由于快速、灵敏、省时省力等优点越来越多地应用到物种鉴定中[11-15]。其中实时荧光聚合酶链式反应(polymerase chain reaction,PCR)技术以其高特异性、快速、高灵敏度、无污染等优点,广泛地应用在食品检测中[16-19]。本研究旨在建立基于双歧杆菌属16S rRNA保守区基因的特异性序列运用实时荧光PCR方法检测鉴定食品中双歧杆菌成分的方法,以保障消费者利益,确保食品质量安全。
1 材料与方法
1.1材料与菌种

表1 标准菌种名称及编号Table1 Names and serial numbers of standard strains
发酵乳、婴幼儿配方奶粉和含益生菌食品均购自上海各大超市,所有样品均标示含有双歧杆菌。记录所有样品标示的菌种成分,包括菌种名称等。
根据卫生部《可用于食品的菌种名单》,本研究供试菌株包括双歧杆菌的6 个种共8 株;非双歧杆菌共46 株,包括12 株乳杆菌,2 株嗜热链球菌;以及大肠杆菌、金黄色葡萄球菌、沙门氏菌等其他细菌共32 株[20]。菌株样本详见表1。
1.2试剂与仪器
脱脂牛乳培养基:脱脂奶粉120.0 g,蒸馏水1.0 L,自然pH值。113 ℃灭菌20 min;强化梭菌琼脂培养基(CM1542) 北京路桥技术有限股份公司;柠檬酸三钠二水、氢氧化钠、无水乙醇、三氯甲烷、酚氯仿 生工生物工程(上海)股份有限公司;细菌基因组DNA提取试剂盒(Cat.:DP302-02)、蛋白酶K(20 mg/mL)、溶菌酶溶液(50 mg/mL)、琼脂糖、溴化乙锭、1×TE(Cat.:DP324-03)、50×TAE Electrophoresis buffer(Fermentas)、DL 2000 DNA Marker 天根生化科技有限公司;TaKaRa Ex TaqTMPCR试剂 宝生物工程(大连)有限公司;HR qPCR Master Mix(Cat:SJ-2101B)上海辉睿生物科技有限公司。所有化学试剂均为分析纯。
Vii7实时荧光PCR仪 美国ABI公司;麦氏比浊仪生物梅里埃中国有限公司;Eppendorf Centrifuge 5415R离心机、Thermomixer Comfort恒温振荡孵育器、Eppendorf Mastercycle Gradient PCR仪 德国艾本德公司;NanoVue Plus微量分光光度计 上海汇检菁英科技有限公司;200/2.2电泳仪、CLP 75.2314电泳槽 伯乐生化仪器公司;ALPHA 2S-2200凝胶分析成像系统 温州市安莱科学仪器有限公司。
1.3方法
1.3.1菌株的处理
冷冻干燥的双歧杆菌菌株首先转接于强化梭菌琼脂培养基中,37 ℃厌氧培养24 h,转接2代恢复活力用于后续实验。
1.3.2样品制备
相对灵敏度测试样品选取巴氏杀菌纯牛乳作为基质,代表菌株青春双歧杆菌ATCC15703和长双歧杆菌ATCC15707培养物稀释到109CFU/mL,取1 mL培养物加入到9 mL纯牛乳中,混匀后,按上述方法用纯牛乳10 倍梯度稀释至10 CFU/mL,每个浓度梯度样品取1 mL备用。
抗干扰能力测试样品是将青春双歧杆菌ATCC15703培养物由109CFU/mL 10 倍梯度稀释到104CFU/mL,分别与106、102CFU/mL两种浓度的大肠杆菌ATCC25922培养物1∶1混合备用。
1.3.3DNA提取
将不同菌株培养物、混合样品或实际样品,使用DNA提取试剂盒并按其操作步骤提取DNA,每次DNA提取均设置提取空白对照。用微量分光光度计测定DNA质量浓度后,置于-20 ℃保存备用。
1.3.4引物和探针设计
在NCBI网站上(http://www.ncbi.nlm.nih.gov/ nucleotide/)下载双歧杆菌属16S rRNA基因序列建立本地数据库,采用ClustalW软件对双歧杆菌属16S rRNA基因保守区进行比对,然后使用PrimerExpress软件设计引物(FBP:5'-GTT GGG TTA AGT CCC GCA A-3',RBP:5'-TGA AGC CCT GGA CGT AAG G-3',BP:5'-FAMACG TAA GGG GCA TGA TGA TCT GAC G-BHQ1-3')用于双歧杆菌鉴定,扩增产物片段长为145 bp。在NCBI网站上使用BLAST数据库比对引物和探针的理论特异性。细菌通用引物序列(27F-5'-AGA GTT TGA TCC TGG CTC AG-3',1492R-5'-TAC GGC TAC CTT GTT ACG ACT T-3')用于扩增提取的DNA[21],细菌通用引物可在所有细菌的DNA中扩增出目的条带。双歧杆菌属16S rDNA tuf基因的引物序列(Bif_tuf_F-5'-GTC CGT GAC CTC CTC GAC-3',Bif_tuf_R-5'-GTG GAA GGT CTC GAT GGA G-3')[22],可对实际样品中提取的双歧杆菌DNA进行扩增,片段大小为339 bp。引物和探针均由上海辉睿生物科技有限公司合成。
1.3.5PCR反应条件
1.3.5.1普通PCR
普通PCR采用25 μL体系进行PCR扩增,其中包括12.5 μL TaKaRa Ex Taq预混液,上、下游引物(10 μmol/L)各2 μL,2.5 μL DNA模板,去离子水补足至25 μL。
普通PCR反应条件:94 ℃预变性5 min;94 ℃变性30 s,54 ℃退火30 s,72 ℃延伸1.5 min,35个循环;72 ℃延伸10 min。
PCR产物检测方法:取5 μL PCR产物,在2.0%琼脂糖凝胶和0.2% TAE缓冲液中电泳30 min(120 V),然后采用凝胶成像系统拍照存档。
1.3.5.2实时荧光PCR
实时荧光PCR反应体系为25 μL,包含Master Mix 12.5 μL,上、下游引物(10 μmol/L)各1.25 μL,探针(10 μmol/L)0.625 μL,2.0 μL DNA模板,去离子水补足至25 μL。采用实时荧光PCR系统进行扩增。实时荧光PCR反应参数:95 ℃预变性5 min,95 ℃变性10 s,58 ℃退火45 s,45 个循环。荧光信号在58 ℃时收集。
1.3.6检测方法的特异性、灵敏度和重复性测试
特异性测试采用8 株双歧杆菌,14 株近缘乳酸菌,以及32 株其他细菌DNA为模板,采用建立的实时荧光PCR检测方法进行扩增。
检测方法的灵敏度测试包括绝对灵敏度和相对灵敏度。绝对灵敏度测试选取收集的8 株双歧杆菌,分别将提取的DNA溶液稀释至10、1、0.1、0.01、0.001、0.000 5、0.000 1 ng/μL,进行实时荧光PCR扩增。相对灵敏度测试采用配制的以纯牛乳作为背景的青春双歧杆菌ATCC15703、长双歧杆菌ATCC15707混合样品DNA为模板,采用建立的实时荧光PCR方法进行测试。灵敏度测试每个质量浓度设置5 个平行,实验重复4 次,即每个质量浓度得到20 个对应的Ct值,以满足不小于95%置信区间的要求,计算阳性扩增的次数。
重复性测试采用双歧杆菌标准菌株DNA的5 个质量浓度梯度稀释液分别进行扩增,每个质量浓度重复3 次,计算Ct值的标准偏差和相对标准偏差。
1.3.7实时荧光PCR体系抗干扰能力测试
对建立的实时荧光PCR体系抗干扰能力测试包括培养物水平和纯基因组DNA水平。培养物水平测试对配制的不同浓度青春双歧杆菌ATCC15703培养物与不同浓度大肠杆菌ATCC25922培养物混合样品提取的DNA进行实时荧光PCR扩增,每个混合样品重复3 次,计算Ct值的标准偏差。纯基因组DNA水平是将提取的青春双歧杆菌ATCC15703 DNA溶液稀释至10、1、0.1、0.01、0.001 ng/μL,在分别添加300 pg、3 ng和30 ng的大肠杆菌ATCC25922 DNA,对制备的混合DNA模板进行实时荧光PCR扩增,每个混合样品重复3 次,计算Ct值的标准偏差。
1.3.8实际样品检测
对收集购买的标注含有“双歧杆菌”成分的25 份实际样品进行测试。每个样品取样2 份,提取DNA后采用细菌通用引物、双歧杆菌属通用引物以及建立的双歧杆菌检测引物和探针进行扩增,每个样品重复扩增2 次。用细菌通用引物进行扩增是为了确保DNA的有效提取,避免假阴性出现。
2 结果与分析
2.1检测方法的特异性
如图1A所示,所有双歧杆菌类样品均产生显著的荧光增幅,Ct值介于10~16之间;而以其他近缘乳酸菌以及常见食源致病菌样品DNA为模板均无荧光扩增信号(图1B),采用细菌通用引物对所有样品进行扩增,均可见目的条带(数据未在此呈现)。因此,建立的实时荧光PCR检测方法特异于双歧杆菌属检测。
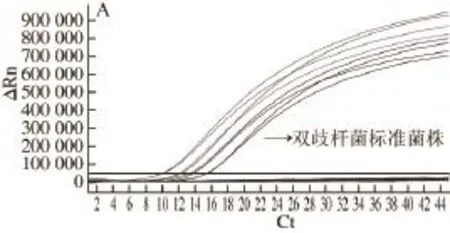
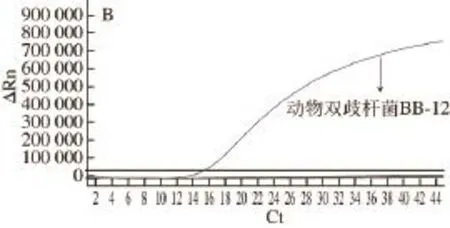
图1 实时荧光PCR检测的特异性测试Fig.1 Specificity of the real-time PCR method
2.2检测方法的灵敏度
2.2.1实时荧光PCR的绝对灵敏度

表2 实时荧光PCR检测的绝对灵敏度Table2 Absolute limit of detection (LOD) of the real-time PCR method
如表2所示,两歧双歧杆菌ATCC25921、青春双歧杆菌ATCC15703、短双歧杆菌ATCC15700和乳双歧杆菌HN019样品可稳定检出的最低质量浓度为0.000 5 ng/μL,即检测下限为1 pg(模板为2 μL)。动物双歧杆菌BB-12、乳双歧杆菌Bi-07、长双歧杆菌ATCC15707和婴儿双歧杆菌ATCC15697样品可稳定检出的最低质量浓度为0.001 ng/μL,即检测下限为2 pg。综合8 株双歧杆菌的检测结果,本研究建立的实时荧光PCR体系的绝对灵敏度可达到2 pg。
2.2.2实时荧光PCR的相对灵敏度

表3 实时荧光PCR检测的相对灵敏度Table3 Relative LOD of the real-time PCR method
相对灵敏度测试用纯牛乳作为稀释基质,按照10 倍稀释方法将青春双歧杆菌ATCC15703、长双歧杆菌ATCC15707培养物稀释到108~101CFU/mL,各浓度取1 mL提取DNA后测定可以稳定扩增的最低浓度,结果如表3所示。当青春双歧杆菌和长双歧杆菌混入牛乳中时可以稳定检出的最低浓度为104CFU/mL。综合上述结果,本研究建立的实时荧光PCR体系的相对灵敏度可达到104CFU/mL。
2.3检测方法的重复性
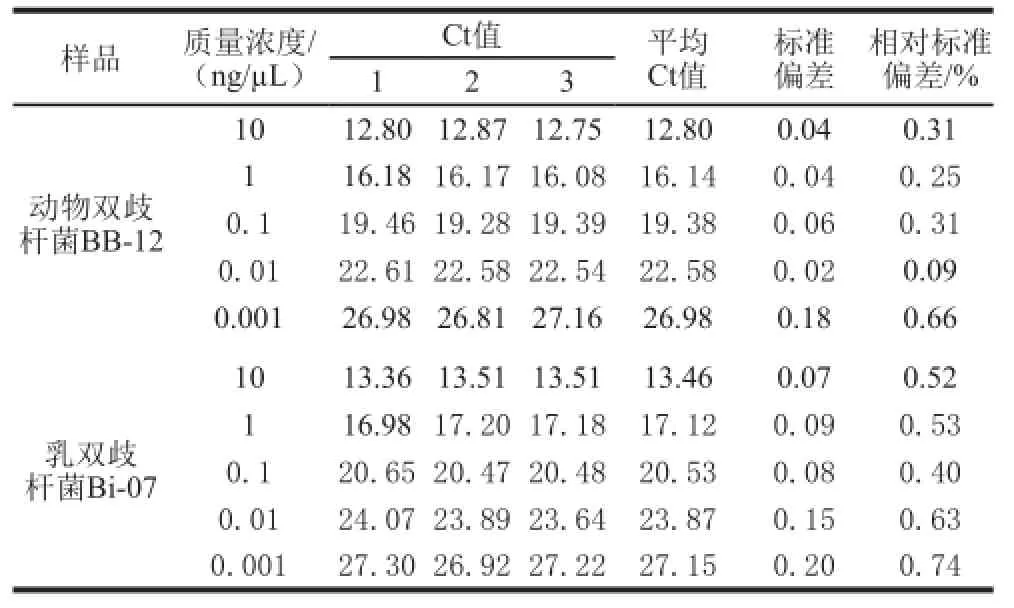
表4 实时荧光PCR重复性Table4 Repeatability of the real-time PCR method
如表4所示,动物双歧杆菌BB-12样品5 个质量浓度样品的Ct值的标准偏差在0.02~0.18之间,相对标准偏差在0.09%~0.66%之间;乳双歧杆菌Bi-07样品各质量浓度DNA扩增Ct值的标准偏差在0.07~0.20之间,相对标准偏差在0.40%~0.74%之间,均小于1%,在可接受范围内;其他6 株双歧杆菌重复性检测结果与动物双歧杆菌BB-12和乳双歧杆菌Bi-07一致(数据未在此呈现),因此,建立的实时荧光PCR检测体系具有较好的重复性。
2.4实时荧光PCR体系抗干扰能力
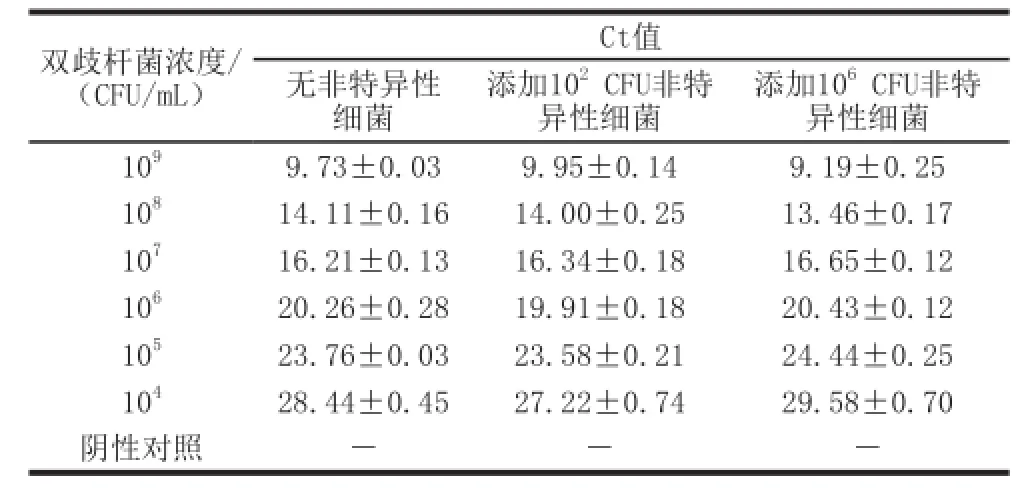
表5 实时荧光PCR体系培养物水平抗干扰能力Table5 Anti-disturbance ability of the real-time PCR method at the culture level
在实际的微生态制剂检测中,检测对象往往不是单一菌株,而是目标菌和杂菌的混合物,因此在培养物水平和纯基因组DNA水平上对建立的荧光定量PCR体系进行抗干扰实验。培养物水平实验结果(表5)表明:存在102CFU/mL和106CFU/mL大肠杆菌ATCC25922的条件下,该荧光PCR反应体系对双歧杆菌的检测灵敏度未受显著影响,检出限仍维持在1×104CFU/mL;不同浓度青春双歧杆菌ATCC15703培养物,分别添加102CFU/mL和106CFU/mL大肠杆菌,对检出Ct值无显著影响,均不影响双歧杆菌的检出。
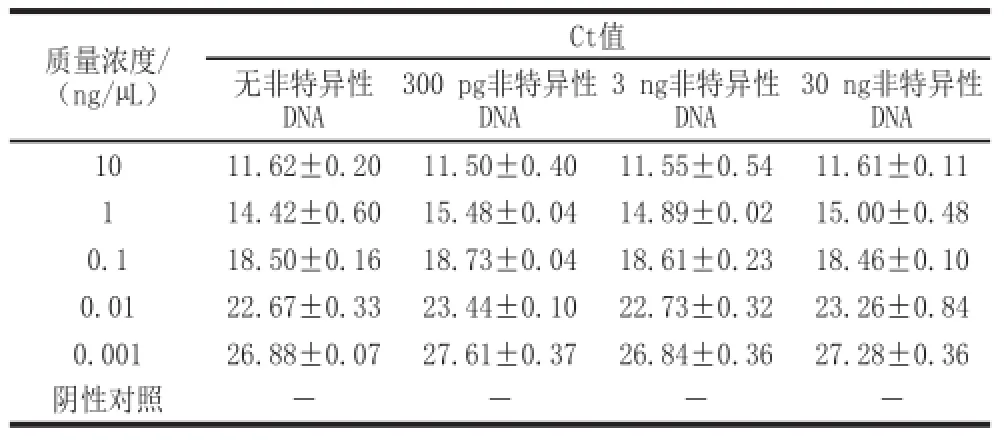
表6 实时荧光PCR体系纯基因组DNA水平抗干扰能力Table 6 Anti-disturbance ability of the real-time PCR method at the level of the genome
纯基因组DNA水平实验结果(表6)表明:不同浓度青春双歧杆菌ATCC15703 DNA,分别添加300 pg、3 ng和30 ng大肠杆菌ATCC25922 DNA,各质量浓度水平DNA检出Ct值未受显出影响,均不影响双歧杆菌的检出。
2.5实际样品的测定结果

图2 实际测试样品DNA的PCR扩增结果Fig.2 PCR results for 25 commercial samples
对25 份市售实际样品测定结果表明,所有样品采用细菌通用引物时均可扩增出目的条带(图2A),表明所有样品都成功提出适合扩增的DNA;采用双歧杆菌属16S rDNA tuf基因引物可在除1、7、8、9、11号样品为模板的扩增中出现目的条带(图2B),表明1、7、8、9、11号样品中没有检测出双歧杆菌。
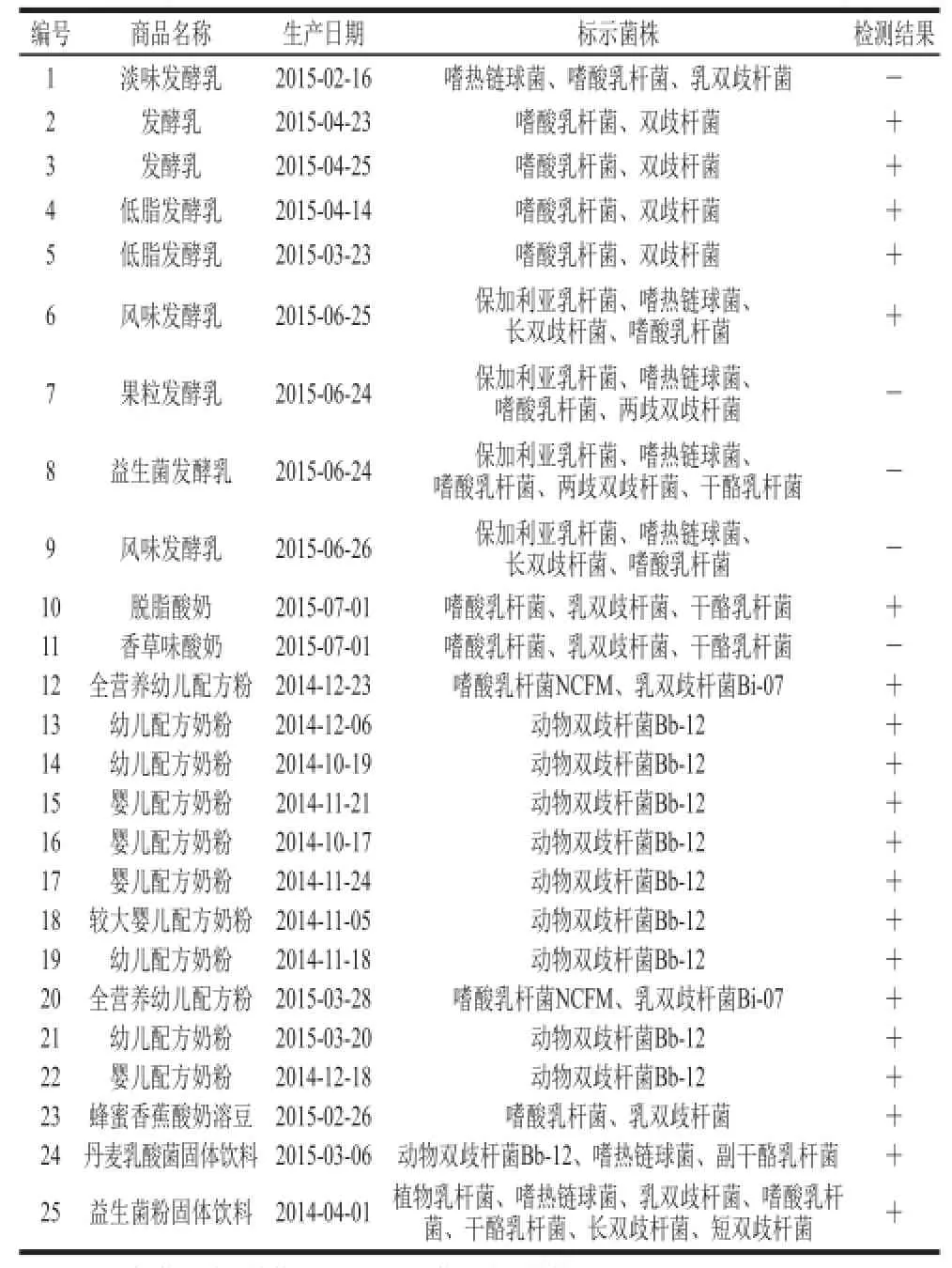
表7 实际样品实时荧光PCR检测结果Table7 Results of real-time PCR detection of commercial products
采用建立的双歧杆菌实时荧光PCR方法进行扩增时(表7),在1、7、8、9、11号样品中没有显著的荧光信号,即无阳性扩增曲线;表明上述5 个样品未检出双歧杆菌成分。这一结果与双歧杆菌属普通PCR检测结果一致。
3 讨 论
添加双歧杆菌的食品作为重要的益生菌制剂越来越受到消费者的重视。卫生部曾发布发酵乳等含益生菌食品安全国家标准,标准中只规定益生菌限量不小于1×106CFU/g(mL)[23]。目前对于益生菌菌种、菌株的检测鉴定缺乏相应的标准。在市场上,通常宣称“添加”了双歧杆菌的食品,比普通乳酸菌食品售价要高出1~3 倍。受利益驱使,我国益生菌制剂鱼龙混杂,核心的菌株依赖进口。
GB 4789.34—2012《食品微生物学检验:双歧杆菌的鉴定》规定了双歧杆菌的检验鉴定,该标准利用传统培养基进行细菌形态和生化鉴定,并结合气相色谱法测定双歧杆菌的有机酸代谢产物,但此方法耗时耗力,难以在实际检测中推广[24]。近年来,基于分子生物学的多种手段已被用于双歧杆菌菌株鉴定,Sheu等[22]根据双歧杆菌16S rDNA tuf基因设计通用引物,采用普通PCR方法检测食品中双歧杆菌,但普通PCR法操作繁琐,不适用于大批量产品快速检测;吴燕涛等[25]利用实时荧光定量PCR法测定发酵乳中双歧杆菌数量,但没有对方法的特异性、灵敏度及重复性做进一步研究。
基于此,本研究利用双歧杆菌属16S rRNA基因保守区建立了实时荧光PCR方法用于检测食品中双歧杆菌成分。经实验室的全面测试,建立的检测方法特异于双歧杆菌属的检测,且具有很好的重复性;检测方法可稳定检测到的DNA量可达到2 pg,相对灵敏度为104CFU/mL双歧杆菌成分;且建立的荧光PCR方法在培养物水平和纯基因组DNA水平都有很强的抗干扰能力,可以满足日常检测的要求。对市售实际样品的检测结果表明,25 份样品有5 份未检出双歧杆菌成分,表明存在不按照产品标识添加益生菌的可能性。
[1] PICARD C, FIORAMONTI J, FRANCOIS A, et al. Review article:bifidobacteria as probiotic agents physiological effects and clinical benefits[J]. Alimentary Pharmacology and Therapeutics, 2005, 22(6):495-512. DOI:10.1111/j.1365-2036.2005.02615.x.
[2] 倪朋海. 双歧杆菌调理和改善肠道相关疾病作用的探讨[J]. 中国初级卫生保健, 2015, 29(3): 97-98. DOI:10.3969/j.issn.1001-568X.2015.03.0042.
[3] COLLADO M C, HERNANDEZ M. Identifi cation and differentiation of Lactobacillus, Streptococcus and Bifidobacterium species in fermented milk products with bifidobacteria[J]. Microbiological Research, 2007, 162(1): 86-92. DOI:10.1016/j.micres.2006.09.007.
[4] OFIR G, BIRTE S, VIBORG A H, et al. The extracellular proteome of Bifi dobacterium animalis subsp. lactis BB-12 reveals proteins with putative roles in probiotic effects[J]. Proteomics, 2011, 11(12): 2503-2514. DOI:10.1002/pmic.201000716.
[5] 朱俊晨, 李世敏, 魏小青. 双歧杆菌对人体的生理作用及研究进展[J].中国微生态学杂志, 2000(1): 53-55. DOI:10.3969/j.issn.1005-376X.2000.01.028.
[6] 吕锡斌, 何腊平, 张汝娇, 等. 双歧杆菌生理功能研究进展[J]. 食品工业科技, 2013, 34(16): 353-358.
[7] 闫磊, 王毳, 曾庆祝, 等. 双歧杆菌的功能特性及其应用前景[J]. 现代食品科技, 2007, 23(3): 86-89. DOI:10.3969/ j.issn.1673-9078.2007.03.029.
[8] SHAH N. Bifidobacterium spp. applications in fermented milks[J]. Encyclopedia of Dairy Sciences, 2002: 147-151. DOI:10.1016/B0-12-227235-8/00044-4.
[9] 网易探索. 自欺欺人的益生菌饮料[EB/OL]. (2010-10-23) [2016-01-18]. http://discovery.163.com/special/probiotic/.
[10] 马志英. 酸奶: 益生菌越多越好吗[J]. 家庭医药: 快乐养生, 2015(2): 16.
[11] BUNESOVA V, VLKOVA E, KOLLER J, et al. Identification of Bifi dobacterium strains from faeces of lambs[J]. Small Ruminant Research, 2012, 105(1/2/3): 355-360. DOI:10.1016/ j.smallrumres.2011.12.004.
[12] TURRONI F, SINDEREN D V, VENTURA M. Genomics and ecological overview of the genus Bifidobacterium[J]. International Journal of Food Microbiology, 2011, 149(1): 37-44. DOI:10.1016/ j.ijfoodmicro.2010.12.010.
[13] BALCAZER J L, BLAS I D, RUIZ-ZARZUELA I, et al. Sequencing of variable regions of the 16S rRNA gene for identifi cation of lactic acid bacteria isolated from the intestinal microbiota of healthy salmonids[J]. Comparative Immunology Microbiology and Infectious Diseases, 2007, 30(2): 111-118. DOI:10.1016/j.cimid.2006.12.001.
[14] SHEU S J, CHEN H C, LIN C K, et al. Development and application of tuf gene-based PCR and PCR-DGGE methods for the detection of 16 Bifidobacterium species[J]. Journal of Food and Drug Analysis, 2013, 21(2): 177-183. DOI:10.1016/j.jfda.2013.05.008.
[15] SARA F, FLORIANA C, RAFFAELLA C, et al. Identification and functional traits of lactic acid bacteria isolated from Ciauscolo salami produced in Central Italy[J]. Meat Science, 2014, 98(4): 575-584. DOI:10.1016/j.meatsci.2014.05.019.
[16] JEAN-PIERRE F, PASCAL Q, PATRICK T. Molecular quantifi cation of lactic acid bacteria in fermented milk products using real-time quantitative PCR[J]. International Journal of Food Microbiology, 2004, 97(2): 197-207. DOI:10.1016/j.ijfoodmicro.2004.04.020.
[17] DELROISSE J M, BOULVIN A L, PARMENTIER I, et al. Quantification of Bifidobacterium spp. and Lactobacillus spp. in rat fecal samples by real-time PCR[J]. Microbiological Research, 2008, 163(6): 663-670. DOI:10.1016/j.micres.2006.09.004.
[18] SEBASTIAN R, FRANCK G, ENER R, et al. Development of a realtime RT-PCR method for enumeration of viable Bifidobacterium longum cells in different morphologies[J]. Food Microbiology, 2010, 27(2): 236-242. DOI:10.1016/j.fm.2009.10.010.
[19] BENEDETTA B, CATERINA A, MONICA G, et al. Development of a multiplex real time PCR to detect thermophilic lactic acid bacteria in natural whey starters[J]. International Journal of Food Microbiology, 2013, 160(3): 290-297. DOI:10.1016/j.ijfoodmicro.2012.10.011.
[20] 卫生部. 卫法监发(2010)65号附件可用于食品的菌种名单[S]. 北京:中国标准出版社, 2010.
[21] MAHMOOD S, FREITAG T E, PROSSER J I. Comparison of PCR primer-based strategies for characterization of ammonia oxidizer communities in environmental samples[J]. Fems Microbiology Ecology, 2006, 56(3): 482-493. DOI:10.1044/cds21.3.78.
[22] SHEU S J, HWANG W Z, CHENG C Y, et al. Use of tuf gene-based primers for the PCR detection of probiotic Bifidobacterium species and enumeration of bifi dobacteria in fermented milk by cultural and quantitative real-time PCR methods[J]. Journal of Food Science, 2010, 75(8): 521-527. DOI:10.1111/j.1750-3841.2010.01816.x.
[23] 卫生部. GB 19302—2010 发酵乳[S]. 北京: 中国标准出版社, 2010.
[24] 卫生部. GB 4789.34—2012 食品微生物学检验: 双歧杆菌的鉴定[S].北京: 中国标准出版社, 2012.
[25] 吴燕涛, 刘晓莉, 曹悦, 等. 实时荧光定量PCR法测定发酵乳中双歧杆菌[J]. 食品科学, 2013, 34(8): 172-175. DOI:10.7506/spkx1002-6630-201308036.
Identification of Bifi dobacterium Strains in Foods by Real-Time PCR
XIAO Qisheng1,2, YANG Jielin2, YANG Huiqin2, DING Zhuoping1, HE Yuping2,*
(1. College of Food Science and Technology, Shanghai Ocean University, Shanghai 201306, China;2. Shanghai Exit-Entry Inspection and Quarantine Bureau, Shanghai 200135, China)
A real-time PCR method was developed to identify Bifi dobacterium in foods. Specifi c primers and probes targeting the conserved region of the 16S rRNA gene of Bifi dobacterium were designed. The specifi city, sensitivity, reproducibility and system anti-interference ability of the proposed method were verifi ed. Twenty-fi ve commercial products labeled “containing Bifidobacterium” were tested by the real-time fluorescence PCR assay. Results showed that the developed method was highly specifi c for Bifi dobacterium detection. The detection limits were 2 pg using eight species of Bifi dobacterium as the templates, and the relative detection limits were 104CFU/mL. Standard deviations and relative standard deviations (RSDs)of Ct values for fi ve DNA concentrations were all in the acceptable range. The Ct values were not affected by a mixture of Bifi dobacterium adolescentis ATCC15703 and Escherichia coli ATCC25922 at both the culture level and genomic DNA level, which showed that the fluorescence PCR method has good anti-interference ability. Five samples were detected without Bifi dobacterium. Thus, considering its high specifi city, sensitivity and repeatability, the real-time PCR could be used to rapidly and accurately identify Bifi dobacterium in foods.
real-time polymerase chain reaction (RT-PCR); Bifi dobacterium; 16S ribosomal RNA; identifi cation
10.7506/spkx1002-6630-201620030
TS207.4
A
1002-6630(2016)20-0177-06
肖其胜, 杨捷琳 杨惠琴, 等. 实时荧光PCR法鉴定食品中双歧杆菌[J]. 食品科学, 2016, 37(20): 177-182. DOI:10.7506/ spkx1002-6630-201620030. http://www.spkx.net.cn
XIAO Qisheng, YANG Jielin, YANG Huiqin, et al. Identification of Bifidobacterium strains in foods by real-time PCR[J]. Food Science, 2016, 37(20): 177-182. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201620030. http://www.spkx.net.cn
2016-01-26
上海市科委长三角联合科技攻关项目(14495810200);国家质检总局项目(2015IK227)
肖其胜(1989—),男,硕士研究生,研究方向为食品营养与安全。E-mail:xiaoqsheng@163.com
何宇平(1964—),男,研究员,本科,研究方向为食品质量与安全。E-mail:heyuping@shciq.gov.cn
