基于磁性免疫传感器的牛乳中四环素残留检测方法的构建
2016-11-07康怀彬马红燕徐宝成罗登林张瑞华邹良亮
康怀彬,马红燕,李 芳,徐宝成,罗登林,张瑞华,邹良亮
(1.河南科技大学食品与生物工程学院,河南 洛阳 471003;2.河南省食品原料工程技术研究中心,河南 洛阳 471003)
基于磁性免疫传感器的牛乳中四环素残留检测方法的构建
康怀彬1,2,马红燕1,李芳1,徐宝成1,2,罗登林1,2,张瑞华1,邹良亮1
(1.河南科技大学食品与生物工程学院,河南 洛阳 471003;2.河南省食品原料工程技术研究中心,河南 洛阳 471003)
建立一种高灵敏磁性光学免疫传感检测方法,可用于生鲜乳中四环素残留的快速检测。方法的检出限为0.03 ng/mL,定量限为0.20 ng/mL;四环素质量浓度在0.25~32 ng/mL时,荧光信号值与质量浓度之间具有良好的线性关系,其回归方程决定系数(R2)为0.995 9;本方法准确度高,四环素不同添加水平条件下的回收率在82.6%~97.0%之间;该方法具有良好的重复性,测定结果的日内精密度和日间精密度均在5.0%以内;本方法与高效液相色谱-串联紫外检测结果高度吻合。
磁珠;免疫反应;荧光检测;四环素;生鲜乳
四环素(tetracycline,TC)属于广谱抗生素,对革兰氏阳性菌、革兰氏阴性菌、立克次氏体属、支原体属、衣原体属等均有抑制作用[1]。TC在奶牛养殖业是一种被广泛使用的抗生素,由于滥用或不遵守休药期,造成其在动物性食品如牛乳、肌肉等组织中的残留日益严重,可导致牛乳发酵异常,并造成人体肠道菌群紊乱和肝、肾毒性[2-3]。因此,欧盟第675/92号令规定:肌肉、牛乳中的TC类化合物的总量不得超过100 ng/g,肾脏、肝脏、鸡蛋中分别不得超过600、300 ng/g和200 ng/g[4];我国农业部2002年12月24日发布的《动物性食品中兽药最高残留限量》以及国家质量监督检验检疫总局和商务部2002年11月18日发布的《供港动物及其产品的生产、经营和检验检疫的有关要求》均规定牛乳中TC类药物的最高残留限量为TC、土霉素、金霉素均小于100 μg/kg[5-6]。
目前,动物源性食品中TC残留检测主要采用微生物法[7]、仪器分析法[8-10]和酶联免疫分析法[11-12]。但微生物分析法常常出现假阳性结果,并且灵敏度较差[7];仪器分析法通常需要对样品进行复杂的前处理,操作繁琐,测试时间长、费用高[13];传统的酶联免疫法虽然简便、快速,但灵敏度较差,难以满足抗生素残留痕量、超痕量检测的要求[14]。针对上述问题,本研究开发了一种磁性光学免疫传感检测法,可用于生鲜乳中TC残留的快速、高灵敏检测,为保障牛乳制品的安全提供更加有效的技术支持。
1 材料与方法
1.1材料与试剂
生鲜牛乳样品 当地奶牛养殖场;灭菌纯牛乳市购;环氧基磁性微粒(粒径1 μm) 无锡百运纳米科技有限公司;牛血清白蛋白(bull serum albumin,BSA)、吐温-20 德国罗氏公司;TC标准抗体、TC-卵清白蛋白抗原(TC-ovalbumin,TC-OVA) 江南大学食品学院食品安全研究室;盐酸TC、强力霉素(盐酸多西环素)、青霉素、氯霉素、头孢克肟、链霉素、庆大霉素标准品(纯度>97%) 中国食品药品检定研究院;辣根过氧化物酶标记的羊抗鼠IgG(horse radish peroxidase-IgG,HRP-IgG) 武汉博士德生物工程有限公司;对羟基苯乙酸(4-hydroxyphenylacetic acid,p-HPA,纯度>99%) 梯希爱(上海)化成工业发展有限公司;甲醇(色谱纯)、乙腈(色谱纯)、乙二胺四乙酸二钠盐二水合物(纯度≥99%) 国药集团化学试剂有限公司;磷酸氢二钠(Na2HPO4·12H2O,纯度9 9%) 西陇化工股份有限公司;柠檬酸(C6H8O7·H2O,纯度≥99.5%) 上海阿拉丁生化科技股份有限公司;其他试剂均为分析纯。
1.2仪器与设备
Cary Eclipse荧光分光光度计、高效液相色谱-串联紫外(high performance liquid chromatography-ultra violet,HPLC-UV)检测器 安捷伦科技有限公司;UV-2600型紫外-可见分光光度计 日本岛津公司;四维旋转混匀器海门市其林贝尔仪器有限公司;XW-80A微型旋涡混合仪 上海沪西分析仪器厂有限公司;6孔型磁性分离率架 洛阳惠尔纳米科技有限公司;Milli-Q超纯水器(电阻率18.2 MΩ·cm,25 ℃) 美国Millipore公司。
1.3方法
1.3.1溶液的配制
偶联液:pH 8.5的0.1 mol/L磷酸盐缓冲(phosphate buffer saline,PBS)溶液;封闭液:在偶联液中添加质量分数2% BSA溶液、质量分数2%甘氨酸和1.3 mol/L无水硫酸钠;淋洗液:在pH 7.4的0.01 mol/L PBS溶液中添加体积分数0.1%吐温-20;磁珠保存液:在淋洗液中添加10 mg/mL的BSA溶液和质量分数0.02%叠氮钠溶液;抗体稀释液:在pH 7.2的0.01 mol/L PBS溶液中添加质量分数0.1% BSA溶液;0.1 mol/L三(羟甲基)氨基甲烷(tris(hydroxymethyl)aminomethane,Tris)-HCl底物缓冲溶液:12.116 g Tris和2.452 mL质量分数38% HCl溶液定容于1 000 mL灭菌超纯水中。
1.3.2磁性光学免疫传感检测方法设计思路
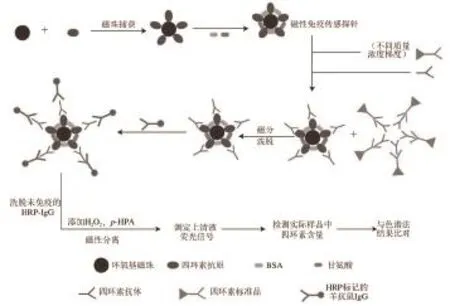
图1 磁珠荧光免疫传感检测方法构思图Fig.1 Schematic representation of the fluorescence immunoassay detection method based on magnetic beads
如图1所示,其基本操作步骤:利用环氧基磁珠偶联TC抗原,并封闭磁珠表面剩余的活性位点,制备磁性免疫传感探针。根据免疫反应原理,加入TC标准品和TC抗体,让探针与标准品竞争性结合抗体,从而形成“磁珠-抗原-抗体”和“标准品-抗体”2 种免疫复合物。利用外加磁场使“磁珠-抗原-抗体”复合物迅速聚集沉降,除去上清液(“标准品-抗体”复合物)。加入HRP-IgG进行第2次免疫反应,使HRP-IgG与抗体结合,形成“磁珠-抗原-抗体-二抗”夹心免疫复合物,反应完成后进行充分洗涤,去除未免疫的HRP-IgG。加入底物液p-HPA和H2O2,在HRP的催化作用下H2O2氧化p-HPA产生强荧光物质联苯乙酸(bi-p,p′-hydroxyphenylacetic aicd,DBDA)[15-16]。荧光反应完成后进行磁分,取上清液用荧光分光光度计(激发波长317 nm,吸收波长414 nm)测定荧光信号值。根据荧光信号值与样品中TC含量之间的竞争抑制关系,制作标准曲线,完成定量检测。
1.3.3磁性光学免疫传感检测步骤
第1步,磁性免疫传感探针制备。1)磁珠偶联TCOVA。用移液枪准确移取混合均匀的磁珠1 mg于2 mL离心管中,用1 000 μL偶联液对磁珠进行3 次洗涤,磁分、弃上清液;然后取60 μL质量浓度为1 mg/mL的TC抗原工作液至磁珠中,再补加偶联液至500 μL,混匀,并于20 ℃ pH 8.5的体系中反应14 h,磁分、去上清液,得免疫磁珠。2)封闭。在1 mg免疫磁珠中加入1 000 μL封闭液,混匀,置于样品混合仪上于20 ℃条件下封闭14 h,磁分、弃上清液;然后分别用1 000 μL偶联液和1 000 μL淋洗液依次对磁珠进行洗涤3 次;最后将所制备的磁性免疫传感探针保存于1 000 μL保存液中,备用。
第2步,取适量环氧基磁性免疫传感探针加入到2 mL离心管中,再加入200 μL淋洗液,置于旋涡混合仪上混匀,然后磁分5 min,弃上清液。按同样步骤重复洗涤1 次。
第3步,加入200 μL不同质量浓度的TC标准品(或200 μL待分析牛乳样品)和100 μL一定稀释倍数的TC抗体,用旋涡混合仪混匀,然后置于样品混合仪上在37 ℃、80 r/min条件下反应40 min。
第4步,竞争反应结束后,取出离心管磁分弃上清液,然后用200 μL淋洗液对磁珠重复洗涤3 次。
第5步,向每支离心管中加入100 μL经3 000 倍稀释的HRP-IgG,用旋涡混合仪混匀,然后置于样品混合仪上在37 ℃、80 r/min条件下反应40 min。
第6步,第2次免疫反应结束后,取出离心管,磁分弃上清液,然后用200 μL淋洗液对磁珠重复洗涤4 次,以充分洗脱未结合的HRP-IgG。
第7步,再次向离心管中分别加入100 μL一定浓度的H2O2和15 mmol/L的p-HPA,充分混匀,避光反应35 min。在HRP的催化作用下H2O2氧化p-HPA产生强荧光物质DBDA。然后添加50 μL浓度为0.5 mol/L的硫酸溶液终止反应5 min。
第8步,终止反应结束后,磁分、取出上清液并加入1 mL 0.1 mol/L的Tris-HCl底物缓冲液,用旋涡混合仪混匀。
第9步,取1 mL反应溶液于微量四面透光石英比色皿中,用荧光分光光度计测定荧光信号值。所有测定数值均需要扣除背景信号值。
1.3.4磁性光学免疫传感检测法关键工作条件的确定
1.3.4.1H2O2浓度的选择
当H2O2浓度过低时,氧化反应不能充分进行,荧光信号值偏低;而浓度过高时,H2O2能淬灭HRP的活性,降低荧光信号数值[17]。因此,本实验考察了H2O2浓度为1、3、5、7、9、11 mmol/L时对荧光信号值的影响。其他实验条件为:免疫磁珠添加量30 μg,无TC标准品竞争,TC抗体稀释倍数4 000 倍,HRP-IgG稀释倍数3 000 倍,p-HPA浓度15 mmol/L,具体操作步骤见1.3.3节。空白对照(用作仪器调零)不添加p-HPA,以100 μL超纯水代替,其他参数及步骤同样品。阴性对照(用作考察磁珠的非特异性吸附)不添加TC抗体,以100 μL抗体稀释液代替,其他参数及步骤同样品。
1.3.4.2免疫磁珠最佳用量及抗体最佳工作稀释倍数的选择
采用棋盘法,免疫磁珠(从左到右列排)选择5、10、15、20、25 μg和30 μg,TC抗体(从上到下横排)2 000~32 000 倍稀释。其他实验条件为:无TC标准品竞争,H2O2浓度选用1.3.4.1节优化结果,p-HPA浓度15 mmol/L,HRP-IgG 3 000 倍稀释,具体操作步骤见1.3.3节。空白对照和阴性对照同1.3.4.1节。
1.3.5磁性光学免疫传感检测方法验证
1.3.5.1方法检出限、定量限和线性范围
按照磁性免疫荧光传感检测方法的操作步骤,分别用质量浓度为32、16、8、4、2、1、0.5 ng/mL和0.25 ng/mL的TC标准品与免疫磁珠进行竞争反应,测定各组的荧光信号值(B),并同时测定无TC标准品竞争条件下的荧光信号值(B0),计算各质量浓度条件下的吸光度比值(B/B0)。每个质量浓度点独立平行测定3 次,以平均吸光度比值(B/B0)为横坐标,对应的TC标准品质量浓度的对数值(lgC)为纵坐标进行线性回归,得到标准曲线及线性回归方程。
采用建立的磁性免疫光学传感检测方法对不含TC的空白样品进行检测,连续进行10 次独立重复测定,计算10 次所得荧光吸收值的平均值和标准偏差,将平均值与3 倍标准偏差的差值代入标准曲线的线性回归方程计算出对应的TC质量浓度,即为该方法的检出限(limit of detection,LOD)。另外,将平均值与10 倍标准偏差的差值代入线性回归方程计算出对应的TC质量浓度,即得该方法的定量限(limit of quantifi cation,LOQ)。以荧光信号值为横坐标,对应的TC标准品质量浓度的对数值为纵坐标进行线性回归,以线性相关系数(R2)为判定标准,确定线性范围。
1.3.5.2方法的准确度、重复性和再现性验证
在空白生鲜乳和商品灭菌乳中分别添加1、10、25、50、100 ng/mL和150 ng/mL的TC标准品,然后用所建立的磁性免疫光学传感检测方法进行分析,每个质量浓度点独立平行测定3 次。根据实测值计算不同添加水平下的回收率。回收率、重复性和再现性实验根据分析方法验证标准进行[18]。
1.3.5.3方法特异性验证
选取6 种常用抗生素(强力霉素、青霉素、氯霉素、头孢克肟、链霉素和庆大霉素)来评估本方法的特异性。首先,利用本方法对上述6 种抗生素进行测定,分别得到它们的50%抑制浓度(half maximal inhibitory concentration,IC50)。然后,以上述6 种抗生素与TC的交叉反应率来评价本方法的特异性,并按下式计算。
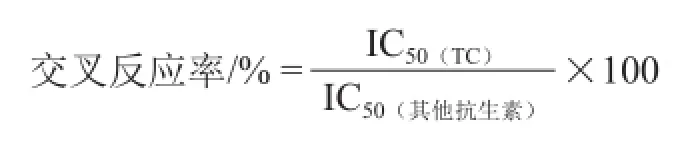
1.3.6磁性光学免疫传感检测法在生鲜牛乳样品检测中的应用及与HPLC-UV检测结果比对
将45 份生鲜乳样品和5 份空白加标样品以随机方式进行编号,然后以本研究建立的磁性光学免疫传感检测法对样品进行检测;同时采用GB/T 22990—2008《牛奶和奶粉中土霉素、四环素、金霉素、强力霉素残留量的测定:液相色谱-紫外检测法》[19]对样品比对检测,考察2 种方法的符合度。检测时,每份样品均独立平行测定3 次。
1.4数据统计分析
采用SPSS 13.0对实验数据进行处理和分析。
2 结果与分析
2.1磁性光学免疫传感检测方法的建立
2.1.1H2O2浓度对荧光信号值的影响
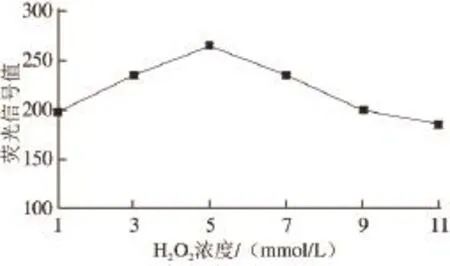
图2 H2H2O2浓度对荧光信号值的影响Fig.2 Effect of H2O2concentration on the signal intensity of fluorescence
由图2可以看出,当H2O2浓度从1 mmol/L增加到5 mmol/L时,荧光信号值逐渐增强,从198.663增加到264.567;然而当进一步增加H2O2浓度时,荧光信号值却反而下降,特别是当H2O2浓度增加到11 mmol/L时信号值仅为185.327。出现上述现象的原因主要是:在低浓度区间,H2O2浓度的增加使HRP催化p-HPA的氧化反应更加充分,产生了更多含量的DBDA;然而当进一步增加浓度时,过多的H2O2可能淬灭了部分HRP的活性,导致荧光信号值降低。这与魏波[20-21]等报道的现象一致。综上分析可知最优的H2O2浓度为5 mmol/L。
2.1.2免疫磁珠最佳用量及抗体最佳工作稀释倍数的确定

表1 不同免疫磁珠用量及TC抗体稀释倍数条件下的荧光信号值Table1 Fluorescence signal intensity of obtained with different amounts of magnetic beads added and TC-antibody dilutions
从表1可以看出,随着磁珠用量增加及抗体稀释倍数的降低,荧光信号呈现逐渐增强的趋势。由于磁性免疫荧光检测体系是基于竞争免疫的原理而建立的,因此无竞争体系条件下的信号不能太强也不能太弱。如果信号太强,则会降低标准品(或待检物)的竞争抑制效应,使检测灵敏度下降;相反,如果信号太弱,虽然能够获得较好的竞争抑制效果,但是也会增加实验操作过程中的偶然误差,使平行测定结果的变异系数增大[22]。因此,本研究选择荧光吸收峰值在100附近时的免疫磁珠用量及TC抗体稀释倍数作为后续IC50测定时的工作参数,筛选结果见表2,对应工作条件下的IC50如图3所示。

表2 磁性免疫荧光传感检测系统的免疫磁珠用量及TC抗体稀释倍数Table2 The amounts of magnetic beads and TC-antibody dilutionsused in fluorescence immunosensor detection system

图3 磁性免疫荧光传感检测系统不同工作条件下的TC抗体IC50Fig.3 IC50of anti-TC antibody obtained by fluorescence immunosensor detection system under different working conditions
从图3可以看出,磁性免疫荧光检测系统在不同工作条件下,TC抗体的IC50及测定结果的重复性均存在一定的差异,其中免疫磁珠用量15 μg、一抗8 000倍稀释时,其IC50最低,为0.73 ng/mL,3 次测定值的相对标准偏差(relative standard deviation,RSD)为6.15%;其次是添加20 μg磁珠时对应的IC50为1.12 ng/mL,RSD为4.04%;相比而言,免疫磁珠用量10 μg、一抗4 000 倍稀释时,所得IC50最高,为3.29 ng/mL,RSD为7.03%。根据IC50最低化的评价原则,并尽量满足方法重复性好的要求[23],本研究选择免疫磁珠用量20 μg、一抗8 000 倍稀释作为后续样品测定时的工作参数。
2.1.3磁性光学免疫传感检测方法的建立
磁性光学免疫传感检测法的关键工作条件为:免疫磁珠用量20 μg;TC抗体稀释倍数8 000 倍,用量100 μL;H2O2浓度5 mmol/L,用量100 μL;其他实验条件及操作步骤同1.3.3节所述。
2.2磁性免疫光学传感检测方法验证
2.2.1检测方法的检出限、定量限和线性范围
TC质量浓度在0.25~32 ng/mL的范围内,标准曲线具有良好的线性关系,线性回归方程为y=-4.193 1x+ 2.349 3,决定系数(R2)为0.995 9。利用本方法对空白生鲜乳样品(不含TC残留)重复测定10 次,计算出荧光信号平均值为120.639,标准偏差为3.283,将平均值与3 倍标准偏差的差值(110.791)代入回归方程计算出LOD为0.03 ng/mL,将平均值与10 倍标准偏差的差值(87.810)代入回归方程计算得LOQ为0.20 ng/mL。与常规酶联免疫检测法(多克隆抗体)[2]和HPLC-串联质谱分析法[9]相比,本方法在检测牛乳中TC残留时的LOQ比常规HPLC-UV检测法低24 倍;与限进介质-磁性微球的磁分散萃取-液相色谱法[5]相比,本方法的LOD和LOQ分别比其低260 倍和130 倍。在检测牛乳中TC残留时,本方法的LOQ之所以比常规仪器分析法,特别是比液相色谱-串联质谱法低,主要是因为仪器分析时需要对样品进行复杂的前处理,如液液萃取、固相萃取柱、阳离子交换柱等进行净化和浓缩,容易导致痕量目标物的丢失;而用本方法进行检测时,无需对样品进行复杂前处理,直接加入磁珠,利用其高分散性和超强顺磁性以及免疫反应的特异性和高灵敏度实现对痕量TC的检测。
2.2.2方法的准确度、重复性和再现性验证
从表3可以看出,TC在生鲜牛乳中的加标回收率在84.2%~96.6%之间,RSD为1.7%~6.4%,在商品灭菌乳中其回收率在82.6%~97.0%之间,RSD为2.7%~6.9%,表明本方法在检测低、中、高6 个不同质量浓度水平的TC时均具有较高的准确度,并且稳定性好,能够满足后续实际样品的检测需求。此外,本方法日内和日间精密度实验结果见表4。

表3 磁性免疫荧光传感检测法加标回收实验结果(n=3)Table3 Recoveries of TC determined by fluorescence immunosensor analysis based on magnetic beads (n = 3)
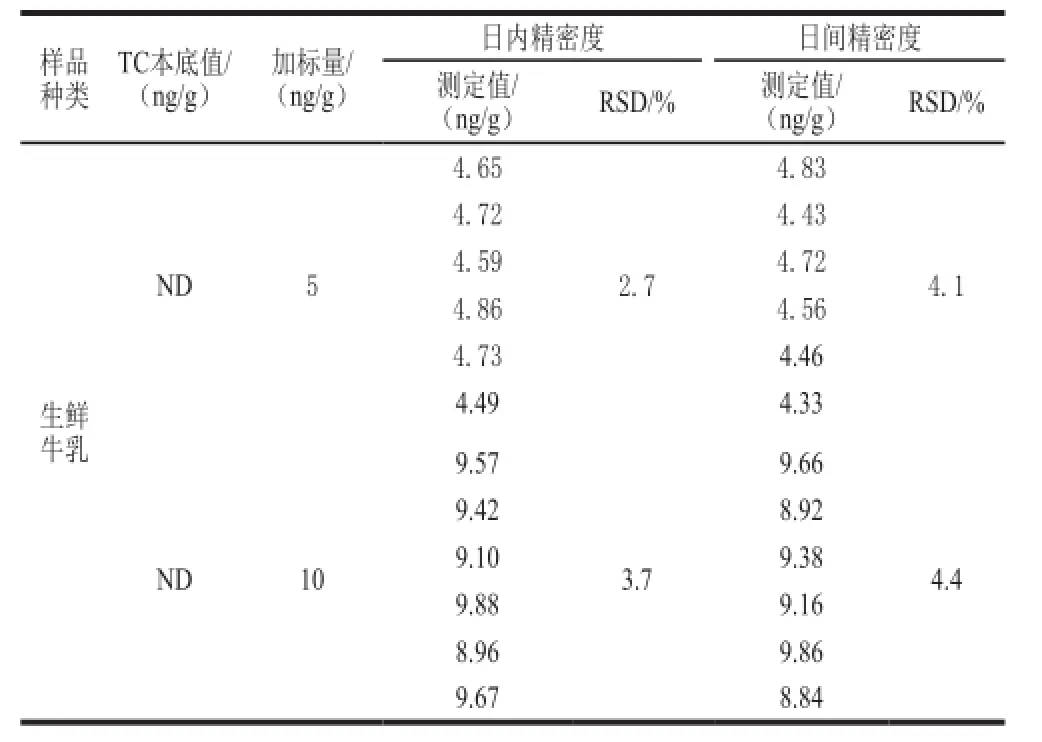
表4 磁性免疫荧光传感检测法的重复性和再现性验证(n=6)Table4 Repeatability and reproducibility of the quantitative results for TC determined by fluorescence immunosensor analysis based on magnetic beads ( n= 6)
从表4可知,在TC添加量为5 ng/g生鲜乳时,本方法测定结果的日内精密度为2.7%,日间精密度为4.1%;在添加量为10 ng/g时,其日内和日间精密度分别为3.7%和4.4%。总体来看,对同一加标样品进行测定时,其日间精密度值要大于日内精密度,表明日间测定值的离散程度稍大,但都在5.0%以内,这也证明本方法具有较高的重复性和再现性,符合方法学验证标准的要求[18],适合于生鲜乳中TC残留的快速、高灵敏度检测。
2.2.3方法特异性验证结果
从表5可知,本方法在检测强力霉素时,交叉反应率小于4%,当检测青霉素、氯霉素、头孢克肟、链霉素和庆大霉素时,它们与TC的交叉反应率均小于0.4%。因此,本方法对TC具有很高的特异性,可用于牛乳中TC残留的高灵敏检测。

表5 磁性免疫荧光传感检测法的特异性Table5 Specificity of fluorescence immunosensor analysis based on magnetic beads
2.3磁性免疫荧光传感检测法与HPLC-UV检测结果比对
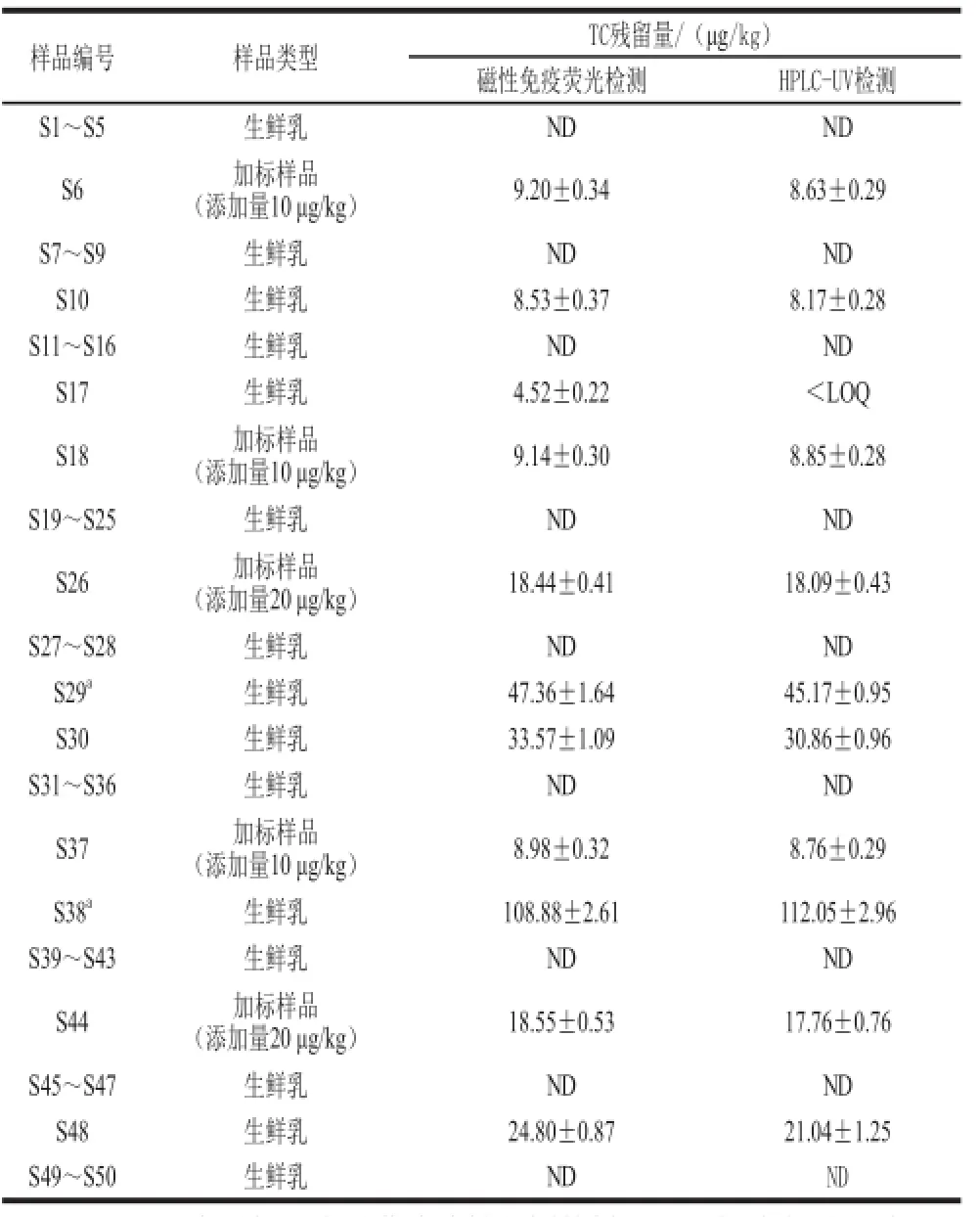
表6 实际样品比对检测结果(n=3)Table6 Comparison of detection results of TC residue in real samples (n = 3)
由表6可知,2 种检测方法具有较高的符合性,除S17(TC含量低于HPLC-UV定量限)外,其他44 种样品的盲测结论完全一致。另外,将10 份阳性样品(S17除外)的比对检测结果进行线性回归分析,如图4所示,线性回归方程为y=1.029 7x-1.661 5,相关系数为0.997 4,表明这2 种方法在检测牛乳中TC残留时其结果具有较高的吻合性。进一步分析加标样品(S6、S18、S26、S37、S44)检测结果可知,磁性免疫荧光检测法的准确度比HPLC-UV稍高,这主要是由于HPLC在检测TC残留时需要先对牛乳中的TC进行液液萃取,然后还需要经过固相萃取柱和阳离子交换柱进行净化、浓缩,步骤较多,容易导致目标物丢失,使检测准确度下降[5,9,19,24-25]。相比而言,磁性免疫荧光检测具有较高的灵敏度和准确度,这主要归因于磁珠免疫反应的高特异性和荧光检测的高灵敏度[21,26]。
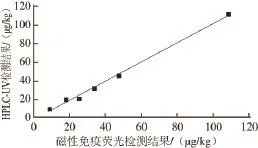
图4 磁性免疫荧光检测与HPLC-UV检测结果的相关性(n=10)Fig.4 Correlation of the results obtained by both fluorescence immunosensor analysis and reference HPLC-UV methods for milk sample (n = 10)
3 结 论
本研究以环氧基磁珠为载体,开发了一种磁性光学免疫传感检测方法,可用于生鲜牛乳中TC残留的快速、高灵敏检测。方法灵敏度高,LOD为0.03 ng/mL;LOQ为0.20 ng/mL,LOQ比常规HPLC-UV检测法低24 倍。本方法检测结果准确可靠,并具有良好的重复性和再现性,与常规HPLC-UV比对检测结果吻合度高。
[1] URAPEN R, MASAWAT P. Novel method for the determination of tetracycline antibiotics in bovine milk based on digital-imagebased colorimetry[J]. International Dairy Journal, 2015, 44: 1-5. DOI:10.1016/j.idairyj.2014.12.002.
[2] CONZUELO F, CAMPUZANO S, GAMELLA M, et al. Integrated disposable electrochemical immunosensors for the simultaneous determination of sulfonamide and tetracycline antibiotics residues in milk[J]. Biosensors and Bioelectronics, 2013, 50: 100-105. DOI:10.1016/j.bios.2013.06.019.
[3] FENG Y, ZHONG D, MIAO H, et al. Carbon dots derived from rose flowers for tetracycline sensing[J]. Talanta, 2015, 140: 128-133. DOI:10.1016/j.talanta.2015.03.038.
[4] Commission Regulation (EEC) No. 675/92 amending Annexes Ⅰand Ⅲ of Council Regulation (EEC) No. 2377/90 laying down a community procedure for the establishment of maximum residue limits of veterinary medicinal products in foodstuffs of animal origin[G]// Offi cial Journal of the European Communities No. L73. Brussels: The Commission of the European Communities, 1992: 8-14.
[5] 农业部. 2002年第235号公告: 动物性食品中兽药最高残留限量[EB/OL]. (2002-12-24) [2016-03-18]. http://www.aqsiq.gov. cn/ xxgk_13386/jgfl /jckspaqj/ywxx/201210/t20121016_252217.htm.
[6] 国家质量监督检验检疫总局, 商务部. 2002年118号公告: 供港动物及其产品的生产、经营和检验检疫的有关要求[EB/OL].(2002-11-18) [2016-03-18]. http://www.mofcom.gov.cn/article/b/ c/200404/20040400206546.shtml.
[7] DANG P K, DEGAND G, DANYI S, et al. Validation of a twoplate microbiological method for screening antibiotic residues in shrimp tissue[J]. Analytica Chimica Acta, 2010, 672(1/2): 30-39. DOI:10.1016/j.aca.2010.03.055.
[8] 杨旭, 刘美娇, 林深, 等. 限进材料固相萃取-高效液相色谱在线联用检测牛奶中四环素类抗生素残留[J]. 分析化学, 2016, 44(1): 146-151. DOI:10.11895/j.issn.0253-3820.150443.
[9] NEBOT C, GUARDDON M, SECO F, et al. Monitoring the presence of residues of tetracyclines in baby food samples by HPLC-MS/MS[J]. Food Control, 2014, 46: 495-501. DOI:10.1016/ j.foodcont.2014.05.042.
[10] 卜明楠, 石志红, 康健, 等. QuEChERS结合LC-MS/MS同时测定虾肉中72 种兽药残留[J]. 分析测试学报, 2012, 31(5): 552-558. DOI:10.3969/j.issn.1004-4957.2012.05.008.
[11] 国占宝, 武玉香, 田文礼, 等. 食品中四环素类残留的酶联免疫检测试剂盒的研制[J]. 食品科学, 2011, 32(2): 333-337.
[12] WANG S, LIU J, YONG W, et al. A direct competitive assaybased aptasensor for sensitive determination of tetracycline residue in honey[J]. Talanta, 2015, 131: 562-569. DOI:10.1016/ j.talanta.2014.08.028.
[13] 方慧文, 卢跃鹏, 周原, 等. 超高效液相色谱串联质谱法同时快速测定牛奶中不同类型的11 种兽药残留[J]. 分析测试学报, 2013, 32(2):262-266. DOI:10.3969/j.issn.1004-4957.2013.02.022.
[14] CHAFER-PERICAS C, MAQUIEIR A Á, PUCHADES R. Fast screening methods to detect antibiotic residues in food samples[J]. TrAC Trends in Analytical Chemistry, 2010, 29(9): 1038-1049. DOI:10.101 6/j.trac.2010.06.004.
[15] GUILBAULT G G, Jr BRIGNAC P J, JUNEAU M. New substrates for the fl uorometric determin ation of oxidative enzymes[J]. Analytical Chemistry, 1968, 40(8): 1256-1263. DOI:10.1021/ac60264a027.
[16] NIU S Y, LI Q Y, REN R, et al. Enzyme-enhanced fluorescence detection of DNA on etched optical fibers[ J]. Biosensors and Bioelectronics, 2009, 24(9): 2943-2946. DOI:10.1016/j.bios.2009.02.022.
[17] SCHMIDT A, SCHUMACHER J T, REICHELT J, et al. Mechanistic and molecular investigati ons on stabilization of horseradish peroxidase C[J]. Analytical Chemistry, 2002, 74(13): 3037-3045. DOI:10.1021/ ac0108111.
[18] USP 37. USP 1225—2007 Validation of compendial procedures[S]. Washington: The United Sta tes Pharmacopieial Convention, 2007.
[19] 中国国家标准化管理委员会. GB/T 22990—2008 牛奶和奶粉中土霉素、四环素、金霉素、强力霉素残留量的测定: 液相色谱-紫外检测法[S]. 北京: 中国标准出版社, 2008.
[20] 魏波. 基于磁珠-酶放大免疫荧光方法检测猪胸膜肺炎放线杆菌感染血清中ApxIVA抗体[D]. 武汉: 华中农业大学, 2012: 15-19.
[21] WEI B, LI F, YANG H, et al. Magnetic beads-based enzymatic spectrofluorometric assay for rapid and sensitive detection of antibody against ApxIVA of Actinobacillus pleuropn eumoniae[J]. Biosensors and Bioelectronics, 2012, 35(1): 390-393. DOI:10.1016/ j.bios.2012.03.027.
[22] 张道宏. 黄曲霉毒素杂交瘤细胞株的选育及免疫层析检测技术研究[D]. 北京: 中国农业科学院, 2011: 54-63.
[23] 陈秀金. 拟除虫菊酯类农药免疫快速检测方法及其定量构效模型的建立[D]. 无锡: 江南大学, 2013: 53-57.
[24] 贾涛. 液相色谱-串联质谱法检测牛奶中的四环素类药物[J]. 中国乳业, 2015(4): 54-58. DOI:10.3969/j.issn.1671-4393.2015.04.016.
[25] 智若岚. 猪肉 及鸡蛋中四环素类抗生素残留检测方法研究[D]. 哈尔滨: 东北农业大学, 2011: 27-34.
[26] LI F, ZHOU R, ZHAO K, et al. Magnetic beads-based electrochemical immunosensor for detection of pseudora bies virus antibody in swine serum[J]. Talanta, 2011, 87: 302-306. DOI:10.1016/ j.talanta.2011.09.049.
Establishment of Magnetic Bead-Based Immunosensor for the Detection of Tetracycline Residues in Milk
KANG Huaibin1,2, MA Hongyan1, LI Fang1, XU Baocheng1,2, LUO Denglin1,2, ZHANG Ruihua1, ZOU Liangliang1
(1. College of Food and Bioengineering, Henan University of Science and Technology, Luoyang 471003, China;2. Henan Engineering Research Center of Food Material, Luoyang 471003, China)
A highly sensitive and rapid immunofluorescence assay for the detection of tetracycline residues in raw milk based on magnetic beads was developed. The limit of detection (LOD) and limit of quantifi cation (LOQ) of this method were 0.03 and 0.20 ng/mL, respectively. The fl uorescence intensity was linear with the concentration of tetracycline in the range of 0.25 to 32 ng/mL with a coeffi cient of determination of 0.995 9 (R2= 0.995 9). The recoveries of TC spiked at different concentrations were between 82.6% and 97.0%, indicating that the method is accurate. Furthermore, precision, calculated as relative standard deviation (RSD), was below 5.0% for intra-day and inter-day determinations, indicating good repeatability of the method. The results of tetracycline residues in raw milk determined by this method and HPLC-UV were highly consistent.
magnetic beads; immunoreaction; fluorescence detection; tetracycline; raw milk
10.7506/spkx1002-6630-201620019
TS207.3
A
1002-6630(2016)20-0113-07
康怀彬, 马红燕, 李芳, 等. 基于磁性免疫传感器的牛乳中四环素残留检测方法的构建[J]. 食品科学, 2016, 37(20):113-119. DOI:10.7506/spkx1002-6630-201620019. http://www.spkx.net.cn
KANG Huaibin, MA Hongyan, LI Fang, et al. Establishment of magnetic bead-based immunosensor for the detection of tetracycline residues in milk[J]. Food Science, 2016, 37(20): 113-119. (in Chinese with English abstract) DOI:10.7506/ spkx1002-6630-201620019. http://www.spkx.net.cn
2016-04-30
国家自然科学基金青年科学基金项目(31501563);洛阳市畜牧局项目(2518);河南科技大学校级创新团队项目(2015XTD007)
康怀彬(1963—),男,教授,硕士,研究方向为农畜产品加工及质量控制。E-mail:khbin001@163.com
