黄芪多糖提高小叶杨抗病性1)
2016-11-07马玲问荣荣邱本军王步勇刘雪峰
马玲 问荣荣 邱本军 王步勇 刘雪峰
(东北林业大学,哈尔滨,150040)
黄芪多糖提高小叶杨抗病性1)
马玲 问荣荣 邱本军 王步勇 刘雪峰
(东北林业大学,哈尔滨,150040)
研究了不同质量浓度黄芪多糖处理过的小叶杨(Populussimonii)在接种杨树烂皮病菌(Valsasordida)后其体内与抗性有关的物质含量和酶活性的变化,探究了黄芪多糖增强植物抗病性的作用机制。结果显示:黄芪多糖对杨树烂皮病菌菌丝生长具有抑制作用;低质量浓度黄芪多糖在短时间内能够提高小叶杨叶片内可溶性糖质量分数,而高质量浓度黄芪多糖可使小叶杨叶片内可溶性糖质量分数缓慢持续增加;0.010 g·L-1黄芪多糖处理后,叶片内可溶性蛋白质量分数和苯丙氨酸解氨酶活性均显著高于对照组;而总酚活性在0.100 g·L-1黄芪多糖处理组中达最高;黄芪多糖各质量浓度处理后,叶片内叶绿素a、b及总量均显著高于对照组。黄芪多糖能够通过提高与抗性相关的物质的含量及酶的活性来提高林木自身抗性,从而促进林木的生长发育。
黄芪多糖;小叶杨;杨树烂皮病菌;抗病性
To explore the mechanism ofPopulussimoniitreated with Astragalus polysaccharide in enhancing the disease resistance, we measured the concentration of active substances and the activities of enzymes in simonii seedlings sprayed with Astragalus polysaccharides and then inoculated withValsasordida. Astragalus polysaccharide could inhibited the growth ofV.sordida. Low concentrations of Astragalus polysaccharides could improve the soluble sugar content in leaf of simonii seedlings in a short period of time, while the soluble sugar was increased slowly and continually for a long time at high concentrations of Astragalus polysaccharides. Astragalus polysaccharides of 0.01 mg/mL could significantly improve soluble protein content and PAL activity inP.simonii, compared with the control. After treated with 0.1 mg/mL Astragalus polysaccharide, the total phenolic content inPopulussimoniireached the highest. Different concentrations of Astragalus polysaccharid improved the content of chlorophyll inP.simonii, and were significantly higher than the control group. Astragalus polysaccharide could raise the substances content and enzyme activity inP.simoniirelated to the resistance to improve the resistance of trees, and thus promote the growth of trees.
杨树(Populusspp.)是世界上分布最广泛的树种,其天然种有100多种[1]。我国杨树资源丰富,天然种约50种,且分布面积广。由于轮伐期短、根系发达、树冠繁茂,能够减少水土流失,使杨树成为速生丰产林的主要树种,并在生态、工业和生活上具有多种用途[2]。近年来,随着林业科技成果的广泛应用,杨树新品种的大力推广,杨树栽植面积的扩大及杨树人工林营造面积的迅速增加,使得病害发生日趋严重,给林业生产和生态建设带来巨大的损失。杨树病害防治应采取能够促进杨树生长并提高抗病性的栽培措施[3],提高树木的自身抗性,能够抵御侵染生长不良、树势衰弱的弱寄生菌,进而减少农药的使用量,减轻生态环境污染、农药残留和抗药性等。目前已有多种植物抗性诱导剂被开发,寡糖类和聚糖类已在农业中得到广泛应用。黄芪多糖在结构与单糖组分上与寡糖和聚糖相类似,同时能够提高动物机体的免疫能力。因此,本研究通过检测与抗性相关的物质含量及酶活性,探究黄芪多糖提高林木自身抗性的机制。
1 材料与方法
1.1 材料
黄芪多糖为东北林业大学森林保护学实验室提取物,小叶杨(Populussimonii)为实验室种子繁殖,杨树烂皮病菌(Valsasordida)由东北林业大学林学院森林保护实验室保存。
1.2 方法
1.2.1 菌种活化
取杨树烂皮病试管斜面保存的菌株,接种到PDA培养基上,培养箱中25 ℃避光培养,备用。
1.2.2 黄芪多糖对杨树烂皮病菌菌丝生长影响的测定
将纯化的黄芪多糖制成0.01、0.10、1.00、10.00 g·L-1的溶液,取相应溶液与PDA培养基按1∶10比例混合后,最终制成0.001、0.010、0.100、1.000 g·L-1的含药平板,以加入相同量蒸馏水的PDA培养基为对照。用直径0.5 cm打孔器取活化的菌饼放置于平板中间,培养箱中25 ℃避光培养。对照菌落生长至培养基边缘时,用十字交叉法测量菌落直径。
抑制率=(1-a/b)×100%。
式中:a为试验组菌落直径;b为对照组菌落直径。
1.2.3 黄芪多糖对接种病原菌的小叶杨生理生化指标影响的测定
小叶杨幼苗的处理:选取大小、长势较一致的1年生小叶杨植株5组,每组20株。试验组分别用0.001、0.010、0.100、1.000 g·L-1黄芪多糖溶液喷雾处理,每天18:00喷施,连续喷施2 d,对照组喷施蒸馏水。黄芪多糖处理植株7 d后,采用烧伤法在距小叶杨根1/3处造成伤口,并在伤口处接种杨树烂皮病孢子悬浮液,后用塑料薄膜将浸泡过孢子悬浮液的脱脂棉包裹在伤口处,保湿培养2 d后取下脱脂棉。在接种6 d后选取出现症状植株。继续培养并在此后24、48、72 h进行取样,每组3次重复,测定其生理生化指标。
可溶性糖测定:称取0.25 g小叶杨鲜叶,剪碎放入具塞试管中,加5 mL蒸馏水,沸水浴30 min,过滤冷却,定容至25 mL,吸取2 mL待测液于具塞试管内,冰水浴内加5 mL蒽酮-H2SO4试剂,充分混匀,沸水浴中煮10 min,水冷却后测620 nm吸光值,吸取2 mL蒸馏水作为空白对照。
可溶性糖质量分数=((C×Vt)/(W×Vs×1 000))×100%。
式中:C为由回归直线计算的测定样品中葡萄糖的质量;Vt为提取液总体积;W为取用样品干质量;Vs为测吸光值时取用的提取液体积;1 000为换算系数,lmg=1 000 μg。
可溶性蛋白测定:称取0.25 g小叶杨鲜叶,加入5 mL蒸馏水在研钵中充分研磨,3 000 r·min-1离心10 min,上清液即为待测液。取0.5 mL待测液于试管中,加入2.5 mL G-250染料,充分混匀,室温静置2~5 min后测OD595,重复3次,根据蛋白标准曲线计算可溶性蛋白质量分数。
总酚活性的测定:用50%甲醇将单宁酸配成0.100 g·L-1的标准单宁酸溶液。在试管中分别加入0.1、0.2、0.3、0.4、0.5、0.6、0.7、0.8、0.9、1.0 mL的标准单宁酸溶液,加入去离子水使单宁酸溶液最后体积为5 mL,加入0.5 mL Folin-酚试剂,摇匀,静置6~8 min后加入2.5 mL 20% NaCO3,摇匀,置于50 ℃恒温水浴中避光保存30 min,测定OD760,以5 mL去离子水代替标准单宁酸溶液为调零管。以单宁酸的量为横坐标,吸光度为纵坐标,绘制标准曲线。
取一定质量的小叶杨叶片,放置于干燥箱中60 ℃烘干至恒质量,称取0.2 g烘干样品置于带盖试管中,加入10 mL 50%甲醇,震荡提取。10 h后抽滤,25 mL容量瓶定容,得总酚提取液。取0.2 mL的提取液加入试管中,加入4.8 mL去离子水,制备成5 mL待测溶液,进行总酚活性测定。
总酚质量分数=(CD×V)/(1 000×M)。
式中:CD为由标准曲线查得的待测液质量浓度;V为粗提液总体积;M为样品干质量。
苯丙氨酸解氨酶(PAL)活性的测定:取0.5 g小叶杨新鲜叶片,加入5 mL 0.05 mol·L-1、pH=8.8的硼酸缓冲液(内含0.005 mol·L-1巯基乙醇),再加1 mL 10% PVP和少量石英砂,冰浴下研磨充分,于4 ℃、10 000 r·min-1离心20 min,上清液即为待测液。参照滕涛[4]测定方法,在试管中依次加入1 mL 0.02 mol·L-1苯丙氨酸,2.8 mL蒸馏水,0.2 mL酶液,以0.2 mL蒸馏水作为调零管。于40 ℃水浴保温30 min,倒入石英比色皿中测定290 nm处OD值,以OD290值变化0.01为1个酶活性单位。
PAL活性=(OD290×V)/(0.01×T×W×VE)。
式中:V为提取液总体积;T为反应时间;W为样品鲜质量;VE为反应酶液体积。
叶绿素质量分数的测定:取去梗后2.0 g新鲜小叶杨叶片,放入40 mL乙醇-丙酮(95%乙醇∶丙酮=1∶1)中避光浸泡24 h,待叶片变成白色后,过滤得待测液。以乙醇-丙酮为对照,测定其A663和A645。
叶绿素a质量分数(Ca)=((12.7A663-2.69A645)×V)/
(1 000×W)。
叶绿素b质量分数(Cb)=((22.9A645-4.68A663)×V)/
(1 000×W)。
叶绿素总质量分数(C(a+b))=Ca+Cb。
式中:V为提取液体积;W为叶片鲜质量。
1.3 数据处理
采用SPSS 16.0统计软件进行方差分析,采用Duncan’s新复极差法比较各处理间的差异显著性(p<0.05)。
2 结果与分析
2.1 黄芪多糖对杨树烂皮病菌菌丝生长的影响
0.001、0.010、0.100、1.000 g·L-1黄芪多糖对杨树烂皮病菌菌丝生长的抑制率分别为(5.899±0.863)%、(6.379±0.840)%、(12.158±0.679)%、(4.519±0.200)%,抑制作用随质量浓度的增加总体呈现先升高后降低的趋势,在0.100 g·L-1处理时,抑制率达到最大值(12.16%)。
2.2 黄芪多糖对接种病原菌的小叶杨生理生化指标的影响
2.2.1 对可溶性糖质量分数的影响
由表1可见,小叶杨在接种杨树烂皮病病原菌后,叶片内可溶性糖质量分数随时间的延长逐渐降低。24 h时,0.001、0.100 g·L-1黄芪多糖处理组小叶杨叶片内可溶性糖质量分数均显著高于对照组,分别是对照组的1.41、1.18倍;随时间的延长,各处理组可溶性糖质量分数降低,而1.000 g·L-1黄芪多糖处理组在24 h与对照组无显著差异,在48、72 h,均显著高于对照组,分别是对照组的1.33、1.41倍。低质量浓度黄芪多糖在短时间内能够提高小叶杨叶片内可溶性糖质量分数,而高质量浓度黄芪多糖可使对小叶杨叶片内可溶性糖质量分数缓慢持续增加。
2.2.2 对可溶性蛋白质量分数的影响
由表1可见,小叶杨在接种杨树烂皮病病原菌后,叶片内可溶性蛋白质量分数保持在较高的水平。各质量浓度黄芪多糖处理24、48 h,其可溶性蛋白质量分数均显著高于对照组,且0.01 g·L-1处理组最高,分别是对照组的1.87、1.17倍;随作用时间的增加,在72 h,除0.01 g·L-1处理组,可溶性蛋白质量分数均出现降低现象。黄芪多糖作用初期能够提高小叶杨叶片内可溶性蛋白质量分数,而72 h小叶杨叶片内可溶性蛋白质量分数只在0.01 g·L-1处理下显著增加。
2.2.3 对PAL活性的影响
由表1可知,小叶杨在接种杨树烂皮病病原菌后,不同质量浓度黄芪多糖对叶片内PAL活性的影响不同。24 h,除0.010 g·L-1黄芪多糖处理,其他处理组与对照组无显著差异;48 h时,除1.000 g·L-1处理外,其他处理组均显著高于对照组;72 h时,除0.010 g·L-1处理外,其他处理组均显著低于对照组。在24、48、72 h,0.010 g·L-1处理组的PAL活性均达最高值,且显著高于对照组,分别为对照组的1.45、1.29、1.17倍。
2.2.4 对总酚活性的影响
采用Folin试剂比色法在760 nm测定以单宁酸为标准物配制的单宁酸标准溶液的吸光值。对测得数据采用回归分析法计算单宁酸标准曲线,回归方程为y=0.048 3x+0.038 1(R2=0.998 1,呈线性关系的质量浓度范围是2~20 mg·L-1)。
由表1可知,小叶杨在接种杨树烂皮病病原菌后,对叶片内总酚活性有不同程度的影响。经过不同处理时间,除1.000 g·L-1,其他质量浓度的黄芪多糖处理后,叶片总酚活性均显著高于对照组。当黄芪多糖质量浓度为0.100 g·L-1时,总酚活性最高,24 h时为对照组的1.53倍,48 h时为对照组的1.79倍,72 h为对照组的1.54倍。
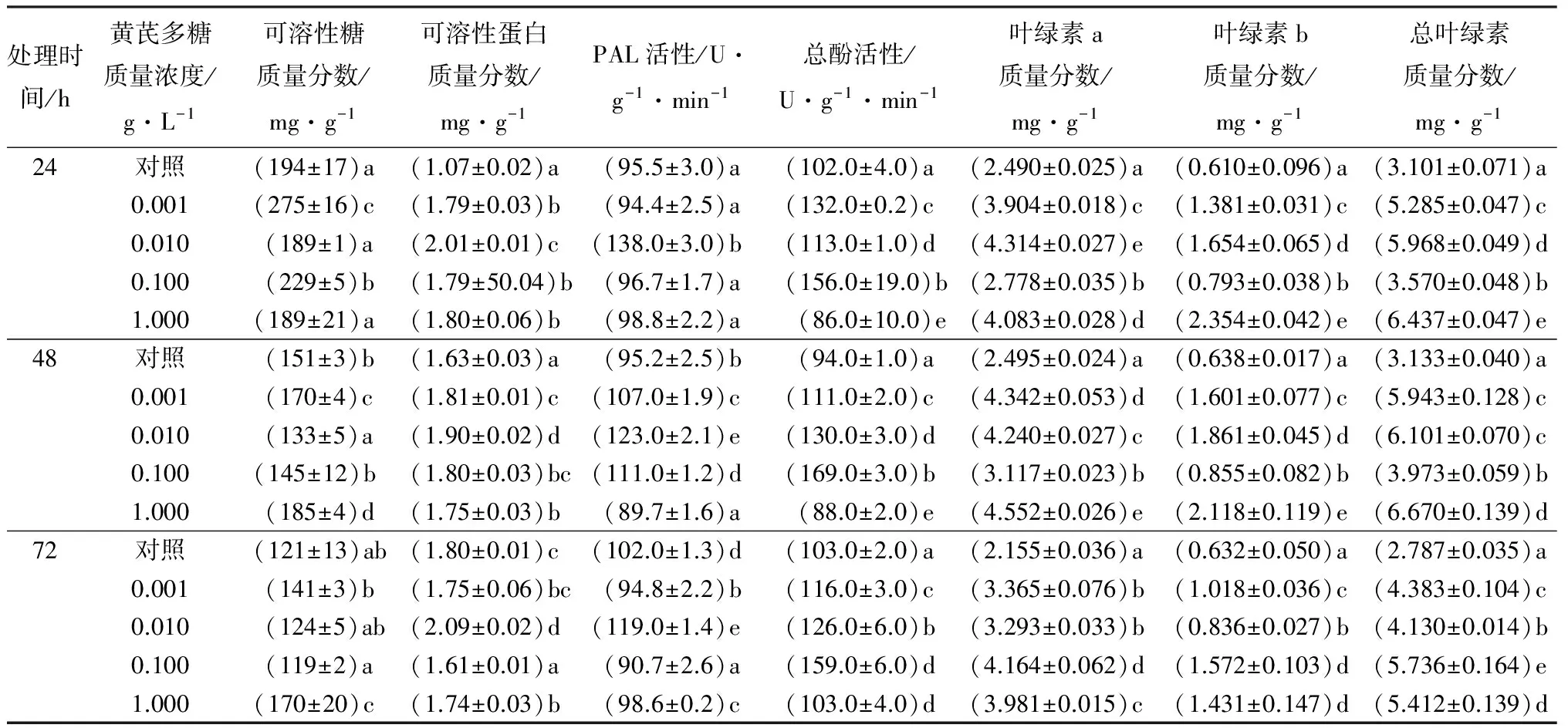
表1 黄芪多糖对接种病原菌的小叶杨生理生化指标的影响
注:表中数据为平均值±标准误。数据后不同字母表示同一时间不同处理间差异显著(p<0.05)。
2.2.5 对叶绿素质量分数的影响
由表1可见,小叶杨接种杨树烂皮病后,各组叶片中叶绿素a质量分数均保持在一个较高水平。随时间的变化,其质量分数变化不大,均高于对照组,且差异显著。不同质量浓度黄芪多糖对叶片内叶绿素a质量分数有不同影响:24 h,0.010 g·L-1处理组叶绿素a质量分数最高,为对照的1.73倍;48 h时,1.000 g·L-1处理组叶绿素a质量分数最高,为对照的1.82倍;72 h时,0.100 g·L-1处理组叶绿素a质量分数最高,为对照的1.93倍。
小叶杨接种杨树烂皮病后,各组叶片中叶绿素b质量分数如表1所示,保持在一个较高水平,对照组叶绿素b质量分数随时间的变化不大,而处理组叶绿素b质量分数在不同时间有一定变化,但在各个时间段处理组叶绿素b质量分数均显著高于对照组;1.000 g·L-1处理组叶绿素b质量分数在24、48、72 h均保持在最高的水平,分别为对照组的3.86、3.32、2.64倍。
小叶杨接种杨树烂皮病后,各处理组叶片中叶绿素总质量分数如表1所示,随时间的变化,其质量分数变化不大;在各个时间段,黄芪多糖处理组叶绿素总质量分数均显著高于对照组;不同处理对叶片内叶绿素总质量分数影响不同,在24、48 h时,1.000 g·L-1黄芪多糖处理组叶绿素总质量分数最高,分别为对照组的2.08、2.13倍,而在72 h时,0.100 g·L-1处理组叶绿素总量质量分数达最高,为对照组的1.94倍。
3 结论与讨论
寡糖及聚糖均具有抑制病原菌的作用,研究发现壳寡糖能够抑制多种动植物病原真菌菌丝的生长及孢子的萌发[5-8]。聚糖的分子质量、脱乙酰度、药剂pH值均能影响其抑菌效果[9]。壳聚糖不仅能够抑制番茄灰霉病菌(Botrytiscinerea)菌落的生长及菌丝的形态,还能够降低病原菌的产孢量和孢子萌发率[10]。徐俊光等研究发现低聚度的壳聚糖的抑菌活性显著高于高聚度壳聚糖[11]。目前,对于在结构与单糖组分上与寡糖和聚糖相类似的黄芪多糖的抑菌作用主要针对细菌进行研究,已发现黄芪多糖对大肠杆菌(Escherichiacoli)、金黄色葡萄球菌(Staphylococcusaureus)和绿脓杆菌(Pseusomonasaeruginosa)等具有抑制作用[12],而对真菌的抑制作用研究较少。本研究测定了不同质量浓度黄芪多糖对杨树烂皮病病原菌丝生长的抑制作用,发现0.100 g·L-1黄芪多糖对杨树烂皮病菌菌丝生长抑制作用最大,抑制率为12.16%。
可溶性糖是控制细胞内含水量和调节细胞渗透压的主要物质,是植物抗逆性和抗病性重要的指标之一,但是其含量与抗病性之间并不呈现一定的规律性[13-14]。梁军等研究发现,可溶性糖的含量与杨树抗溃疡病之间存在正相关的关系[15],而朱丽梅等研究发现可溶性糖与百合(Liliumbrowniivar.viridulum)抗百合灰霉病(Botrytiselliptica)之间存在负相关的关系[16]。本研究发现,接种杨树烂皮病后,小叶杨可溶性糖质量分数不断降低,低质量浓度黄芪多糖能够在短时间内提高小叶杨可溶性糖质量分数,而高质量浓度黄芪多糖能够减缓可溶性糖质量分数降低的速度,最终使小叶杨可溶性糖质量分数保持在一个较高的水平。这可能是低质量浓度黄芪多糖有利于小叶杨的吸收,在短时间即可起效,但随时间延长,作用变小,而高质量浓度黄芪多糖表现出持续缓慢作用。
植物体在受到病原体侵害时会诱导与抗性有关的可溶性蛋白含量急剧升高[17]。朱丽梅等[16]在研究2种百合抗百合灰霉病中发现,抗性品种在感染灰霉病后可溶性蛋白含量显著高于感病品种。小叶杨在接种杨树烂皮病病原菌后,0.010 g·L-1黄芪多糖处理组小叶杨叶片内可溶性蛋白质量分数均高于对照组,且差异显著,而低质量浓度或高质量浓度黄芪多糖对小叶杨叶片内可溶性蛋白质量分数反而具有抑制作用。
PAL是参与苯丙烷途径的一种十分重要的限速酶和关键酶,能够直接控制木质素和植保素的生成来保证植物体免受病原菌的伤害,它的活性直接关系到植物的抗病能力。大量研究表明,在植物体侵染病原菌后,壳聚糖能够显著提高植物体内PAL活性,提高植物抗性。本研究中黄芪多糖提高了接种杨树烂皮病病原菌后小叶杨体内的PAL活性,且随处理质量浓度的增加先升高后降低。这可能是黄芪多糖激发了小叶杨与抗性有关基因的表达,从而引起PAL活性和蛋白增加,进而提高植物的抗病能力。
酚是植物体参与植物抗病过程的重要物质,其含量与植物抗病呈现正相关[18]。李淼等在研究猕猴桃(Actinidiachinensis)抗猕猴桃溃疡病(Pseudomonassyringaepv. actinidiae)的试验中,发现抗病植株体内酚的含量显著高于感病植株[19]。本研究发现叶片内总酚活性均显著增加,说明黄芪多糖能够提高小叶杨体内总酚活性,进而提高其抗病的能力。
叶绿素作为植物光合作用的重要物质,其含量直接影响植物光合作用能力,进而影响林木的生长和发育。在植物体被病原菌侵染后,随着病害危害的加重,叶绿素含量急剧降低,因此叶绿素含量也是植物抗病性的指标之一[20-21]。张俊风等发现不同浓度的寡聚糖处理柠条(Caraganakorshinkii)种子,均能提高柠条幼苗的叶绿素含量[22]。本研究发现,黄芪多糖能够显著提高小叶杨叶片中叶绿素a、叶绿素b和总叶绿素的质量分数。说明黄芪多糖能够提高叶片光合作用,进而提高树木抗病能力。
植物抗病性产生过程中要经过激发子与受体之间的识别作用、信号转导、产生防卫反应等一系列生理生化反应过程。植物防卫反应的产生表现为可溶性糖、可溶性蛋白、总酚、叶绿素等与抗病性有关物质的含量的增加以及PAL等多种酶活性的增强。本试验通过检测与抗性相关物质含量及酶活性的变化,探究了黄芪多糖提高林木自身抗性的机制,为开发新型的提高林木抗性的植物疫苗奠定基础。
[1] 徐纬英.杨树[M].哈尔滨:黑龙江人民出版社,1988.
[2] 刘巍,蔄胜军,纪纯阳,等.我国杨树枝干病害研究进展[J].林业科技开发,2013,27(1):1-4.
[3] 曾大鹏.我国杨树病害的研究现状与防治[J].中国森林病虫,2002,21(1):20-26.
[4] 滕涛,曹福祥,王猛,等.松材线虫侵染对松树苯丙氨酸解氨酶及酚类物质的影响[J].中南林业科技大学学报,2013,27(3):124-127.
[5] 尹爱国,李火娣.壳寡糖的制备及其抑菌性能的研究[J].甘肃科学学报,2013,25(2):40-42.
[6] 杨玉红.壳寡糖对大肠杆菌的抑制作用[J].中国组织工程研究与临床康复,2009,13(16):3101-3104.
[7] 张筠,杜鹏,张亚东.壳寡糖抑菌作用的研究[J].食品工业科技,2009,30(1):88-90.
[8] 王寿权,赵双枝,张彦昊,等.自制壳寡糖抑菌性能及抑菌机理的初步研究[J].食品工业科技,2014,35(24):218-221.
[9] 黄盛东,陈松,李思东.壳聚糖抗菌活性研究进展[J].广州化工,2014,42(24):7-9.
[10] 顾丽嫱.壳寡糖对番茄灰霉病菌的抑制作用[J].江苏农业科学,2014,42(9):115-117.
[11] 徐俊光.壳寡糖对植物病原真菌的抑菌活性及其机理的初步研究[D].大连:中国科学院大连化学物理研究所,2007.
[12] 王娜.中药黄芪、黄芩有效成分的体外抑菌作用研究[D].秦皇岛:燕山大学,2009.
[13] GIBBS A F, WILCOXSON R D. Effect of sugar content ofPoapratensisonHelminthosporiumleaf spot[J]. Physiological Plant Pathology,1972,2(3):279-287.
[14] VIDHYASEKARAN P. Possible role of sugars in restriction of lesion development in finger millet leaves infected withHelminthosporiumtetrmera[J]. Physiological Plant Pathology,1974,4(4):457- 467.
[15] 梁军,王媛,贾秀贞,等.溃疡病菌对杨树愈伤组织细胞膜透性、可溶性糖及MDA含量的影响[J].林业科学,2008,44(8):72-77.
[16] 朱丽梅,罗凤霞.百合叶片中可溶性蛋白、叶绿素、可溶性糖含量与灰霉病抗性的关系[J].江苏农业科学,2011,39(5):134-136.
[17] BEDBROOK J R, MATTHEWS R E F. Changes in the flow of early products of photosynthetic carbon fixation associated with reoplication of TYMV[J]. Virology,1973,53(1):53-84.
[19] 李淼,檀根甲,李瑶,等.猕猴桃品种酚类物质及可溶性蛋白含量与抗溃疡病的关系[J].植物保护,2009,35(1):37-41.
[20] 刘雅倩,谢南南,赵锦,等.枣疯病植原体侵染对枣树叶绿素含量的影响[J].植物保护,2012,38(3):18-22.
[21] 杨峰,黄山,武晓玲,等.根腐病胁迫对大豆光谱特征和叶绿素荧光特性的影响[J].大豆科学,2013,32(4):490-495,500.
[22] 张俊风,段新芳,李庆梅,等.壳聚糖处理对柠条种子萌发及幼苗生长的影响研究[J].种子,2009,28(9):80-83.
Astragalus Polysaccharides Improving the Disease Resistance//
Ma Ling, Wen Rongrong, Qiu Benjun, Wang Buyong, Liu Xuefeng
(Northeast Forestry University, Harbin 150040, P. R. China)//Journal of Northeast Forestry University,2016,44(9):82-85,92.
Astragalus polysaccharide;Populussimonii;Valsasordida; Resistance
1)国家林业局“948”引进项目(2014-4-08)。
马玲,女,1963年1月生,东北林业大学林学院,教授。E-mail:maling63@163.com。
刘雪峰,东北林业大学林学院,研究员。E-mail:757489401@qq.com。
2016年3月22日。
S763.1;S792.119
责任编辑:程 红。
