我国Biobank建设及管理现状研究
2016-11-07贺晶白杨欧阳昭连
贺晶 白杨 欧阳昭连
1 中国医学科学院北京协和医学院 (北京 100020)
2 中国医学科学院医学信息研究所 (北京 100020)
我国Biobank建设及管理现状研究
贺晶1白杨2欧阳昭连2
1 中国医学科学院北京协和医学院(北京100020)
2 中国医学科学院医学信息研究所(北京100020)
内容提要: 目的:分析我国生物样本库的研究现状,明确我国在建设及管理中存在的问题,为生物样本库的完善提供依据。方法:从我国现有主要Biobank的建设和管理情况入手,系统调研和分析我国在Biobank建设和管理中存在的问题,综合国内外的管理经验,为我国建设标准化、高质量的生物样本库提供参考。结果:我国在Biobank建设与管理方面缺少统一标准,相关的政策和法规尚不完善。结论:我国应加大投入、吸取国外经验,尽快建立和完善适合我国的Biobank相关建设与管理体系。
生物样本库建设与管理规章体制伦理
近年来,随着科学技术的迅猛发展,以及全球化程度的加深,生物样本库的建立与管理得到国内外的广泛关注。生物银行(Biobank),亦称人体生物银行或人体生物资料库等[1]。它主要收集、保存各种人类生物样本如全血、血清、血浆、组织、生物体液等,以及此类生物样本的相关临床、治疗及随访等数据资料,用于临床治疗和生命科学研究,是一种按照严格的技术标准收集、运输、存储、管理和使用的生物资源库[2,3]。它已成为用于疾病临床治疗以及生命科学研究方面的生物技术基础设施的重要组成部分[4]。
目前,国际生物样本库逐步呈现网络、联盟化趋势,在北美、欧洲等地已出现一些全国性的生物样本库联合会,以便于规范样本库技术、协调合作,实现资源共享[5]。我国的生物样本库建设起步较晚,但作为人口大国,我国的生物样本资源较为丰富,因此近年来我国的生物样本库建设发展较迅速。国内多方面均在推进Biobank的建设,广州、泰州、北京等地已经建立起Biobank。但由于缺乏足够的交流与沟通,不同的样本库在建设过程中没有统一的标准,在建设质量和管理水平上存在较大差别,难以实现资源共享,并且同国外的样本库也存在着一定的差距。本研究主要对我国现有Biobank的建设和管理情况,以及我国在Biobank建设和管理中存在的各种问题进行调研分析,综合国内外的管理经验,为我国建设标准化、高质量的生物样本库提供参考。
1.建设情况
近几年,在国际医学研究发展趋势的影响下,我国大规模的、以人群为基础的Biobank建设开始推进。2004年,广州生物银行队列研究项目的Biobank开始建立;同年,中国慢性病Kadoorie研究项目的Biobank也开始建立;2007年,泰州市开展了人群健康追踪研究项目并建立了Biobank;2008年,温州市建立温州医学院中心生物样本资料库。
总体来说,我国的Biobank建设起步较晚,Biobank主要是围绕着各研究机构同国内、外相关机构在医学或者基础性研究项目的合作网络而建立的。目前国内较大的几家Biobank主要有Kadoorie Biobank、台湾生物样本资料库、广州Biobank等。
1.1Kadoorie Biobank
Kadoorie Biobank由香港Kadoorie慈善基金会资助于2004年成立,是为中国慢性病前瞻性研究项目Kadoorie Study of Chronic Diseases in China(KSCDC)而建立的。KSCDC是世界上最大的前瞻性研究项目之一,主要目标是研究环境及遗传因素对常见病的影响。是中国医学科学院同英国牛津大学临床试验服务部的合作项目,该项目陆续得到英国威康信托、医学研究基金会和英国心脏基金会的资助。
Kadoorie Biobank于2003年到2008年间收集了我国10个地区35~74岁的513000人的血液样本、健康信息和生活习惯资料,现在项目进入队列人群长期随访监测阶段,将对该人群20年内的疾病、住院及死亡信息进行密切跟踪[6]。
10个采集点是根据中国疾病的分布情况和不同地区的经济发展水平以及交通等方面的因素而选取的,5个在城市、5个在农村。基线调查期间,参与者需要填写一份非常详细的问卷调查,其中包括饮食、吸烟、喝酒、日常生活习惯、体力活动、精神状况以及家族病史等;还要接受身体检查,包括测量血压、体重和肺功能;最后是被抽取血液样本。英国方面专门为该项目开发了30多个软件,实现了无纸化调查,以确保数据的可靠和可控。
Kadoorie Biobank在设计、样本量和设施方面处于世界领先地位,目前基于该Biobank的多篇研究论文已经在《科学》和《自然》杂志上发表。
1.2广州Biobank
广州Biobank建于2004年,是我国首家大型的队列生物样本资料库。由广州市第十二人民医院、香港大学和英国伯明翰大学合作开展的广州生物银行队列研究项目(GBCS)建立,该项目主要研究“基因、生活方式及环境因素对致命性疾病的影响”。该项目在广州地区收集了5万名50岁以上居民血液样本、健康状况及环境因素信息,并计划进行5至10年的追踪,以便采取巢式病例对照研究恶性肿瘤、脑中风、冠心病、糖尿病等疾病的基因状况。例如是否有基因变异、新基因形成、微量元素及生化改变等因素,分析其原因和机理,为疾病的控制、预防和临床治疗提供科学依据[7,8]。
1.3泰州人群健康追踪研究项目Biobank
2007年6月,复旦大学与泰州医药高新产业园联手启动泰州市人群健康追踪研究项目。该项目在泰州建立数十万人的生物样本资料库,计划通过至少20年的跟踪研究,找出中国人群中脑溢血、心肌梗塞、糖尿病等常见慢性病病因、诊治、预防的一些共性,推动中国慢性病诊治和预防水平的提高。复旦大学与泰州医药高新产业园签订协议,建立中国医药城泰州复旦健康科学研究院,组织实施泰州市人群健康追踪研究项目。泰州市人群健康追踪研究项目的目的是:①描述群体慢性病的死亡率和疾病率;②了解慢性病的环境影响因素和生活方式影响因素;③识别慢性病的遗传风险;④识别慢性病的基因环境相互影响[9]。目前,该项目只收集人类的口腔细胞,经当地居委会同意,由医学院学生志愿者在泰州市的居民中采集。
1.4台湾生物样本资料库
台湾Biobank计划采用长期追踪研究设计,依据不同遗传氏族在台湾地区居住分布的特性,预计在苗栗、嘉义、花莲三个地区中,邀请20万名40岁~70岁的居民参与研究,建立属于台湾地区的生物数据库。针对本土常见慢性疾病进行长期追踪研究,所收集之资料包含关于参与者的健康情形、医药史、生活形态、生活环境信息以及生物检体。并长期追踪参与者之健康变化情形,以进行常见慢性疾病中基因与环境(包括生活习惯、饮食、行为、职业等)交互作用的相关研究。期望藉由研究结果了解常见疾病的致病因素,协助改善疾病的预防、诊断与治疗,降低医疗成本,进而达成促进民众健康的目标。
2006年,可行性研究计划开展,在嘉义地区先募集1,000名志愿者,收集的资料包含:健康情况、疾病史、生活形态、生活环境信息等。藉由此可行性研究计划,可以达到以下两个目的:①评估正式计划启动时将可能遭遇的困难,以及如何设计妥当的程序;②评估项目包含受访者如何告知及同意的过程、样本收集的流程与进行时间、文件信息之递送处理及保存、参与者对样本收集的整体印象等,作为日后执行、调整正式计划的参考[10]。
2.管理情况
我国对于Biobank的管理还在起步阶段,管理措施和法规还有待制定和完善,因此,我国对Biobank还谈不上规范化管理。但是我国在人类资源和数据管理方面还是做了大量的工作,也出台了一些相关的法规和措施。2009年6月4日,中国医药生物技术协会组织生物样本库分会由国家卫生部、民政部正式批复成立,该协会目前正在积极进行生物样本库管理方面的研究。该分会始终以“珍惜样本、执行标准、充分应用、维护产权”为宗旨,成立以来积极组织活动,促使我国的生物样本库规范、有序、稳步发展[11]。
2.1规章
人类样本及相关的信息收集和使用涉及隐私保护、知情同意等伦理及相关法律问题,因此应人类生物资源中心发展的需求[12],多个国家均出台了相关的伦理规范和法律制度,如冰岛颁布了《卫生部数据库法(act in a health sector database)》、《生物样本库法(act on biobanks)》,瑞典颁布《瑞典生物样本库法》,英国制定了《伦理与管理框架(ethics and governace framework)》等[6,13,14]。
我国在人类遗传资源以及数据管理的方面也做了大量的工作,出台了一些相关的政策和规章,如:涉及人的生物医学研究伦理审查办法(试行):该办法由卫生部于2007年1月11日颁布,旨在规范涉及人的生物医学研究和相关技术的应用,保护人的生命和健康,维护人的尊严,尊重和保护人类受试者的合法权益。《办法》分五章,共三十条,主要规定涉及人的生物医学研究的伦理审查原则,伦理委员会的设置,伦理审查的程序、方法,以及审查的监督与管理等。
人类遗传资源管理暂行办法:暂行办法由科技部和卫生部于1998年6月10日联合颁布,旨在有效保护和合理利用我国的人类遗传资源,加强人类基因的研究与开发,促进平等互利的国际合作和交流。《暂行办法》分六章,共二十六条,主要规定人类遗传资源的管理机构,涉及我国人类遗传资源的国际合作项目的申报与审批、知识产权、奖励和处罚等。其中第五条规定人类遗传资源及有关信息、资料,属于国家科学技术秘密的,必须遵守《科学技术保密规定》。
科学技术保密规定:由科技部于1995年1月6日颁布,该规定分五章,共三十四条,主要规定了国家科学技术秘密的范围和密级,国家科学技术秘密密级的确定、变更及其解密,国家科学技术秘密保密管理等。
实验室生物安全通用要求:最初是由国家质量监督检验检疫总局和国家标准化管理委员会于2004年颁布的国家标准。编制主要参考了ISO15190∶2003(E)《医学实验室—安全要求》和WHO《实验室生物安全手册》[第二版(修订版),2003]。规定了实验室生物安全管理和实验室的建设原则,同时,还规定了生物安全分级、实验室设施设备的配置、个人防护和实验室安全行为的要求。为进一步完善相关使用标准,2008年我国颁布了新的《实验室生物安全通用要求》(GB19489-2008),对标准要素的划分进行了调整,修订并增减了部分属于和定义、风险评估和控制要求、实验室相关规范等。在国家相关政策的指导下,一些涉及人类遗传资源的研究项目也建立了各自的管理办法和内部准则,但是,目前我国还没有针对Biobank的统一的规范化管理法规。
2.2管理体制
我国涉及Biobank的管理主要是对医学研究项目的伦理监管和对人类遗传资源的管理。
2.2.1伦理监管
根据《涉及人的生物医学研究伦理审查办法(试行)》规定,涉及人的生物医学研究和相关技术应用项目需要由伦理委员会审查。《办法》中将伦理委员会分为三级,即卫生部伦理专家委员会、省级伦理专家委员会和机构伦理委员会。卫生部和省级卫生行政部门设立的伦理专家委员会是医学伦理专家咨询组织,主要针对重大伦理问题进行研究讨论,提出政策咨询意见,必要时可组织对重大科研项目的伦理审查;对辖区内机构伦理委员会的伦理审查工作进行指导、监督。机构伦理委员会由开展涉及人的生物医学研究和相关技术应用活动的机构设立,这些机构包括医疗卫生机构、科研院所、疾病预防控制和妇幼保健机构等。机构伦理委员会主要承担伦理审查任务,对本机构或所属机构涉及人的生物医学研究和相关技术应用项目进行伦理审查和监督;也可根据社会需求,受理委托审查;同时组织开展相关伦理培训(详见图1)。
卫生部对全国的伦理委员会实行宏观管理,研究制订有关政策。省级的卫生行政部门对本行政区域内的伦理委员会的伦理审查工作负有监督管理的责任。
机构伦理委员会的委员由设立该伦理委员会的部门或者机构在广泛征求意见的基础上,从生物医学领域和管理学、伦理学、法学、社会学等社会科学领域的专家中推举产生,人数不得少于5人,并且应当有不同性别的委员。少数民族地区应考虑少数民族委员。机构伦理委员会委员任期5年,可以连任。伦理委员会设主任委员一人,副主任委员若干人,由伦理委员会委员协商推举产生,可以连任。
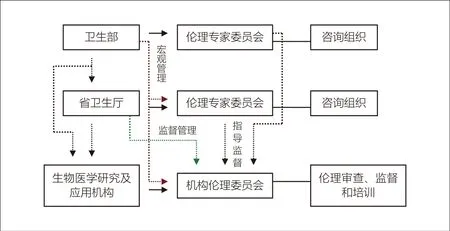
图1. 我国医学伦理委员会体系结构图
机构伦理委员会的审查职责是:审查研究方案,维护和保护受试者的尊严和权益;确保研究不会将受试者暴露于不合理的危险之中;对已批准的研究进行监督和检查,及时处理受试者的投诉和不良事件。伦理委员会委员应当为接受伦理审查的研究项目保密,伦理委员会按照伦理原则自主做出决定,不受任何干扰;审查结果应当及时传达或者发布。
2.2.2人类遗传资源管理
根据《人类遗传资源管理暂行办法》的规定,我国对人类遗传资源实行分级管理,统一审批制度。由科技部和卫生部联合成立中国人类遗传资源管理办公室负责日常工作。该办公室职责如下:
(1)起草有关的实施细则和文件,经批准后发布施行,协调和监督《暂行办法》的实施;
(2)负责重要遗传家系和特定地区遗传资源的登记和管理;
(3)组织审核涉及人类遗传资源的国际合作项目;
(4)受理人类遗传资源出口、出境的申请,办理出口、出境证明;
(5)与人类遗传资源管理有关的其他工作。
根据《暂行办法》的规定,凡涉及我国人类遗传资源的国际合作项目,须由中方合作单位办理报批手续。中央所属单位按隶属关系报国务院有关部门,地方所属单位及无上级主管部门或隶属关系的单位报该单位所在地的地方主管部门,审查同意后,向中国人类遗传资源管理办公室提出申请,经审核批准后方可正式签约。国务院有关部门和地方主管部门在审查国际合作项目申请时,应当征询人类遗传资源采集地的地方主管部门的意见。
3.总结
总体来看,我国Biobank起步较晚,但是我国有56个不同的民族拥有大量的遗传资源,在建库方面有着极大的优势。目前,国内各方面都在推进Biobank的建设,但由于缺乏足够的交流与沟通,不同的Biobank在建设过程中没有统一的标准,在建设质量和管理水平上存在较大差别,同国外的Biobank相比也存在着一定的差距。对于Biobank的管理,我国正处在探索阶段,现有的相关政策和法规已经跟不上医学研究发展的需要,我国目前急需建立和完善Biobank相关的管理体系。
[1] 伍春艳, 焦洪涛, 范建得. 生物银行运作中的知识产权问题探析[J]. 知识产权, 2015, (3)∶63-69.
[2] Asslaber M, Zatloukal K, et al. Biobanks∶ transnational, European and global networks[J]. Brief Funct Genomic Prmeomic,2007, 6∶ 193-201.
[3] Sgaier SK, Jha P, Mony P, et a1. Biohanks in Developing Countries∶ Needs and Feasibility[J]. Science, 2007, 318∶ 1074-1075.
[4] WIKIPEDIA. The Organization for Economic Co-operation and Development. [EB/OL].[2013].https∶//en.wikipedia.org/ wiki/Organisation_for_Economic_Co-operation_and_Development.
[5] Diaz JI, Cazares LH, Semmes OJ. Tissue sample collection for proteomics analysis[J]. Methods Mol Biol, 2007, 428(1)∶43-54.
[6] The Kadoorie Biobank Study in China[EB/OL]. [20131205].http∶//www.dxy.cn/bbs/topic/27013292.
[7] Chaoqiang Jiang, etc. Cohort Profle∶ The Guangzhou Biobank Cohort Study, a Guangzhou- Hong Kong-Birmingham collaboration[J]. International Journal of Epidemiology, 2006,35∶ 844-852
[8] Chaoqiang Jiang, etc. An overview of the Guangzhou Biobank Cohort Study-Cardiovascular Disease Subcohort (GBCSCVD)∶ a platform for multidisciplinary collaboration[J]. Journal of Human Hypertension, 2010, 24∶ 139-150
[9] Webmaster. Biobanking & Personal Genomics∶ Challenges and Futures for EU-China Collaborations∶ Ethical Governance of Biological and Biomedical Research∶ Chinese-European Co-operation, BIONET 4th workshop. University of Copenhagen, 2009∶28.
[10] 台湾生物资料库可行性研究计划[EB/OL].http∶//www.twbiobank.org.tw/nsc/intro.html.
[11] 张小燕.中国医药生物技术协会组织生物样本库分会成立大会会议纪要[J].中国医药生物技术,2010,5(1)∶7.
[12] Gettweis H,ZafoukM K.Biobank governance:trends and perspectives.Pathobiology.2007, 74∶206-211.
[13] Longstaff H, Burghs MM. Recruiting for representation in public deliberation on the ethics of biobanks. Public Underat sci. 2010, 212-224.
[14] Meslin EM,Cho MK.Research ethics in the m of personalized medicine:updating science's contract with society. Public Health Genomics. 2010,13∶ 378-384.
Research on Biobank Construction and Governance in China
HE Jing1BAI Yang2OUYANG Zhao-lian2
1 Chinese academy of medical sciences, Peking union medical college(Beijing100020)
2 The Chinese academy of medical sciences institute of medical information(Beijing100020)
Objective∶ To have overall review of our country's biobank research status, clear on the problems existing in the construction and management in our country, and provide the basis for the improvement of the biobank. Methods∶ Statistical of the construction of the Biobank in standard and management system according to the existing laws and regulations in China. Results∶ China is still lack of uniform standards in the Biobank construction and management, and the relevant policies and regulations need to be perfect. Conclusion∶ To improve the relevant construction and management system of our country's Biobank,China should increase reaearch budget and absorb foreign experience.
biobank,construction and management,regulations,system,ethics
1006-6586(2016)09-0022-06
R318
A
2016-01-02
贺晶,研究生,助理研究员;白杨,研究生;欧阳昭连,通讯作者,研究生,副研究员。
