烟曲霉白化株致免疫正常宿主肺曲霉球
2016-11-06刘芳孔庆涛张彩云桑红沈永年吕桂霞刘维达施毅
刘芳 孔庆涛 张彩云 桑红 沈永年 吕桂霞 刘维达 施毅
210002南京总医院 南京大学附属南京总医院皮肤科(刘芳、孔庆涛、张彩云、桑红),呼吸科(施毅);中国医学科学院 北京协和医学院 皮肤病研究所真菌科(沈永年、吕桂霞、刘维达)
烟曲霉白化株致免疫正常宿主肺曲霉球
刘芳 孔庆涛 张彩云 桑红 沈永年 吕桂霞 刘维达 施毅
210002南京总医院 南京大学附属南京总医院皮肤科(刘芳、孔庆涛、张彩云、桑红),呼吸科(施毅);中国医学科学院 北京协和医学院 皮肤病研究所真菌科(沈永年、吕桂霞、刘维达)
患者女,76岁,因右侧胸痛3个月就诊。肺部CT示右侧下叶背段4.8 cm×3.0 cm团块状密度增高影。取患者肺穿刺组织进行真菌培养及组织病理检查。组织病理显示慢性肉芽肿性炎,有隔的透明菌丝。SDA培养见白色绒毛状致密菌落,中央略高起,表面可见皱褶或放射状纹,背面呈淡黄色,小培养见较丰富的分枝分隔菌丝,可见极少量无色透明类圆形孢子。对分离菌种行rDNA ITS、β微管蛋白测序鉴定及抗真菌药物体外药敏试验,利用MEGA7.0软件构建烟曲霉复合体及其近源菌种系发生树。分子生物学测序鉴定为烟曲霉。诊断:肺曲霉球。先后予以伊曲康唑口服液及伏立康唑片治疗后明显好转。
烟曲霉菌;肺曲霉菌病;烟曲霉白化株;肺曲霉球
近年尽管新的抗真菌药物不断问世,肺曲霉感染临床死亡率仍较高[1]。肺曲霉球(aspergilloma)是肺曲霉病的一种常见类型[2],本研究组成功治疗1例不产孢烟曲霉白化株所致的肺曲霉球,同时结合相关文献对该菌株引起的临床及实验室特点进行分析。
对象和方法
一、临床资料
患者女,76岁。因右侧胸痛3个月就诊。患者2012年9月无明显诱因出现右侧胸痛,约位于季肋部,为阵发性针刺样疼痛,未予重视及治疗。2012年10月患者右季肋部疼痛较前加重,于当地医院胸部CT示右肺占位,予阿莫西林克拉维酸钾加左氧氟沙星抗感染治疗1周,疼痛无明显缓解,且右肺占位性质不明。2012年11月转至南京某医院行CT引导下经皮肺穿刺,病理见上皮细胞及大量炎细胞,穿刺组织培养见白色绒毛状致密菌落,真菌G试验(1,3⁃β⁃D葡聚糖抗原)、半乳甘露聚糖(galactomannan,GM)试验正常,同时请我院协助鉴别分离菌株,并于2012年11月26日于我院住院治疗,再次行肺穿刺术。患者30岁左右患肺结核,抗结核治疗后诉治愈(具体不详);48岁时因咯血诊断为肺囊肿,予对症治疗后好转(具体不详);50岁左右患胸膜炎。有高血压病10余年,现口服复方硫酸双肼屈嗪,血压控制良好。
体检:神清,全身浅表淋巴结未触及肿大及压痛。右下肺呼吸音低,叩诊呈实音,触觉语颤增强,听诊两肺呼吸音粗,未闻及干湿性啰音。
辅助检查:血常规、肝肾功能、血糖无异常,血癌胚抗原(CEA)、甲胎蛋白(AFP)、糖类抗原无异常;体液免疫包括IgA 2 290 mg/L,IgG 13.0 g/L,IgE 40.0 IU/ml,IgM 1 130 mg/L,C3 1 160 mg/L,C4 322 mg/L;细胞免疫包括CD3+62.0%,CD4+31.0%,CD8+27.0%,CD4+/CD8+1.15,B细胞15.0%,NK细胞17.0%,均在正常范围。真菌G试验(<10)、GM试验均正常(<0.5),抗结核抗体阴性,隐球菌乳胶凝集试验阴性。胸部CT示:右肺下叶背段一约4.8 cm×3.0 cm团块状密度增高影,其内可见环形透光影及钙化灶,壁厚薄不均。可见一支气管与病灶及右侧肺门相连。见图1A。
二、真菌学检查及菌种鉴定
1.真菌培养:取患者肺穿刺组织及外院分离菌株接种于含有放线菌酮及氯霉素和仅含氯霉素的沙堡培养基(SDA)上。并置于25℃和37℃条件下培养,同时进行药物敏感试验。
2.分子生物学测序鉴定:2次肺穿刺分离菌株进行PCR检测,共检测3次,用Biopsin真菌基因组DNA提取试剂盒(杭州博日科技有限公司)按照说明提取菌株DNA,PCR扩增获取菌的ITS区。其体系及流程如下,PCR体系(50 μl):DNA样本1 μl,无核酶纯水22 μl,上下游引物(10 mmol/L)各1 μl,2 ×Go Taq Green…Master Mix 25 μl。使用真菌通用引物:ITS(internal transcribed spacer)1 5′⁃TCCGTAGGT GAACCTGCGG⁃3′和 ITS4 5′⁃TCCTCCGCTTATTGAT ATGC⁃3′。Partial β微管蛋白特异引物benA⁃F(5′⁃AATTGGTGCCGCTTTCTGG⁃3′)和 benA⁃R(5′⁃AGTT GTCGGGACGGAATAG⁃3′)。PCR反应条件为95 ℃变性10 min;94℃变性30 s;55℃退火40 s;72℃延伸1 min;循环35次,72℃终末延伸7 min。4℃储存备用。

图1 患者胸部CT 1A:右肺下叶背段见一4.8 cm×3.0 cm团块状密度增高影,其内可见环形透光影及钙化灶,壁厚薄不均;1B:伊曲康唑治疗1个月后,右肺下叶背段病灶较前缩小
三、药物敏感试验
由于本菌株完全不产生孢子,无法进行孢子计数定量,需定量时采用打孔法保证菌丝块面积的一致性,用接种针将致病菌接种到YAG固体平板上,37℃培养2 d,打孔后倒放于YAG固体药平板中央。药平板的药物浓度分别为伊曲康唑2、4、8、16、32mg/L,伏立康唑0.125、0.25、0.5、1、2 mg/L,两性霉素B 4、8、16、32、64 mg/L。将接种好的菌平板置于37℃恒温培养箱中培养3 d后,从平板地面量取菌落直径,为避免接种面积对结果的影响,将各药平板上的菌落直径与不加药物的相应菌株直径均减去5 mm后的差值比较各种药对菌生长的相对抑制程度。
四、构建种系发生树
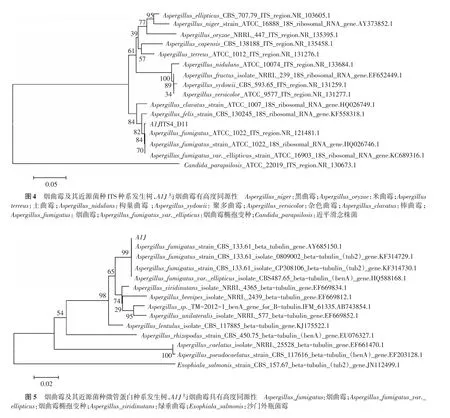
NCBI中选取烟曲霉复合体及其近源菌种的β微管蛋白及ITS序列及β微管序列保存于txt文本中,利用MEGA7.0软件构建系统发生树,Phylogeny选用Construct/Test Neighbor⁃Joining Tree法,Bootstrap验证值为1 000。
结 果
一、真菌培养
2次穿刺组织在SDA培养基上,37℃生长较快,4 d后形成圆形菌落,表面呈白色绒毛状致密菌落,中央略高起,表面可见皱褶或放射状纹(图2A),背面呈淡黄色(图2B)。小培养见较丰富的分枝分隔菌丝,菌丝体类顶囊样结构,可见极少量无色素分生孢子,呈类圆形(图2C),次代分离株在SDA、马铃薯葡萄糖琼脂培养基(PDA)、CDA(CzapekDoxAgar)、CA(CzapekMedium)等多种培养基中菌落与亲代相同,小培养仅见丰富的分支分隔菌丝,未见孢子产生。
二、组织病理
右肺穿刺组织HE染色,示黏膜轻度急慢性炎症伴纤维组织明显增生及玻璃样变,另可见多量菌丝(图3A);PAS染色(图3B)、PAM染色阳性(图3C)。

三、分子生物学鉴定
3次PCR产物所得分离菌株的保守区序列与基因库中烟曲霉的对应序列99%一致(GenBank aceession no.KX098468.NCBI)。β微管蛋白所得产物测序与烟曲霉99%一致(GenBank aceession no.DQ438548.1,NCBI)。该菌种序列资料已经上传GenBank并获得序列号(BankIt1908552 Seq1 KX098468)。MEGA7.0构建的种系发生树与烟曲霉(Aspergillus fumigatus)具有高度同源性(图4、5)。
四、药物敏感试验
伊曲康唑最低抑菌浓度(MIC)≤32 mg/L,伏立康唑≤2mg/L,两性霉素B≤64mg/L(打孔法),均为敏感。
五、诊断
烟曲霉所致肺曲霉球。
六、治疗
伊曲康唑注射液0.5 g/d静脉滴注治疗2 d,患者出院后口服伊曲康唑口服液20 ml日2次,1个月后复查胸部CT提示病灶较前缩小(图1B)。由于患者胃肠道反应较大,改为伏立康唑0.2 g口服每隔12 h 1次,治疗后2个月复查CT,病灶吸收明显。随访至今患者病情无反复。
讨 论
肺曲霉病(pulmonary aspergillosis,PA)是由曲霉属感染或吸入曲霉属病原体引起的一组急慢性肺部病变,其中以烟曲霉最为常见,约占90%[1]。肺曲霉球是肺曲霉病的一种较常见类型,属于寄生型曲霉[2]。本例患者根据临床表现、胸部CT、穿刺组织病理、真菌学检查及分子生物学鉴定,最终确诊肺曲霉球,同时其临床及分离菌种均具有特殊性。首先,患者有基础性肺疾病:肺曲霉球主要是外源性感染,多为曲霉入侵或植入肺内原有疾患形成的空洞或空腔内,在腔内继发生长,其菌丝、孢子和黏液纤维、炎症形成曲霉球,同时由于烟曲霉本身的特性如烟曲霉分布广泛,生长迅速,其孢子体积较小(3~5 μm),可以沉积于肺脏远端。该患者既往有肺结核、肺囊肿、胸膜炎等慢性肺部疾病史,虽然胸部CT显示无陈旧病灶,但是不排除原有基础肺疾病在曲霉定植中起到一定的作用。第二,缺乏PA的先决条件即该患者免疫功能正常,同时缺乏曲霉接触史。肺曲霉病多因职业因素,长期暴露于存在大量曲霉孢子的环境中,如处理动物皮毛、晒谷和饲养鸽子等,当吸入的曲霉孢子超出机体防御能力时,便会引起爆发性肺部感染。该患者缺乏职业暴露史,同时否认长期系统应用抗生素、糖皮质激素及免疫抑制剂史,辅助检查显示患者的体液免疫及细胞免疫状况正常。第三,临床病程长,预后好。肺曲霉球患者的预后主要与基础疾病的自然病程及严重性有关。Limper等[3]分析该病预后不良的危险因素包括严重的肺部基础疾病,曲霉球数量和体积,免疫缺陷状态等。目前关于该病的最佳治疗方法还未达成共识,多数学者认为手术是最佳治疗方案。该患者病程长达3个月,同时年龄较大,经2个月的抗真菌治疗后临床症状及影像学检查均显著改善,预后较好。我们认为除了与患者免疫功能正常相关外,同时也可能与该临床分离株特性(即不产黑素及产孢子少)密切相关,此分离菌株在37℃培养条件下,经多种培养基(包括SDA、PDA、CDA、CA)等培养21 d后仍未见色素产生,镜下无产孢。烟曲霉标准菌株的分生孢子为烟绿色,主要存在于细胞壁,包含一种色素称为二羟基萘(dihydroxynaphtalene,DHN),这种黑素能够保护菌种抵抗紫外线辐射、酶裂解、活性氧、高热等[4]。黑素除了保护烟曲霉抵抗宿主防御外,同时是分生孢子细胞壁基本成分[5],因此黑素在烟曲霉的致病过程中起到重要的作用。本临床分离株表现出产孢贫瘠,次代分离株在多种培养基中无产孢,亦无色素产生。分析该菌株的RNA⁃Seq数据发现,参与烟曲霉DHN⁃黑色合成相关基因pksP/alb1、ayg1、arp2、arp1、abr1和abr2较正常菌株均显著下调[6⁃8],同时在动物试验中证实,该菌株毒力低于烟曲霉标准株Af293[9],提示其致病力较标准株下降。Jahn 和Kocho等[10]曾诱导ALB1基因突变获得烟曲霉白化株,通过小鼠模型试验发现,其致病力显著降低。第四,2次真菌G试验、GM试验阴性。GM试验对于曲霉病的早期诊断具有重要价值,但多个研究表明,血清GM对非粒细胞缺乏、非器官移植的肺曲霉病患者的诊断价值较低。Park等[11]发现,血清GM诊断曲霉球的敏感性仅38%,合并咯血患者敏感性52%,而无咯血患者敏感性仅9%。
临床分离株菌种特性:主要包含2个方面:①菌落形态不同,传统的菌落形态为烟绿色,经久培养后变为深绿色、烟绿色,而该分离株菌落在多种培养基中均为致密白色绒毛状;②镜下形态不同,传统的烟曲霉镜下可见典型曲霉头结构包括顶囊、分生孢子梗、大量圆形分生孢子等,而该患者肺穿刺组织临床分离株未见典型顶囊,仅有较丰富的分枝分隔菌丝及极少量类圆形无色透明孢子,由于该菌形态结构的非典型性,通过真菌通用引物3次扩增测序鉴定均为烟曲霉,利用产孢少的烟曲霉特异性引物β微管蛋白引物扩增也与烟曲霉一致。高露娟等[12]曾对我国大陆地区报道的1 457例曲霉病例进行综述,发现培养阳性的481例中仅258例进行了菌种鉴定,仅4例提供了分子生物学鉴定依据,提示在曲霉病的诊断中需要重视形态学及分子学检测。本实验组分离所得烟曲霉菌株曾经被考虑是否为烟曲霉的有性阶段,但是其菌种形态及镜下结构并不随时间延长有所改变。Katz等[13]曾经研究烟曲霉临床分离株的基因变异情况,对4株孢子生成贫瘠的非典型烟曲霉进行分子分析,通过临床分离株的碱性蛋白酶基因DNA序列分析,发现每个菌株在遗传上均不同,同时每个菌株表现出与烟曲霉核苷酸序列7%~11%的差异。随后的形态学研究表明,所有菌株都可以被规划为Aspergillus viridinutans,但是它们的菌落形态主要表现为蓝绿色,与本菌菌落形态有本质区别,本菌株除了形态学不同于标准株外,分子学鉴定有99%的一致性。Katz等[13]曾为了弄清4个非典型分离株的分类,检测了非典型菌株的部分β微管蛋白序列和18S rRNA基因序列,发现所有非典型菌株都包含独特的β微管蛋白序列,具有较低水平的DNA序列变异,同时非典型分离株的18S rRNA基因在单个核苷酸位点上亦不同于烟曲霉。高露娟等[14]也曾对125例患者的162株烟曲霉复合体菌株通过形态学及分子生物学测序进行鉴定,所有烟曲霉复合体菌株均为经典烟曲霉,未检出烟曲霉相关新种,同时所有菌株生长形态及光镜下产孢结构均较典型。本研究检测该临床分离株的β微管蛋白序列,与标准株具有99%的一致性,有别于既往报道的非典型烟曲霉,目前已将该临床分离株命名为A1J,同时已对其生长特性、致病力及药物敏感试验及动物实验等多方面进行了研究。
[1] Walsh TJ,Anaissie EJ,Denning DW,et al.Treatment of aspergillosis:clinicalpractice guidelinesofthe Infectious Diseases Society of America[J].Clin Infect Dis,2008,46(3):327⁃360.DOI:10.1086/525258.
[2] Ma JE,Yun EY,Kim YE,et al.Endobronchial aspergilloma:report of 10 cases and literature review[J].Yonsei Med J,2011,52(5):787⁃792.DOI:10.3349/ymj.2011.52.5.787.
[3] Limper AH,Knox KS,Sarosi GA,et al.An official American Thoracic Society statement:treatment of fungal infections in adult pulmonary and critical care patients[J].Am J Respir Crit Care Med,2011,183(1):96⁃128.DOI:10.1164/rccm.2008⁃740ST.
[4] Brakhage AA,Liebmann B.Aspergillus fumigatusconidial pigment and cAMP signal transduction:significance for virulence[J].Med Mycol,2005,43 Suppl 1:S75⁃82.
[5] Pihet M,Vandeputte P,Tronchin G,et al.Melanin is an essential component for the integrity of the cell wall ofAspergillus fumigatusconidia[J].BMC Microbiol,2009,9:177.DOI:10.1186/1471⁃2180⁃9⁃177.
[6] Jahn B,Koch A,Schmidt A,et al.Isolation and characterization of a pigmentless⁃conidium mutant ofAspergillus fumigatuswith altered conidial surface and reduced virulence[J].Infect Immun,1997,65(12):5110⁃5117.
[7] Tsai HF,Washburn RG,Chang YC,et al.Aspergillus fumigatusarp1 modulates conidial pigmentation and complement deposition[J].Mol Microbiol,1997,26(1):175⁃183.
[8] Langfelder K,Jahn B,Gehringer H,et al.Identification of a polyketide synthase gene(pksP) ofAspergillusfumigatusinvolved in conidial pigment biosynthesis and virulence[J].Med Microbiol Immunol,1998,187(2):79⁃89.
[9] Zhang C,Kong Q,Cai Z,et al.The newly nonsporulated characterization of anAspergillus fumigatusisolate from an immunocompetent patient and its clinic indication[J].Fungal Genet Biol,2015,81:250⁃260.DOI:10.1016/j.fgb.2015.03.001.
[10] Jahn B,Koch A,Schmidt A,et al.Isolation and characterization of a pigmentless⁃conidium mutant ofAspergillus fumigatuswith altered conidial surface and reduced virulence[J].Infect Immun,1997,65(12):5110⁃5117.
[11] Park SY,Lee SO,Choi SH,et al.Serum and bronchoalveolar lavage fluid galactomannan assays in patients with pulmonary aspergilloma[J].Clin Infect Dis,2011,52(7):e149 ⁃152.DOI:10.1093/cid/cir027.
[12] 高露娟,余进,李若瑜.中国大陆地区曲霉病流行现状分析[J].中国真菌学杂志,2010,5(4):247⁃251.DOI:10.3969/j.issn.1673⁃3827.2010.04.016.Gao LJ,Yu J,Li RY.Epidemiology of aspergillosis in mainland China[J].Chin J Mycol,2010,6(4):247⁃251.DOI:10.3969/j.issn.1673⁃3827.2010.04.016.
[13] Katz ME,Dougall AM,Weeks K,et al.Multiple genetically distinct groups revealed among clinical isolates identified as atypicalAspergillus fumigatus[J].J Clin Microbiol,2005,43(2):551⁃555.DOI:10.1128/JCM.43.2.551⁃555.2005.
[14] 高露娟,余进,李若瑜.烟曲霉再鉴定、标准化CSP分型及体外药物敏感性[J].中国真菌学杂志,2011,6(6):328⁃331,316.DOI:10.3969/j.issn.1673⁃3827.2011.06.003.Gao LJ,Yu J,Li RY.Re⁃identification,standard CSP typing andin vitrosusceptibility ofAspergillus complex[J].Chin J Mycol,2011,6(6):328⁃336.DOI:10.3969/j.issn.1673⁃3827.2011.06.003.
An albino strain ofAspergillus fumigatuscauses pulmonary aspergilloma in an individual with normal immune system
Liu Fang,Kong Qingtao,Zhang Caiyun,Sang Hong,Shen Yongnian,Lyu Guixia,Liu Weida,Shi Yi
Department of Dermatology,Nanjing General Hospital/Nanjing General Hospital Affiliated to Nanjing University,Nanjing 210002,China(Liu F,Kong QT,Zhang CY,Sang H);Department of Pneumology,Nanjing General Hospital of Nanjing Military Command,Nanjing 210002,China(Shi Y);Institute of Dermatology,Chinese Academy of Medical Sciences and Peking Union Medical College,Nanjing 210042,China(Shen YN,Lyu GX,Liu WD)
A 76⁃year⁃old female patient complained of right chest pain for three months.CT scan showed a clump⁃like high⁃density shadow measuring 4.8 cm × 3.0 cm in size in the dorsal portion of the right lower lobe of the lung.Aspiration biopsy was performed,and biopsy samples were subjected to fungal culture and histopathological examination.Histopathological examination showed chronic granulomatous inflammation with hyaline septate hyphae.After 4⁃day culture,white villous dense colonies were formed on the Sabouraud′s agar medium.The center of the colonies was slightly elevated with wrinkles or radiating striae on the surface,and the bottom of the colonies was faint yellow in color.Microculture yielded abundant septate branched hyphae,and very few colorless hyaline quasi⁃circular spores.DNA sequencing of rDNA internal transcribed spacer(ITS)regions and β ⁃tubulin genes was performed to identify the isolate,and antifungal susceptibility testing was carried outin vitro.The MEGA7.0 software was used to build phylogenetic trees ofAspergillus fumigatuscomplex and its closely related species.The isolate was identified asAspergillus fumigatusby molecular biologic sequencing.The patient was diagnosed with pulmonary aspergilloma.After administration of itraconazole oral solution and vorionazole tablets,the condition got better obviously.
Aspergillus fumigates;Pulmonary aspergillosis;Aspergillus fumigates,albino strain;Pulmonary aspergilloma
Sang Hong,Email:shzwqzsl@163.com
桑红,Email:shzwqzsl@163.com
10.3760/cma.j.issn.0412⁃4030.2016.08.009
国家自然科学基金(81330035)
Fund program:National Natural Science Foundation of China(81330035)
2016⁃02⁃17)
(本文编辑:颜艳)
