盐酸伊达比星有关物质研究的新发现
2016-11-06陈爽张舒
陈爽,张舒
(浙江省食品药品检验研究院,浙江杭州310014)
盐酸伊达比星有关物质研究的新发现
陈爽,张舒
(浙江省食品药品检验研究院,浙江杭州310014)
目的提高盐酸伊达比星产品质量控制水平。方法色谱柱采用十八烷基硅烷键合硅胶为填充剂,流动相为甲醇-0.1%磷酸溶液(57∶43),检测波长为254 nm。结果通过改进盐酸伊达比星有关物质的检测方法,发现了1个新杂质。同时,在市售产品检测中发现了1个含量高达1.0%的新杂质。结论新发现的杂质会直接影响产品质量合格与否的判定。
盐酸伊达比星;有关物质;新杂质
盐酸伊达比星为蒽环霉素类抗癌药,临床用于治疗包括乳癌、淋巴癌、骨髓癌、非霍奇金淋巴癌等各种癌症。其剂型为注射用粉针,市售有原研厂家A的进口产品及国内厂家B的仿制产品。盐酸伊达比星我国现行的国家标准为YBH01842011,美国药典(USP35-NF30)和日本药典(JP16)均有收载[1-3]。根据国家药典委员会《关于安排2014年化药标准提高品种任务的通知》的任务安排,我院承担了盐酸伊达比星质量标准提高工作。本研究中在现有标准检测方法基础上改善色谱条件,提高了盐酸伊达比星杂质的检出率,在市售产品中新发现了1个高达1.0%的新杂质,直接影响产品质量合格与否的判定。
1 仪器与试药
1.1仪器
Agilent 1260型高效液相色谱仪。
1.2试药
盐酸伊达比星对照品(USP对照品,批号为1335701,含量为95.5%);杂质对照品:杂质A(4-去甲基-盐酸柔红霉素)、杂质B(13-二亚甲基缩酮-盐酸伊达比星)、杂质C(4-去甲氧基-柔红霉素酮)、杂质E(盐酸柔红霉素)均由辉瑞制药(无锡)有限公司提供;盐酸伊达比星(厂家A,批号13013FR332,13011ER332;厂家B,批号F131201,F131202);注射用盐酸伊达比星(厂家A,批号2YE002P,3YP0021;厂家B,批号120501,120601,130601);甲醇为色谱纯,水为重蒸馏水,其他试剂均为分析纯。
2 方法与结果
2.1色谱条件
研究比较了4种方法的色谱条件,详见表1。
2.2溶液制备
取供试品适量,精密称定,加流动相溶解并稀释制成每1 mL含盐酸伊达比星0.2 mg的溶液,作为供试品溶液。
取盐酸伊达比星对照品约20 mg,精密称定,置10 mL容量瓶中,加流动相溶解并稀释至刻度,摇匀,作为对照品贮备液。取杂质A,B,C,E各10 mg,分别置100 mL容量瓶中,加流动相溶解并稀释至刻度,摇匀,作为各自的杂质对照品贮备液。

表1 盐酸伊达比星有关物质测定的色谱条件
取杂质对照品贮备液各2.0 mL和对照品贮备液10.0 mL,置100 mL容量瓶中,加流动相稀释至刻度,制成每1 mL中含盐酸伊达比星0.2 mg与A,B,C,E各杂质各2 μg的溶液,作为混合对照品溶液。
2.3有关物质检测方法比较
取混合对照品溶液及供试品溶液,照2.1项下各色谱条件检测。结果如下。
方法1:各杂质峰与主峰间分离度良好,经杂质定位发现混合对照品溶液中检出一未知色谱峰(相对保留时间约为0.92,杂质D),经供试品溶液检测,在厂家A的样品中均检出了杂质D,厂家B样品未发现杂质D。色谱图见图1。
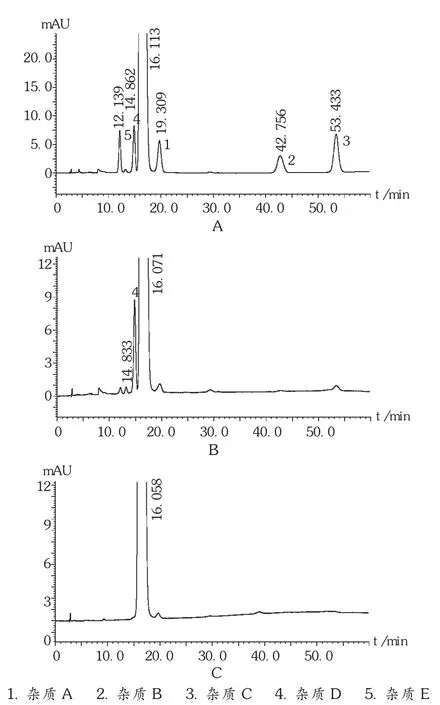
图1 方法1高效液相色谱图
方法2:各杂质峰与主峰间分离度良好,但杂质C与杂质E无法很好分离,混合对照品溶液及供试品溶液中均无法检出新杂质D。典型色谱图谱见图2A。
方法3:杂质A与主峰无法分离,混合对照品溶液及供试品溶液中均无法检出杂质D。典型图谱见图2B。
方法4:各杂质峰与主峰间分离度良好,但混合对照品溶液及供试品溶液中均无法检出杂质D。色谱图谱见图2C。
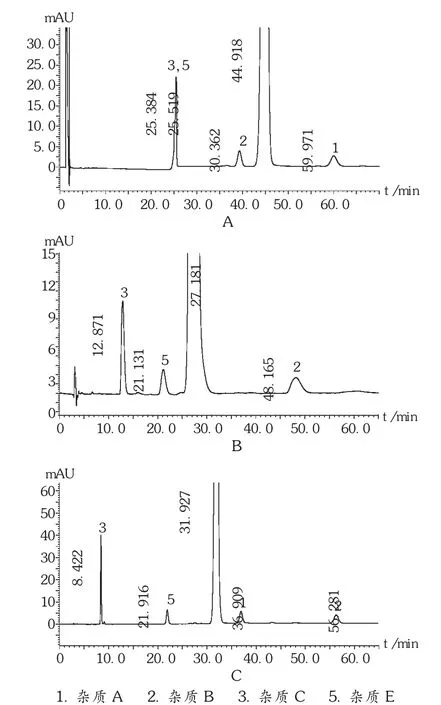
图2 方法2-4混合对照品溶液的典型色谱图
2.4样品有关物质检测
取9批样品,照2.1项下方法制备供试品溶液,依方法1、方法3项下色谱条件测定,结果见表2。国家标准有关物质限度要求“单个杂质≤1.0%,杂质总量≤2.0%”,USP标准有关物质限度要求“单个杂质≤1.0%,杂质总量≤2.0%”。依方法1检测,厂家A的样品检出的新杂质(杂质D)以现有标准限度要求,大部分不合格。
3 讨论
3.1杂质D
杂质D为本次标准提高质量研究中新发现的杂质,自定义命名为杂质D。经DAD紫外扫描显示,杂质D的紫外吸收图谱与伊达比星基本一致。进一步的质谱分析显示,杂质D的相对分子质量与伊达比星相同。文献调研发现,伊达比星在合成过程中要经过一步缩合反应,故会产生一对对映体。综上分析,初步认为杂质D可能为伊达比星的对映异构体。

表2 样品有关物质测定结果(%)
3.2色谱柱的选择
方法1的色谱条件下,色谱柱的选择对杂质D的检出存在较大的影响。试验结果表明,采用150 mm柱长的色谱柱时,杂质D湮没在主峰中无法检出,只有采用250 mm柱长的色谱柱时,才能将杂质D从主峰中分离。
3.3有关物质的测定
按改善的有关物质方法测定,市售厂家A的原料药及制剂中均检出了1个高达1.2%的未知杂质,而此杂质在现有标准方法下均无法检出。在未明确鉴定该杂质前,为避免产品的潜在风险,建议厂家采取必要措施控制风险。另外,因USP对照品中也检出该未知杂质,而USP方法自身无法检出该杂质,因此盐酸伊达比星USP对照品的标示含量有可能不准确。
[1]YBH01842011,国家食品药品监督管理局国家药品标准[S].
[2]The United States Pharma copeial Corention.USP35-NF30[M]. U.S.Pharmacopeia,2011:3 475-3 476.
[3]Society of Japanese Pharmacopoeia.JP16[M].French and European Publication Inc,2015:945-946.
[4]YBH01732005,国家食品药品监督管理局国家药品标准[S].
[5]JX20000015,进口药品注册标准[S].
[6]YBH05422004,国家食品药品监督管理局国家药品标准[S].
New Discovery in Idarubicin Hydrochloride-Related Substances
Chen Shuang,Zhang Shu
(Zhejiang Institute for Food and Drug Control,Hangzhou,Zhejiang,China310014)
ObjectiveTo improve the product quality control of idarubicin hydrochloride.MethodsThe separation was performed on a C18column with a mixture of methanol and 0.1%phosphoric acid solution(57∶43).The UV detection wavelength was 254 nm. ResultsA new impurity was found by an improved HPLC method for related substance in idarubicin hydrochloride,and the content rate of the new impurity found in the samples from marketing was as high as 1.0%.ConclusionThe new found impurity can directly affect the quality of the product.
idarubicin hydrochloride;related substance;new Impurity
TQ460.7;R927.11;R979.1
A
1006-4931(2016)17-0029-03
陈爽,硕士研究生,主管药师,研究方向为药品检验及化学药品质量控制,(电子信箱)credear@ 126.com。
(2016-04-20;
2016-06-06)
