雄激素调节小鼠泪膜功能与角膜上皮细胞Mucins表达的体内研究
2016-11-04王双梅康前雁
黎 黎,郑 璇,王双梅,高 鸽,康前雁
·实验论著·
雄激素调节小鼠泪膜功能与角膜上皮细胞Mucins表达的体内研究
黎黎1,郑璇2,王双梅3,高鸽3,康前雁1
•METHODS:Withorchiectomyoperation,wesetupmicemodel.Andserumandrogenconcentrationofmicewasdetectedbyradioimmunoassay.Break-uptime(BUT)oftearfilmwastestedinthedifferentexperimentalpoints.MicecornealepitheliawerepeeledandMUC1andMUC4mRNAandproteinlevelsweremeasuredbyRT-PCRandWesternblot.
•RESULTS:Theserumandrogenconcentrationreducedto0ng/μLat1wkafterorchiectomy.TheBUTvalueswere68.33±12.86s, 62.47±3.75s, 58.67±10.03s, 47.17±7.64s, 39.51±3.39s, 32.67±3.88sand31.00±2.36sinthenormalcontrolgroup,shamgroupandinorchectomygroupat1, 2, 4, 6and8wk,respectively,andtheBUTsweresignificantlyshorterintheorchectomyat2, 4, 6and8wkgroupsthanthoseinthenormalcontrolgroup(allatP<0.05).MUC1andMUC4mRNAandproteinslevelsdecreasedwithandrogenlevellowering(P<0.05).Mucin1levelwasthelowestat2wkafterorchiectomy,andthelowestMucin4levelwasfoundat1wkafterorchiectomy.
•CONCLUSION:In vivo,androgenregulatesMucinsexpressionsinmicecornealepithelialcells,makesBUTshorter,andinfluencethestabilityoftearfilm.
目的:探讨去势小鼠干眼模型中雄激素浓度对小鼠泪膜稳定性以及角膜上皮细胞Mucins表达的影响。
方法:通过双侧睾丸切除去势手术,改变体内雄激素水平,观察泪膜破裂时间的变化,同时在不同时间点采用RT-PCR法与Western-Blot法分别检测小鼠角膜上皮细胞中Muc1和Muc4的mRNA和蛋白水平的表达变化。
结果:去势1wk后小鼠睾酮质量浓度下降至0ng/μL;正常对照组、伪手术组及去势术后1、2、4、6、8wk组小鼠BUT分别为68.33±12.86、62.47±3.75、58.67±10.03、47.17±7.64、39.51±3.39、32.67±3.88、31.00±2.36s,其中术后2、4、6、8wk组小鼠泪液BUT值较正常对照与伪手术组均明显缩短,差异均有统计学意义(均P<0.05)。Muc1与Muc4的mRNA与蛋白水平表达,随雄激素浓度下降,表达下调(P<0.05),Muc1在去势后第2wk表达最低,而Muc4在去势后第1wk表达降至最低。
结论:在体内,雄激素可调控小鼠角膜上皮Mucins表达,并缩短泪膜破裂时间,参与泪膜稳定性的维持。
雄激素;泪膜破裂时间;黏蛋白;角膜上皮细胞
引用:黎黎,郑璇,王双梅,等.雄激素调节小鼠泪膜功能与角膜上皮细胞Mucins表达的体内研究.国际眼科杂志2016;16(7):1228-1231
0引言
干眼是一类因泪液量或质异常导致泪膜不稳定,伴眼部不适,严重时导致眼表组织结构病变的疾病总称。干眼的发病由多因素参与,近年研究发现性激素分泌失衡也参与干眼的发生和发展[1-2]。已有研究证实,雄激素水平的改变可以调控睑板腺、泪腺功能,进而影响泪膜的稳定性[3],我们前期研究也发现雄激素水平影响体外小鼠角膜上皮细胞Muc1和Muc4表达[4],同时去势小鼠的泪膜稳定性也明显下降[5],然而在体内实验,雄激素浓度改变是否可以调节Muc1和Muc4的表达,是我们本研究希望了解的内容。本研究拟建立去势小鼠模型,观察在体内小鼠角膜上皮细胞Muc1和Muc4表达的变化,并观察泪膜稳定性的重要指标——泪膜破裂时间(break-uptime,BUT)的表化。
1材料和方法
1.1材料
1.1.1实验动物SPF级6~8周龄BALB/c雄性小鼠56只,无眼部疾病,体质量20±2g,由西安交通大学医学院动物中心提供。本研究中,实验动物的使用和喂养遵循国家科学技术部颁布的《实验动物管理条例》。
1.1.2主要试剂及仪器设备Muc1兔抗鼠多克隆抗体(ab15481,美国Abcam公司),Muc4兔抗鼠多克隆抗体(sc-20117,英国Santa公司);TrizolReagent(美国Gibco公司)。反转录Real-timePCR试剂盒(大连宝生物制品公司);酚红棉线(天津晶明医用器材公司);荧光素钠(广州白云山明兴制药有限公司)。眼前节照相系统(苏州66视觉科技股份有限公司);游标卡尺(上海仪器一厂)。
1.2方法
1.2.1干眼模型的建立及分组按照随机数字表法将小鼠随机分为正常对照组、伪手术组、术后1wk组、术后2wk组、术后4wk组、术后6wk组和术后8wk组,每组各8只小鼠。手术组小鼠全身麻醉(盐酸氯胺酮100mg/kg),无菌条件下经阴囊正中切口,摘除小鼠双侧睾丸,立即缝合创口,肌内注射青霉素G0.1mL。伪手术组小鼠麻醉,无菌条件下剪开阴囊正中皮肤但不摘除睾丸,术后处理同手术组。
1.2.2竞争放射免疫法检测小鼠外周血睾酮浓度正常对照组、伪手术组于术后1wk、手术组于术后1、2、4、6、8wk脱颈法处死小鼠,摘除小鼠右眼眼球(每组8只),同时采集血液500μL以上,室温下静置2~3h,待血液凝固后收集析出的血清,转移至1mL离心管中,置于-20℃冰箱内保存。加样前融化摇匀,采用竞争放射免疫法检测并建立标准曲线,计算样品中睾酮浓度。
1.2.3角膜上皮细胞取材正常对照组、伪手术组于术后1wk、手术组于术后1、2、4、6、8wk脱颈法处死小鼠,无菌条件下摘除眼球,并放置于D-Hank液(含300μg/mL青-链霉素)中漂洗2遍。显微镜下钝性分离角膜上皮组织待用。
1.2.4实时荧光定量PCR检测各组小鼠Muc1和Muc4mRNA的表达每组2个角膜上皮样本,TrizolReagent提取细胞的总RNA,测总RNA浓度及波长260nm与280nm处的吸光度(A)值的比值(260/280),-70℃保存备用。引物设计:在Genbank中查出MUC基因和内对照基因(β-Actin)的cDNA序列,用软件Primer6.0设计引物。所用引物序列由大连宝生物制品公司合成。Muc1引物序列:上游5’-CCAGGACACCTACCATCCTATGAG-3’,下游5’-TCACCACAGCTGGGTTGGTATAAG-3’。Muc4引物序列:上游5’-AGGCCAATGCAAGCACCTG-3’,下游5’-AGTGTTCGCCCGAGGATGTA-3’。以总RNA为模板,用反转录试剂盒将RNA逆转录为cDNA,然后进行Real-time PCR检测。
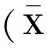
表1 各组小鼠泪膜破裂时间的比较±s,s)
注:P值为各组与正常对照组比较。
1.2.5 Western-Blot检测各组小鼠Muc1和Muc4蛋白水平的表达每组6个小鼠角膜上皮样本,液氮研磨,加入RIPA缓冲液和PMSF,获得细胞裂解液,进行Bradford比色法测定蛋白质浓度,以20~50μg总蛋白量上样,12% SDS-PAGE电泳,转膜,漂洗后室温封闭1h,一抗1∶1000室温孵育1h,漂洗后二抗孵育1h,漂洗后ECL显色,拍照,利用Image J软件分析条带的灰度值。以β-Actin作为内参。
1.2.6各组小鼠泪膜破裂时间测定正常对照组、伪手术组于术后1wk、手术组分别于术后1、2、4、6、8wk用微量注射器将1%荧光素钠1μL滴入各组小鼠下穹隆部,瞬目后可使荧光素钠均匀分布于眼表面。在裂隙灯显微镜的钴蓝光下进行观察,记录小鼠出现第一个泪膜破裂斑所需的时间,即BUT,重复观察3次,取其平均值。
2结果
2.1去势手术对血清睾酮浓度的影响正常对照组、伪手术组小鼠血清睾酮质量浓度分别为573.87±6.74、579.74±8.24ng/μL,各组间差异无统计学意义(P>0.05)。手术组小鼠去势术后1wk开始血清睾酮浓度下降至0ng/μL,与正常组和伪手术组比较,差异有统计学意义(P<0.05)。
2.2各组小鼠泪膜破裂时间比较正常对照组与伪手术组测定BUT分别为68.33±12.86、62.47±3.75s,各组间比较差异均无统计学意义(F=2.762,P=0.119)。与正常对照组比较,术后1wk组小鼠BUT差异均无统计学意义(P>0.05),但术后2wk组、术后4wk组、术后6wk组和术后8wk组小鼠BUT逐渐缩短,差异均有统计学意义(P<0.05,表1)。
2.3去势后小鼠角膜上皮Muc1和Muc4 mRNA表达的影响与正常对照组比较,去势后各组角膜上皮细胞中Muc1mRNA表达降低,差异有统计学意义(P<0.05);去势2wk时,Muc1mRNA表达降低至最低,去势4、6、8wk后Muc1mRNA表达缓慢增加,但仍低于正常对照组表达水平,差异有统计学意义(P<0.05,图1)。与正常对照组比较,去势后各组角膜上皮细胞中Muc4 mRNA表达降低,差异有统计学意义(P<0.05);去势1wk时,Muc4 mRNA表达降低至最低,去势2、4、6、8wk后Muc4 mRNA表达缓慢增加,但仍低于正常对照组表达水平,差异有统计学意义(P<0.05,图2)。
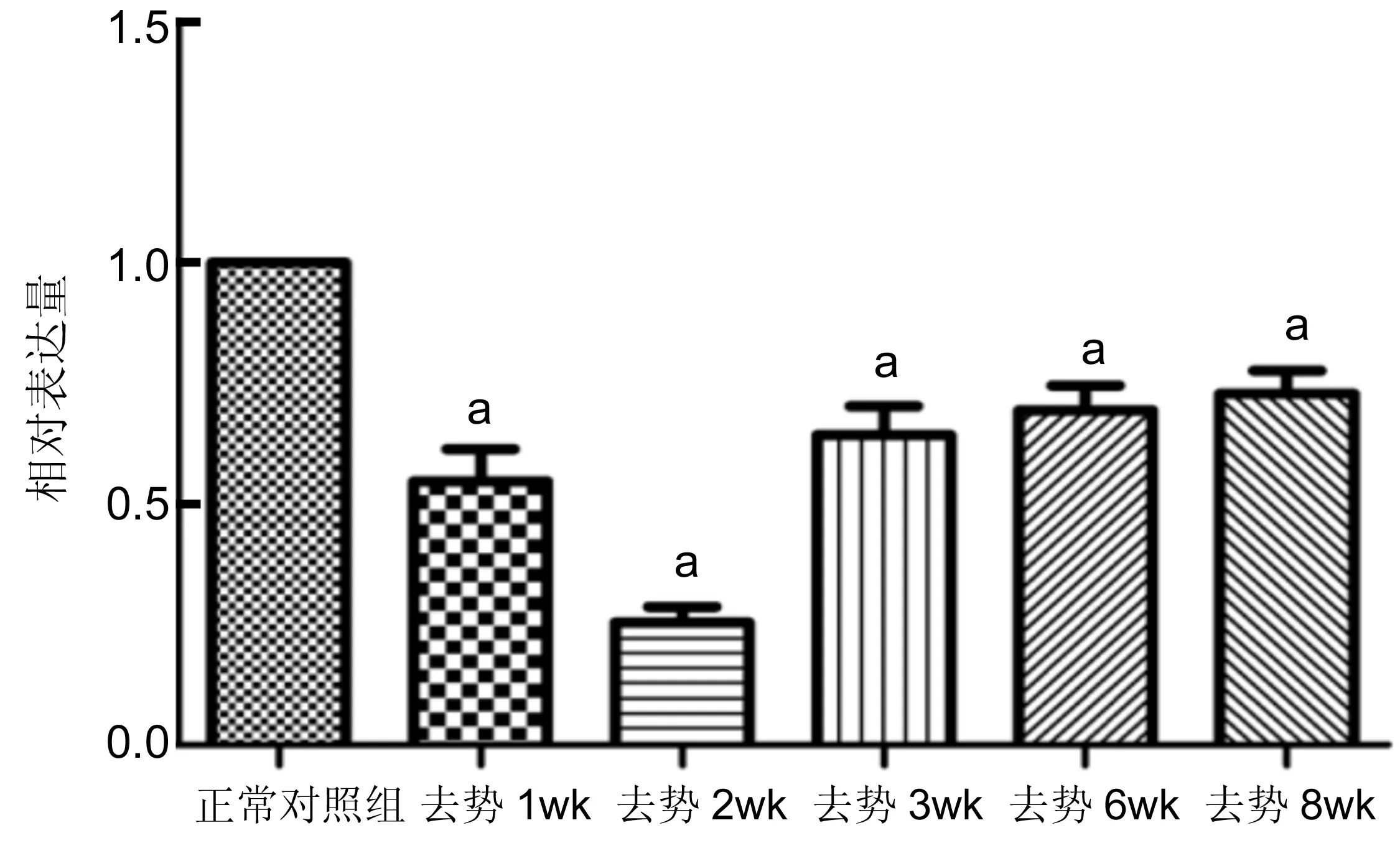
图1去势后小鼠角膜上皮Muc1mRNA的表达变化aP<0.05vs正常对照组。
2.4去势后小鼠角膜上皮Muc1和Muc4蛋白水平表达的影响去势后Muc1与Muc4蛋白水平表达也有下降(图3~5),变化规律基本与其mRNA水平的变化一致。Muc1在去势后第2wk表达最低,而Muc4在去势后第1wk表达降至最低。
3讨论
世界干眼研究小组(DEWS)根据临床以及基础研究证据,已经阐明女性是干眼的易患因素[6-7],女性干眼患者也高于男性,这与雄激素的保护作用有关。泪膜是一层仅为7μm的动态薄膜,覆盖于眼表,对于维持眼表微环境意义重大。目前已知泪膜可分为三层,分别为脂质层、水样层、黏蛋白层,各层对维持泪膜稳定性均很重要;动物实验发现,雄激素可明显减少睑板腺分泌量,引起泪膜的脂质层功能异常,泪膜稳定性下降[8-9];另有研究通过对去势后的雄兔眼表及泪膜的变化进行观察,发现雄激素水平降低,泪腺上皮细胞萎缩,导致泪液分泌减少[10]。而泪膜中黏蛋白层,尤其是膜结合型Mucins,其与角膜上皮细胞微绒毛形态对维持泪膜的稳定性具有更为重要的意义,膜结合型Mucins为极化跨膜大分子物质,疏水端跨膜固定于角膜上皮的微绒毛上,而亲水端形成一个长尾巴,游离在泪膜中,以此方式将疏水性的角膜上皮细胞与亲水性的泪膜水样层联系起来,二者共同作用才将泪膜通过瞬目运动均匀地涂布在角膜表面,同时保护上皮细胞免受瞬目摩擦带来的损伤,维持角膜上皮细胞的非角化特性[11]。眼表主要的膜结合型Mucins为Muc1与Muc4。有关雄激素对黏蛋白表达的影响已在体内多种组织细胞中得到证实,如在男性泌尿生殖道上皮细胞中表达多种黏蛋白,且受雄激素调节[12],此外DHT可上调前列腺癌细胞(PC-3)Muc1 mRNA表达[13]。在眼部的研究相对较少。而本研究发现,去势后雄激素水平骤降,接近0μg/mL,小鼠角膜上皮中Muc1和Muc4,无论是基因水平还是蛋白水平,均有下降;这与本课题组之前的体外研究结果一致[4];体内实验结果还显示,随着去势时间的延长,Mucins表达逐渐回升,我们考虑是存在其他途径的调控有关。
本研究利用BUT作为评价泪膜稳定性的指标,采用荧光素染色观察BUT,该方法简便经济,适用于体内的动物实验。我们的结果显示,去势后体内睾酮含量几乎消失,BUT明显缩短,并且随时间延长而加重;目前临床中主要用于评价泪膜稳定性的方法有:(1)BUT:BUT的检查包括利用泪膜镜测得的非侵犯性BUT及利用荧光素的BUT,操作简便,适合初步筛查以及动物实验;(2)角膜地形图[14],该检测方法可以一定程度上对泪膜分布的情况作一描述,在泪膜分布出现异常或者波动时表现出异常的散光增加。在干眼患者的检测中发现,其角膜表面的规则相关性参数较正常人增高,并且随着干眼造成的眼表损伤程度的加重,参数增高,但由于采样面积等因素,预实验中数据稳定性与重复性不佳,故在本研究中未被采用。泪膜稳定性是对泪膜功能的一个综合评定,并且常与临床表现直接相关。本实验证实,在体内雄激素浓度下降后,BUT明显缩短,同时Muc1和Muc4表达也下降。因此,推测雄激素可能通过影响角膜上皮细胞Mucins表达,最终影响泪膜稳定性,其中的具体机制需要进一步探索。我们知道BUT是一个综合性指标,而泪膜三层结构(脂质层、水样层、黏蛋白层)的任何一个或多个异常,均会影响BUT,而本研究并未考虑到脂质层与水样层的差异,这是本文的不足之处,需要进一步补充研究。
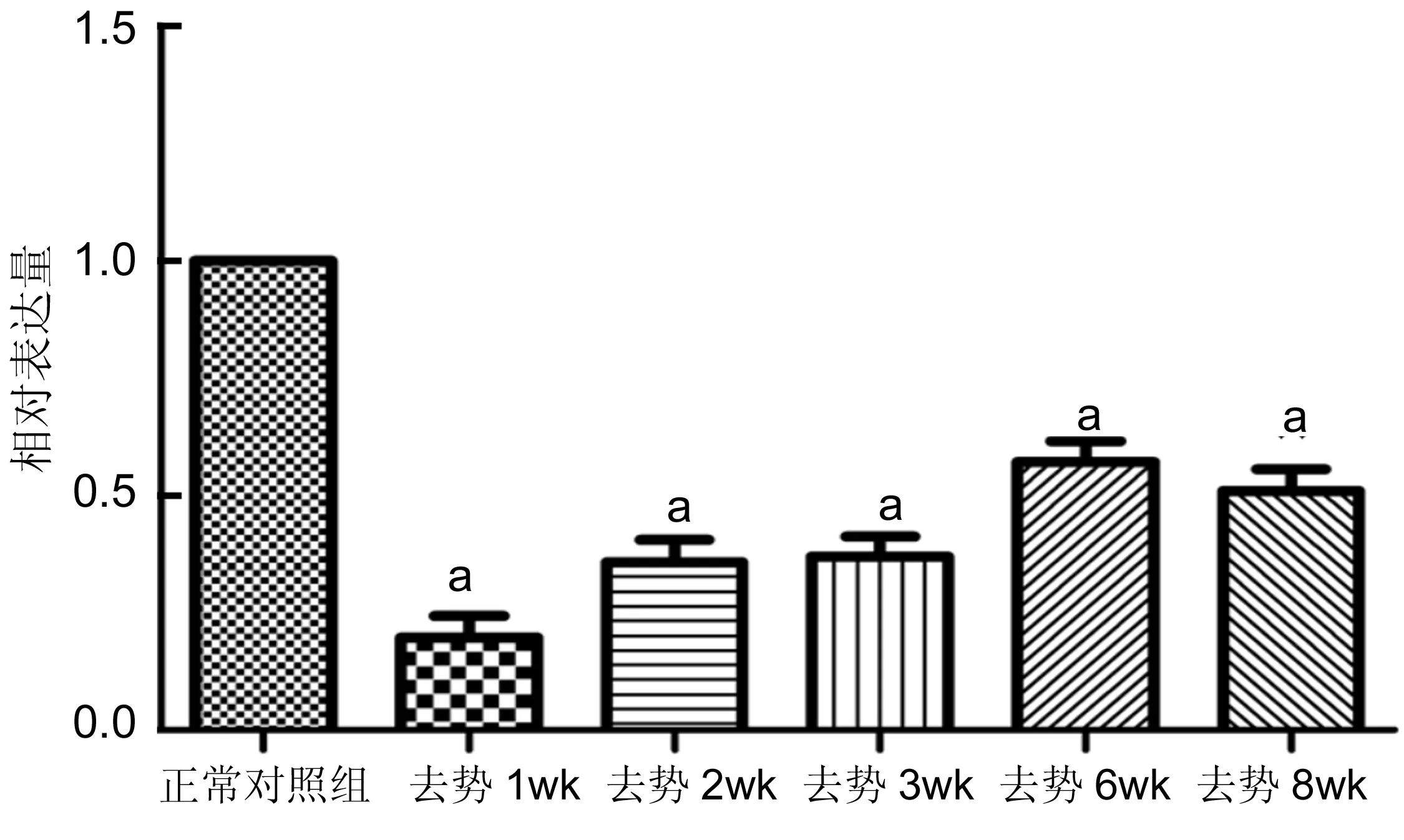
图2去势后小鼠角膜上皮Muc4mRNA的表达变化aP<0.05vs正常对照组。
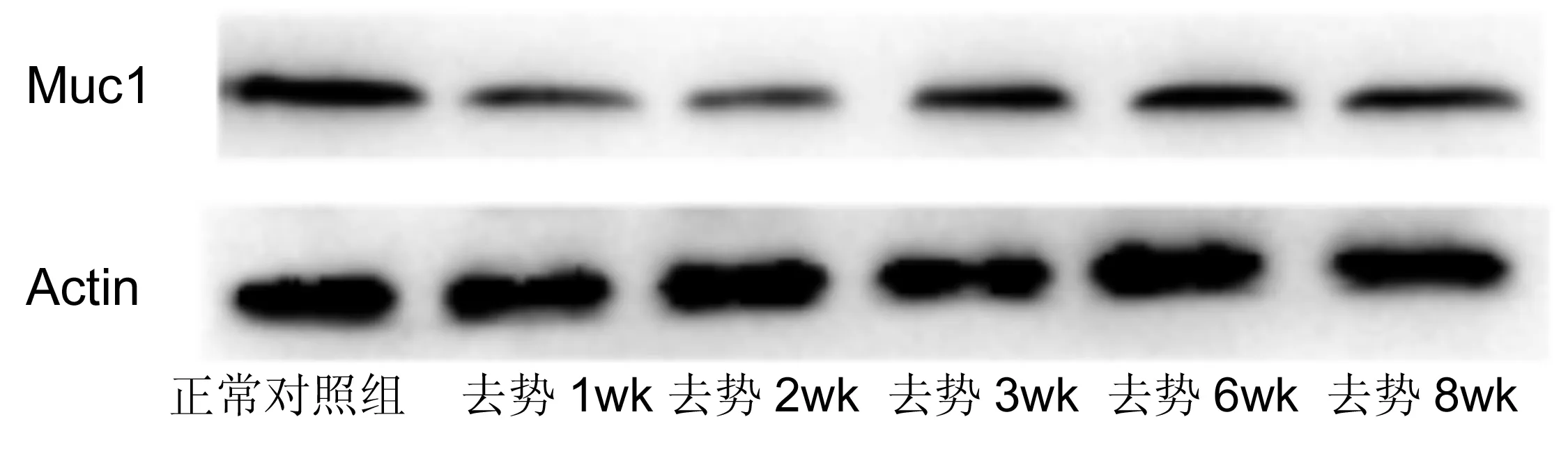
图3去势后小鼠角膜上皮Muc1蛋白水平的表达变化。
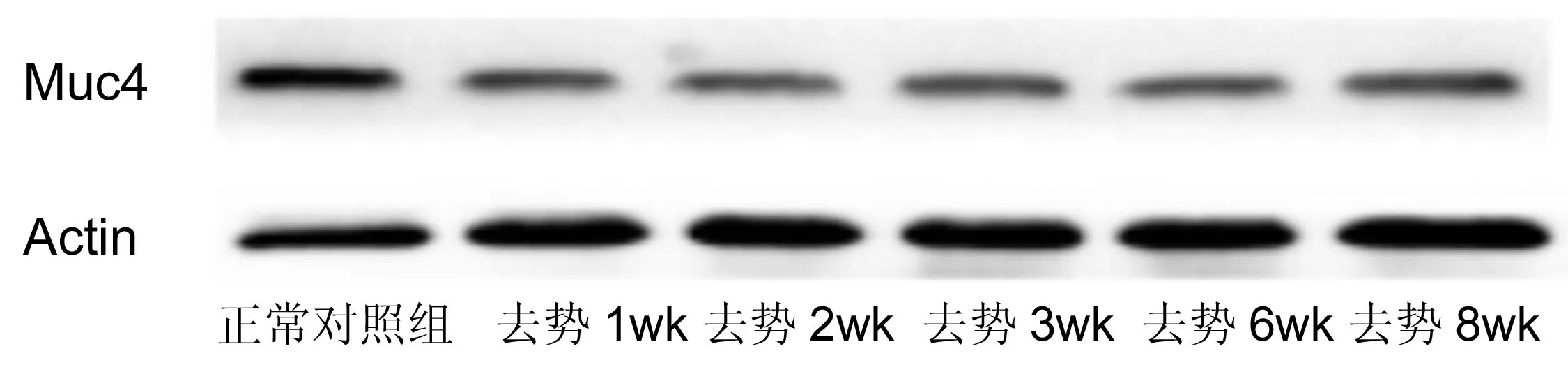
图4去势后小鼠角膜上皮Muc4蛋白水平的表达变化。
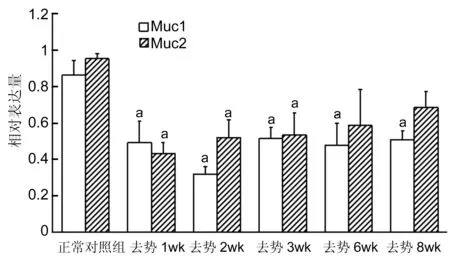
图5去势后小鼠角膜上皮Muc1和Muc4蛋白水平表达的柱形图aP<0.05vs正常对照组。
综上所述,在体内雄激素可调控小鼠角膜上皮黏蛋白表达,并且雄激素水平变化影响BUT与泪膜稳定性。对以上现象的作用机制进行深入探索,将可能为干眼的研究和临床治疗开辟新的方向。
1胡道德,顾磊,刘焰,等.干眼症的研究进展. 眼科新进展 2007;27(5):380-382
2张宏,马俊旗,安晓,等.围绝经期干眼患者眼表CXCR3表达与性激素的相关性分析.眼科新进展 2013;33(9):839-842
3 Schirra F, Suzuki T, Dickinson DP,etal. Identification of steroidogenic enzyme mRNAs in the human lacrimal gland, meibomian gland, cornea, and conjunctiva.Cornea2006;25(4):438-442
4黎黎,高鸽,郑璇,等. 二氢睾酮对小鼠角膜上皮细胞Mucins表达的影响.眼科新进展2014;34(8):701-704
5黎黎,王双梅,郑璇,等. 去势雄性小鼠泪膜功能异常及角膜上皮细胞超微结构改变. 中华实验眼科 2016;34(2):103-107
6 The epidemiology of dry eye disease: report of the epidemiology subcommittee of the international Dry Eye WorkShop.OculSurf2007;5(2):93-107
7 Yazdani C,McLaughlin T,Smeeding JE,etal. Prevalence of treated dry eye disease in a managed care population.ClinTher2001;23(10):1672-1682
8 Suzuki T, Kinoshita Y, Tachibana M,etal. Expression of sex steroid hormone receptors in human cornea.CurrEyeRes2001;22(1):28-33
9 Schirra F, Suzuki T, Richard SM,etal. Androgen control of gene expression in the mouse meibomian gland.InvestOphthalmolVisSci2005;46(10):3666-3675
10罗丰年,张汗承,孙叙清,等.去势雄兔泪液分泌及泪膜稳定性的改变.中华眼科杂志2001;37(6):458-461
11 Ashutosh S. Energetics of corneal epithelial cell-ocular mucus-tear film interactions: some surface-chemical pathways of corneal defense.BiophysChem1993;47(1):87-99
12 Russo CL, Spurr-Michaud S, Tisdale A,etal. Mucin gene expression in human male urogenital tract epithelia.HumReprod2006;21(11):2783-2793
13 Evanqelou A, Letarte M, Marks A,etal. Androgen modulation of adhesion and antiadhesion molecules in PC-3 prostate cancer cells expressing androgen receptor.Endocrinoloqy2002;143(10):3897-3904
14李劼,赵恳,孙明,等.干眼症对角膜地形图角膜厚度检测结果的影响.国际眼科杂志 2011;11(4):735-736
Effect of androgen on mice tear film stability and Mucins expressions in mice corneal epithelial cells in vivo
Li Li1, Xuan Zheng2, Shuang-Mei Wang3, Ge Gao3, Qian-Yan Kang1
NationalScienceFoundationofChina(No.81100647)
Qian-YanKang.DepartmentofOphthalmology,theFirstAffiliatedHospitalofXi’anJiaoTongUniversity,Xi’an710061,ShaanxiProvince,China.eyelili2010@mail.xjtu.edu.cn
2016-03-06Accepted:2016-06-15
•AIM:Tostudyin vivotheeffectofandrogenonmicetearfilmstabilityandMucinsexpressionsincornealepithelialcellsinBALB/cmiceafterorchectomy.
androgen;tearfilmbreaktime;mucins:cornealepitheliumcell
国家自然科学青年基金(No.81100647)
1(710061)中国陕西省西安市,西安交通大学第一附属医院眼科;2(710002)中国陕西省西安市第一医院眼科;3(710004)中国陕西省西安市第四医院眼科
黎黎,毕业于首都医科大学附属北京同仁医院,眼科学博士,主治医师,助理研究员,讲师,研究方向:眼表疾病。
康前雁,毕业于西安交通大学,博士,主任医师,研究方向:眼组织损伤修复.eyelili2010@mail.xjtu.edu.cn
2016-03-06
2016-06-15
1DepartmentofOphthalmology,theFirstAffiliatedHospitalofXi’anJiaoTongUniversity,Xi’an710061,ShaanxiProvince,China;2DepartmentofOphthalmology,Xi’anNo.1Hospital,Xi’an710002,ShaanxiProvince,China;3DepartmentofOphthalmology,Xi’anNo.4Hospital,Xi’an710004,ShaanxiProvince,China
LiL,ZhengX,WangSM, et al.EffectofandrogenonmicetearfilmstabilityandMucinsexpressionsinmicecornealepithelialcellsin vivo. Guoji Yanke Zazhi(Int Eye Sci) 2016;16(7):1228-1231
10.3980/j.issn.1672-5123.2016.7.06
