TODGA/HNO3萃取La3+的界面性质
2016-11-03马守涛杨全宁孙国新
韦 兵, 崔 玉, 马守涛, 杨全宁, 孙国新
(济南大学化学化工学院, 济南 250022)
TODGA/HNO3萃取La3+的界面性质
韦兵, 崔玉, 马守涛, 杨全宁, 孙国新
(济南大学化学化工学院, 济南 250022)
利用滴体积法研究了La3+/HNO3/N,N,N′,N′-四辛基-3-氧戊二酰胺(TODGA)/稀释剂体系的界面性质, 考察了TODGA浓度、 液滴形成时间、 稀释剂种类、 La3+浓度、 体系温度、 离子强度和溶液酸度等因素对体系界面性质的影响. 实验结果表明, 体系达到界面饱和吸附时间约为120 s, 可认为体系达到萃取平衡; TODGA浓度不同时, 界面张力也不同, 进而判定界面饱和吸附物种亦不相同; 极性较小的稀释剂体系的界面张力降低较大, 按照正辛烷>环己烷>苯>甲苯次序降低; HNO3对TODGA的质子化作用使其表面活性显著增强, 故硝酸浓度增大导致界面张力降低; NaNO3的存在降低了界面上游离萃取剂分子的浓度, 致使界面张力增大.
TODGA; La3+; 滴体积法; 界面性质; 萃取
酰胺萃取剂具有易合成、 耐辐射、 不易水解、 不影响萃取过程和能完全燃尽无污染等优点, 被广泛用于镧系、 锕系离子的萃取分离[1~3]. 其中,N,N,N′,N′-四辛基-3-氧戊二酰胺(TODGA)与其它类型的酰胺萃取剂相比, 在萃取率及稳定性上表现出较大优势, 已成为研究热点之一. 目前, 大多数关于TODGA萃取的研究均集中于热力学方面, 对其萃取动力学研究较少[4,5], 但是许多萃取体系存在动力学分离因素影响远远大于平衡分离因素的现象, 因此进行萃取动力学实验和理论研究具有重要意义.
考虑到萃取反应主要是在界面区域进行[6,7], 因此考察两相界面性质对于深入解析其萃取过程及萃取动力学机理显得至关重要. 界面张力是反应界面性质的最直观参数, 界面张力的常用测量方法有滴体积法[8,9]、 悬滴法[10]、 铂金环法[11]、 最大泡压法[12]和毛细管上升法[13]等, 其中滴体积法具有测定数据准确性较高、 重复性好和误差较小等优点[14]. 与其它测量方法相比, 滴体积法通过控制液滴生长时间来考察液滴形成时间对界面性质的影响, 对研究萃取过程有独特优势. 基于此, 本文采用滴体积法, 考察了包括稀释剂种类、 萃取剂浓度、 平衡时间、 La3+浓度、 体系温度、 溶液酸度和离子强度等化学环境因素[15]对TODGA/HNO3萃取La3+的界面性质的影响. 以期通过改变实验条件引起界面现象的变化, 来分析萃取过程中萃取剂分子在有机相中的扩散、 在界面上的吸附-解吸以及离子萃取等行为, 进而对萃取过程动力学做出更本质的理解.
1 实验部分
1.1试剂
TODGA由本实验室自制[16], 纯度为99%; 其它试剂均为市售商品, 依据试剂纯化手册进行纯化.
1.2实验过程
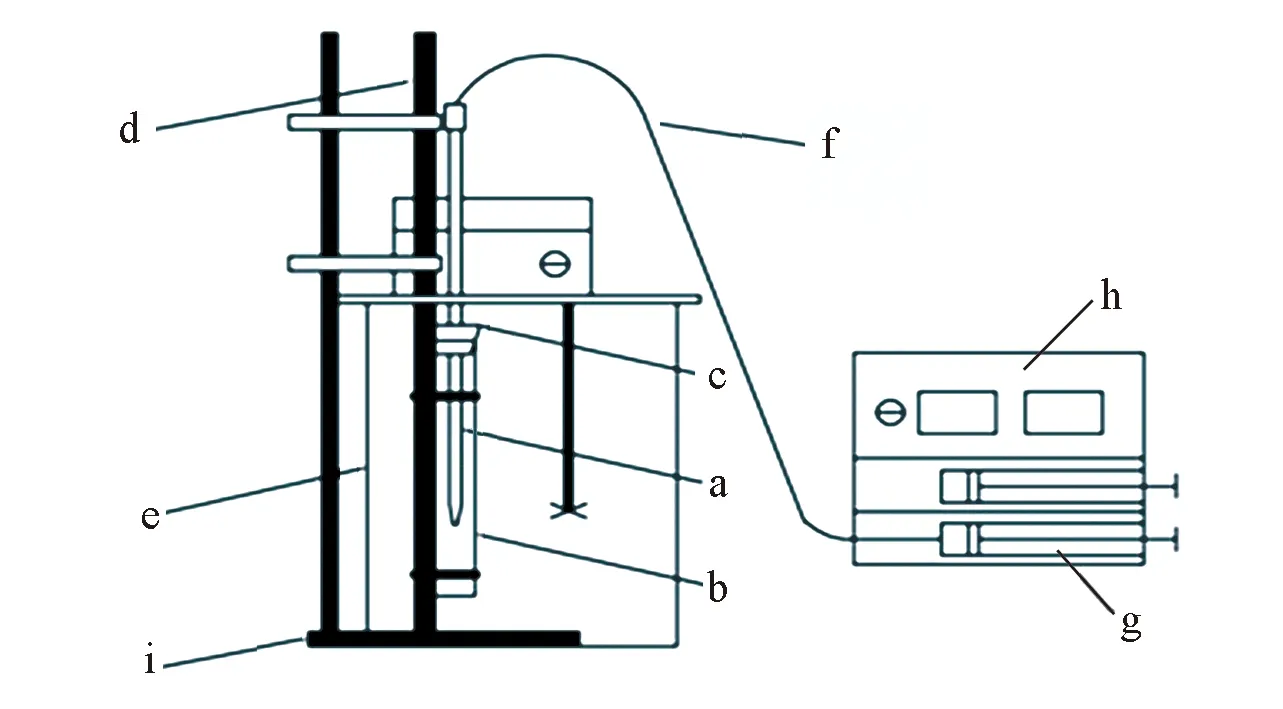
Fig.1 Schematic diagram of drop volume devicea. Drop volume tube; b. sample tube; c. rubber plug with a groove; d. sample tube rack; e. glass thermostatic water bath; f. injection line; g. syringe; h. trace injection pump; i. retort stand
1.2.1操作步骤自行设计制作滴体积装置, 装置示意图见图1. 按图1所示将各部件固定好, 设定好恒温槽温度, 再进行以下操作:(1) 将密度小的溶液装入样品管; (2) 用注射器将密度大的溶液吸入滴体积管, 将滴体积管尖端伸入样品管内液面以下, 将注射器固定于微量注射泵上; (3) 设置微量注射泵流速, 开始滴液; (4) 控制微量注射泵, 在滴体积管管口慢慢形成液滴, 滴落瞬间停止微量注射泵, 读取滴体积管示数V0(mL); 然后, 将微量注射泵示数调零, 重复滴定操作, 同时开始记时, 记录从开始到结束滴落的液滴数n及时间t0(s), 以及此时滴体积管示数V(mL), 则(V-V0)/n为每一滴的体积,t0/n(t)为每一滴的生成时间.
1.2.2界面张力的计算界面张力γ按下式计算:
(1)
式中:γ(N/m)为两相液体之间的界面张力; ρ1(g/mL)为重相液体密度; ρ2(g/mL)为轻相液体密度;V(mL)为液滴的体积;g为重力加速度;r(m)为滴体积管管口半径; π为常数; φ为r/V1/3的函数, 与溶液的界面张力、 滴管材料、 液体密度和黏度等无关[17].
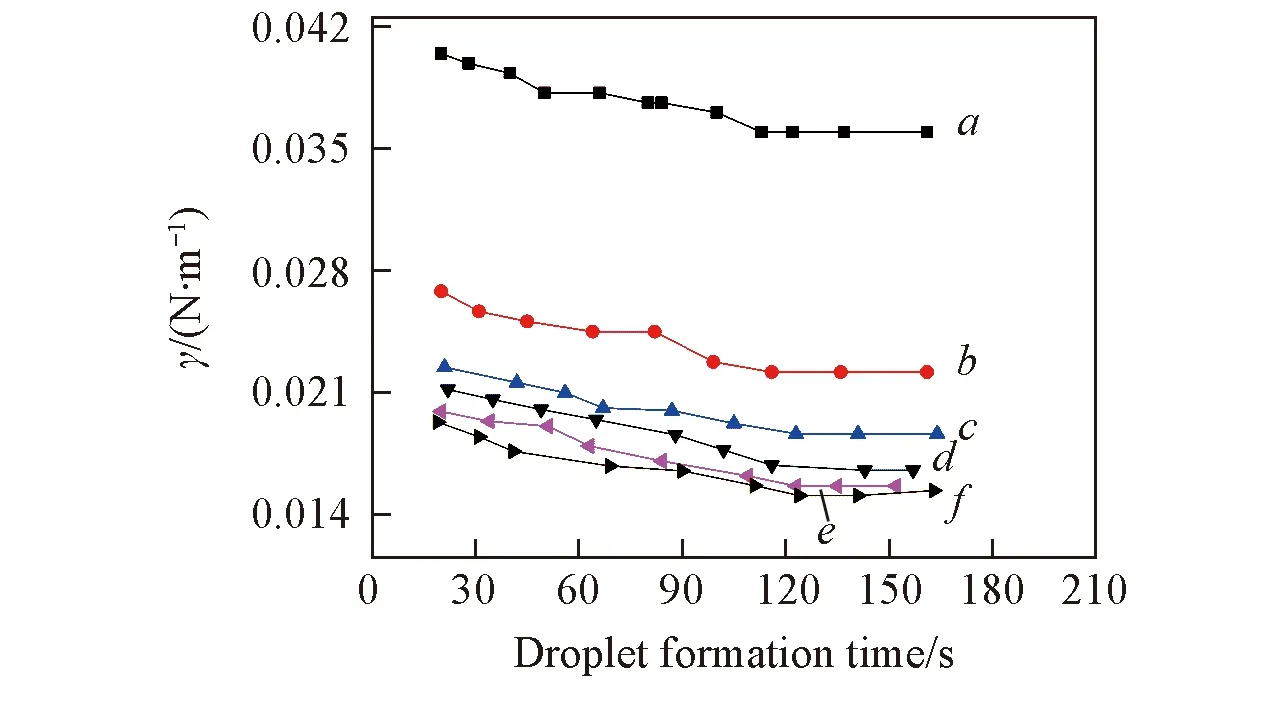
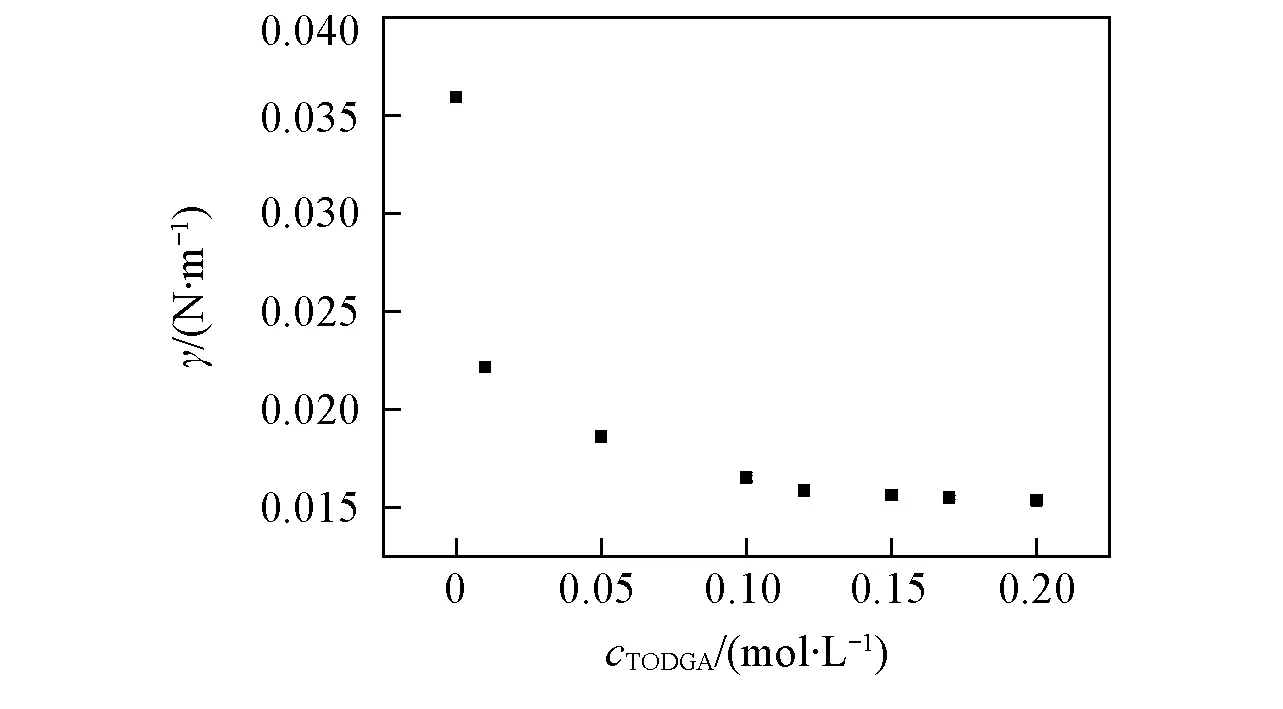
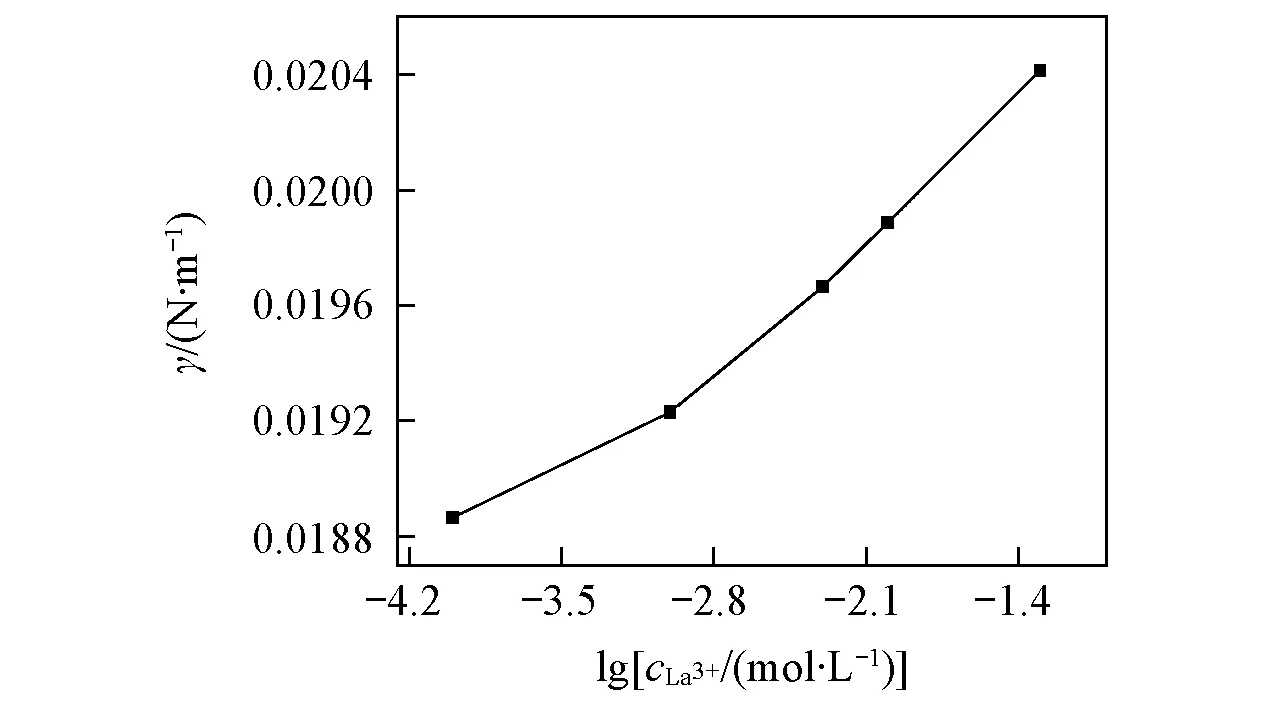
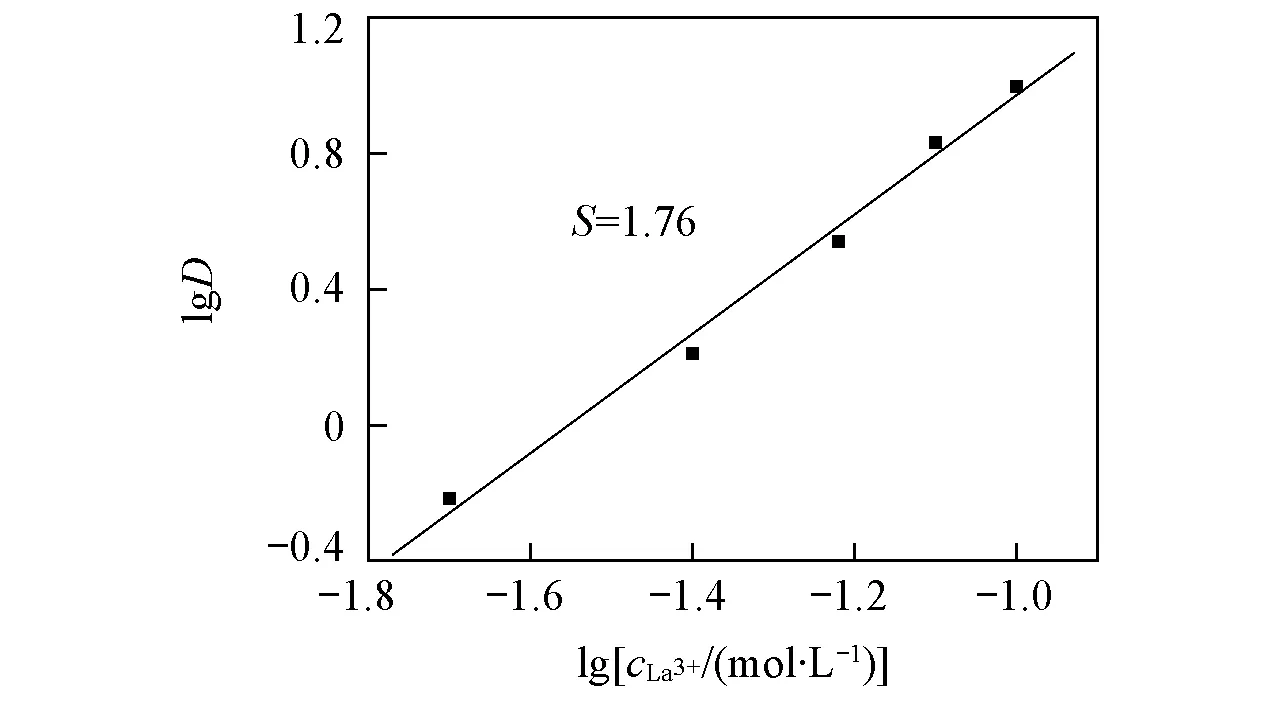
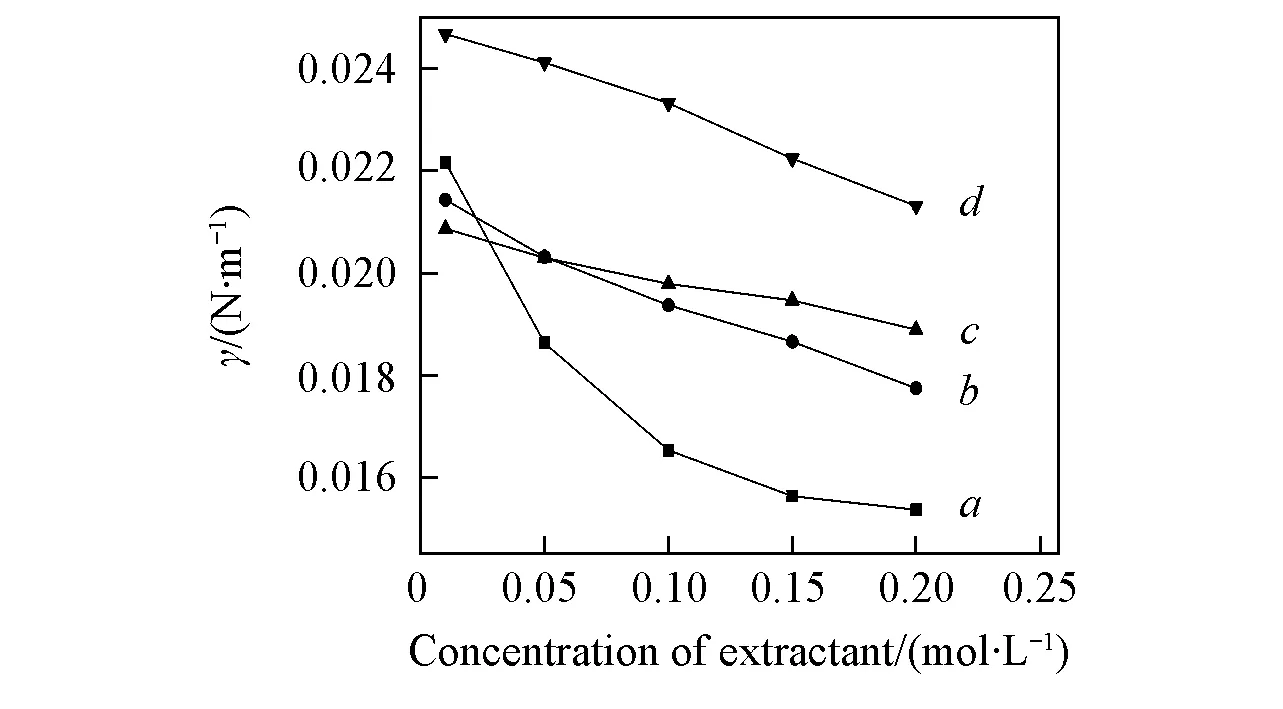
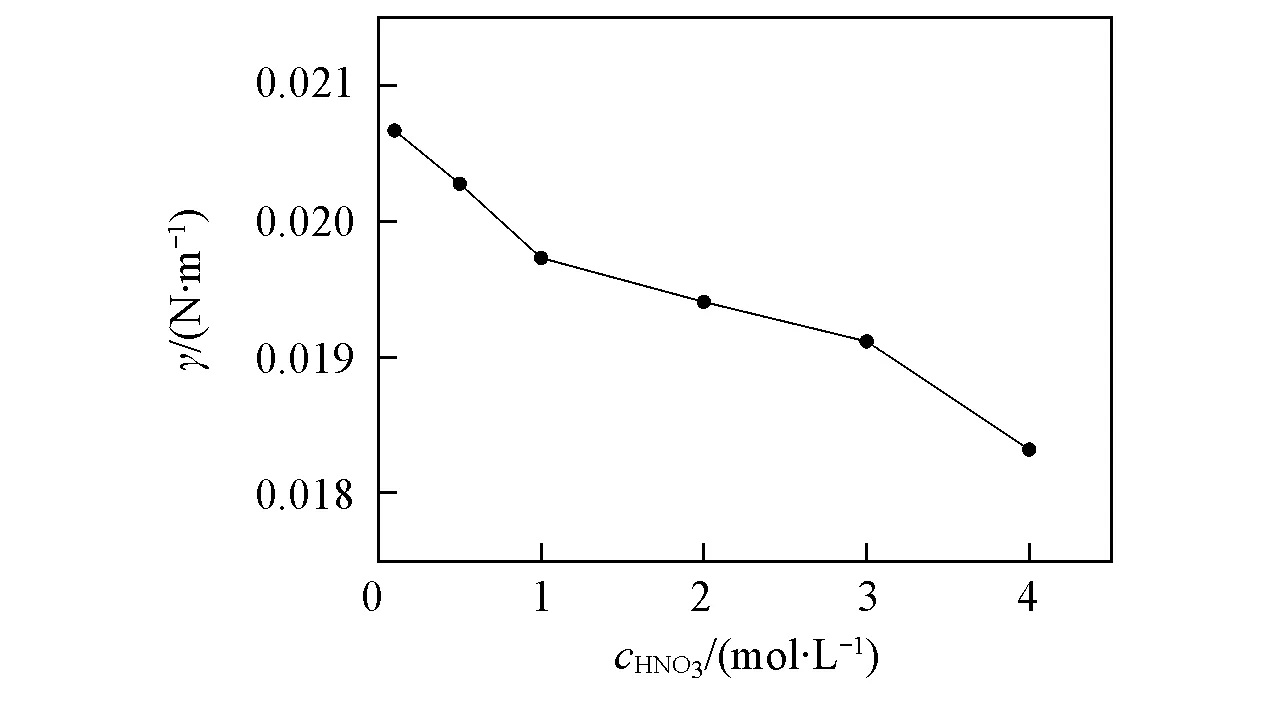
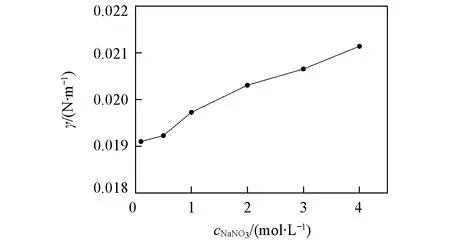
当0.3 (2) 当r/V1/3≤0.3时: (3) 2.1不同TODGA浓度下液滴形成时间对界面张力的影响 考察了以正辛烷作稀释剂时, 不同TODGA浓度体系的界面张力随液滴形成时间的变化情况. 从图2可以看出, 对于不同TODGA浓度(包括不添加TODGA)的体系, 界面张力均随着时间的延长逐渐降低, 约在120 s时基本达到界面吸附平衡, 可以认为萃取过程在此时间段内基本完成; 液滴形成时间相同时, TODGA浓度越大, 体系的界面张力值越小, 即不同浓度下达到界面吸附平衡的浓度不同, 表明不同TODGA浓度体系界面物种成分不同[19]. Fig.2 Effect of droplet formation time on the interfacial tension cLa3+=1×10-3 mol/L; cHNO3=1 mol/L; cNaNO3=1 mol/L; T=298 K. c(TODGA)/(mol·L-1):a. 0; b. 0.01; c. 0.05; d. 0.10; e. 0.15; f. 0.20. Fig.3 Effect of TODGA concentration on the interfacial tensioncLa3+=1×10-3 mol/L; cHNO3=1 mol/L; cNaNO3=1 mol/L; T=298 K; t=150 s. 图3示出了界面张力随萃取剂浓度的变化曲线, 在液滴形成时间相同时, 界面张力随萃取剂浓度的增大而逐渐降低, 在0.15 mol/L时, 界面张力趋于平衡, 界面区域萃取剂达到此酸度下的临界胶束浓度[20]. 液滴生长过程是一个水相与有机相接触, 发生萃取, 逐渐趋于平衡的过程. 在这一过程中萃取剂分子通过扩散、 吸附-解吸等行为最终在两相界面区域达到平衡, 平衡时间的长短主要由萃取剂分子在有机相中的扩散时间和在界面区域达到吸附-解吸平衡时间2个过程决定. 鉴于平衡时间约为120 s, 所以在考察其它因素的影响时将液滴形成时间均控制在 120 s以上, 以保证界面区域处于稳定状态. 2.2La3+浓度的影响 如图4所示, 以正辛烷作为稀释剂, 界面张力随着La3+浓度的增大而逐渐升高. TODGA萃取La3+的过程包括TODGA在界面区域的吸附平衡、 La3+的界面吸附平衡、 TODGA与La3+的界面区域化学反应以及萃合物在界面区域和有机相间的扩散平衡等步骤. 在有机相中萃合物及萃取剂分子与有机溶剂分子间作用力以范德华引力为主, 二者差别不大; 界面区域的作用力以相关分子与水分子的氢键缔合作用力为主, 氢键缔合作用力的大小与作用分子体积密切相关. 界面区域萃取反应生成的配合物分子体积远远大于萃取剂分子[21], 萃合物分子和萃取剂分子在界面区域及有机相间移动必须克服相应的氢键缔合作用力或者范德华引力以形成空腔来容纳分子, 形成空腔所需的空腔作用能的大小与分子大小成正比[22]. 假定反应过程中萃取剂分子由有机相主体移动到界面区域包含萃取剂分子在有机相中扩散、 界面上原有氢键的断裂以及与水分子重新生成氢键3个步骤, 前2个步骤需要吸收能量, 进行较慢; 萃合物分子由界面区域扩散到有机相主体过程中所克服的空腔作用能由氢键缔合作用力与范德华引力同时作用转变为有机相分子间范德华引力, 该步骤为能量释放过程, 进行较快. 因此, 形成萃合物并扩散至有机相主体中的速度大于萃取剂分子扩散到界面区域的速度, 最终导致界面张力随着金属离子浓度的增大而升高. Fig.4 Effect of La3+ concentration on the interfacial tensioncTODGA=0.1 mol/L; cHNO3=1 mol/L; cNaNO3=1 mol/L; T=298 K, t=150 s. Fig.5 Effect of La3+ concentration on the distribution ratio 在相同水相条件下, 测定了萃取剂浓度对分配比的影响(图5), 根据斜率法得到萃合物的组成为La(NO3)3·2TODGA. 位于界面区域的萃取剂与金属离子形成萃合物, 界面区域游离萃取剂分子减少, 导致体系的界面张力增大. 2.3稀释剂的影响 Fig.6 Effect of extractant concentration on the interfacial tension with different types of diluentscLa3+=1×10-3 mol/L; cHNO3=1 mol/L; cNaNO3=1 mol/L; T=298 K; t=150 s. a. TODGA/octane; b. TODGA/cyclohexane; c. TODGA/benzene; d. TODGA/toluene. 考察了在正辛烷、 环己烷、 苯和甲苯4种稀释剂体系中, 界面张力随TODGA浓度的变化情况. 由图6可知, 在TODGA浓度>0.05 mol/L时, 不同稀释剂体系中TODGA的界面活性顺序为正辛烷>环己烷>苯>甲苯, TODGA在2种脂肪烃稀释剂中的界面活性更强. 稀释剂种类不同导致的这些差异可能是由萃取剂、 稀释剂和水分子之间的相互作用引起的, 如TODGA的羰基极性较强, 与苯环上π键电子产生较强的相互作用, 使得萃取剂活度与脂肪烃体系相比有明显下降, 进而减小了萃取剂分子在界面上的吸附量, 降低其界面活性[23]. 2.4温度的影响 图7示出了正辛烷和苯作为稀释剂时, 界面张力随温度升高的变化情况. 温度对两相界面性质的影响比较复杂[7,15,24], 尚未见温度对纯稀释剂体系界面张力影响的报道. 本文发现纯稀释剂条件下界面张力均随着温度的升高而降低, 这可能是由于温度升高导致界面分子动能增加, 热运动加剧, 分子间引力减弱, 从而使界面张力降低. 这与水的表面张力随着温度升高而降低的情况相似. 溶有萃取剂时, 不同稀释剂体系中界面张力随温度升高的变化趋势明显不同(见图7). 首先, 萃取剂的存在会使体系的界面张力明显降低; 其次, 萃取剂/脂肪烃正辛烷体系的界面张力随着温度的升高缓慢上升; 而萃取剂/芳香烃苯体系的界面张力随着温度的升高逐渐下降. 稀释剂种类不同时, 界面张力随温度的变化趋势明显不同, 反映了界面层结构受温度影响的不同. 通常情况下, 加入萃取剂后, 随着温度升高TODGA分子在界面上与水分子的结合力降低, 导致其聚集浓度下降; 同时, 温度的升高对TODGA分子在界面上的缔合有影响, 导致其缔合状态不稳定, 降低其聚集浓度. 这两者均导致界面张力随着温度的升高而增大, 并且大于温度升高热运动对界面分子间作用力的影响; 对于芳香烃稀释剂体系来说还存在另一个重要影响因素, 即苯环上π键的存在. 随着温度的升高, 苯环上π键与界面萃取剂分子上极性基团间的相互作用被破坏, 使TODGA活度增大, 进而增大了TODGA在界面上的聚集浓度, 使得界面张力降低[7]. 相比较而言, 芳香烃作稀释剂时温度升高对苯环上π键与萃取剂分子间相互作用的影响明显大于其对前两者的作用. Fig.7 Effect of temperature on the interfacial tension cLa3+=1×10-3 mol/L; cHNO3=1 mol/L; cNaNO3=1 mol/L; t=150 s. (A) a. Octane; b. 0.01 mol/L TODGA/octane. (B) a. Benzene; b. 0.1 mol/L TODGA/benzene. 2.5HNO3浓度的影响 如图8所示, 以正辛烷作为稀释剂时, TODGA/HNO3萃取La3+的界面张力随着硝酸浓度的升高逐渐降低. 根据文献[25]报道, 在硝酸体系中, 3-氧戊二酰胺类萃取剂能够萃取硝酸, 萃取过程中随着硝酸浓度升高, 萃取分配比明显增大[26,27]. 因此, 硝酸浓度较高时TODGA与硝酸发生萃取缔合作用, 使中性萃取剂TODGA质子化, 其界面活性明显增强, 导致界面张力迅速降低, 这与图3结果一致. Fig.8 Effect of HNO3 concentration on the interfacial tension with 0.1 mol/L TODGA/octanecLa3+=1×10-3 mol/L; cNaNO3=1 mol/L; T=298 K; t=150 s. Fig.9 Effect of NaNO3 concentration on the interfacial tension with 0.1 mol/L TODGA/octanecLa3+=1×10-3 mol/L; cHNO3=1 mol/L; T=298 K; t=150 s. 2.6离子强度的影响 以电解质NaNO3作为离子强度变量, 考察了NaNO3浓度变化对界面张力的影响. 结果(图9)表明, 界面张力随着NaNO3浓度的升高而增大, 这是由于随着NaNO3浓度的升高, TODGA在界面上聚集的稳定性降低, 降低了其溶解性, 增大了界面张力; 同时会增强对金属离子的萃取能力[28], 减少界面上游离的萃取剂分子数, 使界面张力增大. 采用滴体积法考察了TODGA/HNO3体系萃取La3+的相关界面性质, 在实验条件下加入TODGA后, 随着液滴形成时间的延长, 体系界面张力逐渐降低, 当时间延长至约为120 s时, 界面张力基本趋于不变, 界面吸附达到平衡, 可以认为此时已达萃取平衡. 界面张力随着La3+浓度的增大而逐渐升高, 可以认为是生成的萃合物进入到界面区域的速度大于萃取剂分子扩散到界面区域的速度, 降低了界面区域萃取剂浓度所致; 还说明萃取剂分子向界面的扩散可能为该反应的控速步骤. 稀释剂种类不同, 两相界面物理状况不同, 萃取剂的界面活性按正辛烷>环己烷>苯>甲苯的次序降低. 苯环π键与萃取剂分子的相互作用使芳烃体系中萃取剂界面活性降低. 对于纯稀释剂/水体系, 界面张力随着温度的升高而减小, 随着萃取剂的加入界面张力整体下降. 在脂肪烃正辛烷中, 界面张力随着温度的升高而缓慢增大, 而在芳香烃苯中, 界面张力随着温度的升高而减小. 由于TODGA对HNO3萃取后的质子化作用, 导致界面张力随着硝酸浓度的升高而减小; NaNO3浓度的增大降低了界面上游离萃取剂分子的浓度, 使界面张力呈增大趋势. [1]Chen L., Li Y., Wang Z. W., Peng Z. Y., Yang Z. M., Yuan L. H., Feng W.,Chem.J.ChineseUniversities, 2015, 36(8), 1485—1490(陈龙, 李艳, 王真文, 彭智勇, 杨泽明, 袁立华, 冯文. 高等学校化学学报, 2015, 36(8), 1485—1490) [2]Dutta S., Mohapatra P. K., Manchanda V. K.,Appl.Radiat.Isot., 2011, 69, 158—162 [3]Huang S., Ding S. D., Jin Y. D., Ma L. J., Xia C. Q., Li S. J., Wu Y. X., Huang H.,Chem.J.ChineseUniversities, 2014, 35(7), 1369—1378(黄松, 丁松东, 金永东, 马利建, 夏传琴, 李首建, 吴宇轩, 黄璜. 高等学校化学学报, 2014, 35(7), 1369—1378) [4]Zhu W. B., Ye G. A., Li F. F., Li H. R.,J.Radioanal.Nucl.Chem., 2013, 298, 1749—1755 [5]Zhu W. B., Ye G. A., Li F. F., Li H. R.,JournalofNuclearandRadiochemistry, 2013, 35(4), 229—235(朱文彬, 叶国安, 李峰峰, 李会蓉. 核化学与放射化学, 2013, 35(4), 229—235) [6]Sun G. X., Yang Y. H., Sun S. X., Shen J. R.,Chem.J.ChineseUniversities, 1995, 16(11), 1677—1679(孙国新, 杨永会, 孙思修, 沈静兰. 高等学校化学学报, 1995, 16(11), 1677—1679) [7]Wu D. B., Xiong Y., Li D. Q.,J.ColloidInterfaceSci., 2005, 290, 235—240 [8]Zhang K., Du C. L., Li R. X., Wu D. C.,JournalofSichuanUniversity, 2004, 36(2), 58—61(张科, 杜宗良, 李瑞霞, 吴大诚. 四川大学学报, 2004, 36(2), 58—61) [9]Fang Y. W., Wang J. H.,Chem.J.ChineseUniversities, 1996, 17(2), 298—299(方奕文, 王镜和. 高等学校化学学报, 1996, 17(2), 298—299) [10]Joseph D. B., Michael J. N., Raymond R. D., Derek Y. C. C., Rico F. T.,J.ColloidInterfaceSci., 2015, 454, 226—237 [11]M. Soledade C S. Santos., Ana Paula Paiva.,J.ColloidInterfaceSci., 2014, 413, 78—85 [12]Jiang R., Zhao J. X., You Y.,ActaChim.Sinica, 2005, 63(2), 126—130(姜蓉, 赵剑曦, 游毅.化学学报, 2005, 63(2), 126—130) [13]Guo L. S., Cao P. Y.,JournalofDalianUniversity, 1988, 3(6), 41—42(郭立山, 曹佩玉. 大连大学学报, 1988, 3(6), 41—42) [14]Xiong H. J., Li W., Zhang Y. Y.,JournalofWuhanPolytechnicUniversity, 2007, 26(3), 42—44(熊会军, 李炜, 张誉赢. 武汉工业学院学报, 2007, 26(3), 42—44) [15]Zhao J. M., Sun X. B., Li W.,J.ColloidInterfaceSci., 2006, 294, 429—435 [16]Sun G. X., Liu M., Cui Y., Yuan M. L., Yin S. H.,SolventExtr.IonExch., 2010, 28(4), 482—494 [17]Lando J. L., Oakley H. T.,J.ColloidInterfceSci., 1967, 25(4), 526—530 [18]Wilkinson M. C., Kidwell R. L.,J.ColloidInterfceSci., 1971, 35(1), 114—119 [19]Manori J., Thomas L. B.,J.Phys.Chem.B., 2009, 113(34), 11662—11671 [20]Nave S., Molodo G., Madic C., Testard F.,SolventExtr.IonExch., 2004, 22(4), 527—551 [21]Zhang Y. J., Cui. Y., Hu Y. F., Sun G. X.,Chin.J.Inorg.Chem., 2010, 26(4), 663—667(张艳菊, 崔玉, 胡玉芬, 孙国新. 无机化学学报, 2010, 26(4), 663—667) [22]Yang B. H.,UraniumoreProcessingTechnology, Beijing Research Institute of Chemical Engineering and Metallurgy, Beijing, 2002, 352(杨伯和. 铀矿加工工艺学, 北京:核工业北京化工冶金研究院, 2002, 352) [23]Liu J. J., Wang W. W., Li D. Q.,ColloidsSurf.A:Physicochem.Eng., 2007, 311, 124—130 [24]Sarikhani K., Jeddi K., Thompson R. B., Park C. B., Chen P.,ThermochimicaActa, 2015, 609, 1—6 [25]Zhang Y. J., Cui Y., Liu M., Yin S. H., Sun G. X.,Chin.J.Inorg.Chem., 2008, 24(12) , 2047—2050(张艳菊, 崔玉, 刘敏, 尹少宏, 孙国新. 无机化学学报, 2008, 24(12) , 2047—2050) [26]Gujar R. B., Ansari S. A., Murali M. S., Mohapatra P. K., Manchanda V. K.,J.Radioanal.Nucl.Chem., 2010, 284, 377—385 [27]Zhu W. B., Ye G. A., Li F. F., Jiang D. X., Li H. R.,J.Nucl.Radiochem., 2011, 33(6), 328—334(朱文彬, 叶国安, 李峰峰, 蒋德祥, 李会蓉. 核化学与放射化学, 2011, 33(6), 328—334) [28]Liu X. L., Sun G. X., Cai X. C., Yang X. F., Li Y. X., Sun Z. M., Cui Y.,J.Radioanal.Nucl.Chem., 2015, 306, 549—553 (Ed.:V, Z, K) † Supported by the National Natrual Science Foundation of China(Nos.21077044, 21171069). Extraction Interfacial Properties of La3+from HNO3System with TODGA† WEI Bing, CUI Yu, MA Shoutao, YANG Quanning, SUN Guoxin* (School of Chemistry and Chemical Engineering, University of Jinan, Jinan 250022, China) The interfacial properties of La3+/HNO3/N,N,N′,N′-tetraoctyl diglycolamide(TODGA)/dilute system were studied by the drop volume method, including the effect of TODGA concentration, equilibrium time, types of diluents, La3+concentration system temperature, ionic strength and acidity on the interfacial properties. It was found that:(1) the interfacial saturated adsorption time is about 120 s in this system; (2) the interfacial tension are different with the different TODGA concentrations, so the interfacial saturated adsorption species may exist differences; (3) the decrease of the interfacial tension is bigger in small polarity dilute system, such as octane>cyclohexane>benzene>toluene; (4) because of the protonation effect for TODGA, the interfacial activity enhanced with the increasing of HNO3concentration, and reduced the interfacial tension; the presence of NaNO3reduced the concentration of free TODGA molecules at the interface, and let the interface tension increased. N,N,N′,N′-tetraoctyl diglycolamide(TODGA); La3+; Drop volume method; Interfacial property; Extraction 10.7503/cjcu20160037 2016-01-15. 网络出版日期:2016-08-17. 国家自然科学基金(批准号:21077044, 21171069)和山东省自然科学基金(批准号:ZR2015BM030)资助. O647.11 A 联系人简介:孙国新, 男, 博士, 教授, 博士生导师, 主要从事萃取剂的合成及无机新材料的制备及纯化方面的研究.E-mail:chm_sungx@ujn.edu.cn2 结果与讨论

3 结 论
