Schiff碱功能化壳聚糖负载CuBr高效催化合成1,2,3-三唑化合物
2016-11-02熊兴泉江云兵肖上运宋思达
熊兴泉, 江云兵, 肖上运, 石 霖, 宋思达
(福建省高校功能材料重点实验室, 华侨大学材料科学与工程学院, 厦门361021)
Schiff碱功能化壳聚糖负载CuBr高效催化合成1,2,3-三唑化合物
熊兴泉, 江云兵, 肖上运, 石霖, 宋思达
(福建省高校功能材料重点实验室, 华侨大学材料科学与工程学院, 厦门361021)
以壳聚糖为原料, 在乙醇溶液中通过将其与2-吡啶甲醛反应制得Schiff碱功能化的壳聚糖(PYCS), 然后将PYCS与CuBr进行络合反应制得负载型催化剂(PYCS-CuBr). 采用红外光谱、 热重分析和X射线衍射分析等方法对PYCS-CuBr催化剂进行表征. 热重分析结果表明, 该催化剂在200 ℃以内具有较好的热稳定性, 能够满足其使用温度. 结合微波辐射技术以及“一锅法”合成策略, 以PYCS-CuBr为催化剂催化有机炔、 卤代烷以及NaN3之间的环加成反应. 结果表明, PYCS-CuBr催化剂具有良好的催化性能, 在微波辐射功率为480 W, 温度为70 ℃条件下, 15 min可快速制得1,2,3-三唑类化合物, 该催化剂易回收, 且可重复使用至少4次, 活性未见明显降低. 放大反应结果表明, 1,2,3-三唑类化合物能够以较高收率并以数十克规模制备.
壳聚糖; Schiff 碱; 异相催化剂; 1,2,3-三唑
具有五元氮杂环结构的有机小分子是一类具有潜在的抗病毒、 抗菌及抗细胞增殖等药物活性的化合物, 在生物、 制药等方面具有重要作用[1~3], 其中, 最典型的为1,2,3-三唑类化合物(图1)[4].

Fig.1 Pharmaceutical molecules based on five-membered heterocycle
1,2,3-三唑类化合物因具有良好的药物及生物活性而备受关注. 目前, 1,2,3-三唑类化合物有多种合成方法, 其中最绿色、 最可靠且最高效的方法为微波或超声促进Cu(Ⅰ)催化的多组分一锅法叠氮-炔之间环加成反应(CuAAC反应)[5~8]. 近年来, CuAAC反应的研究主要集中在均相反应体系方面, 如CuBr/PMDETA和CuSO4/NaAsc等[9]. 但是, 对于这些均相催化体系而言, 催化剂不能重复使用, 且在反应结束后催化剂与产品不易分离, 这样会导致金属铜催化剂污染产品. 由于铜可在生物体内积累从而产生细胞毒性, 在很大程度上限制了由均相催化体系制备的1,2,3-三唑类化合物在医药生物领域的应用. 后续的改进研究表明, 采用负载型异相铜催化剂可以有效解决这一问题[10]. 一方面, 异相铜催化剂具有操作简便、 反应条件温和、 催化剂易回收和能重复使用的优点; 另一方面, 异相铜催化体系可以大大降低产品中铜的污染问题. 目前, 已有利用固体材料负载Cu(Ⅰ)催化CuAAC反应的报道, 如磁性纳米粒子[8,11~13]、 SiO2[14~18]以及聚合物等[19~23]. 但这些催化剂载体或制备步骤较繁琐、 成本较高, 或很难进行生物降解而导致环境污染.
随着绿色化学理念的不断深入, 利用环境友好型的固载材料或废弃物负载金属催化有机反应已经受到重视[24,25]. 其中, 天然高分子价廉易得、 易于功能化且易生物降解, 因此由其负载的金属催化有机反应受到了广泛的关注[26]. 壳聚糖具有多胺基与羟基结构特点, 不仅使其具有亲水性、 易降解等优点, 重要的是其容易被化学修饰以接枝更多的功能性基团. 因此, 壳聚糖已成为一个异相反应的绿色载体材料, 被广泛应用于多种反应中[27]. 基于壳聚糖以及异相Cu(Ⅰ)催化剂的优点, 本文以2-吡啶甲醛对壳聚糖进行Schiff碱功能化, 进而制备出负载型异相催化剂PYCS-CuBr. 在水相反应条件下, 通过微波促进的“一锅法”策略, 利用该催化剂高效、 绿色地催化合成出一系列1,2,3-三唑类化合物.
1 实验部分
1.1试剂与仪器
壳聚糖(CS, 脱乙酰度>85%, 分子量为1.06×105)购自浙江金壳生物化学有限公司; 溴化亚铜(分析纯)购自上海晶纯试剂有限公司, 使用前经醋酸溶解洗去变质溴化亚铜, 再用乙醚洗涤, 真空干燥; 2-吡啶甲醛和叠氮化钠(NaN3)等试剂均为分析纯, 未经处理直接使用; 溴化苄、 氯化苄等卤代物(分析纯)购自国药集团化学试剂有限公司; 苯乙炔为市售工业级; 其它炔衍生物为实验室自制.
MAS-Ⅲ型微波化学反应器(上海新仪微波化学科技有限公司); Nicolet Nexus 470型红外光谱仪(KBr压片, 测试范围为4000~400 cm-1); Bruker D8 Advance X射线衍射仪(德国Bruker公司); Shimadzu DTG-60H型自动热分析仪 (氮气保护, 升温速率10 ℃/min, 温度范围为室温~1100 ℃, 日本岛津公司); Varian AA275型原子吸收光谱仪(铜标准溶液为标样, 美国Varian公司); Bruker DMX 400 MHz 核磁共振波谱仪(CDCl3为溶剂, TMS为内标, 瑞士Bruker公司).
1.2实验过程
1.2.1负载型催化剂的制备称取10.0 g壳聚糖和1.2 g 2-吡啶甲醛置于圆底烧瓶中, 加入100 mL乙醇, 于80 ℃加热搅拌24 h. 冷却至室温、 过滤, 用乙醇洗涤直至滤液无色透明(除尽2-吡啶甲醛), 得淡绿色粉末状2-吡啶甲醛功能化的Schiff碱功能化壳聚糖(PYCS), 真空干燥备用, 反应过程如Scheme 1所示.
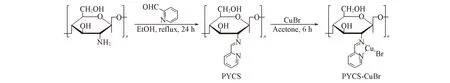
Scheme 1 Preparation of PYCS-CuBr catalyst
称取3.0 g PYCS置于圆底烧瓶中, 加入20 mL丙酮, 在氮气保护下, 加入适量的CuBr, 室温下搅拌反应6 h, 过滤、 洗涤, 得到负载型催化剂PYCS-CuBr, 真空干燥备用.
Scheme 2Synthesis of 1,2,3-triazoles via one-pot strategy
相转移剂(0.05 g)以及催化剂PYCS-CuBr, 在70 ℃, 微波辐射功率为480 W的微波化学反应器中进行搅拌反应, 用TLC监测反应进程. 反应结束后, 冷却, 用乙酸乙酯萃取(10 mL×3), 重结晶得1,2,3-三唑化合物. 反应体系中催化剂经过滤, 洗涤, 再回收使用. 合成路线如Scheme 2所示, 所合成的三唑化合物经FTIR和
1
H NMR等手段表征.
2 结果与讨论
2.1催化剂的制备与红外分析
先以壳聚糖和2-吡啶甲醛为原料, 合成了Schiff碱功能化PYCS; 再将其与CuBr进行络合, 制备了负载型催化剂PYCS-CuBr, 铜负载量由原子吸收光谱(AAS)测定为0.365 mmol/g.

Fig.2 FTIR spectra of CS(a), PYCS(b), PYCS-CuBr(c) and 2-pyridinecarboxaldehyde(d)

2.2催化剂的热重分析


Fig.3 TGA curves of CS(a), PYCS(b) and PYCS-CuBr(c)

Fig.4 XRD patterns of CS(a), PYCS(b) and PYCS-CuBr(c)
2.3X射线粉末衍射分析
CS, PYCS及PYCS-CuBr的XRD谱图如图4所示. 可见, 壳聚糖是一种结晶性的高分子多糖, 在2θ=12.4°和20.8°附近有较强的衍射峰. 经过2-吡啶甲醛改性后的PYCS的结晶性降低, 主要强峰变弱, 2θ=12.4°附近的衍射峰消失; 同时在2θ=4.8°, 7.2°, 14.9°和17.4°附近出现4个新的衍射峰. 这是由于2-吡啶甲醛的引入破坏壳聚糖大分子链之间或者大分子链内的氢键作用, 同时形成新的氢键作用从而导致晶型发生变化. 在与铜结合后, 2θ=7.2°和20.8°附近的衍射峰明显减弱, 而2θ=4.8°, 14.9°和17.4°附近3个衍射峰消失, 这主要是因为与铜络合后的功能化PYCS-CuBr分子内的氢键进一步发生变化, 使其结晶性能减弱所致.
2.4EDX分析
采用EDX对PYCS-CuBr负载的铜元素进行进一步分析. 图5(A)为催化剂PYCS-CuBr表面的铜元素分布, 图5(B)为催化剂连续使用4次后的铜元素分布图. 可见, 催化剂使用前铜元素均匀分布在载体PYCS基体上; 循环使用4次后, 分布在催化剂中的铜元素则表现出不均匀分布的状态, 且铜元素的含量呈降低趋势.

Fig.5 EDX images of fresh PYCS-CuBr(A) and reused PYCS-CuBr(B) catalysts
2.5催化剂的性能
2.5.1反应条件优化异相催化剂PYCS-CuBr由于具有多羟基等亲水性基团, 因此在水相中的分散性较好, 易溶胀, 使该催化剂能够有效催化反应. 从绿色化学的角度来说, 水是一种环境友好型的溶剂, 因此本实验选取水作为以下反应的溶剂. 由于反应是在水相中原位生成叠氮化合物, 然后进行“一锅法”点击反应, 反应体系中会出现油/水分离的现象, 对反应具有一定的影响, 因此本实验采用溴化苄为与苯乙炔作为模型反应, 考察不同相转移剂对反应的影响. 由表1可见, 四丁基氯化铵(TBAC)对CuAAC 反应的影响最大(表1, Entry 3), 与其它相转移剂相比, 在相同的反应条件下, 产率最高可高出40%.

Table 1 Effect of the phase transfer catalyst on the CuAAC reactiona
a. Reaction conditions: phenyl acetylene(1.60 mmol), benzyl bromide(1.46 mmol), NaN3(1.60 mmol), PYCS-CuBr(0.03 g, 1.1% Cu) and deionized water(5.0 mL) at 70 ℃, 480 W;b. PTC: phase transfer catalyst;c. isolated yields.
2.5.2最佳催化剂的筛选为了考察铜元素在CuAAC反应的中的作用, 以溴化苄与苯乙炔之间的反应作为模型反应, 研究了几种不同的催化剂对该反应的影响, 结果见表2. 可见, 选择不含铜金属的催化剂时, 无论是在传统加热条件下还是在微波辐射下收率均较低(表2, Entries 1~3); 相比较而言, 采用含有金属铜的催化剂所得产物收率在传统加热和微波辐射条件下均较高(表2, Entries 4~6). 催化剂PYCS-CuBr能够在微波辐射的条件下高效、 选择性地催化CuAAC反应(表2, Entry 7); 并且与其它的含铜催化剂相比, 在传统的加热条件下亦表现出高催化活性.

Table 2 Effect of catalyst on the CuAAC reaction in water
a. The reaction was carried out under 480 W microwave irradiation in water;b. the reaction was carried out using the traditional heating method;c. Cu(Ⅱ): CuSO4·5H2O and sodium ascorbate.
2.5.3PYCS-CuBr催化合成1,2,3-三唑类化合物在上述优化条件下, 通过水相微波“一锅法”的策略, 采用不同活性的卤代物与端基炔进行CuAAC反应合成1,2,3-三唑类化合物, 以此验证该催化剂的高效性及普遍适用性, 结果如表3所示. 可见, 该催化剂在水相中可高效率、 高选择性地催化不同的卤代物与炔之间的CuAAC反应, 得到1,2,3-三唑类化合物; 但是苄基卤代物和烷烃卤代物的反应活性不同, 苄基卤代物的活性总体要比烷烃卤代物的活性高(表3, Entries 1~13). 另外, 对于芳香端基炔与烷烃端基炔也存在一定的活性差异(表3, Entries 3, 6, 9, 12和14~16), 芳香端基炔在该催化体系中表现出更好的活性. 芳香族端基炔上带有的不同功能性基团在该反应体系中并未表现出明显影响(表3, Entries 3, 6, 9和12), 说明该催化剂对于带有不同基团的端基炔仍具有高效的催化活性. 在此基础上, 又探究了二卤化合物与端基炔化合物的反应以及二端基炔化合物与卤代物的反应, 例如1,6-二溴己烷与苯乙炔的反应, 利用TLC跟踪反应进程, 结果表明二卤代物与炔的反应不能进行完全, 即使延长时间一取代与二取代生成物仍然存在. 在反应过程中催化剂被包覆成黏稠状的固体. 推测其原因是在该体系中随着反应的进行催化剂逐渐被包覆, 使得反应底物与催化剂的活性中心接触机会减少, 反应不能进行完全. 因此, 该催化体系主要适用于单卤代物或单端基炔的反应.

Table 3 One-pot synthesis of 1,2,3-trazoles under microwave in aqueous phase conditions
* Isolated yields.
2.5.4催化剂的循环使用性能能否重复使用是异相催化剂一个重要参数指标, 因此考察了该催化剂的重复使用性能. 反应结束后, 用乙酸乙酯萃取(10 mL×3), 重结晶得固体产物. 反应体系中催化剂再经过滤、 洗涤, 回收使用. 然后在相同条件下进行反应, 后处理方法类似. 催化剂的重复使用性能如图6所示, 可见催化剂至少可以重复使用4次, 产率仍能达到87%; 与催化剂首次使用相比, 催化活性稍有减弱. 然而, 当该催化剂循环使用到第5次时, 其催化活性明显降低, 产物分离产率低于70%, 其原因可能是催化剂中负载的铜的流失造成活性降低. 对循环使用5次的催化剂分别进行AAS测试, 并取3次测试结果的平均值. 结果表明, 使用前的PYCS-CuBr铜负载量为0.365 mmol/g, 每次使用后回收所得催化剂中铜含量分别为0.253, 0.162, 0.111, 0.089和0.021 mmol/g, 铜流失率依次为31%, 36%, 31%, 19%和76%. 可见, 从第4次到第5次循环使用时,负载的铜离子明显降低, 导致催化体系活性明显下降. 因此, 综合考虑合成成本及节省原料, 建议该催化剂循环使用4次即可.

Fig.6 Reusability of catalyst PYCS-CuBr

2.5.5模型反应的放大实验中尝试以苄氯与苯乙炔之间的反应为模型反应, 对该反应进行了放大实验, 结果如表4所示. 可见, 当放大量从10倍增加到60倍时(表4, Entries 2~5), 该催化剂仍能较好地催化反应进行, 并能够高收率的得到数十克的三唑化合物. 再以10倍的放大量对该反应的放大循环使用进行探究, 发现该催化剂在该放大量下仍能循环使用至少4次, 且活性无明显下降.

Table 4 Scale-up synthesis on the CuAAC reaction of the catalysta

3 结 论
以易得、 易功能化的天然高分子壳聚糖为原料, 通过简单的两步法制备了催化剂 PYCS-CuBr; 通过绿色的合成途径, 采用水相微波一锅法策略, 利用该催化剂催化不同卤代物与端基炔之间的CuAAC反应, 高收率地制得一系列1,2,3-三唑类化合物. 该制备方法具有反应条件温和、 反应时间短、 产率优良且后处理简单方便等优点. 所制备的催化剂可重复使用至少4次, 催化活性仍没有明显的减弱. 放大反应研究结果表明, 1,2,3-三唑类化合物能够以高的收率并以数十克规模制备.
[ 1 ]Agalave S. G., Maujan S. R., Pore V. S.,Chem.AsianJ., 2011, 6(10), 2696—2718
[ 2 ]Mao M. Z., Li Y. X., Zhou Y. Y., Yang X. P., Zhang X. L., Zhang X., Li Z. M.,Chem.Res.ChineseUniversities, 2013, 29(5), 900—905
[ 3 ]Tang X. B., Li Z. H., Li Y. H., Liu W., Yu P., Li L. X., Guo Y., Yang C.,Chem.Res.ChineseUniversities, 2015, 31(1), 71—77
[ 4 ]Siddiqui N., AhsanW., Alam M. S., Ali R., Jain S., Azad B., Akhtar J.,Int.J.Pharm.Sci.Rev.Res., 2011, 8, 161—169
[ 5 ]Appukkuttan P., Dehaen W., Fokin V. V., van der Eycken E.,Org.Lett., 2004, 6(23), 4223—4225

[ 7 ]Driowya M., Puissant A., Robert G., Auberger P., Benhida R., Bougrin K.,Ultrason.Sonochem., 2012, 19(6), 1132—1138
[ 8 ]Xiong X. Q., Cai L.,Catal.Sci.Technol., 2013, 3(5), 1301—1307
[ 9 ]Meldal M., Tornøe C. W.,Chem.Rev., 2008, 108(8), 2952—3015
[10]Dervaux B., Du Prez F. E.,Chem.Sci., 2012, 3(4), 959—966

[12]Hudson R., Li C. J., Moores A.,GreenChem., 2012, 14(3), 622—624
[13]Baig R. B. N., Varma R. S.,GreenChem., 2012, 14(3), 625—632
[14]Miao T., Wang L.,Synthesis, 2008, 2008(3), 363—368
[15]Sharghi H., Khalifeh R., Doroodmand M. M.,Adv.Synth.Catal., 2009, 351(1/2), 207—218
[16]Coelho A., Diz P., Caamano O., Sotelo E.,Adv.Synth.Catal., 2010, 352(7), 1179—1192
[17]Shamim T., Paul S.,Catal.Lett., 2010, 136(3/4), 260—265
[18]Wan L., Cai C.,Catal.Lett., 2012, 142(9), 1134—1140
[19]Lipshutz B. H., Taft B. R.,Angew.Chem.Int.Ed., 2006, 45(48), 8235—8238
[20]Lammens M., Skey J., Wallyn S., O’Reilly R., Du Prez F.,Chem.Commun., 2010, 46(46), 8719—8721
[21]Ozkal E., Özçubukçu S., Jimeno C., Pericas M. A.,Catal.Sci.Technol., 2012, 2(1), 195—200
[22]Roy S., Chatterjee T., Islam S. M.,GreenChem, 2013, 15(9), 2532—2539
[23]Xiong X. Q., Chen H. X., Tang Z. K., Jiang Y. B.,RSCAdv., 2014, 4, 9830—9837
[24]Xiong X. Q., Cai L., Jiang Y. B., Han Q.,ACSSustainableChem.Eng., 2014, 2(4), 765—771
[25]Xiong X. Q., Chen H. X., Zhu R. J.,Chin.J.Catal., 2014, 35(12), 2006—2013
[26]Zhou W. J., Zhou Y., Zhang X. Z., Zeng B.,Chem.J.ChineseUniversities, 2016, 37(4), 669—673(周文俊, 周宇, 张霞忠, 曾彬. 高等学校化学学报, 2016, 37(4), 669—673)
[27]Guibal E.,Prog.Polym.Sci., 2005, 30(1), 71—109
(Ed.: P, H, N, K)
Highly Efficient Synthesis of 1,2,3-Triazoles Catalyzed by Schiff Base Functionalized Chitosan-CuBr Catalyst†
XIONG Xingquan*, JIANG Yunbing , XIAO Shangyun, SHI Lin, SONG Sida
(CollegeofMaterialsScienceandEngineering,HuaqiaoUniversity,theKeyLaboratoryforFunctionalMaterialsofFujianHigherEducation,Xiamen361021,China)
Pyridine-2-carboxaldehyde-modified chitosan(PYCS) was prepared through a simple procedure using chitosan(CS) and pyridine-2-carboxaldehyde in ethanol solution. Subsequently, PYCS supported CuBr(PYCS-CuBr) was synthesized by the reaction of PYCS with CuBr in acetone at room temperature under N2atmosphere. The obtained catalyst was characterized by FTIR, TGA and XRD. TGA result showed that the catalyst had a good stability up to 200 ℃ and could meet the normal use. The catalytic performances were evaluated in one-pot multi-component copper(Ⅰ)-catalyzed azide-alkyne cycloaddition(CuAAC) reaction under microwave-assisted condition. PYCS-CuBr was found to exhibit obvious catalytic activity to rapidly produce 1,2,3-triazole compounds under the microwave irradiation(480 W) at 70 ℃. Furthermore, the catalyst could be easily recovered by simple filtration and recycled at least 4 cycles without obvious loss of catalytic activity. 1,2,3-triazoles can be exclusively generated on multi-gram scale.
Chitosan; Schiff base; Heterogeneous catalyst; 1,2,3-Triazole
10.7503/cjcu20160252
2016-04-18. 网络出版日期: 2016-08-31.
国家自然科学基金(批准号: 21004024)、 福建省自然科学基金(批准号: 2016J01063)、 福建省“高校新世纪优秀人才支持计划”(批准号: 2012FJ-NCET-ZR03)和“华侨大学中青年教师科研提升资助计划”(批准号: ZQN-YX103)资助.
O643.3; O631
A
联系人简介: 熊兴泉, 男, 博士, 副教授, 主要从事绿色有机合成方面的研究. E-mail: xxqluli@hqu.edu.cn
† Supported by the National Natural Science Foundation of China(No.21004024), the Natural Science Foundation of Fujian Province, China(No.2016J01063), the Program for New Century Excellent Talents in Fujian Province, China(No.2012FJ-NCET-ZR03) and the Promotion Program for Young and Middle-aged Teacher in Science and Technology Research of Huaqiao University, China(No.ZQN-YX103).
