以四肽自组装体为模板制备手性3-氨基苯酚甲醛树脂纳米纤维
2016-11-02曹严方邵长振李宝宗杨永刚
曹严方, 邵长振, 李宝宗, 李 艺, 杨永刚
(江苏省先进功能聚合物设计与应用重点实验室, 苏州大学材料与化学化工学部, 苏州 215123)
以四肽自组装体为模板制备手性3-氨基苯酚甲醛树脂纳米纤维
曹严方, 邵长振, 李宝宗, 李艺, 杨永刚
(江苏省先进功能聚合物设计与应用重点实验室, 苏州大学材料与化学化工学部, 苏州 215123)
采用经典的固相合成法制备了一对烷基取代丙氨酸四肽衍生物对映体, 研究了其在不同溶剂中的成胶行为, 并以其在甲醇中形成的超分子自组装体为模板, 利用溶胶-凝胶法制备了单手螺旋3-氨基苯酚甲醛树脂纳米纤维. 利用扫描电子显微镜和透射电子显微镜观察超分子自组装体及3-氨基苯酚甲醛树脂的螺旋形貌, 并利用圆二色谱研究其光学性质. 研究发现, 3-氨基苯酚甲醛树脂纳米纤维既具有纳米尺度的手性, 又具有分子尺度的手性. 手性从小分子形成的自组装体传递到高分子树脂中.
四肽; 超分子模板法; 酚醛树脂; 纳米纤维; 手性
手性和螺旋纳米材料在对映体分离、 不对称催化及光学领域备受关注[1~3]. 目前已经有多种方法制备和合成手性和螺旋纳米材料, 其中, 超分子模板法是一种发展迅速并取得显著进展的有效方法[4~6]. 超分子模板法主要采用表面活性剂、 胶体、 油脂和增稠剂等作为模板. Rambaud等[7]、 Toyodome等[8]和Yang等[9]以手性小分子胶体为模板剂, 倍半硅氧烷为前驱体, 制备了各种单手螺旋的二氧化硅[9,10]和有机无机杂化氧化硅纳米管[8,11]、 纳米带[12]及纳米纤维[7,10]等.
Fan等[13]、 Paik等[14]及Zou等[15]利用超分子模板法合成了具有螺旋形貌和独特光学性能的聚吡咯和聚苯胺手性高分子聚合物. 但这些高分子聚合物基本都是线型的且耐热性差, 限制了其进一步应用. Yang等[16]以一对苯丙氨酸的烷基衍生物作为模板剂, 以3-氨基苯酚和甲醛的低聚物作为前驱体, 制备了一种单手螺旋的3-氨基苯酚甲醛树脂纳米管. 该纳米管具有与模板剂对应的手性, 其中手性传递的过程值得深入研究.
四肽化合物能够利用分子间弱的相互作用(如氢键和范德华力), 自组装形成具有螺旋形貌的纳米结构[17]. 本文设计合成了一对烷基链取代的丙氨酸四肽衍生物对映体, 以其超分子自组装体为模板, 制备了具有单一手性的3-氨基苯酚甲醛树脂纳米纤维, 并利用圆二色谱研究了其光学活性. 利用高分子材料复制四肽化合物自组装体的形貌尚未见文献报道.
1 实验部分
1.1试剂与仪器
3-氨基苯酚、 甲醛(质量分数, 37%)、 无水甲醇、 肉豆蔻酸、 三氟乙酸、 甲苯、N,N-二甲基甲酰胺(DMF, 重蒸后使用)、 二氯甲烷(重蒸后使用)、 无水乙醚、 正己烷、 四氢呋喃(THF)、 乙腈和二甲基亚砜(DMSO), 分析纯, 国药集团化学试剂有限公司; 2-Cl-Trt(R)树脂、 Fmoc-L-丙氨酸(Fmoc-L-Ala)、 Fmoc-D-丙氨酸(Fmoc-D-Ala)和N,N-二异丙基乙胺(DIPEA), 分析纯, 吉尔生化上海有限公司; 苯并三氮唑-N,N,N′,N′-四甲基脲六氟磷酸酯(HBTU), 分析纯, 苏州昊帆生物科技有限公司.
C18柱(10 μm, 10 nm, 30 mm×150 mm), 广东研创公司; S-4800型场发射扫描电子显微镜(FE-SEM), 日本日立公司; Tecnai G220型透射电子显微镜(TEM), 美国FEI公司; AVIV-410型圆二色谱(CD)仪, 美国 AVIV Biomedical公司; 1260型高效液相色谱仪, 美国Waters公司.
1.2正十四酰L-丙氨酸-L-丙氨酸-L-丙氨酸-D-丙氨酸[13-(LLLD)]和正十四酰D-丙氨酸-D-丙氨酸-D-丙氨酸-L-丙氨酸[13-(DDDL)]的合成
采用经典的9-芴甲氧羰基(Fmoc)的固相法[18]合成13-(LLLD)和13-(DDDL). 在N2气保护下, 将2.00 g R树脂用30 mL二氯甲烷振荡30 min, 保证树脂溶胀完全; 过滤除去二氯甲烷, 用DMF冲洗3次; 将1.58 g Fmoc-D-Ala溶解于DMF中, 加入2138 μL DIPEA, 混合均匀, 反应50 min, 产物用DMF冲洗3次, 得到R-Fmoc-D-Ala.
将二氯甲烷、 甲醇和DIPEA按体积比为80∶15∶5配成阻断试剂, 将20 mL阻断试剂加入到装有R-Fmoc-D-Ala树脂的反应容器中振荡10 min, 过滤后用阻断试剂继续振荡保证树脂上的反应位点阻断完全, 过滤后用DMF冲洗3次. 配制体积比20∶80的哌啶/DMF混合溶液作为脱保护试剂, 将20 mL脱保护试剂加入反应容器振荡30 min切断第一个连接到树脂上氨基酸的芴甲氧羰基保护基, 脱保护试剂冲洗后继续用DMF冲洗3次, 得到R-D-Ala.
将1.58 g Fmoc-L-Ala和1.88 g HBTU完全溶解于DMF中, 加入2138 μL DIPEA混合均匀, 反应50 min, 用DMF冲洗3次; 将20 mL脱保护试剂加入反应容器, 振荡切断第二个氨基酸的芴甲氧羰基保护基, 得到R-L-Ala-D-Ala. 重复此步骤2次.
用95%(体积分数)三氟乙酸水溶液水解肽链和固相载体之间的酯键. 将含有产物的三氟乙酸水溶液收集后旋干, 用甲苯超声分散后除去甲苯; 用无水乙醚超声分散旋干产物, 过滤得到白色粉末状的产物, 于25 ℃真空干燥12 h; 利用反相高效液相色谱法进一步纯化样品, 所用反相柱为C18柱, 流动相为水和含体积分数为0.1%三氟乙酸的甲醇溶液, 采用梯度洗脱纯化得到最终产物, 命名为13-(LLLD). 用Fmoc-L-Ala代替Fmoc-D-Ala, 采用同样的方法合成13-(DDDL).

1.3单手螺旋3-氨基苯酚甲醛树脂的制备
参照文献[16]方法制备3-氨基苯酚甲醛树脂(PPR). 将10 mg 13-(LLLD)和50 mg 3-氨基苯酚溶解于2 mL无水甲醇中, 60 ℃下加入16 mL去离子水, 在1500 r/min下搅拌15 min后加入30 μL 37%甲醛溶液, 反应1 h后过滤, 用无水甲醇冲洗, 干燥后得到左手螺旋3-氨基苯酚甲醛树脂(MPR).
以13-(DDDL)为模板剂, 采用同样的方法可以得到右手螺旋3-氨基苯酚甲醛树脂(PPR).
2 结果与讨论
2.1 13-(LLLD)和13-(DDDL)的自组装行为
手性两亲氨基酸(单肽或寡肽)衍生物可以通过分子间弱相互作用自组装形成多种多样的螺旋纳米结构, 在医药、 电子、 生物及化工等领域具有极大的潜在应用[19~21]. 本文设计合成了一对基于丙氨酸的烷基链取代的四肽对映体13-(LLLD)和13-(DDDL), 其结构式如图1所示. 通过在不同溶剂中的成胶实验发现, 这对化合物在甲醇中的成胶浓度分别为5和10 mg/mL, 在DMF中的成胶浓度为10 mg/mL, 在DMSO中的成胶浓度为20 mg/mL, 而在水、 乙醇、 正丙醇、 四氢呋喃、 乙腈及二氯甲烷等溶剂中的溶解性极差. 将10 mg 13-(LLLD)或13-(DDDL)加热溶解于1 mL甲醇中, 在25 ℃下放置12 h后完全成胶. 图2给出13-(LLLD)和13-(DDDL)胶体的SEM照片. 13-(LLLD)和13-(DDDL)在甲醇中分别自组装形成右手螺旋和左手螺旋的纳米纤维, 纤维直径在50 nm左右, 长度为数微米.
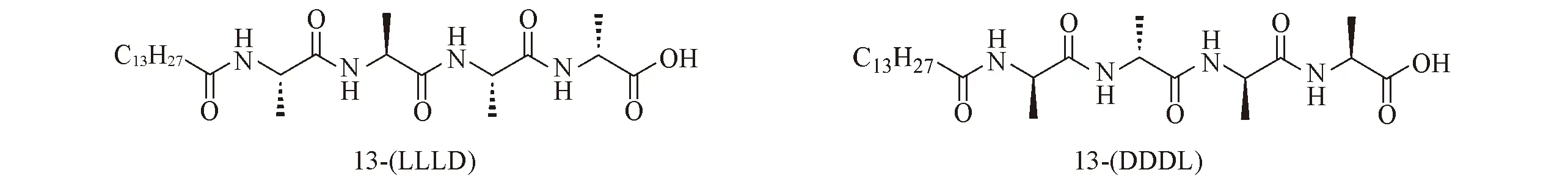
Fig.1 Molecular structures of 13-(LLLD) and 13-(DDDL)

Fig.2 FE-SEM images of 13-(LLLD)(A) and 13-(DDDL)(B) in methanol at concentration of 10 mg/mL

Fig.3 CD(a, b) and UV-Vis(c, d) spectra of 13-(LLLD)(a, c) and 13-(DDDL)(b, d) in methanol at concentration of 10 mg/mL
图3给出13-(LLLD)和13-(DDDL)组装体在甲醇中的紫外-可见光谱及圆二色谱. 在紫外-可见吸收光谱(图3谱线a和b)中, 13-(LLLD)和13-(DDDL)组装体在195 nm处出现了羰基的吸收带. 在圆二色谱(图3谱线c和d)中, 13-(LLLD)和13-(DDDL)的谱图呈现出类似镜面对称的形状. 13-(LLLD)组装体在245 nm处出现第一个正信号, 表明在组装过程中分子中的羰基按照顺时针方向进行堆积. 而13-(DDDL)组装体在250 nm处出现第一个负信号, 表明组装过程中13-(DDDL)分子中羰基按照逆时针方向进行堆积. 13-(LLLD)和13-(DDDL)组装体的信号不完全相反的现象可能来源于线二色谱[22].

Fig.4 FE-SEM(A, B) and TEM(C, D) images of 3-aminophenol-formaldehyde resin nanofibers MPR(A, C) and PPR(B, D)
2.2单手螺旋3-氨基苯酚甲醛树脂的表征
分别以13-(LLLD)和13-(DDDL)的超分子自组装体作为软模板, 3-氨基苯酚和甲醛为前驱体, 制备手性3-氨基苯酚甲醛树脂MPR和PPR. 图4给出手性3-氨基苯酚甲醛树脂MPR和PPR的SEM和TEM照片. 由图4可见, MPR和PPR分别具有左手和右手螺旋的纳米纤维结构. MPR纳米纤维的直径约为200 nm, 螺距约为1300 nm; PPR纳米纤维的直径约为120 nm, 螺距约为950 nm. 从不同手性的自组装体模板剂得到的树脂产物的手性也不相同, 表明手性从模板剂传递到高分子树脂; 但3-氨基苯酚甲醛树脂的螺旋取向与对应的自组装体恰好相反, 表明手性传递并不是简单的复制过程, 而是模板剂与树脂前驱体间协同作用的结果[23].
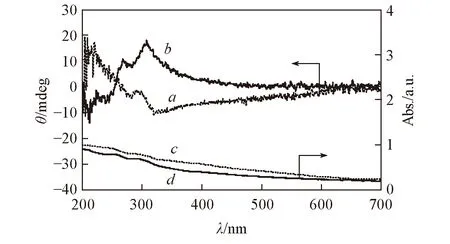
Fig.5 CD(a, b) and UV-Vis(c, d) spectra of MPR(a, c) and PPR(b, d) at concentration of 0.15 mg/mL in ethanol
图5给出3-氨基苯酚甲醛树脂的紫外-可见及圆二色谱. MPR和PPR在200~700 nm范围内都有一个宽的紫外吸收. MPR在260~700 nm 范围内有负的CD信号, 主要来源于芳环在纳米管壁上的堆积[24,25], 而PPR在此范围内得到的信号正好相反, 表明这对3-氨基苯酚甲醛树脂纳米纤维具有相反的光学活性. 这与图4结果一致. 这对3-氨基苯酚甲醛树脂纳米纤维在纳米尺度(外在螺旋)和分子尺度(光学信号)上都表现出手性, 有可能应用于手性分离和催化.
2.33-氨基苯酚甲醛树脂MPR的形成机理
将10 mg 13-(LLLD)和50 mg 3-氨基苯酚溶于2 mL无水甲醇中, 在60 ℃时整个体系为澄清透明溶液, 加入16 mL去离子水后, 在剪切力的作用下出现胶状物, 体系颜色变成白色. 图6给出MPR制备过程中不同时间的SEM照片. 从图6(A)可以观察到左手螺旋的纳米纤维. 对比图2(A), 13-(LLLD)在甲醛中自组装形成的是右手螺旋的纳米纤维. 烷基链的疏水作用和酰胺键间的氢键作用有助于13-(LLLD)形成组装体的骨架[26]. 由于13-(LLLD)和3-氨基苯酚可以通过氨基与羧基间的静电作用相互结合形成络合物[16,27], 同时通过四肽分子间的相互作用发生聚集, 这种协同组装改变了胶束的螺旋方向. 加入甲醛溶液后, 30 s时反应体系为浅黄色, 由图6(B)可见, 此时已经有结构相对完整的左手螺旋MPR的生成, 直径约为200 nm, 说明甲醛吸附到胶束的表面, 并与3-氨基苯酚缩合形成低聚物. 低聚物进一步聚合和热固化, 5 min后体系变成黄色, 从图6(C)可以观察到树脂的直径和厚度同时增大, 而反应30 min后的树脂形貌基本与反应5 min时一致[图6(D)], 螺距更加明显. 上述研究表明, 3-氨基苯酚甲醛树脂的聚合反应在较短的时间内就可以发生, 从而将模板剂自组装体的螺旋形貌复制出来.

Fig.6 FE-SEM images of the reaction of MPR at different time Time/min: (A) 0; (B) 0.5; (C) 5; (D) 30.
3 结 论
合成了一对丙氨酸的四肽衍生物对映体, 并以其超分子自组装体为模板, 利用溶胶-凝胶法制备了单手螺旋的3-氨基苯酚甲醛树脂纳米纤维. 研究发现, 螺旋树脂纳米纤维的形成过程中存在模板剂与前驱体的协同组装. 得到的3-氨基苯酚甲醛树脂既具有纳米尺度的手性, 又具有分子尺度的手性, 手性从小分子形成的自组装体传递到了高分子树脂中.
[ 1 ]Terech P., Velu S. K. P., Pernot P., Wiegart L.,J.Phys.Chem.B, 2012, 116, 11344—11355
[ 2 ]Hanabma K., Tanaka R., Suzuki M., Kimura M., Shirai H.,Adv.Mater., 1997, 9, 1095—1097
[ 3 ]Zhang C. H., Zhang H. B., Hu Y. F., Liu L., Li H., Yao S. Z.,Chem.J.ChineseUniversities, 2008, 29(10), 1941—1946(张朝晖, 张华斌, 胡宇芳, 刘丽, 李辉, 姚守拙. 高等学校化学学报, 2008, 29(10), 1941—1946)
[ 4 ]Xie J. J., Qiu H. B., Che S. A.,Chem.Eur.J., 2012, 18, 2559—2564
[ 5 ]Jung H., Shinkai S., Shimizu T.,Chem.Mater., 2003, 15, 2141—2145
[ 6 ]Jin Q. X., Zhang L., Zhu X. F., Duan P. F., Liu M. H.,Chem.Eur.J., 2012, 18, 4816—4922
[ 7 ]Rambaud F., Valle K., Thibaud S., Julian-Lopez B., Sanchez C.,Adv.Funct.Mater., 2009, 19, 2896—2905
[ 8 ]Toyodome H., Higo Y., Sasai R., Kurawaki J., Kaneko Y.,Nanosci.Nanotechnol., 2013, 13, 3074—3078
[ 9 ]Yang Y. G., Suzuki M., Fukui H., Shirai H., Hanabusa K.,Chem.Mater., 2006, 18, 1324—1329
[10]Yang Y. G., Suzuki M., Owa S., Shirai H., Hanabusa K.,J.Mater.Chem., 2006, 16, 1644—1650
[11]Yan Z. J., Li Y., Wang S. B., Xu Z., Chen Y. L., Li B. Z., Zhu X. L., Zhu G. S., Yang Y. G.,Chem.Commun., 2010, 46, 8410—8412
[12]Chen Y. X., Wang S. B., Liu X. J., Li Y., Li B. Z., Yang Y. G.,Chin.J.Chem., 2010, 28(10), 1941—1945(陈玉霞, 王思兵, 刘潇娟, 李艺, 李宝宗, 杨永刚. 中国化学, 2010, 28(10), 1941—1945)
[13]Fan. C., Qiu H., Ruan J., Terasaki O., Yan Y., Wei Z., Che S. A.,Adv.Funct.Mater., 2008, 18, 2699—2707
[14]Paik P., Gedanken A., Mastai Y.,J.Mater.Chem., 2010, 20, 4085—4093
[15]Zou W. J., Yang Y., Fang J., Yang Y., Liang J., Deng K., Yao J. L., Wei Z. X.,J.Am.Chem.Soc., 2013, 136, 578—581
[16]Chen H., Li Y., Tang X. H., Li B. Z., Zhang C. Y., Yang Y. G.,RSCAdvances, 2015, 5, 39946—39951
[17]Cui H. G., Cheetham A., Thomas P. E., Stupp S.,J.Am.Chem.Soc., 2014, 136, 12461—12468
[18]Alewood P., Johns R., Valerio R., Kemp B.,Synthesis, 1983, 1, 30—31
[19]Mason A., Muller K.,Nature, 1982, 296, 655—657
[20]Kaneto K., Tsuruta M., Motojima S.,SynthMet., 1999, 103, 2578—2579
[21]Girardet C., Vardanega D., Picaud F.,Chem.Phys.Lett., 2007, 443, 113—117
[22]Fu Y. T., Li B. Z., Huang Z. B., Li Y., Yang Y. G.,Langmuir, 2013, 29, 6013—6017
[23]Liu D., Li B. Z., Guo Y. M., Li Y., Yang Y. G.,Chirality, 2015, 27, 809—815
[24]Pappas C., Frederix P., Mutasa T., Fleming S., Abul-Haija Y., Kelly S., Gachagan A., Kalafatovic D., Trevino J., Ulijn R., Bai S.,Chem.Commun., 2015, 51, 8465—8468
[25]Marchesan S., Waddington L., Easton C., Winkler D., Goodall L., Forsythe J., Hartley P.,Nanoscale, 2012, 4, 6752—6760
[26]Shen Z. C., Wang T. Y., Liu M. H.,Chem.Commun., 2014, 50, 2096—2099
[27]Chakraborty P., Bairi P., Roy B., Nandi A. K.,ACSAppl.Mater.Interfaces, 2014, 6, 3615—3622
(Ed.: W, Z)
Preparation of Chiral 3-Aminophenol-formaldehyde Resin Nanofibers Using the Self-assemblies of Tetrapeptides as Template†
CAO Yanfang, SHAO Changzhen, LI Baozong, LI Yi, YANG Yonggang*
(JiangsuKeyLaboratoryofAdvancedFunctionalPolymerDesignandApplication,DepartmentofChemistry,ChemicalEngineeringandMaterialsScience,SoochowUniversity,Suzhou215123,China)
A pair of tetrapeptide enantiomers derived from alanine was prepared through a classic solid phase peptide synthesis method. Their gel-forming properties were investigated, and their self-assemblies in methanol were selected as the template to prepare 3-aminophenol-formaldehyde resinsviaa sol-gel process. The obtained resins products were single-handed helical nanofibers characterized by field-emission scanning electron microscopy and transmission electron microscopy. Meanwhile, their optical activities were disclosed by circular dichroism. The research results indicate that 3-aminophenol-formaldehyde resins exhibited chirality both at the nano level and at the molecular level. Chirality transferred from the self-assemblies to the resins successfully.
Tetrapeptide; Supramolecular template; Phenolic resin; Nanofiber; Chirality
10.7503/cjcu20160286
2016-04-26. 网络出版日期: 2016-09-20.
国家自然科学基金(批准号: 51473106, 21574095)资助.
O632.7+2
A
联系人简介: 杨永刚, 男, 博士, 教授, 主要从事手性纳米材料研究. E-mail: ygyang@suda.edu.cn
† Supported by the National Natural Science Foundation of China(Nos.51473106, 21574095).
