不同灌注流速对复方壳多糖组织工程真皮生长代谢的影响
2016-11-02唐辉闫洪涛陈年杨航杨桂红伍津津
唐辉 闫洪涛 陈年 杨航 杨桂红 伍津津
400042重庆,第三军医大学第三附属医院皮肤科
不同灌注流速对复方壳多糖组织工程真皮生长代谢的影响
唐辉 闫洪涛 陈年 杨航 杨桂红 伍津津
400042重庆,第三军医大学第三附属医院皮肤科
目的探讨三维动态培养条件下不同灌注流速对复方壳多糖组织工程真皮生长代谢的影响。方法 将人真皮成纤维细胞(HDF)以2×104/ml的终浓度接种到复方壳多糖胶原凝胶中,采用自制的灌注培养装置,培养基分别以50、100和200 ml/min的流速灌注培养12 d,以静态培养为对照。用倒置显微镜观察细胞形态,MTT法检测细胞活力,葡萄糖及乳酸测试盒检测细胞代谢特性,HE染色观察细胞形态和分布,羟脯氨酸测试盒检测胶原合成,同时用改进后的高敏度小张力膜状生物材料力学检测装置检测最大抗张强度。统计分析采用重复测量方差分析、单因素方差分析及LSD⁃t检验。结果灌注组细胞比对照组更密集,第8天时100 ml/min灌注组细胞几乎全部融合成片,200 ml/min灌注组细胞约达80%融合,且有沿培养基流动方向生长的趋势。MTT结果显示,4组细胞增殖活性(A值)都随培养时间的延长先持续上升后逐渐下降(P<0.05),其中灌注组的细胞增殖活性均明显高于对照组,100 ml/min灌注组的最大细胞增殖活性是对照组的1.67倍,且显著高于其他组(均P<0.05)。各组培养基中葡萄糖含量随培养时间延长均下降(P<0.05),第12天时100 ml/min灌注组的葡萄糖含量(1.604±0.038 mmol/L)显著低于对照组(2.205±0.020 mmol/L)、50 ml/min灌注组(1.939±0.037 mmol/L)及200 ml/min灌注组(2.047±0.039 mmol/L),均P<0.05。各组乳酸含量随时间变化的趋势与葡萄糖含量的变化相反,均缓慢上升(P<0.05),但其最大值对真皮内HDF影响不明显。培养第12天,100 ml/min灌注组的羟脯氨酸含量及最大抗张强度均显著高于其余3组,且组间差异均有统计学意义(F=61.512、694.216,均P<0.05)。培养第6、10天,灌注培养条件下细胞在支架中的分布比静态培养时均匀,胞核较大、长,且灌注组细胞数量显著高于对照组(均P<0.05),其中100 ml/min灌注组的细胞数量最多,显著高于其他灌注组(均P<0.05)。结论 100 ml/min的灌注流速更适合培养复方壳多糖组织工程真皮,此流速下的细胞活力、细胞分布、代谢速度、胶原合成及最大抗张强度都优于其他组。
壳多糖;组织工程;培养技术;成纤维细胞
组织工程皮肤作为最早应用于临床的工程化组织,为急性创伤和慢性溃疡的愈合和修复提供了一种较好的治疗方案。目前国外已批准组织工程皮肤用于治疗烧伤和糖尿病皮肤溃疡,并已有超过百万的患者接受了人工植皮[1⁃2]。生物反应器是工程化组织体外发育、成熟和扩大生产的关键设备,其中灌注式生物反应器的培养效果明显优于其他非灌注式生物反应器[3]。工程皮肤灌注培养的特殊要求是气液界面、低应力环境,加之对工程化皮肤体外生长代谢状况知之甚少,不能针对其生长特性及生长要求合理控制并优化灌注培养条件。我们拟采用前期自制的灌注式生物反应装置,通过探讨不同灌注流速培养条件下组织工程真皮生长代谢情况,为体外皮肤灌注培养模型的建立和工程化皮肤的扩大生产奠定基础。
材料和方法
一、主要试剂及仪器
Ⅱ型胶原酶、胰蛋白酶、小牛血清、DMEM培养基(美国Life Technologies公司);分离酶(瑞士Roche公司);壳多糖、6硫酸软骨素、透明质酸(美国Sigma⁃Aldrich公司);噻唑蓝(MTT)(北京索莱宝科技有限公司);PBS(北京中杉金桥生物技术有限公司);葡萄糖测试盒、乳酸测试盒、羟脯氨酸测试盒(南京建成生物工程研究所);改进后的高敏度小张力膜状生物材料力学检测装置[4]。
二、灌注装置
本实验室自主研制,并已获得专利授权[5]。见图1。装置由蠕动泵、无菌硅胶管、储液瓶、生物反应盒及培养盘构成,其中培养盘置于生物反应盒内。培养盘主要由静压槽、截流板、培养室、培养板、后溢流台和泄流沟组成。工作原理是培养基在蠕动泵的带动下从储液瓶进入静压槽,并在此将动压转换成稳定静压,再经截流板进口流入培养室,在培养室中形成均匀平面流场,随后培养基经后溢流台从泄流沟进入下一层培养盘的静压槽或反应盒,再通过蠕动泵带动返回储液瓶,如此反复循环。
三、细胞培养及组织构建
1.培养基的配制:用D⁃Hanks液稀释常规DMEM培养基至终浓度为20%,添加10%小牛血清和100 U/ml青霉素及链霉素,0.22 μm微孔滤膜过滤待用。
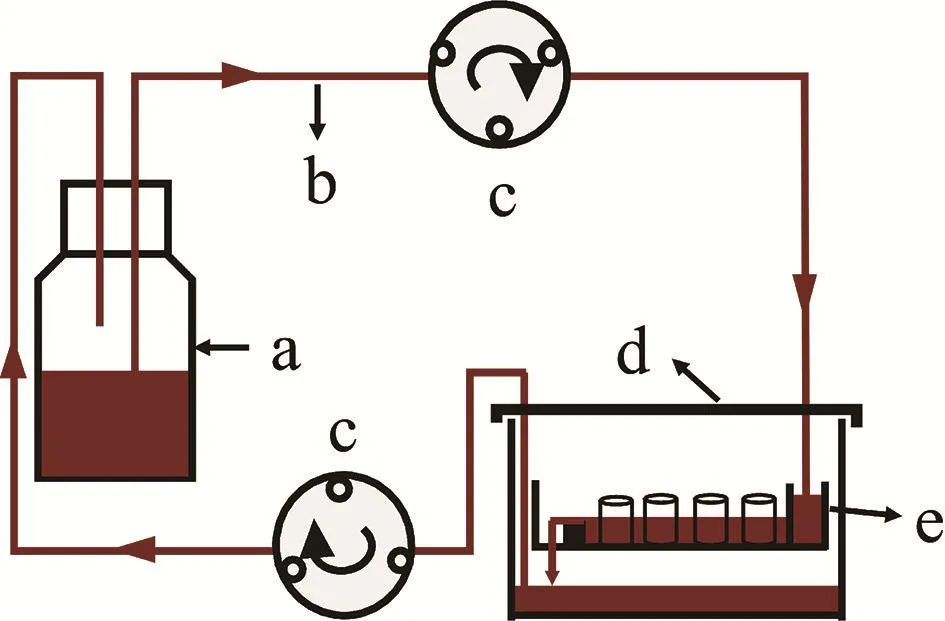
图1 灌注装置示意图 a:储液瓶;b:无菌硅胶管;c:蠕动泵;d:生物反应盒;e:培养盘;箭头指示培养基流动方向及蠕动泵转动方向
2.人真皮成纤维细胞(human dermal fibroblasts,HDF)的分离和培养:第三军医大学大坪医院泌尿外科无皮肤病变的包皮环切术患者(年龄6~18岁),征得其法定监护人知情同意后,切取包皮放入PBS溶液中,并迅速进行细胞分离培养[6],以后每隔3 d换液1次,观察细胞融合至90%用胰酶消化传代。采用第3~7代HDF进行实验。
3.复方壳多糖组织工程真皮构建:按本研究组建立的方法构建复方壳多糖组织工程真皮[7]:在冰浴条件下,按比例加入浓缩DMEM、酸溶性鼠尾胶原、壳多糖、6硫酸软骨素以及透明质酸,充分混匀后用1 mol/L NaOH溶液调pH至7.2~7.4,取HDF悬液,按2×104/ml的终浓度与凝胶混匀,将该混合液接种到底部有微孔的24孔板中,每孔2 ml,待凝胶凝固后行灌注培养。按培养基的灌注流速不同,实验分为50、100和200 ml/min灌注组,每隔11.5 h灌注1次,每次灌注0.5 h。三维静态培养为对照组,其培养环境及条件与灌注组一致。
四、MTT法检测细胞活力
每隔2 d取各组培养的复方壳多糖组织工程真皮,37℃下避光并在5 g/L MTT中孵育4 h,滤纸吸干水份并用DMSO溶解,于490 nm波长处检测样品吸光度(A值),制作细胞生长曲线。
五、细胞代谢特性检测
每2 d取各组的培养基0.5 ml于-80℃保存备用,按葡萄糖测试盒及乳酸测试盒说明书分别于505 nm、530 nm波长处检测样品吸光度。
六、羟脯氨酸含量测定
取各组培养第12天的复方壳多糖组织工程真皮,于60℃电热鼓风干燥箱中干燥至衡重,称量样品干重,按羟脯氨酸测试盒样本碱水解法处理样本,并于550 nm处检测样品吸光度。
七、最大抗张强度检测
取各组培养第12天的复方壳多糖组织工程真皮,于高敏度小张力膜状生物材料力学检测装置上检测最大抗张强度,具体步骤参见文献[8]。
八、苏木素⁃伊红(HE)染色及细胞计数
各组在第6天和第10天取材后,用4%多聚甲醛溶液固定24 h以上,常规脱水、浸蜡、包埋、切片,HE染色,显微镜观察照相,每组各时间点随机抽取5个视野计数细胞。
九、统计学分析
采用SPSS18.0统计软件进行分析。除特别说明外,每份检测样本均为3个独立重复,计量资料以±s表示。羟脯氨酸及最大抗张强度数据采用单因素方差分析,其余数据采用重复测量方差分析,组间比较采用LSD⁃t检验进行两两比较。P<0.05为差异有统计学意义。
结 果
一、HDF形态比较
培养至第8天,HDF呈长梭形,各灌注组细胞均比对照组密集(图2)。100 ml/min灌注组细胞几乎全部融合成片,200 ml/min灌注组细胞约达80%融合,且有沿水流方向生长的趋势,而50 ml/min灌注组和对照组的细胞间隙较大。
二、细胞生长代谢情况比较
不同灌注流速下复方壳多糖组织工程真皮中细胞生长代谢情况见图3。4组细胞增殖活性(A值)都随培养时间的延长先持续上升后逐渐下降(F时间=653.918,P<0.05),且不同灌注流速对细胞增殖影响的差异有统计学意义(F组别=952.096,P<0.05),培养时间与灌注流速分组存在交互作用(F交互=22.567,P<0.05)。200 ml/min灌注组细胞增殖活性(0.142±0.002)和对照组(0.108±0.001)于培养第8天达到最大,而50 ml/min灌注组(0.128±0.005)和100 ml/min组(0.180±0.005)于第10天达到最大。灌注组的细胞增殖活性均明显高于对照组,其中100 ml/min灌注组的最大细胞增殖活性是对照组的1.67倍,且显著高于其他组(均P<0.05)。

图2 培养基在不同灌注流速下培养第8天复方壳多糖组织工程真皮中人真皮成纤维细胞生长情况(×200) 三维培养条件下细胞呈长梭形,灌注组细胞比对照组更密集,100 ml/min灌注组细胞几乎全部融合成片,200 ml/min灌注组细胞达80%融合。标尺=100 μm
培养前,4组培养基的葡萄糖含量均为2.548 mmol/L,随培养时间延长,其含量均缓慢降低(F时间=257.108,P<0.05),且不同灌注流速对培养基中葡萄糖含量变化的差异有统计学意义(F组别=88.182,P<0.05),培养时间与灌注流速分组存在交互作用(F交互=57.778,P< 0.05)。LSD⁃t检验显示,培养第12天,100 ml/min灌注组的葡萄糖含量显著低于其他3组(均P<0.05)。见图3。

各组乳酸含量随时间变化的趋势与葡萄糖含量的变化相反,均缓慢上升(F时间=81.301,P<0.05),且不同灌注流速对培养基中乳酸含量变化的差异有统计学意义(F组别=14.618,P<0.05),培养时间与灌注流速分组不存在交互作用(F交互=1.600,P>0.05)。LSD⁃t检验显示,各组不同时间点间乳酸含量差异均有统计学意义(P<0.05)。除第4天外,其余时间点的组间乳酸含量差异均有统计学意义(P<0.05)。第12天,100 ml/min灌注组的乳酸含量达到最高,且显著高于其他组(P<0.05)。见图3。
三、羟脯氨酸含量及最大抗张强度比较
培养第12天,100 ml/min灌注组的羟脯氨酸含量(49.156±1.025 mg/g)显著高于50 ml/min灌注组(34.002±3.392 mg/g)、200 ml/min灌注组(40.568±0.827 mg/g)及对照组(29.105± 1.207 mg/g),且组间差异有统计学意义(F=61.512,P<0.05)。100 ml/min灌注组的最大抗张强度(8.845±0.096 kPa)显著高于50 ml/min灌注组(4.503±0.121 kPa)、200 ml/min灌注组(5.535±0.118 kPa)及对照组(3.718±0.224 kPa),且组间差异有统计学意义(F=694.216,P< 0.05)。
四、HDF在复方壳多糖组织工程真皮内的分布
MTT结果显示,第10天细胞活力最好,故选择第10天作为取材时间,且为了进一步验证MTT结果,同时检测了第6天工程真皮内HDF的分布情况,其HE染色结果见图4。灌注培养条件下,细胞在支架中的分布比静态培养时均匀,胞核较大、长,但随着灌注流速增大,胞核变圆、变短、变大(200 ml/min组)。各组随机选取5个视野计数细胞,重复测量方差分析结果显示(表1),4组细胞数量随培养时间延长均有所增加(F时间=197.149,P<0.05),不同灌注组的细胞数量存在显著差异(F组别=625.151,P<0.05),培养时间与灌注流速分组存在交互作用(F交互=83.823,P< 0.05),与MTT结果一致。LSD⁃t检验显示,灌注组细胞数量显著高于对照组(均P<0.05),其中100 ml/min组细胞数量最多,显著高于其他灌注组(均P<0.05)。
讨 论
工程化组织中细胞生长面临的最大问题是为支架材料内部区域提供充足的营养[9]。传统的静态三维培养依赖扩散方式传递养分,存在扩散受限的缺点,有代谢活性的细胞在超过100 μm深的支架区域就不能获得足够的营养,形成组织“空化”现象[10],而有流体流动的灌注式生物反应器是解决营养传递受限最有效的方法[11⁃12]。培养基连续流经工程组织内部或周围的灌注培养能给予厚度超过500 μm区域以可靠的营养[13]。除增强养分传递外,灌注液流产生的剪切力能提供机械刺激,有利于构建物的发育和成熟。灌注培养使工程化组织一直处于新鲜的培养液中,不仅避免了代谢产物的非生理性累积,而且避免了细胞因子的旁分泌过度,这样低亲和力分子被排除,而高亲和力分子的浓度可以相对较高[14]。因此,灌注培养是增强细胞活力、促进细胞生长和基质合成的有效手段。灌注培养的灌注速度直接影响支架内物质的转运速度及液流对细胞产生的力学刺激[15],而灌注速度随组织类型、细胞种类、细胞支架复合物成分和生物反应器的结构不同而变化。因此,本研究在前期自制灌注培养装置的基础上,进一步探究不同灌注流速对复方壳多糖组织工程真皮中HDF生长代谢的影响,以期寻求最佳灌注培养流速,为体外皮肤灌注培养模型的建立奠定基础,也为下一步扩大化生产提供数据参考。

图4 培养基不同灌注流速下第6、10天复方壳多糖组织工程真皮中人真皮成纤维细胞分布情况(HE×100) 与对照组相比,灌注组细胞分布更均匀,胞核更大、更长;200 ml/min灌注组胞核较圆、较短、较大。标尺=200 μm
表1 培养基不同灌注流速下第6天和第10天复方壳多糖组织工程真皮中人真皮成纤维细胞数量比较(±s)
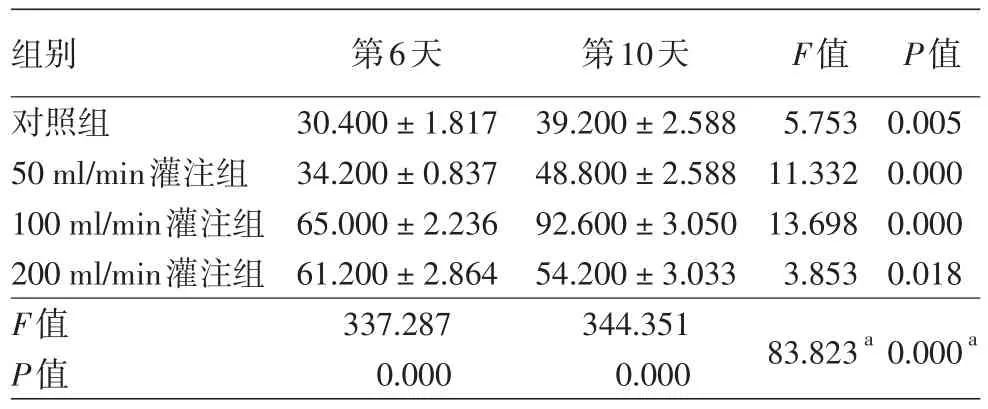
表1 培养基不同灌注流速下第6天和第10天复方壳多糖组织工程真皮中人真皮成纤维细胞数量比较(±s)
注:n=5。经Mauchly球形检验计算W=0.069,P=0.186,接受球形假设;a:交互效应
组别对照组50 ml/min灌注组100 ml/min灌注组200 ml/min灌注组F值P值第6天30.400±1.817 34.200±0.837 65.000±2.236 61.200±2.864 337.287 0.000第10天39.200±2.588 48.800±2.588 92.600±3.050 54.200±3.033 344.351 0.000 F值5.753 11.332 13.698 3.853 83.823a P值0.005 0.000 0.000 0.018 0.000a
本实验设计了3个不同大小的灌注流速,结果发现,灌注培养可增强细胞活力,但过低的流速(50 ml/min)细胞活力较低且增殖缓慢,过高的流速(200 ml/min)不仅降低其活力,还会使真皮细胞提前进入衰退期,并在一定程度上影响细胞形态,当灌注流速为100 ml/min时细胞活力最高。Kalyanaraman等[16]在其自制的反应器中对组织工程皮肤进行熟化培养时也发现,灌注流速为5 ml/min和15 ml/min时能增强工程皮肤细胞活力并维持表皮屏障功能,更适合移植;但流速为50 ml/min时细胞只有少量增殖。在较低的灌注流速下(50 ml/min),养分供应不充足加之支架中积累的代谢废物滞留时间相对较长,影响了真皮细胞的活力及生长速度;而较高的流速会产生较高的流体剪切力,一定强度的剪切力会刺激细胞生长和胞外基质合成,但过高的剪切力会影响细胞形态、细胞活性及胞外基质沉积[17]。因此,200 ml/min灌注组其细胞活力和胞外羟脯氨酸的含量均较100 ml/min组低。100 ml/min的灌注流速在增强传质的同时,可有效地平衡养分供应、代谢废物的排除与力学刺激,因此细胞活力、细胞分布、胞外胶原合成能力及物理抗张强度都最佳。
值得注意的是,采用常规的DMEM完全培养基培养的组织工程真皮细胞容易迁移并聚集到皮片边缘形成“包衣”结构,过厚的这种结构会阻碍养分的传递,影响组织工程真皮内部细胞的生长。因此,我们前期降低营养浓度到20%后发现,细胞的边缘移行情况有明显好转,故本文采用20%DMEM完全培养基。葡萄糖和乳酸含量检测结果表明,100 ml/min灌注组消耗的葡萄糖最多,积累的乳酸也最多,说明其细胞代谢最旺盛。有报道称,当乳酸的积累量超过22~55 mmol/L时会负面影响培养的细胞[18],本实验检测到乳酸的最大值为(1.512±0.058)mmol/L,故对真皮内HDF影响不明显。
组织工程皮肤作为皮肤替代物,不仅要具备良好的生物学特性,还应具有良好的力学特性以适应临床移植,因此抗张强度是评价其力学性能的重要指标。软组织的张力强度主要与胶原密度、胶原结构排列、平均胶原纤维直径和胶原交联程度等相关[19]。本研究组研制的复方壳多糖组织工程真皮主要由胶原构成。在体外培养过程中,HDF不断合成分泌胶原蛋白形成胶原纤维,因此具有良好的韧性,可任意剪切和缝合。本实验测定了不同灌注流速对复方壳多糖组织工程真皮抗张强度的影响,结果表明灌注组的最大抗张强度比对照组大,其中100 ml/min灌注组最大抗张强度最大、200 ml/min灌注组次之,50 ml/min灌注组最小,这一结果与细胞活力和羟脯氨酸测量结果一致。说明灌注培养能增强工程真皮的力学性能,但过高的流速(200 ml/min)由于影响了HDF活力,降低了细胞合成分泌胶原的能力,使其抗张强度有所降低。因此,100 ml/min灌注组较其他组更适合工程真皮力学特性的塑造。
综上所述,灌注培养条件下,复方壳多糖组织工程真皮细胞生长代谢及物理特性都优于静态培养,但不同灌注流速产生的培养效果不同。在本实验设定的流速条件下,100 ml/min的培养效果最好,细胞活力、细胞分布、代谢速度、胶原合成及抗张强度都优于其他组,但是否有更适合组织工程真皮培养的灌注模式仍需进一步研究。
[1]Groeber F,Holeiter M,Hampel M,et al.Skin tissue engineering:in vivoandin vitroapplications[J].Adv Drug Deliv Rev,2011,63(4⁃5):352⁃366.DOI:10.1016/j.addr.2011.01.005.
[2]Langer R,Vacanti J.Advances in tissue engineering[J].J Pediatr Surg,2016,51(1):8⁃12.DOI:10.1016/j.jpedsurg.2015.10.022.
[3]Hossain MS,Bergstrom DJ,Chen XB.Modelling and simulation of the chondrocyte cell growth,glucose consumption and lactate production within a porous tissue scaffold inside a perfusion bioreactor[J].Biotechnol Rep(Amst),2015,5:55⁃62.DOI:10.1016/j.btre.2014.12.002.
[4]张才茂,伍津津,鲁元刚,等.高敏度小张力膜状生物材料力学检测装置改进[J].第三军医大学学报,2010,32(9):904⁃907.Zhang CM,Wu JJ,Lu YG,et al.Improvement of high⁃sensitivity mechanical test device for detecting properties of small tension membranaceous biomaterials[J].J Third Mil Med Univ,2010,32(9):904⁃907.
[5]伍津津.一种适用于三维组织细胞灌注培养的生物反应器:中国,CN103966095A[P].2014⁃08⁃06.Wu JJ.The bioreactor suitable for three⁃dimensional tissue perfusion culture:China,CN103966095A[P].2014⁃08⁃06.
[6]Wu JJ,Liu RQ,Lu YG,et al.Enzyme digestion to isolate and culture human scalp dermal papilla cells:a more efficient method[J].Arch Dermatol Res,2005,297(2):60⁃67.DOI:10.1007/s00403⁃005⁃0554⁃z.
[7]伍津津,刘荣卿,叶庆佾,等.人工皮肤培养模型的建立[J].重庆医学,1999,28(4):247.DOI:10.3969/j.issn.1671⁃8348.1999.04.004.Wu JJ,Liu RQ,Ye QQ,et al.A model of artificial skin established by three⁃dimension culture[J].Chongqing Medicine,1999,28(4):247.DOI:10.3969/j.issn.1671⁃8348.1999.04.004.
[8]张才茂.组织工程真皮动态三维应变培养装置和抗张强度检测装置的研制[D].重庆:第三军医大学,2010:38.Zhang CM.Development of dynamic three⁃dimensional strain culture equipment and tensile strength testing device for tissue⁃engineered dermis[D].Chongqing:The Third Military Medical University,2010:38.
[9]MacNeil S.Progress and opportunities for tissue⁃engineered skin[J].Nature,2007,445(7130):874⁃880.DOI:10.1038/nature05664.
[10]Vunjak⁃Novakovic G,Tandon N,Godier A,et al.Challenges in cardiac tissue engineering[J].Tissue Eng Part B Rev,2010,16(2):169⁃187.DOI:10.1089/ten.TEB.2009.0352.
[11]Hossain MS,Bergstrom DJ,Chen XB.Modelling and simulation of the chondrocyte cell growth,glucose consumption and lactate production within a porous tissue scaffold inside a perfusion bioreactor[J].Biotechnol Rep(Amst),2015,5:55 ⁃62.DOI:10.1016/j.btre.2014.12.002.
[12]Rodrigues CA,Fernandes TG,Diogo MM,et al.Stem cell cultivation in bioreactors[J].Biotechnol Adv,2011,29(6):815⁃829.DOI:10.1016/j.biotechadv.2011.06.009.
[13]Zhao S,Li L,Wang H,et al.Wound dressings composed of copper⁃doped borate bioactive glass microfibers stimulate angiogenesis and heal full⁃thickness skin defects in a rodent model[J].Biomaterials,2015,53:379⁃391.DOI:10.1016/j.biomaterials.2015.02.112.
[14]Minuth WW,Denk L,Glashauser A.A modular culture system for the generation of multiple specialized tissues[J].Biomaterials,2010,31(11):2945⁃2954.DOI:10.1016/j.biomaterials.2009.12.048.
[15]Martin I,Wendt D,Heberer M.The role of bioreactors in tissue engineering[J],Trends Biotechnol,2004,22(2):80⁃86.
[16]Kalyanaraman B,Supp DM,Boyce ST.Medium flow rate regulates viability and barrier function of engineered skin substitutes in perfusion culture[J].Tissue Eng Part A,2008,14(5):583⁃593.DOI:10.1089/tea.2007.0237.
[17]罗厚勇,丁春梅,周燕,等.灌注速率对成纤维细胞在三维支架中生长和胶原合成的影响[J].华东理工大学学报(自然科学版),2012,38(4):465⁃471.Luo HY,Ding CM,Zhou Y,et al.Effect of perfusion rate on growth and collegen production of human dermal fibroblasts in 3D scaffold[J].Journal of East China University of Science and Technology(Natural Science Edition),2012,38(4):465⁃471.
[18]李寅,高海军,陈坚.高细胞密度发酵技术[M].北京:化学工业出版社,2006:321.Li Y,Gao HJ,Chen J.High cell density fermentation technology[M].Beijing:Chemical Industry Press,2006:321.
[19]Ahlfors JE,Billiar KL.Biomechanical and biochemical charac⁃teristics of a human fibroblast⁃produced and remodeled matrix[J].Biomaterials,2007,28(13):2183 ⁃2191.DOI:10.1016/j.biomaterials.2006.12.030.
Effects of different medium perfusion rates on the growth and metabolism of composite chitosan⁃based tissue⁃engineered dermi
s
Tang Hui,Yan Hongtao,Chen Nian,Yang Hang,Yang Guihong,Wu Jinjin
Department of Dermatology,Daping Hospital,The Third Military Medical University,Chongqing 400042,China Corresponding author:Wu Jinjin,Email:wjjjj@163.com
ObjectiveTo evaluate effects of different medium perfusion rates on the growth and metabolism of composite chitosan⁃based tissue⁃engineered dermis in a dynamic three⁃dimensional culture system.MethodsHuman dermal fibroblasts(HDFs)at a density of 2 × 104/ml were inoculated onto chitosan⁃collagen composite hydrogels,and then cultured in a self⁃made perfusion culture device with the medium perfusion rates being 50,100 or 200 ml/min for 12 days(perfusion culture groups),and statically cultivated HDFs served as the control group.An inverted microscope was used to observe morphological changes of HDFs,and methyl thiazolyl tetrazolium(MTT)assay was conducted to evaluate proliferative activity of HDFs.Test kits were used to determine glucose and lactate levels to evaluate cellular metabolic activity,and hydroxyproline content was measured to estimate collagen synthesis.An improved highly sensitive mechanical testing device was used to measure the tensile strength of the tissue⁃engineered dermis,and hematoxylin and eosin(HE)staining was performed to observe the morphology and distribution of HDFs.Statistical analysis was carried out by repeated⁃measures analysis of variance,one⁃way analysis of variance and the least significant difference(LSD)⁃ttest.ResultsCompared with the control group,HDFs were distributed more densely in the perfusion culture groups.After 8⁃day culture,HDFs,which tended to grow along the direction of medium flow,grew to almost complete confluence in the 100⁃ml/min perfusion culture group,and to 80%confluence in the 200⁃ml/min group.As MTT assay showed,the proliferative activity of HDFs(expressed as absorbance[A]value)increased initially,but then gradually decreased over time in all the above 4 groups(allP<0.05).Moreover,perfusion culture groups all showed significantly higher cellular proliferative activity compared with the control group,and the maximum cellular proliferative activity in the 100⁃ml/min group was 1.67 times that in the controlgroup,andsignificantlyhigherthanthatintheotherperfusionculturegroups(bothP< 0.05).Thelevelsofglucose in the 4 groups all decreased over time(allP< 0.05),and the 100⁃ml/min group(1.604 ± 0.038 mmol/L)showed significantly lower levels of glucose compared with the control group(2.205 ± 0.020 mmol/L,P< 0.05),50⁃ml/min group(1.939 ± 0.037 mmol/L,P< 0.05)and 200⁃ml/min group(2.047 ± 0.039 mmol/L,P< 0.05)after 12⁃day culture.However,in contrast to glucose,the levels of lactate changed in the opposite direction,and increased gradually over time in all the 4 groups(P< 0.05),but even the maximum level of lactate had no obvious effect on HDFs in the dermis.On day 12,the 100⁃ml/min group showed significantly higher hydroxyproline levels and maximum tensile strength compared with the other three groups(F=61.512,694.216,respectively,bothP< 0.05).On days 6 and 10,all the perfusion culture groups showed increased quantities(allP< 0.05)of more evenly distributed HDFs with larger and longer nuclei in scaffolds compared with the control group.Moreover,the amounts of cells were significantly larger in the 100⁃ml/min group than in the other perfusion culture groups(bothP< 0.05).Conclusions The medium perfusion rate of 100 ml/min is optimal for the culture of composite chitosan⁃based tissue⁃engineered dermis.At this medium perfusion rate,cellular proliferative activity,cell distribution,metabolic rates,collagen synthesis and the maximum tensile strength were more favourable compared with those at other perfusion rates.
Chitin;Tissue engineering;Culture techniques;Fibroblasts
伍津津,Email:wjjjj@163.com
10.3760/cma.j.issn.0412⁃4030.2016.12.008
国家自然科学基金(31570975)
Fund program:National Natural Science Foundation of China(31570975)
2016⁃04⁃01)
(本文编辑:周良佳 颜艳)
