体外仿生法研究牡蛎和蛤仔体内微量金属元素的生物可给性
2016-11-01王增焕王许诺陈成桐陈瑛娜
王增焕王许诺 林 钦 陈成桐 陈瑛娜
(中国水产科学研究院南海水产研究所,农业部水产品加工重点实验室,广东省渔业生态环境重点实验室,广州 510300)
体外仿生法研究牡蛎和蛤仔体内微量金属元素的生物可给性
王增焕*王许诺 林 钦 陈成桐 陈瑛娜
(中国水产科学研究院南海水产研究所,农业部水产品加工重点实验室,广东省渔业生态环境重点实验室,广州 510300)
采用体外全仿生消解方法,模拟人体的消化道环境,对牡蛎和蛤仔样品进行仿生消解,分析牡蛎和蛤仔体内微量元素的生物可给性。以原子吸收光谱法测定胃、肠仿生提取液中微量元素的含量。结果表明,牡蛎胃提取液中Fe,Cu,Zn,Cd的含量明显高于肠提取液中的含量,蛤仔胃提取液中Fe,Cu的含量与肠提取液中的含量没有明显差异,而Zn,Cd的含量远高于其在肠提取液中的含量。经全仿生消解后,牡蛎体Fe,Cu,Zn,Cd的可给性分别为60.2%,83.6%,83.1%,76.8%;蛤仔Fe,Cu,Zn,Cd的可给性分别为46.3%,86.3%,85.3%,87.7%。本研究结果为进一步研究牡蛎和蛤仔对金属元素的累积和迁移、生物可利用性,Cd等有害元素对食用者的健康风险评估,提供技术支持和理论依据。
体外仿生消解;生物可给性;原子光谱法;微量元素;牡蛎和蛤仔
1 引言
牡蛎和蛤仔是常见的两种贝类,营养丰富、蛋白质含量高、脂肪含量低,易被人体消化吸收,深受消费者的青睐[1~3]。牡蛎和蛤仔的Fe,Zn,Cu等多种生命必需元素含量高[4,5],具有较高的食用价值与保健作用。另一方面,牡蛎和蛤仔生活在沉积物表面,受养殖环境影响,一些有害元素如Cd等的含量也比较高[6,7],对食用安全有潜在的危害[8,9]。
金属元素在生理和病理中有重要作用[10,11]。氨基酸等营养物质可以在人体内合成,但微量元素必须从饮食中获取[12],并且随着能量的消耗而流失。但是,所有通过膳食途径进入人体的物质,包括营养物质和有害物质,首先要在消化液作用下从食物基体上释放出来,才有可能被机体组织利用,成为潜在的生物可利用部分,即生物可给性[1,13~15]。许多关于牡蛎和蛤仔体内微量元素的研究,主要以元素的总量为基础,分析必需元素的功能作用,讨论有害元素对食用者的危害[6,9]。本实验采用体外全仿生消化法,应用仿生消化液对牡蛎和蛤仔样品进行消解,以原子吸收光谱法测定胃、肠仿生提取液以及剩余残渣中Fe,Cu,Zn和Cd的含量,分析牡蛎和蛤仔中微量金属的生物可给性。
2 实验部分
2.1 仪器与试剂
HITCH Z-2000型原子吸收分光光度计(日本Hitachi公司);Ethos 1型微波消解系统(意大利Milestone公司);ALPHA 1型真空冷冻干燥机(德国Christ公司);ZHWY-200D型气浴恒温振荡器(中国智诚公司),Anke DL-6000B型低温离心机(中国安亭公司)。
HNO3、H2O2(优级纯,广州试剂厂);牛血清白蛋白(分析纯,广州威佳科技有限公司);黏液素(分析纯,广州鼎国生物技术有限公司);胃蛋白酶、胰酶、脂肪酶、胆汁、α-淀粉酶、氨基葡萄糖盐酸盐、葡萄糖醛酸、葡萄糖、尿素、尿酸等试剂(分析纯,上海晶纯生化科技股份有限公司);多元素混合标准溶液(10 mg/L,上海市计量测试技术研究院)。
2.2 样品制备
牡蛎和蛤仔采集于广东沿海主要养殖区,现场用海水冲洗干净外壳后,取出软组织,-20℃保存,
带回实验室。在实验室再用真空冷冻干燥机冻干后,用玛瑙研钵研磨成均匀粉末,待用。
2.3 仿生消化液制备
参照文献[18,19]制备仿生消化液,由一定的生物酶和适当的无机盐与有机物制成如下:
仿生唾液烧杯中加入10 mL KCl溶液(89.6 g/L)、10 mL硫氰化钾(KSCN)溶液(20 g/L)、10 mL NaH2PO4溶液(88.8 g/L)、10 mL Na3PO4溶液(57 g/L)、1.7 mL NaCl溶液(175.3 g/L)、1.8 mL NaOH溶液(40 g/L),再加入8 mL尿素溶液(25 g/L)和145 mg α-淀粉酶、15 mg尿酸、50 mg粘液素,用HCl 或NaHCO3溶液调pH至6.5±0.2,用超纯水定容至500 mL,在4℃保存。
仿生胃液烧杯中加入15.7 mL NaCl溶液(175.3 g/L)、3.0 mL NaH2PO4溶液(88.8 g/L)、9.2 mL KCl溶液(89.6 g/L)、18 mL CaCl2溶液(22.2 g/L)、8.3 mL HCl溶液(37%),加入10 mL葡萄糖溶液(65 g/L)、10mL葡萄糖醛酸溶液(2 g/L)、3.4 mL尿素溶液(25 g/L)、10 mL氨基葡萄糖盐酸盐溶液(33 g/L),再加入1 g牛血清蛋白、1 g胃蛋白酶、3 g粘液素,调节至pH 1.07±0.07,稀释至500 mL,4℃保存待用。
仿生十二指肠液烧杯中加入40 mL NaCl溶液(175.3 g/L)、40 mL NaHCO3溶液(84.7 g/L)、10 mL KH2PO4溶液(8 g/L)、6.3 mL KCl溶液(89.6 g/L)、10 mL MgCl2溶液(5 g/L)、9 mL CaCl2溶液(22.2 g/L)、0.18 mL HCl溶液(37%)和4 mL尿素溶液(25 g/L),再加入1 g牛血清蛋白、3 g胰酶、0.5 g脂肪酶,调节至pH 7.8±0.2,稀释至500 mL,4℃保存待用。
仿生胆汁烧杯中加入30 mL NaCl溶液(175.3 g/L)、68.3 mL NaHCO3溶液(4.7 g/L)、4.2 mL KCl溶液(89.6 g/L)、0.2 mL HCl溶液(37%)、10 mL CaCl2溶液(22.2 g/L),再加入1 g牛血清蛋白、6 g胆汁,调节至pH 8.0±0.2,稀释至500 mL,4℃保存待用。
2.4 牡蛎和蛤仔仿生提取液制备
称取牡蛎和蛤仔样品1 g(准确至0.001 g),加入10 mL唾液,恒温(37℃)振荡5 min;加入150 mL胃液,继续恒温(37℃)振荡2 h,取100 mL仿生消化食糜,于4℃以8000 r/min离心10 min,上层清液为胃仿生提取液;余下胃仿生消化食糜加入200 mL十二指肠液和80 mL胆汁,继续恒温(37℃)振荡8 h后,取100 mL于4℃以8000 r/min离心10 min,取上层清液为肠仿生提取液,下层沉淀为仿生消解后的残渣。仿生提取液于4℃保存待测。
2.5 牡蛎和蛤仔元素测定
称取适量牡蛎和蛤仔样品(准确至0.001 g),加入8 mL浓HNO3、1 mL H2O2,微波消解。样品仿生提取液和残渣参照进行,同时做试剂空白。原子吸收测定Fe、Cu,Zn,Cd的含量。
准确量取Fe,Cu,Zn,Cd标准溶液(10 mg/L)适量,用2%HNO3(V/V)稀释成浓度分别为0.2,0.4,0.8,1.6和3.2 μg/mL的Fe,Cu,Zn,Cd标准溶液,火焰原子吸收光谱法测定各元素的吸光度,绘制工作曲线。仪器的工作条件为:Fe,Cu,Zn,Cd波长分别为248.3,324.8,213.9和228.8 nm,狭缝为0.2,1.3,1.3和1.3 nm,乙炔流量均为2.0 L/min,空气流量均为15 L/min,燃烧器高度均为7.5 mm。
3 结果与讨论
3.1 方法的准确度
分别随机选择牡蛎和蛤仔样品各2个,按仿生消解方法重复进行3次,测定胃、肠提取液和残渣中Fe,Cu,Zn,Cd的含量,计算测定结果的相对标准偏差,结果见表1。以牡蛎和蛤仔为样品,采用标准加入法进行加标回收实验(表2)。Fe,Cu,Zn,Cd的最大相对标准偏差小于5%,回收率在93%~103%之间,表明Fe,Cu,Zn,Cd测定的准确度好,结果可靠。
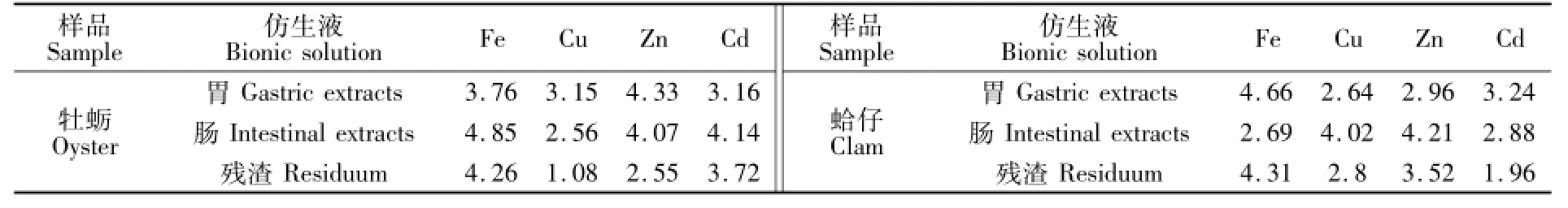
表1 牡蛎和蛤仔样品中Fe,Cu,Zn,Cd测定的相对标准偏差(%)Table 1 Relative standard deviation of trace metal measurements for oyster and clam samples(%)

表2 牡蛎和蛤仔样品中Fe,Cu,Zn,Cd的含量及其回收率Table 2 Trace metal contents and their recovery in oyster and clam samples
3.2 牡蛎和蛤仔中元素含量
如图1所示,牡蛎和蛤仔样品中Fe,Cu,Zn,Cd的总量呈现相同的分布趋势,含量从高到低的顺序为Fe>Zn>Cu>Cd。牡蛎样品中元素Fe,Cu,Zn和Cd的含量分别为1.69 mg/g,0.305 mg/g,0.957 mg/g和7.99 μg/g,蛤仔样品中的Fe,Cu,Zn和Cd的含量分别为1.23 mg/g,0.028 mg/g,0.106 mg/g和1.75 μg/g。
3.3 胃、肠提取液中元素的含量
牡蛎样品经仿生消解后,提取液中微量元素的含量变化如图2所示。微量元素在胃提取液中的含量明显高于其在肠提取液中的含量,在残渣中的含量则变化较大。牡蛎胃提取液中Fe,Cu,Zn和Cd的含量分别为0.674 mg/g,0.198 mg/g,0.620 mg/g和6.00 μg/g,是肠提取液的1.97,2.27,2.33和3.53倍。残渣中Fe的含量为0.675 mg/g,与胃提取液中Fe含量相同,而残渣中Cu,Zn和Cd的含量分别为0.020 mg/g,0.071 mg/g和0.29 μg/g,远低于其在胃和肠提取液中的含量。
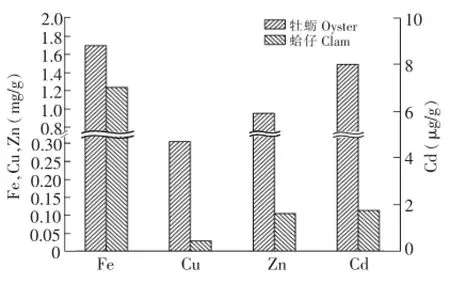
图1 牡蛎和蛤仔体元素含量Fig.1 Contents of elements in oyster and clam samples
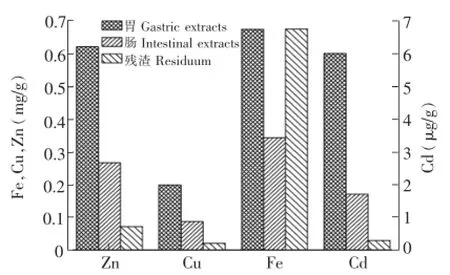
图2 牡蛎样品仿生提取液中元素的含量Fig.2 Contents of elements in in vitro digestion of oyster samples
蛤仔样品的胃、肠提取液和残渣中微量元素的含量变化如图3所示。胃、肠提取液中Fe的含量分别为0.292和0.268 mg/g,明显低于残渣中Fe的含量。胃提取液中 Cu,Zn和 Cd的含量分别为0.0115 mg/g,0.0663 mg/g和1.39 μg/g,明显高于残渣中的含量。
3.4 生物可给性
本研究中,以胃或肠提取液中微量元素的量占用于仿生消解的牡蛎或蛤仔样品中微量元素总量的百分数表示生物可给性。表3列出了牡蛎和蛤仔样品中微量元素的生物可给性结果。牡蛎和蛤仔经胃仿生液消解后,Fe的可给性最低(39.9%,22.6%),Cu,Zn和Cd的可给性在59.5%~65.1%之间。牡蛎样品经肠仿生液消解后,Fe,Cu,Zn和Cd的可给性在20.3%~24.1%之间。蛤仔样品经肠仿生液消解后,Cu的可给性最高(36.4%)、Cd的可给性最低(18.2%),而Fe,Zn的可给性基本相同(表3)。牡蛎和蛤仔样品中分别有40.7%和44.7%的Fe留在消解的残渣中,而Cu,Zn和 Cd在残渣中的量仅占总量的12.3%~16.9%。

图3 蛤仔样品仿生提取液中元素的含量Fig.3 Contents of elements in in vitro digestion of clam samples
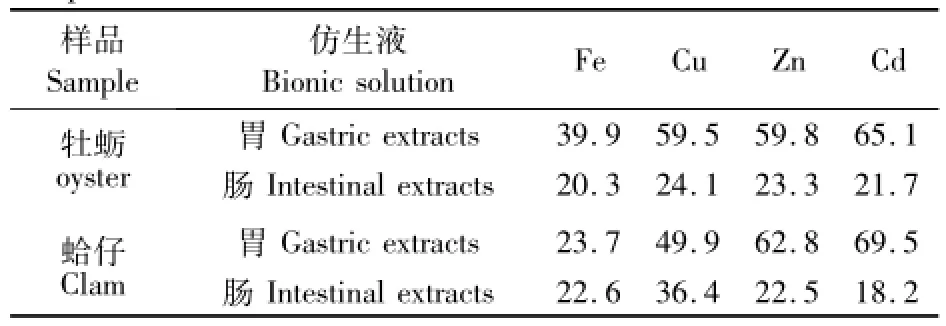
表3 牡蛎和蛤仔样品中元素的生物可给性(%)Table 3 Bioaccessibility of 4 trace elements in oyster and clam samples(%)
文献[18]报道,以单层脂质体为细胞生物膜模型,研究海带和紫菜水煎液中微量金属的形态,经仿生消解后,Fe,Zn等以不同的形态存在。紫菜中Cd的形态分析[19]发现,紫菜经全仿生消解后,Cd以谷胱甘肽-Cd、植物螯合肽-Cd等形态存在。牡蛎和蛤仔样品经全仿生消解后,超过50%的Fe和超过80%的Cu,Zn,Cd从基体上释放出来,可以推断,这些元素也存在不同的形态。消化酶可以通过影响微量金属配合物的配体组成,从而对海带和紫菜中的微量元素的形态分布和生物可给性产生影响[18]。在消化酶的作用下,牡蛎和蛤仔样品产生许多小分子有机物,与金属元素形成配位竞争反应,金属的配位能力也不相同,因此影响微量元素的形态和生物可利用性。本实验结果表明,与仅测定元素的总量相比,测定仿生提取液中微量元素的含量,能更准确地反映通过膳食途径,牡蛎和蛤仔样品中必需元素Fe,Cu,Zn对人体可用量,以及有害元素Cd对食用者的健康危害。
4 结论
牡蛎样品胃提取液中Fe,Cu,Zn,Cd的含量明显高于其在肠提取液中的含量。残渣中Cu,Zn,Cd的含量很低,Fe的含量较高,与胃提取液中的含量相同。蛤仔样品胃、肠提取液和残渣中Fe,Cu,Zn,Cd的含量差异较大。Fe在残渣中的含量最高,Cu,Zn,Cd在胃提取液中的含量最高、在肠提取液和残渣中的含量较低。牡蛎和蛤仔样品经仿生消解后,微量元素胃仿生的生物可给性高于肠仿生的生物可给性。经全仿生消解后,Fe的可给性低,为46%~60%,而Cu,Zn,Cd的可给性比较高,在83%~88%之间。
1 Amiard J C,Amiard-Triquet C,Charbonnier L,Mesnil A,Rainbow P S,Wang W X.Food Chem.Toxicol.,2008,46(6):2010-2022
2 GU Xiang-Fei,LIN Zhi-Hua,DONG Ying-Hui,YAO Han-Han.Chinese Journal of Animal Nutrition,2014,26(12):3850-3857
顾向飞,林志华,董迎辉,姚韩韩.动物营养学报,2014,26(12):3850-3857
3 WANG Dan,ZHAO Yuan-Hui,ZENG Ming-Yong,LIU Zun-Ying,DONG Shi-Yuan.Food Science and Technology,2011,36(3):209-212
王丹,赵元晖,曾名湧,刘尊英,董士远.食品科技,2011,36(3):209-212
4 WANG He-Ya,YANG Rui-Jin,WANG Zhang.Journal of Fisheries of China,2003,27(2):163-168
汪何雅,杨瑞金,王璋.水产学报,2003,27(2):163-168
5 ZHAO Yan-Fang,NING Jin-Song,SHANG De-Rong,ZHAI Yu-Xiu.Guangdong Trace Elements Science,2009,16(9):50-54
赵艳芳,宁劲松,尚德荣,翟毓秀.广东微量元素科学,2009,16(9):50-54
6 Conti M E,Stripeikis J,Finoia M G,Tudino M B.Ecotoxicology,2012,21(4):1112-1125
7 Deudero S,Box A,March D,Valencia J M,Grau A M,Tintore J,Benedicto J.Mar.Pollut.Bull.,2007,54(9):1523-1558
8 Bendell L I.Toxicol.Lett.,2010,198(1):7-12
9 Jovic′M,Onjia A,Stankovic S.Environ.Chem.Lett.,2012,10(1):69-77
10 LI Yu-Feng,GAO Yu-Xi,CHEN Chun-Ying,LI Bo,ZHAO Yu-Liang,CHAI Zhi-Fang.Scientia Sinica Chimica,2009,39(7):580-589
李玉锋,高愈希,陈春英,李柏,赵宇亮,柴之芳.中国科学B辑:化学,2009,39(7):580-589
11 GE Rui-Guang,CHEN Zhuo,SUN Hong-Zhe.Scientia Sinica Chimica,2009,39(7):590-606
葛瑞光,陈卓,孙红哲.中国科学B辑:化学,2009,39(7):590-606
12 Zhang H,Wang Z Y,Yang X,Zhao H T,Zhang Y C,Dong A J,Jing J,Wang J.Food Chemistry,2014,147(15):189-194
13 BragigandV,Berthet B,Amiard J C,Rainbow P S.Food and Chemical Toxicology,2004,42(11):1893-1902
14 Intawongse M,Dean J R.TrAC-Trend.Anal.Chem.,2006,25(9):876-886
15 TANG Xiang-Yu,ZHU Yong-Guan.Journal of Environment and Heath,2004,21(3):183-185
唐翔宇,朱永官.环境与健康杂志,2004,21(3):183-185
16 Oomen A G,Rompelberg C J M,Bruil M A,Dobbe C J G,Pereboom D P K H,Sips A J A M.Arch.Environ.Contam. Toxicol.,2003,44(3):281-287
17Versantvoort C H M.,Oomen A G,van de Kamp E,Rompelberg C J M,Sips A J A M.Food Chem.Toxicol.,2005,43(1):31-40
18 LIN Lu-Xiu,LI Shun-Xing,ZHENG Feng-Ying.Chinese J.Anal.Chem.,2010,38(6):823-827
林路秀,李顺兴,郑凤英.分析化学,2010,38(6):823-827
19 ZHAO Yan-Fang,SHANG De-Rong,NING Jin-Song,ZHAI Yu-Xiu,SHENG Xiao-Feng,ZHANG Ming.Journal of Fisheries of China,2012,36(1):148-152
赵艳芳,尚德荣,宁劲松,翟毓秀,盛晓风,张明.水产学报,2012,36(1):148-152
This work was supported by the Key Projects in the National Science&Technology Pillar Program(No.2009BADB7B02)
Bioaccessibility of Microamount Metal Elements in Oyster and Cam Samples Using in vitro Digestion
WANG Zeng-Huan*,WANG Xu-Nuo,LIN Qin,CHEN Cheng-Tong,CHEN Ying-Na
(Key Lab.of Fishery Ecology Environment,Guangdong Province;South China Sea Fisheries Research Institute,Chinese Academy of Fishery Sciences;Key Lab.of Aquatic Product Processing,Ministry of Agriculture,Guangzhou 510300,China)
A bionic method,in vitro digestion,was used for the pretreatment of oyster and clam samples.The oyster and clam samples were digested at 37℃ under the action of bionic digestive juice including saliva,gastric juice and intestinal juice.The contents of trace metals in in vitro digestion extracts(gastric juice extracts and intestinal juice extracts)were determined by atomic absorption spectrometry.The bioaccessibility of trace metals was assessed using the contents of trace metals in bionic extracts.The results showed that the contents of Fe,Cu,Zn and Cd in gastric juice extracts of in vitro digestion on oysters were higher than those in intestinal juice extracts.The contents of Fe and Cu in gastric juice extracts of in vitro digestion on clam were not obviously different with that of in intestinal juice extracts.Otherwise,the contents of Zn and Cd in gastric juice extracts were much higher than those of in intestinal juice extracts.The bioaccessibility of Fe,Cu,Zn and Cd in oysters using in vitro digestion was 60.2%,83.6%,83.1%and 76.8%,respectively. The bioaccessibility of Fe,Cu,Zn and Cd in clams was 46.3%,86.3%,85.3%and 87.7%,respectively. The results will provide a scientific basis for further researches such as bioaccumulation and bioavailability of trace metal in oysters and clams,evaluation of the health risk of Cd from oyster and clam consumption.
In vitro digestion;Bioaccessibility;Atomic spectrometry;Microamount metal;oyster and clam
18 August 2015;accepted 16 October 2015)
10.11895/j.issn.0253-3820.150655
2015-08-18收稿;2015-10-16接受
本文系国家科技支撑计划课题(No.2009BADB7B02)、农业部水产品加工重点实验室开放基金(No.NYJG201306)、中央级科研院所基本科研业务费专项资金(Nos.2013YD08,2015TS16)资助
*E-mail:zh-wang1211@163.com
