不同品种鸭胚胎期骨骼肌成肌细胞GHR和IGF-1 mRNA表达差异分析
2016-11-01姬改革陶志云朱春红束婧婷刘宏祥徐文娟李慧芳
姬改革,陶志云,朱春红,束婧婷,刘宏祥,徐文娟,胡 艳,李慧芳
(江苏省家禽科学研究所,江苏省家禽遗传育种重点实验室,江苏 扬州 225003)
不同品种鸭胚胎期骨骼肌成肌细胞GHR和IGF-1 mRNA表达差异分析
姬改革,陶志云,朱春红,束婧婷,刘宏祥,徐文娟,胡艳,李慧芳*
(江苏省家禽科学研究所,江苏省家禽遗传育种重点实验室,江苏 扬州 225003)
为探讨生长激素受体(growth hormone receptor,GHR)和胰岛素样生长因子-1(Insulin-like growth factor-1,IGF-1)在不同品种鸭胚胎期骨骼肌成肌细胞中的表达差异。选择生长速度不同的金定鸭和高邮鸭为试验动物,采用实时荧光定量PCR方法检测鸭13,15,17,19,21和23胚龄时胸肌和腿肌成肌细胞GHR,IGF-1 mRNA的表达情况,并进行了品种间比较。结果发现:13胚龄时,高邮鸭胸肌和腿肌成肌细胞IGF-1的表达均显著高于金定鸭(P<0.05);17胚龄是两个品种鸭GHR和IGF-1共同的表达高峰期;17胚龄之后,鸭胸肌和腿肌成肌细胞GHR和IGF-1表达均显著降低。在19,21胚龄时,高邮鸭胸肌成肌细胞2个基因的表达均显著高于金定鸭(P<0.05),而腿肌成肌细胞GHR和IGF-1表达在品种间无显著差异(P>0.05)。鸭胚胸肌和腿肌成肌细胞GHR和IGF-1表达呈现极显著的正线性相关(P<0.01)。提示:GHR和IGF-1的表达谱及各自在品种间的变化规律基本一致;鸭胚骨骼肌成肌细胞GHR和IGF-1 mRNA表达有组织特异性,二者之间可能存在正调控的作用机制。
鸭;胚胎;成肌细胞;GHR;IGF-1
生长激素受体(GHR)和胰岛素样生长因子-1(IGF-1)在动物骨骼肌发育过程中起着重要的调控作用。动物的生长受到生长轴“下丘脑—垂体—靶器官”上的激素及受体组成的神经内分泌系统的调控,生长激素(growth hormone,GH)与IGF-1都是生长轴上的重要因子。GH处于生长轴的中心环节,可以通过与肝脏或肝外组织细胞膜表面的GHR结合,介导产生IGF-1,IGF-1以内分泌或旁分泌与骨骼肌上的受体结合,激活下游的信号因子,启动基因表达,促进蛋白质合成、细胞分裂等;或者不通过IGF-1[1],直接作用于骨骼肌上的GHR发挥其作用。
肌肉的基本单位是肌纤维,是由成肌细胞增殖、分化与融合形成。胚胎期成肌细胞的增殖与分化能力的大小对肌肉产量的提高具有重要意义[2-3]。关于GH对成肌细胞的作用,目前主要集中在哺乳动物。在小鼠中,体内和体外的实验表明,GH可以通过介导IGF-1促进成肌细胞的增殖与融合[4-6];但也有研究认为,GHR可以不通过IGF-1调控成肌细胞的增殖与分化[7]。在鸡上,体内体外的试验表明[8-9],IGF-1可促进成肌细胞的增殖与分化。鸭作为水禽的代表,其生长发育与哺乳动物、鸡等具有不同的特点。有关GHR和IGF-1在鸭成肌细胞的表达变化规律尚未见报道。
在前期研究中我们也已经建立一套完善的分离与培养体系[10],本试验以高邮鸭和金定鸭为研究对象,提取不同时间点鸭胚骨骼肌成肌细胞,采用实时荧光绝对定量分析技术,对GHR和IGF-1的mRNA表达量进行比较分析,初步揭示鸭胚胎期骨骼肌成肌细胞中GHR和IGF-1基因表达的品种差异和时空特点,为提高鸭的肌肉产量,和品种选育等提供可借鉴的遗传学资料。
1 材料与方法
1.1实验动物
在相同的日粮水平下,收集高邮鸭和金定鸭种蛋。种蛋孵化前,进行称量、消毒和编号,品种内蛋质量变异系数在2%以内。2个品种种蛋随机置入同一孵化箱,在相同条件下同时孵化。种蛋入孵后的24 h设定为1胚龄,分别于6个时间点(13,15,17,19,21和23胚龄)取5~8个鸭胚,用于胸肌和腿肌成肌细胞的提取。
1.2主要试剂和仪器
DMEM和FBS购于Hyclone公司;胰蛋白酶,Ⅰ型胶原酶购自Sigma公司;青霉素-链霉素溶液购自碧云天生物技术研究所,Percoll细胞分离液购自北京索莱宝科技有限公司。TRNzol-A+总RNA提取试剂、SuperReal PreMix、Quant cDNA 第一链合成试剂盒、pGM-T克隆试剂盒、质粒小提试剂盒、DNA产物纯化回收试剂盒购自TIANGEN公司;DNA Marker DL2000为TaKaRa公司产品。倒置显微镜(日本尼康公司);9700PCR仪和Max3000P荧光定量PCR仪(爱普拜斯应用生物系统上海有限公司);凝胶成像系统(Tanon 2500);紫外分光光度计(GeneQuant Ⅱ,Pharmacia Biotech)。
1.3鸭胚胎期骨骼肌原代成肌细胞的提取
无菌分离鸭胚胸肌和腿肌,用PBS清洗,去除脂肪及筋膜后,将肌肉剪为肉糜,加入1倍体积的混合酶(胶原酶和胰蛋白酶)消化5~10 min,用FBS终止消化。被消化下来的细胞经不同孔径的滤膜(50目~400目)过滤后,500 g离心10 min,去上清,细胞团重悬在DMEM培养基中。将重悬的细胞液加入到含60%,20% Percoll的不连续密度梯度Percoll柱中,800 g,离心25 min。小心取出60%和20% Percoll两层之间的云雾状细胞至新的离心管。添加少量DMEM并混匀,500 g离心10 min,弃上清,用适量DMEM液悬浮,吸管吹吸,将细胞团块吹散,计数后将所得成肌细胞调整单细胞悬液密度为106cells·mL-1。
1.4总RNA提取和cDNA合成
将所得的单细胞悬液分装至2 mL离心管中,每管1 mL,每个时间点分装6~8管。500 g离心5 min后,去上清。将所得的细胞沉淀加入1 mL Trizol裂解液,保存在-20℃,用于总RNA提取。成肌细胞总RNA 提取,按总RNA提取试剂盒的说明书进行。所得的RNA用DEPC水溶解后,用1.4%琼脂糖凝胶电泳和紫外分光光度计检测纯度和含量,保证RNA样品质量可靠,计算样品总RNA浓度。经检测合格的总RNA样品,取1 μg按照反转录试剂盒的使用说明书进行cDNA 第1链的合成。用内参基因β-actin检测cDNA合成质量以及是否有基因组DNA污染。RT产物保存在-20℃用于PCR检测。
1.5引物设计、目的片段标准品的制备
根据GenBank中相关序列设计引物,由上海英骏生物工程有限公司合成(表1)。PCR产物经2%琼脂糖凝胶鉴定后,用DNA产物纯化回收试剂盒纯化回收目的片段,与pGM-T载体相连接,然后转化Escherichia coli TOP10感受态细胞,挑取转化子于含氨苄抗性的LB液体培养基中,37℃,200 r·min-1振摇培养过夜,用PCR鉴定。将鉴定正确的质粒送上海生工生物工程技术服务有限公司进行序列测定,所获序列结果在NCBI网站中用Blast程序与数据库中公布的已知基因进行序列同源性比较。比对正确后,用质粒小提试剂盒提取阳性克隆的质粒,用分光光度计测其浓度后作为标准品备用。
1.6荧光实时定量PCR
所用荧光定量PCR采用SYBR Green Ⅰ法。将上述经测序验证后正确的含GHR,IGF-1基因的标准质粒,分别做10n梯度稀释。将每个待测样品RT产物取等体积混合,用混合样(cDNA mix)和梯度稀释的标准品进行反应条件的优化,包括标准品稀释梯度范围、目的基因和内参基因引物设计和合成、最佳退火温度、引物浓度、模板浓度等,确定好最佳反应条件。根据最佳反应条件,将待测样品进行稀释。将稀释后的样品与梯度稀释的标准品在同一个试验中进行定量PCR,每次反应均设阴性对照,每个样品设置3个重复。根据标准品构建的标准曲线(标准曲线由系统软件自动分析获得)计算出待测样品目的基因的拷贝数。
表1基因引物序列
Table 1The primer sequences of the target genes
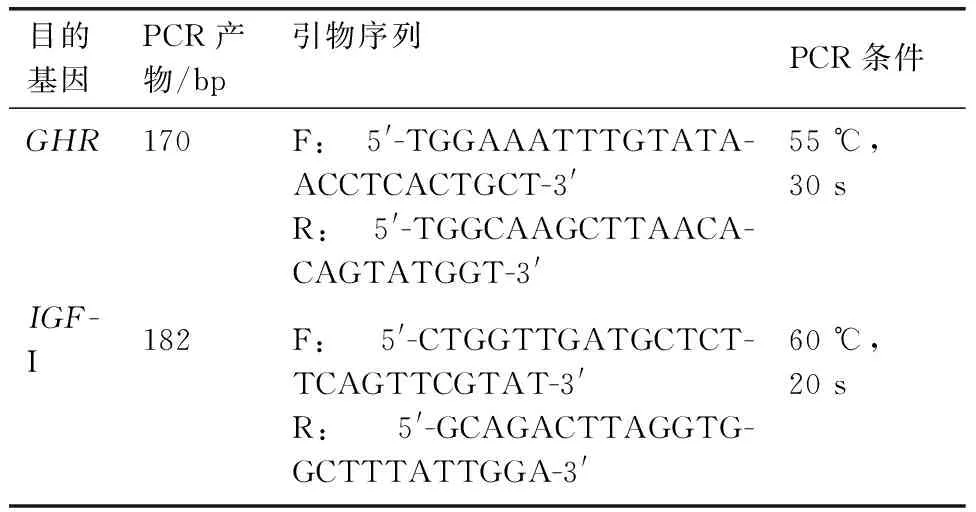
目的基因PCR产物/bp引物序列PCR条件GHR170F:5'-TGGAAATTTGTATA-ACCTCACTGCT-3'R:5'-TGGCAAGCTTAACA-CAGTATGGT-3'55℃,30sIGF-I182F:5'-CTGGTTGATGCTCT-TCAGTTCGTAT-3'R:5'-GCAGACTTAGGTG-GCTTTATTGGA-3'60℃,20s
1.7统计分析
运用SPSS 20.0软件中One-way ANOVA,t 检验,Univarinate,Bivariate Correlation进行差异显著性检验和相关性分析。所有数据以Mean ± SE表示,P<0.05,表示差异显著;P<0.01,表示差异极显著。
2 结果与分析
2.1鸭胚胸肌成肌细胞GHR,IGF-1表达
鸭胚胸肌成肌细胞GHR表达情况如图1-A所示,GHR mRNA表达在2个品种的变化规律基本一致,都是13胚龄表达较高,15胚龄时表达下降,17胚龄时表达上升到最高,显著高于其他胚龄(P<0.05),随后表达开始下降,至23胚龄时,表达量又有所上升。不同的是,高邮鸭19,21胚龄时的基因表达量与23胚龄无显著差异,金定鸭的则是显著低于23胚龄(P<0.05)。品种间比较,17胚龄时,金定鸭基因表达量极显著高于高邮鸭(P<0.01),而19~21胚龄时,则是高邮鸭的显著高于金定鸭(P=0.009,P=0.002)。胸肌成肌细胞GHR mRNA 表达存在极显著的日龄(P<0.01)、日龄与品种的交互效应(P=0.002),品种效应不显著(P=0.689)。
鸭胚胸肌成肌细胞IGF-1的表达如图1-B所示,2个品种的IGF-1 mRNA变化趋势基本一致,都是在13,15胚龄时表达较高,17胚龄的表达量显著高于其他胚龄(P<0.05),19胚龄时,表达显著下调,之后至21~23胚龄时,又逐渐回升;但高邮鸭13胚龄时的表达量与17胚龄无显著差异(P=0.769),金定鸭的则是13胚龄表达显著低于17胚龄(P<0.05)。品种间比较,13,19,21胚龄时,高邮鸭IGF-1基因表达显著高于金定鸭(P<0.01),与之相反,17胚龄时金定鸭的显著高于高邮鸭(P<0.01)。胸肌成肌细胞IGF-1 mRNA 表达存在极显著的日龄(P<0.01)、日龄与品种的交互效应(P<0.01),品种效应不显著(P=0.662)。
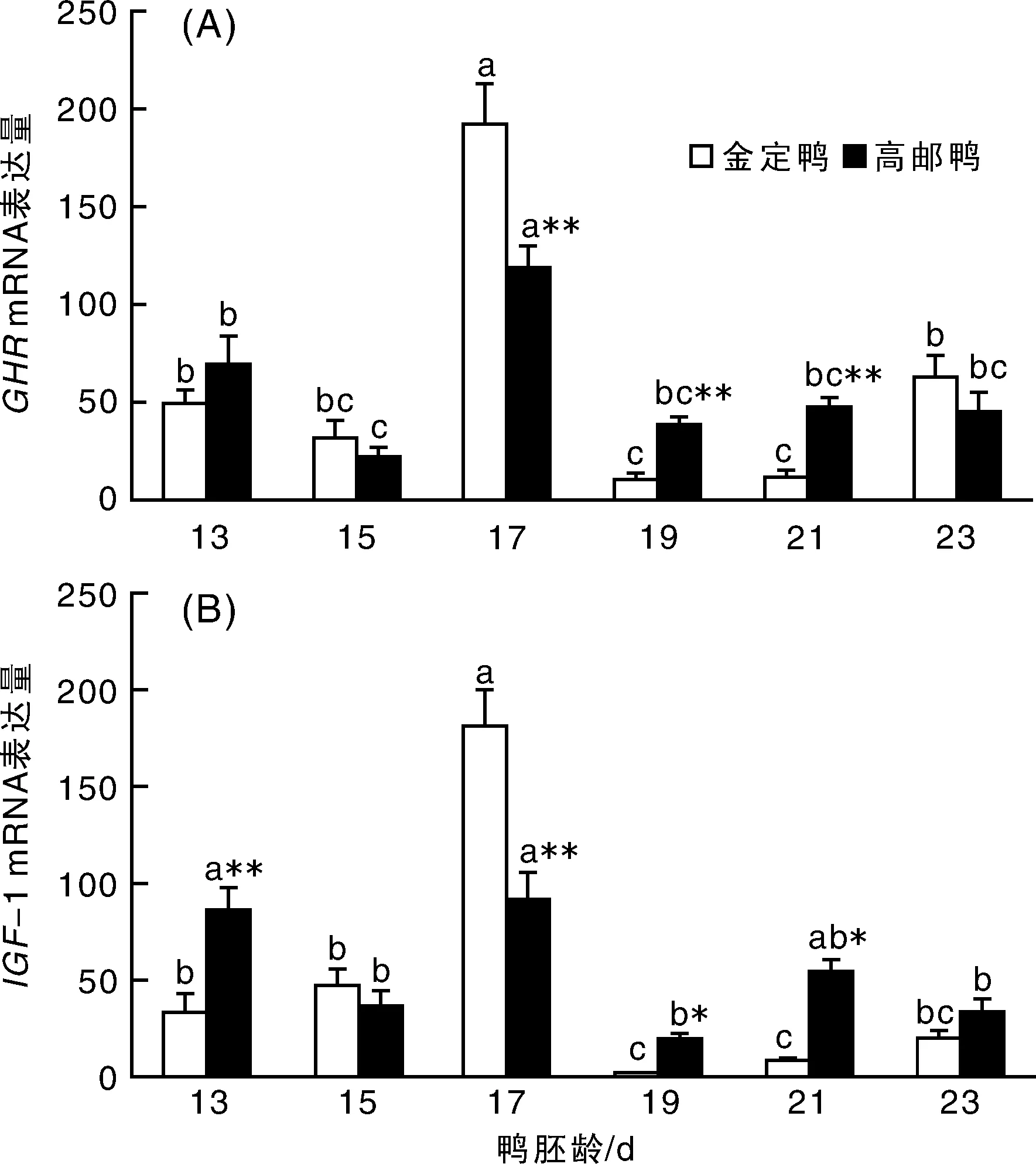
A:GHR表达量变化;B:IGF-1表达量变化。*表示同胚龄品种间差异显著(P<0.05);**表示同胚龄的种间差异极显著(P<0.01)。柱形图上字母不同者表示同一品种不同胚龄之间差异显著(P<0.05)。图2同。图1 鸭胚胸肌成肌细胞GHR,IGF-1 mRNA表达量变化Fig.1 The profiles of GHR and IGF-I mRNA expression in breast myoblast of different duck breeds
2.2鸭胚腿肌成肌细胞GHR,IGF-1表达
鸭胚腿肌成肌细胞GHR表达情况如图2-A所示,GHR mRNA表达在2个品种的变化规律基本一致,17胚龄是表达的高峰期,显著高于其他胚龄(P<0.05);其他胚龄的表达趋于平缓,相互之间无显著差异(P>0.05)。品种间比较,17胚龄时,金定鸭基因表达量显著高于高邮鸭(P<0.01)。GHR mRNA表达存在显著的日龄(P<0.01)、品种效应(P<0.05)及日龄与品种的交互效应(P<0.01)。
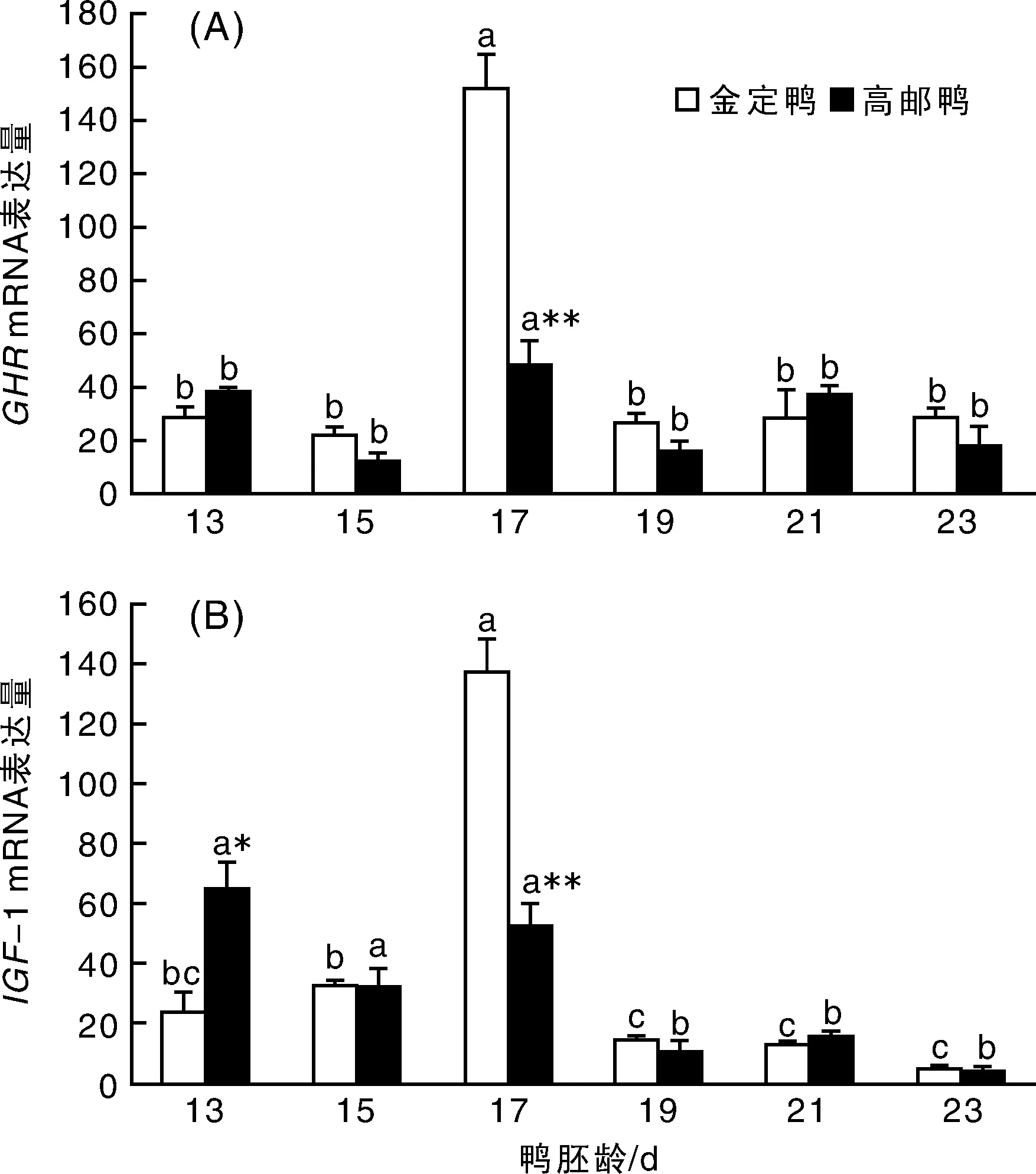
图2 鸭胚腿肌成肌细胞GHR,IGF-1 mRNA表达量变化Fig.2 The profiles of GHR and IGF-I mRNA expression in leg myoblast of different duck breeds
鸭胚腿肌成肌细胞IGF-1的表达如图2-B所示,2个品种的IGF-1 mRNA表达变化规律基本一致,都是13,15胚龄时表达较高,至17胚龄时,上升至最高(P<0.05),19胚龄时则显著下调,并持续至23胚龄;但高邮鸭13胚龄的基因表达量与17胚龄无显著差异(P=0.506)。品种间比较,13胚龄时,高邮鸭的表达量高于金定鸭的2倍之多(P<0.05),17胚龄则相反(P<0.01)。IGF-1 mRNA 表达存在极显著的日龄效应(P<0.01)、日龄与品种的交互效应(P<0.01),品种效应不显著(P=0.356)。
2.3鸭不同品种成肌细胞GHR与IGF-1表达的相关性
表2表明,2个品种的胸肌成肌细胞GHR与IGF-1 mRNA的表达呈极显著的正线性相关(r=0.899,P<0.01;r=0.862,P<0.01);金定鸭腿肌成肌细胞GHR与IGF-1 mRNA表达的相关性(r=0.951,P<0.01)略高于高邮鸭(r=0.784,P<0.01)。
表2成肌细胞GHR,IGF-1 mRNA表达量的相关性分析
Table 2Correlation analysis between GHR and IGF-1 mRNA expression in myoblast
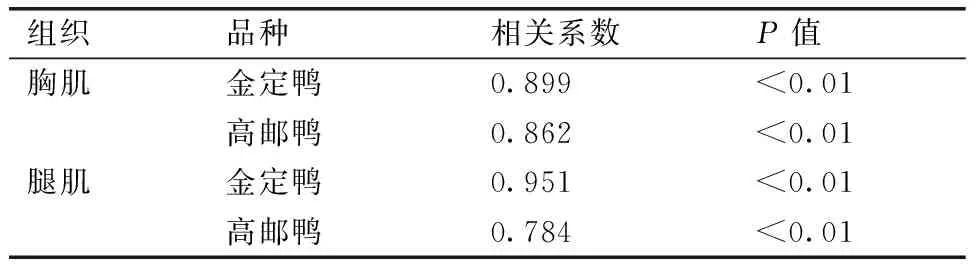
组织品种相关系数P值胸肌金定鸭0.899<0.01高邮鸭0.862<0.01腿肌金定鸭0.951<0.01高邮鸭0.784<0.01
3 讨论
GH要与骨骼肌上GHR结合,才能发挥生物学作用。因此,动物的生长速度及各器官发育的优先顺序,很大程度上要受骨骼肌上的GHR及与之相关的基因表达的时空特异性影响。为了揭示成肌细胞GHR和IGF-1 mRNA的变化规律,选择生长发育存在明显表型差异的金定鸭和高邮鸭为试验动物,检测了鸭胚骨骼肌成肌细胞GHR和IGF-1 mRNA的表达,并进行了品种间比较。结果发现,成肌细胞GHR和IGF-1 mRNA各自的发育性表达变化特征在品种间基本一致,与之前肌肉中的研究结果相似[11-12]。17胚龄是GHR和IGF-1 mRNA共同的表达高峰期,基因的表达升高[7,13],会促进成肌细胞向分化的方向转变[7,13],这个时期可能是成肌细胞分化的高峰期,也是肌纤维数量形成的高峰期。17胚龄之后,高邮鸭胸肌成肌细胞GHR mRNA的表达趋于平稳,且在19,21胚龄时,显著高于金定鸭;IGF-1的表达与之类似,推测在17胚龄之后,高邮鸭胸肌成肌细胞增殖与分化活性高于金定鸭,最终导致在25胚龄时,高邮鸭的胸肌质量显著高于金定鸭[14]。腿肌成肌细胞GHR,IGF-1 mRNA表达则在各胚龄间无显著差异,与胚胎发育后期,腿肌重[14]、肌纤维直径、面积等[15]在品种间无显著差异相对应。
Mavalli等[5]在小鼠上研究认为,GH主要是通过与靶器官上的GHR结合,介导成肌细胞产生IGF-1,促进成肌细胞分化为肌管。也有报道指出,GH促进成肌细胞的分化,不是通过介导IGF-1来实现的[7]。本试验结果显示,胸肌和腿肌成肌细胞GHR表达与各自的IGF-1表达规律基本一致,呈正相关,提示GHR的表达可能发挥着正调控作用,通过调节IGF-1的表达来调节成肌细胞向增殖或分化的方向转变。GHR表达量低时,IGF-1的表达量维持在低水平,大量成肌细胞更多地进入到G2/M期,使该时期所占时相增加,向增殖方向转变;GHR表达升高,介导IGF-1表达升高,促进成肌细胞向分化转变,基因表达量的变化,对应于成肌细胞增殖与分化转变[15]。因此,17胚龄之后,随着基因的表达显著下调,成肌细胞更多地向增殖方向转变,相应的肌纤维密度下降[16]。
13胚龄时,胸肌成肌细胞GHR表达在品种间无显著差异,但IGF-1表达是高邮鸭显著高于金定鸭,且与17胚龄时的高邮鸭IGF-1表达无显著差异。同样的情况也出现在腿肌成肌细胞IGF-1的表达上,说明高邮鸭骨骼肌成肌细胞比金定鸭多了一个13胚龄IGF-1的表达高峰期。由于IGF-1可以促进成肌细胞的分化,可能高邮鸭比金定鸭多了一个成肌细胞分化的高峰期。尽管高邮鸭胸肌和腿肌成肌细胞都存在13胚龄的表达高峰期,但13胚龄时仅有胸肌质量表现出品种差异[14],这可能与胸肌和腿肌成肌细胞表面分布的IGF-1受体数量不同有关[17]。
在鸡上的研究认为,禽类胚胎期血液中IGF-1主要来源于肝外其他组织[18-19]。在鸭上,13胚龄时,已检测到肝脏中IGF-1 mRNA表达,并且呈现极显著的品种差异[20],与13胚龄时,成肌细胞IGF-1 mRNA表达出现品种差异相一致。IGF-1作为一种内分泌和旁分泌激素,鸭胚胎期骨骼肌成肌细胞IGF-1的分泌,可能受到肝源性IGF-1的影响,可能是使骨骼肌发育表现出品种差异的因素之一。Ge等[21]在牛成肌细胞上的研究认为,GH对成肌细胞的影响具有物种依赖性。在鸭上,GH是否通过介导IGF-1调节成肌细胞的增殖与分化,是课题组下一步的研究重点。
本研究通过检测鸭胚成肌细胞GHR和IGF-1 mRNA表达,初步证实二者表达品种效应不显著,在胸肌和腿肌成肌细胞存在不同的表达模式;GHR可能通过正调控IGF-1的表达来调节成肌细胞向增殖或分化的方向转变。
[1]LUPU F,TERWILLIGER J D,LEE K,et al.Roles of growth hormone and insulin-like growth factor 1 in mouse postnatal growth [J].Developmental Biology,2001,229(1):141-162.
[2]DU M,YAN X,TONG J F,et al.Maternal obesity,inflammation,and fetal skeletal muscle development [J].Biology of Reproduction,2010,82(1):4-12.
[3]PICARD B,LEFAUCHEUR L,BERRI C E C,et al.Muscle fibre ontogenesis in farm animal species [J].Reproduction Nutrition Development,2002,42(5):415-432.
[4]SADOWSKI C L,WHEELER T T,WANG L H,et al.GH regulation of IGF-I and suppressor of cytokine signaling gene expression in C2C12 skeletal muscle cells [J].Endocrinology,2001,142(9):3890-3900.
[5]MAVALLI M D,DIGIROLAMO D J,FAN Y,et al.Distinct growth hormone receptor signaling modes regulate skeletal muscle development and insulin sensitivity in mice [J].Journal of Clinical Investigation,2010,120(11):4007-4020.
[6]FROST R A,NYSTROM G J,LANG C H.Regulation of IGF-I mRNA and signal transducers and activators of transcription-3 and-5 (Stat-3 and-5) by GH in C2C12 myoblasts [J].Endocrinology,2002,143(2):492-503.
[7]SOTIROPOULOS A,OHANNA M,KEDZIA C,et al.Growth hormone promotes skeletal muscle cell fusion independent of insulin-like growth factor 1 up-regulation [J].Proceedings of the National Academy of Sciences of the United States of America,2006,103(19):7315-7320.
[8]SATO K,AOKI M,KONDO R,et al.Administration of insulin to newly hatched chicks improves growth performance via impairment of MyoD gene expression and enhancement of cell proliferation in chicken myoblasts [J].General and Comparative Endocrinology,2012,175(3):457-463.
[9]SCHMID C,STEINER T,FROESCH E R.Preferential enhancement of myoblast differentiation by insulin-like growth factors (IGF Ⅰ and IGF Ⅱ) in primary cultures of chicken embryonic cells [J].FEBS Letters,1983,161(1):117-121.
[10]SHAN Y J,SHU J T,SONG C,et al.Culture and Identification of Myoblasts Isolated from Duck Embryos [J].Agricultural Science &Technology,2014,15(8):1281-1284.
[11]徐文娟,单艳菊,束婧婷,等.鸭胚骨骼肌GHR基因表达与生长发育的关系[J].江苏农业学报,2013,29(1):126-130.
[12]单艳菊,顾华兵,宋卫涛,等.不同鸭种胚胎期和岀雏早期肌肉组织中IGF-Ⅰ基因mRNA的差异表达分析[J].西北农林科技大学学报(自然科学版),2013(3):1-6.
[13]TOLLEFSEN S E,LAJARA R,MCCUSKER R H,et al.Insulin-like growth factors (IGF) in muscle development.Expression of IGF-I,the IGF-I receptor,and an IGF binding protein during myoblast differentiation [J].Journal of Biological Chemistry,1989,264(23):13810-13817.
[14]HU Y,LIU H,SHAN Y J,et al.The relative expression levels of insulin-like growth factor 1 and myostatin mRNA in the asynchronous development of skeletal muscle in ducks during early development [J].Gene,2015,567(2):235-243.
[15]岑石强,张峻梅,黄富国,等.IGF-1 促原代人胚骨骼肌成肌细胞体外增殖与分化的研究[J].中国修复重建外科杂志,2008,22(1):84-87.
[16]单艳菊,束婧婷,胡艳,等.不同鸭种肌纤维早期发育特性及其与骨骼肌生长发育的相关性研究[J].农业生物技术学报,2014,22(2):225-231.
[17]OUDIN A,CHEVALIER B,SIMON J,et al.Muscle insulin-like growth factor-I (IGF-I) receptors in chickens with high or low body weight:effects of age and muscle fibre type [J].Growth Hormone &IGF Research,1998,8(3):243-250.
[18]LU F Z,WANG X X,PAN Q X,et al.Expression of genes involved in the somatotropic,thyrotropic,and corticotropic axes during development of Langshan and Arbor Acres chickens [J].Poultry Science,2008,87(10):2087-2097.
[19]PABLO F D,ROBICS H L,CALDES T,et al.Insulin-like growth factor-I and insulin as growth and differentiation factors in chicken embryogenesis [J].Poultry Science,1991,70(8):1790-1796.
[20]胡艳,宋迟,宋卫涛,等.鸭发育早期肝脏IGF-1 mRNA的表达特异性及其与体质量的相关性分析[J].南京农业大学学报,2013,36(6):95-99.
[21]GE X,YU J,JIANG H.Growth hormone stimulates protein synthesis in bovine skeletal muscle cells without altering insulin-like growth factor-Ⅰ mRNA expression [J].Journal of Animal Science,2012,90(4):1126-1133.
(责任编辑卢福庄)
The expression analysis of GHR and IGF-1 mRNA in embryonic skeletal muscle myoblasts of different duck breeds
JI Gai-ge,TAO Zhi-yun,ZHU Chun-hong,SHU Jing-ting,LIU Hong-xiang,XU Wen-juan,HU Yan,LI Hui-fang*
(Jiangsu Provincial Key Laboratory of Poultry Heredity &Breeding,Jiangsu Institute of Poultry Science,Yangzhou 225003,China)
To investigate the expression patterns of growth hormone receptor (GHR) and insulin-like growth factor-1 (IGF-1) in duck skeletal muscle myoblasts,fluorescent real-time quantitative PCR was used to detect the distribution profile of GHR and IGF-I mRNA in skeletal muscle myoblasts of Jinding and Gaoyou ducks at the embryonic day 13,15,17,19,21 and 23.The results showed that the expressions of IGF-1 of Gaoyou ducks in breast and leg muscle myoblasts were significantly higher than that of Jinding ducks at embryonic day 13 (P<0.05);the embryonic day 17 was the common expression peak of GHR and IGF-1 both in Gaoyou ducks and Jinding ducks;and then,significantly decreased.But at the embryonic day 19 and 21,the expressions of GHR and IGF-1 in Gaoyou ducks breast muscle myoblasts were significantly higher than those of Jinding ducks (P<0.05),while there was no significant difference between varieties in the leg muscle myoblasts (P>0.05).The expression of GHR had a significantly linear positive correlation with the expression of IGF-1 in breast and leg muscle myoblasts(P<0.01).The results showed that the expression pattern of GHR was consistent with the expression of IGF-1 between breeds;the expressions of GHR and IGF-1 mRNA in the skeletal muscle myoblasts of duck embryo showed tissue specificity,and there might be a positive regulation mechanism between them.
duck;embryo;myoblasts;GHR;IGF-1
浙江农业学报Acta Agriculturae Zhejiangensis,2016,28(3):406-411http://www.zjnyxb.cn
姬改革,陶志云,朱春红,等.不同品种鸭胚胎期骨骼肌成肌细胞GHR和IGF-1 mRNA表达差异分析[J].浙江农业学报,2016,28(3):406-411.
10.3969/j.issn.1004-1524.2016.03.08
2015-08-28
国家自然科学基金资助项目(31172194);江苏省科技支撑计划项目(BE2014362);扬州市农业前瞻性研究资助项目(YZ2014142)
姬改革(1985—),女,河南洛阳人,硕士,助理研究员,从事家禽遗传育种与资源保护研究。E-mail:jigaige@126.com
,李慧芳,E-mail∶lhfxf_002@aliyun.com
S834+.8
A
1004-1524(2016)03-0406-06
