姜黄素抗肾纤维化的分子生物学机制实验研究*
2016-11-01朱方强陈民佳赵洪雯余荣杰吴雄飞
朱方强,陈民佳,朱 明,徐 祥,赵洪雯,刘 宏,余荣杰,吴雄飞,黄 宏△
(1.第三军医大学大坪医院野战外科研究所第一研究室/创伤、烧伤与复合伤国家重点实验室,重庆 400042;2.第三军医大学西南医院肾内科,重庆 400038)
·论著·doi:10.3969/j.issn.1671-8348.2016.26.001
姜黄素抗肾纤维化的分子生物学机制实验研究*
朱方强1,陈民佳1,朱明1,徐祥1,赵洪雯2,刘宏2,余荣杰2,吴雄飞2,黄宏1△
(1.第三军医大学大坪医院野战外科研究所第一研究室/创伤、烧伤与复合伤国家重点实验室,重庆 400042;2.第三军医大学西南医院肾内科,重庆 400038)
目的探讨姜黄素抗肾纤维化的分子生物学机制,为临床治疗提供可靠的实验依据。方法以人肾小管上皮细胞(HKC)为研究对象,采用不同浓度的姜黄素(0、0.780、1.563、3.125、6.250、12.500、25.000、50.000和100.000 μmol/L)刺激HKC 72 h,倒置相差显微镜下观察细胞形态变化,并应用MTT比色法检测姜黄素对HKC生长的影响;应用不同浓度TGF-β1(0、1、5、10 ng/mL)单独或联合姜黄素(6.250、12.500、25.000、50.000 μmol/L和100.000 μmol/L)共同刺激HKC细胞72 h,观察细胞形态变化,应用逆转录PCR(RT-PCR)检测TGF-β1、骨形态发生蛋白-7(BMP-7)和Ⅰ型胶原基因表达变化。结果HKC贴壁生长,呈铺路石样外观。姜黄素刺激对细胞形态无影响;TGF-β1刺激能明显促进细胞由上皮样形态向纤维样细胞形态转化,且发生形态转变的细胞数量和TGF-β1基因表达呈TGF-β1浓度依赖性增加(P<0.05,P<0.01);MTT结果显示:姜黄素在3.125~25.000 μmol/L浓度范围内,能显著促进HKC增殖(P<0.05,P<0.01);姜黄素能对抗TGF-β1诱导的细胞形态转变,以12.500~50.000 μmol/L的姜黄素作用最明显,同时,下调TGF-β1基因和蛋白的表达,相反上调BMP-7基因和蛋白表达,并伴随着Ⅰ型胶原基因和蛋白的表达下降(P<0.05,P<0.01)。 结论姜黄素能促进HKC增殖并维持其表型,能对抗TGF-β1诱导的HKC向梭形细胞转化,抑制细胞上皮TGF-β1和Ⅰ型胶原的表达,而促进BMP-7表达。
肾疾病;纤维化;转化生长因子β;姜黄素;骨形态发生蛋白-7;Ⅰ型胶原
大量研究已证实,TGF-β1是促进各种肾脏疾病纤维化以及移植肾纤维化密切相关的一种细胞因子,是诱导肾小管上皮细胞(HKC)向间质细胞的转化(epithelial-to-mesenchymal transition,EMT)的关键诱因[1-2]。而骨形态发生蛋白-7(bone morphogenetic proteins-7,BMP-7)是肾脏或其他脏器TGF-β1的内源性拮抗剂,是细胞内TGF-β1信号的竞争者,它不仅能对抗TGF-β1诱导的小管细胞增殖抑制,也是维持小管上皮细胞功能和表型的关键细胞因子。此外,研究证实BMP-7能逆转由TGF-β1诱导的EMT而抑制肾脏上皮管状细胞转化成间质细胞,促进小管上皮细胞生长,恢复损伤的肾小管的功能的作用,减少肾脏纤维化的Ⅰ型胶原产生[3-5]。目前研究证实,姜黄素具有抗肺、肝、肾纤维化作用,但其抗肾纤维化作用的机制并不十分清楚[6-8]。笔者推测姜黄素的抗纤维化作用可能与姜黄素对HKC生长,以及对TGF-β1和BMP-7基因表达的影响有关。为此,本实验欲通过体外实验探讨姜黄素抗肾纤维化的分子生物学机制。
1 材料与方法
1.1试剂与仪器人肾小管上皮细胞株(human kidney cells,HKCs)购于中国科学院;TGF-β1、姜黄素、四甲基偶氮唑盐(MTT)和胰酶(Sigma);RT-PCR试剂盒购自TaKaRa公司;DMEM 培养基和优质胎牛血清(Hyclone)。
1.2方法
1.2.1姜黄素对HKC增殖的影响采用MTT比色分析法检测细胞增殖。HKC用含10%优质胎牛血清的高糖DMEM培养,将细胞接种于96孔板,加入不同浓度姜黄素:0.780、1.563、3.125、6.250、12.500、25.000、50.000、100.000、200.000 μmol/L,每组设5个平行孔及空白对照孔,培养2 h后吸弃上清液,加入20 μL MTT(5 g/L PBS),再培养4 h,弃上清液,加入DMSO 溶液100 μL作用10 min,不停振荡,用自动酶联检测仪测定波长492 nm的吸光度(A)值。A值越高表明细胞增殖活性越强。
1.2.2TGF-β1对HKC细胞TGF-β1和BMP-7蛋白表达的影响将传代的HKC接种于6孔板,实验分4组,正常对照组和不同浓度的TGF-β1(1、5、10 ng/mL)刺激组,作用72 h后,倒置显微镜下观察细胞形态变化,收集细胞,提取RNA,采用RT-PCR检测TGF-β1基因表达。
1.2.3TGF-β1和姜黄素联合作用对HKC细胞 TGF-β1、BMP-7和Ⅰ型胶原基因和蛋白表达的影响将培养传代的HKC接种于6孔板内,实验分7组,正常对照组(仅加培养基),单纯TGF-β1刺激组(5 ng/mL),其余组为5 ng/mL TGF-β1联合不同浓度姜黄素联合处理(6.250、12.500、25.000、50.000和100.000 μmol/L)72 h后,倒置显微镜下观察细胞形态变化,收集细胞,提取总RNA,通过逆转录PCR(RT-PCR)和蛋白免疫印迹法(Wersten blot)检测肾小管上皮TGF-β1、BMP-7和Ⅰ型胶原基因和蛋白的表达。
1.2.4PCR检测采用异硫氢酸胍一步法提取成纤维细胞总RNA,紫外分光光度计测定浓度,取三磷酸甘油醛脱氢酶(GAPDH)为内对照基因。采用RT-PCR对转录产物进行扩增。所用引物如下:人TGF-β1(339 bp),P1:5′-GGG ACT ATC CAC CTG CAA GA-3′,P2:5′-CGG AGC TCT GAT GTG TTG AA-3′;人BMP-7(304 bp),P1:5′-ATG TTC ATG CTG GAC CTG TAC-3′,P2:5′-GGA TGT AGT CCT TGT AGA TCC-3′;Ⅰ型胶原(α1链,214 bp),P1:5′-CCA AAT CTG TCT CCC CAG AA-3′,P2:5′-TCA AAA ACG AAG GGG AGA TG-3′;GAPDH(591 bp),P1:5′-GGC AAA TTC CAT GGC ACC GTC -3′,P2:5′-TTC TAG ACG GCA GGT CAG GTC-3′。取PCR反应产物10 μL在1×电泳缓冲液Tris-乙酸(TAE)制备2.0%琼脂糖凝胶中电泳,加入浓度为0.5 μg/mL的溴化乙啶(EB)染色,取10 μL PCR产物,用DL2000做分子量标准来判断PCR产物片段大小,恒压5 V/cm电泳,然后用凝胶扫描仪观察并扫描。实验结果以检测条带与GAPDH条带的总灰度值的比值(IOD)作为检测目的片段的相对值。
1.2.5Wersten blot检测HKC细胞TGF-β1和BMP-7基因以及Ⅰ型胶原蛋白表达HKCs经不同浓度TGF-β1单独或联合姜黄素处理72 h后,提取细胞蛋白,BCA法测定蛋白质浓度。各组取等量总蛋白上样,经SDS-PAGE电泳后转膜至PVDF膜,5%脱脂牛奶-PBS封闭后,分别加入一抗:TGF-β1、BMP-7和Ⅰ型胶原(均为1∶500稀释),β-actin (1∶5 000稀释),4 ℃摇床上孵育过夜。次日洗膜,加入二抗(羊抗兔,1∶10 000稀释),室温孵育2~3 h。洗膜后,采用辣根过氧化物酶标记的增强型化学发光法显色,显影于X线片上。采用Lab Works 4.6软件对目的条带和β-actin条带行灰度值分析,计算两者比值代表目的蛋白表达的相对量。
2 结 果
2.1不同浓度姜黄素和TGF-β1共同作用对HKC细胞形态变化的影响HKC为贴壁生长细胞,呈铺路石样外观。单纯姜黄素作用对HKC细胞形态无明显影响,高浓度姜黄素100.000 μmol/L刺激能使HKC细胞之间的黏附性下降,部分细胞呈梭形改变,部分细胞分离、悬浮,见图1。不同浓度TGF-β1(1、5、10 ng/mL)刺激HKC,都能显著促进HKC由上皮样形态向梭形样形态转化,并且细胞生长缓慢,少部分细胞脱落、悬浮,随着TGF-β1浓度和刺激时间的增加,发生形态转化的细胞数量也增加。当姜黄素和TGF-β1共同作用时,随着姜黄素浓度(6.250、12.500、25.000、50.000、100.000 μmol/L)的增加,细胞向梭形形态转化的数量逐渐减少。当姜黄素浓度为12.500~50.000 μmol/L(B、C、D组)时,绝大部分小管上皮细胞维持着上皮样形态(鹅卵石形),细胞间连接紧密,并且细胞数量较多。由此表明姜黄素在一定的浓度范围内能够对抗TGF-β1 诱导的HKC向梭形样形态细胞转化,而维持肾小管上皮形态特征(图1)。
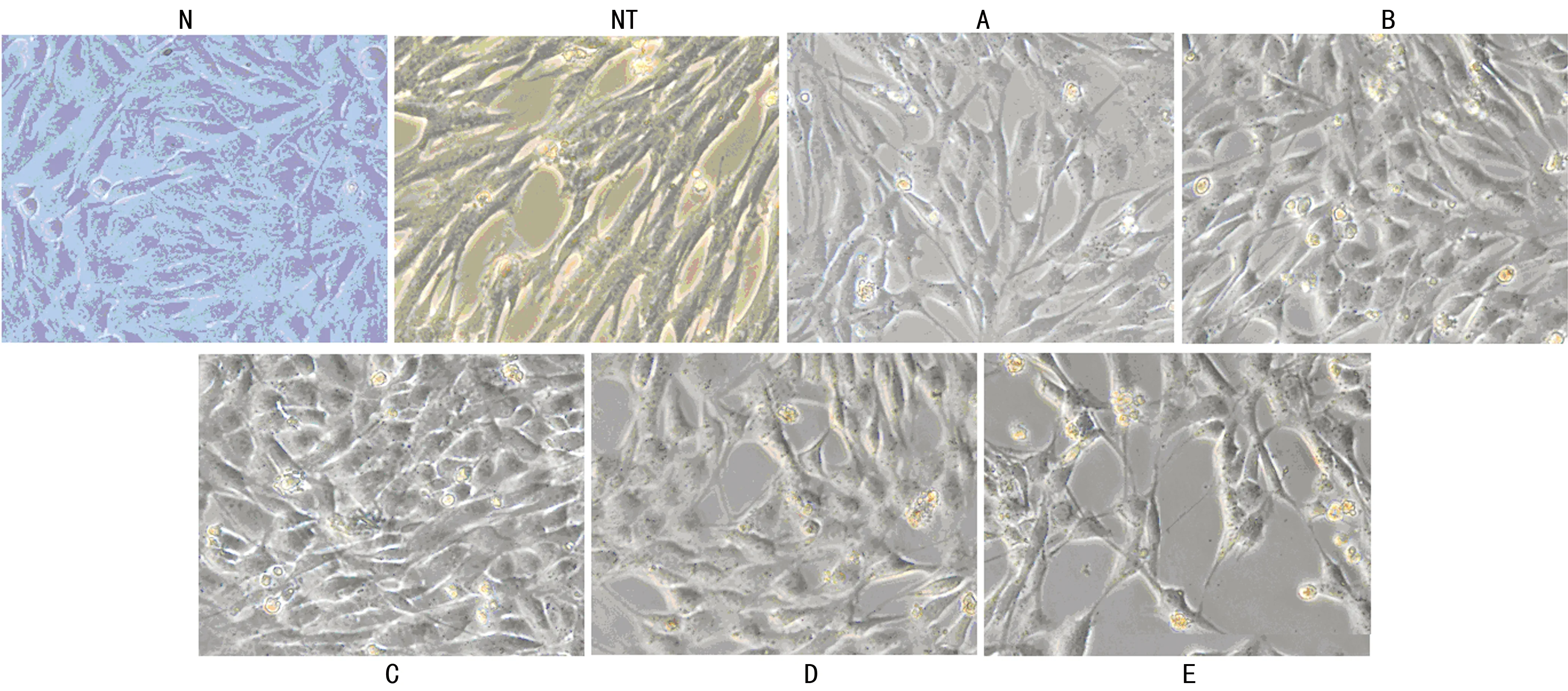
N:正常对照组;NT:单纯TGF-β1(5 ng/mL)刺激组;A:姜黄素6.25 μmol/L+TGF-β1 5 ng/mL;B:姜黄素12.5 μmol/L+TGF-β1 5 ng/mL;C:姜黄素25 μmol/L+TGF-β1 5 ng/mL;D:姜黄素50 μmol/L+TGF-β1 5 ng/mL;E:100 μmol/L+TGF-β1 5 ng/mL。刺激72 h后,倒置显微镜下观察细胞形态变化(×200)。
图1不同浓度姜黄素和TGF-β1共同作用对HKC细胞形态变化的影响
2.2姜黄素对HKC细胞增殖的影响MTT检测结果显示:与对照组比较(图2),0.780、1.563 μmol/L姜黄素刺激HKC对细胞增殖活性没有显著影响(P>0.05),但在3.125~25.000 μmol/L浓度范围内,姜黄素能显著促进HKC增殖(P<0.05),6.250 μmol/L时,HKC增殖达峰值,随后随姜黄素浓度进一步增加,细胞增殖活性却逐渐下降,12.500、25.000 μmol/L浓度时,细胞增殖活性仍显著高于对照组(P<0.05),50 μmol/L浓度时对HKC增殖活性没有影响,100.000 μmol/L时,细胞增殖活性显著低于对照组(P<0.01)。

a:P<0.05,b:P< 0.01,与正常对照组比较。
图2MTT法检测姜黄素对HKC细胞增殖的影响
2.3不同浓度TGF-β1作用后HKC细胞TGF-β1基因表达变化与正常对照组(0 ng/mL TGF-β1)不同浓度TGF-β1 作用于肾小管上皮细胞株HKC 72 h后,均能显著促进其表达TGF-β1(P<0.05);并且随着TGF-β1浓度的增加,TGF-β1基因的表达水平也显著增加,于10 ng/mL浓度时,HKC表达TGF-β1基因的水平达峰值(P<0.01,图3)。
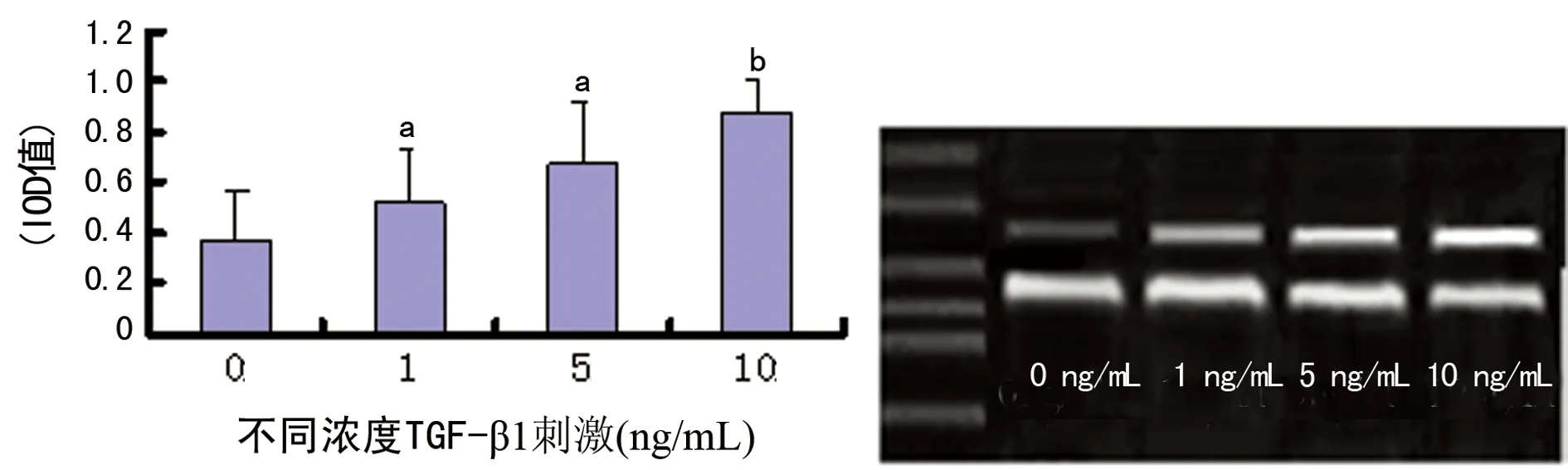
a:P<0.05,b:P<0.01,与正常对照组比较。
图3不同浓度TGF-β1作用于HKC细胞72 h后,其TGF-β1基因的表达变化
2.4TGF-β1和姜黄素联合作用对HKC细胞 TGF-β1和BMP-7基因和蛋白表达的影响与正常对照组比较,TGF-β1刺激能显著上调HKC细胞TGF-β1、而下调BMP-7的基因和蛋白的表达(P<0.01);然而,当TGF-β1与不同浓度姜黄素联合刺激HKC时,在12.500~50.000 μmol/L浓度范围内的姜黄素则能对抗TGF-β1诱导的TGF-β1基因和蛋白的上调和BMP-7基因和蛋白的下调(P<0.05),抑制TGF-β1的表达,相反促进BMP-7的表达,基因呈低水平表达。与正常对照组比较,单纯刺激组(5 ng/mL,NT组)处理HKC后,可以显著促进基因表达上调;当TGF-β1与不同浓度姜黄素联合刺激HKC时,6.250 μmol/L姜黄素仍不能对抗TGF-β1诱导的HKC细胞TGF-β1基因的表达上调,但随姜黄素浓度的逐渐增加,则对HKC细胞TGF-β1基因表达的抑制作用也逐渐增加(P<0.05)。当姜黄素为100.000 μmol/L浓度时,这种抑制作用有所减弱,但仍然显著高于NT组(P<0.05)。见图4。
2.5TGF-β1和姜黄素联合作用后HKC细胞Ⅰ胶原mRNA的表达变化体外培养的HKC细胞表达极低水平的Ⅰ型胶原,5 ng/mL TGF-β1单独作用细胞72 h后,Ⅰ型胶原基因表达显著增强(P<0.01)。但如果加入不同浓度的姜黄素与TGF-β1共同作用后,姜黄素在12.500~50.000 μmol/L浓度范围内可见Ⅰ型胶原基因表达明显受抑制(P<0.05,P<0.01)。姜黄素为25.000 μmol/L时,Ⅰ型胶原基因表达水平最低(P<0.01),随后随着姜黄素浓度的逐渐增加,Ⅰ型胶原基因表达有上调趋势,但仍然显著高于5 ng/mL TGF-β1对照组(P<0.05)。见图5。
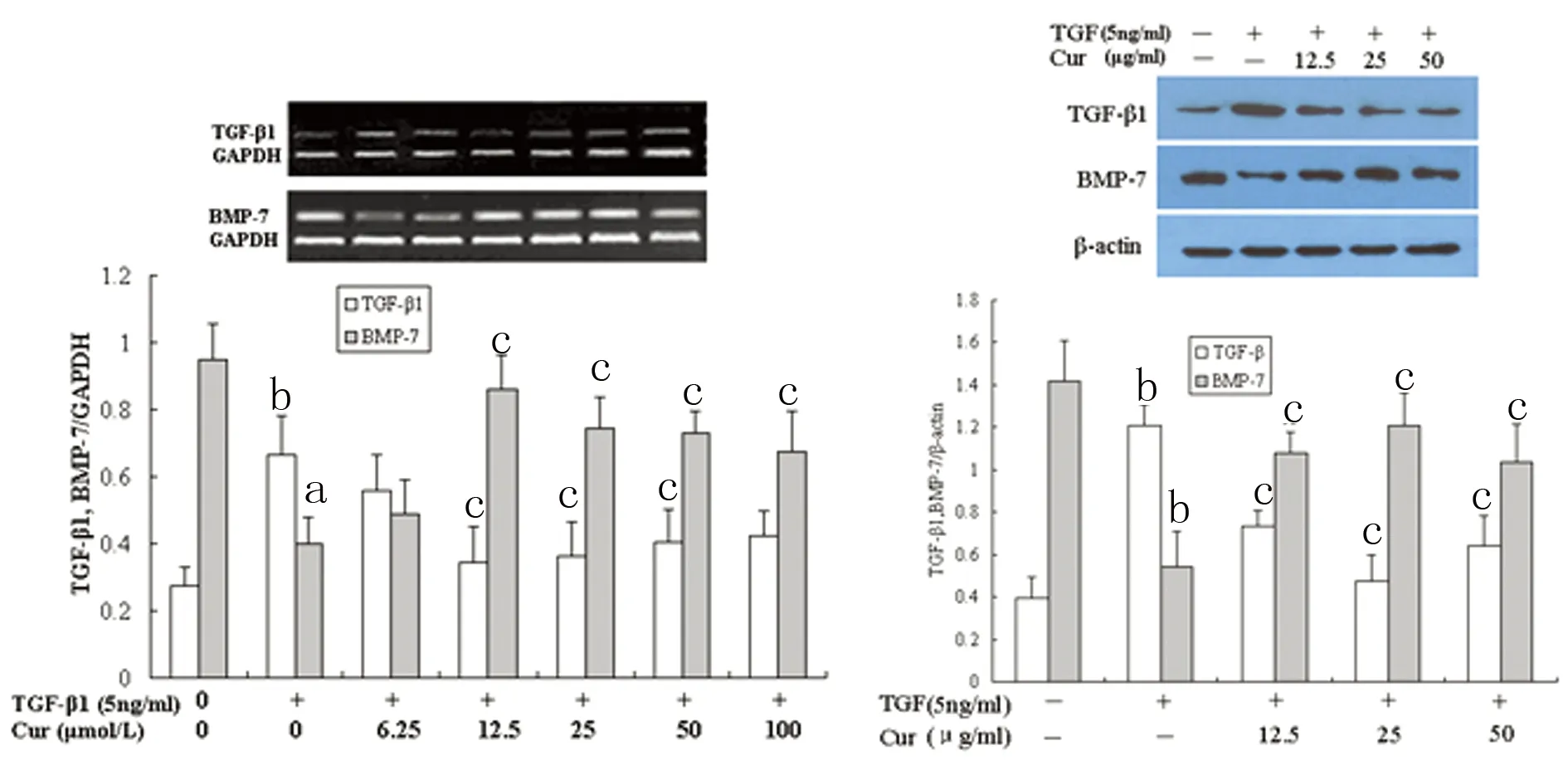
a:P<0.05,b:P<0.01,与正常对照组比较;c:P<0.05,与单纯TGF-β1刺激组比较。
图4TGF-β1和姜黄素联合处理对HKC细胞TGF-β1和BMP-7基因和蛋白的表达变化

a:P<0.01,与正常对照组比较;b:P<0.01,c:P<0.05,与单纯TGF-β1刺激组比较。
图5TGF-β1和姜黄素联合处理对HKC细胞Ⅰ型基因和蛋白的表达变化
3 讨 论
肾间质纤维化的主要病理表现为肾间质细胞外基质累积、肾小管萎缩、肾间质肌成纤维细胞 (kidney myofibroblasts,KMF)增多等。而肾间质KMF是合成细胞外基质的主要细胞,在间质纤维化的发病中起重要作用。研究表明,TGF-β1诱导的HKC向肌成纤维细胞转化是肾间质纤维化KMF的重要来源,也是肾纤维化发生、发展的关键诱因[1-2]。因而,维持HKC特性、抑制EMT的发生、发展,已成为控制肾间质纤维化的重要途径之一。内源性致纤维化因子TGF-β1和抗纤维化因子BMP-7是一对对EMT发生、发展起着关键作用的细胞因子,其表达水平的平衡对于维持肾内微环境的稳定起着关键作用。作为具有抗纤维化作用的中药单体姜黄素可能对这两个因子在肾脏的合成分泌产生重要影响。
姜黄素具有多种药理功效,除可抗炎、抗细胞增殖、抗血管增生外,还具有抗组织器官纤维化作用。动物实验研究发现,姜黄素具有抗肝、肺、肾纤维化作用[6-9],证实姜黄素能显著改善纤维化大鼠的肝功能和抑制梗阻性肾病大鼠肾纤维化,但对于姜黄素抗肾纤维化的分子生物学机制并不十分清楚。
本实验结果显示:姜黄素对HKC具有明显的促增殖作用,姜黄素在3.125~25.000 μmol/L浓度范围内,能显著促进HKC增殖(P<0.05),但高浓度姜黄素 (100.000 μmol/L)则对HKC增殖表现为抑制作用。同时,倒置显微镜下发现此时细胞有分离、悬浮改变,提示单纯这一浓度姜黄素可能对细胞具有毒性作用。相反,中、低浓度姜黄素作用于细胞,细胞呈现小管上皮典型的鹅卵石形态,提示此作用浓度姜黄素对HKC没有毒性作用。不同浓度的TGF-β1均能诱导HKC向梭形细胞转化,并且随时间和浓度的增加,促进转化细胞的数量也增加。而当姜黄素与TGF-β1共同作用时,姜黄素在12.500~50.000 μmol/L浓度范围内,表现出对抗TGF-β1的诱导的形态变化而维持小管上皮样形态;由此表明,姜黄素在一定的浓度范围内能促进HKC增殖,并且能对抗TGF-β1诱导的上皮向间质细胞形态转化而维持其上皮样形态特征,提示姜黄素可能具有对抗TGF-β1诱导的EMT的作用,因为EMT也是促进移植肾纤维化的重要机制。
BMP-7是TGF-β超家族中的一个成员,是一种内源性肾内环境稳定调节因子和重要的肾纤维化拮抗因子,它和TGF-β的平衡影响着肾组织内环境的稳定性[4]。外源性给予人工重组BMP-7 可明显抑制肾间质纤维化进展,刺激小管上皮细胞的再生,改善肾功能[10];BMP-7 能够促进急性肾损伤的修复[3-4],以及改善单侧输尿管梗阻模型、糖尿病肾病、MRL lpr/lpr 狼疮小鼠模型慢性肾纤维化的进展[1-3]。TGF-β1是各种肾脏纤维化过程中致纤维化的关键细胞因子[1-2]。它能直接刺激细胞外基质(ECM)成分的合成,能通过减少蛋白酶的合成和刺激蛋白酶抑制剂(如PAI-1) 阻止ECM 降解。实验性肾纤维化模型的发展和小管间质纤维化的不断加重过程中,BMP-7的表达进行性减少,而TGF-β1则进行性增加,二者表达呈负相关,由于二者是肾脏小管间质纤维化重塑过程中一对重要的多功能调节因子,其表达比值对于维持肾组织结构和正常生理功能起着重要作用。
在纤维化肾组织内BMP-7表达下调,而促进肾BMP-7合成分泌,不仅可以对抗TGF-β1诱导的EMT,促进间质细胞向上皮细胞转化,而且有助于维持小管上皮细胞表型,而且还能促进其再生[3-4]。研究证实,补充外源性BMP-7有助于延缓肾功能不全的进展和肾纤维化的形成[3]。Zeisberg等[4]研究发现,给予rHuBMP-7 (100 ng/mL) 能逆转TGF -β1诱导体外培养的远端肾小管上皮细胞株和近端肾小管上皮细胞发生的EMT,重新表达E-钙黏蛋白、ZO-1 蛋白和细胞形态的恢复。TGF-β1作为强效致纤维化因子,不仅能诱导肾小管上皮细胞发生EMT,它还能促进肾小管细胞进一步合成分泌TGF-β1,由此可以形成恶性循环[11]。本实验结果显示,HKC呈TGF-β1浓度依赖性地上调TGF-β1表达;同时,倒置显微镜下观察也发现随TGF-β1浓度增加,向梭形形态转化的细胞数量也相应显著增加。但如果再加入不同浓度的姜黄素共同作用,不仅能显著减少向梭形形态转化的细胞数量,绝大部分细胞维持小管上皮样形态;同时,也能显著减少TGF-β1基因和蛋白的表达上调,相反显著促进HKC BMP-7基因和蛋白的表达。其中,尤其是姜黄素为25.000 μmol/L浓度时,这一效应最为显著,表明该浓度可能是姜黄素抗纤维化的最佳药物浓度,对于临床用药有一定的指导意义,并揭示姜黄素作用上调肾小管细胞BMP-7/TGF-β1水平,可能是其抗纤维化效应重要的分子生物学机制。进一步的实验证实,姜黄素能抑制TGF-β1诱导的小管细胞Ⅰ型胶原基因和蛋白的表达,以25.000 μmol/L姜黄素的作用最强,表明姜黄素可能通过抑制TGF-β1诱导的上皮细胞向成纤维细胞转化,从而减少了Ⅰ型胶原表达。
由此认为,姜黄素一方面可能是通过促进BMP-7表达,从而促进小管上皮细胞增生、维持上皮样形态;另一方面可能对抗TGF-β1诱导的EMT发生,从而发挥抗纤维化效应。因此,尽管小管间质纤维化是各种慢性肾脏疾病,以及移植肾肾病的一个显著特征,控制肾脏纤维化发展至终末期肾衰竭目前仍然没有特异性的治疗方法,但姜黄素作为一种中药有效成分,可能为其治疗带来新希望。
[1]Rastaldi MP.Epithelial-mesenchymal transition and its implications for the development of renal tubulointerstitial fibrosis[J].J Nephrol,2006,19(4):407-412.
[2]Kramann R,DiRocco DP,Humphreys BD.Understanding the origin,activation and regulation of matrix-producing myofibroblasts for treatment of fibrotic disease[J].J Pathol,2013(231):273-289.
[3]Zeisberg M,Shah AA,Kalluri R.Bone morphogenic protein-7 induces mesenchymal to epithelial transition in adult renal fibroblasts and facilitates regeneration of injured kidney[J].J Biol Chem,2005,280(9):8094-8100.
[4]Zeisberg M,Hanai J,Sugimoto H,et al.BMP-7 counteracts TGF-beta1-induced epithelial-to-mesenchymal transition and reverses chronic renal injury[J].Nat Med,2003,9(7):964-968.
[5]Wang S,Hirschberg R.Bone morphogenetic protein-7 signals opposing transforming growth factor beta in mesangial cells[J].J Biol Chem,2004,279(22):23200-23206.
[6]Kang HC,Nan JX,Park PH,et al.Curcumin inhibits collagen synthesis and hepatic stellate cell activation in-vivo and in-vitro[J].J Pharm Pharmacol,2002,54(1):119-126.
[7]Kuwabara N,Tamada S,Iwai T,et al.Attenuation of renal fibrosis by curcumin in rat obstructive nephropathy[J].Urology,2006,67(2):440-446.
[8]Bridle KR,Popa C,Morgan ML,et al.Rapamycin inhibits hepatic fibrosis in rats by attenuating multiple profibrogenic pathways[J].Liver Transplantation,2009,15(10):1315-1324.
[9]Punithavathi D,Venkatesan N,Babu M.Curcumin inhibition of bleomycin-induced pulmonary fibrosis in rats[J].Br J Pharmacol,2000,131(2):169-172.
[10]Negri AL.Prevention of progressive fibrosis in chronic renal diseases:Antifibrotic agents[J].J Nephrol,2004,17(4):496-503.
[11]Danilewicz M,Wagrowska-Danilewicz M.Correlative insights into the immunoexpression of transforming growth factor beta-1 in acutely rejected renal allografts[J].Pathol Res Pract,2006,202(1):9-15.
To investigate the anti-fibrotic molecular mechanisms of curcumine in kidney*
Zhu Fangqiang1,Chen Minjia1,Zhu Ming1,Xu Xiang1,Zhao Hongwen2,Liu Hong2,Yu Rongjie2,Wu Xiongfei2,Huang Hong1△
(1.StateKeyLaboratoryofTrauma,BurnandCombinedInjury,InstituteofSurgeryResearchofDapingHospital,ThirdMilitaryMedicalUniversity,Chongqing400042,China;2.DepartmentofNephrology,SouthwestHospital,ThirdMilitaryMedicalUniversity,Chongqing400038,China)
ObjectiveIn order to provide experiment evidences for clinical therapy,we investigate the molecular biologic mechanisms of anti-kidney fibrosis of curcumine.MethodsThe effect of curcumin on the proliferation of HKC was measured by MTT.The morphology of cells was observed by phase contrast microscopy,and the expressions of TGF-β1,BMP-7 and type Ⅰ collagen were analyzed by reverse transcription polymerase chain reaction and Wersten blot.ResultsHKC cells showed a classic cobblestone morphology.Exposure of HKC to TGF-β1 for 72 h induced a complete conversion of the epithelial cell to myofibroblast.Low dose curcumine could effectively promote HKC cells proliferation(P<0.05,P<0.01).When HKC were co-incubated with TGF-β1 and different concentration curcumine for 72 h,curcumin could maintain the epithelial morphology in a dose-dependent manner concomitantly with decreased expression of TGF-β1and type Ⅰ collagen,and increased expression of BMP-7.ConclusionCurcumine can promote the proliferation of kidney tubular epithelial cells,and may be a potent inhibitor of TGF-β1 induced EMT.Curcumine could inhibits TGF-β1 induced upregulating BMP-7 expression and donwregulating TGF-β1 and type Ⅰ collagen expression,which may be the anti-fibrotic mechanisms of curcumine in kidney.
kidney diseases;fibrosis;transferming growth factor beta;curcumine;bone morphogenetic protein-7;typeⅠcollagen
创伤、烧伤与复合伤国家重点实验室开放基金资助(200717);国家重点基础研究发展973项目(2012CB518104)。作者简介:朱方强(1965-),副主任医师,硕士,主要从事肾脏再生与修复的研究。△
,E-mail:huanghongcq@163.com。
R363.2
A
1671-8348(2016)26-3601-04
2016-03-18
2016-06-15)
