高糖对大鼠腹膜间皮细胞分泌细胞因子的影响及苦参碱的干预作用
2016-11-01朱士彦巫建芳龙贵华
朱士彦,甘 平,廖 彧,巫建芳,龙贵华
(1.广东省佛山市顺德区龙江医院肾内科 528318;2.贵阳医学院附属医院肾内科,贵阳 510000)
高糖对大鼠腹膜间皮细胞分泌细胞因子的影响及苦参碱的干预作用
朱士彦1,甘平2,廖彧1,巫建芳1,龙贵华1
(1.广东省佛山市顺德区龙江医院肾内科528318;2.贵阳医学院附属医院肾内科,贵阳 510000)
目的研究高糖刺激下大鼠腹膜间皮细胞分泌肿瘤坏死因子α(TNF-α)和转化生长因子β1(TGF-β1)及苦参碱的干预作用,探讨腹膜纤维化发生机制。方法通过体外培养大鼠腹膜间皮细胞(PMCs),依据加入药物浓度分成5组:2.5%葡萄糖组(n=15,A组); 低糖苦参碱组(2.5%葡萄糖,n=15,B组);4.25%葡萄糖组(n=15,C组); 高糖苦参碱组(4.25%葡萄糖,n=15,D组);对照组(n=15,E组,仅加不含血清的DMEM-F12 BMSC培养基),分别于第24、48、72小时收集培养上清液,采用ELISA法测定各组培养上清液中TNF-α和TGF-β1浓度的变化,同时观察各组大鼠腹膜间皮细胞光镜下的表现。结果光镜下,可见E组和B组腹膜间皮细胞小,呈卵圆形或圆形,生长较为密集。A、C、D组腹膜间皮细胞大、呈梭形或多边形,分布较为稀疏;在A组,培养上清液中TNF-α和TGF-β1水平较E组无明显统计学变化(P>0.05);而在C组,培养上清液中TNF-α和TGF-β1水平较E组增加明显,差异有统计学意义(P<0.05)。在B组和D组中,PMCs分泌TNF-α和TGF-β1水平B组较A组减少,差异无统计学意义(P>0.05);D组较C组明显下降,差异有统计学意义(P<0.05)。结论苦参碱能拮抗高糖致大鼠腹膜间皮细胞分泌TNF-α和TGF-β1,从而保护腹膜间皮细胞。
葡萄糖;苦参碱;肿瘤坏死因子α;转化生长因子β1;腹膜间皮细胞
腹膜透析(peritoneal dialysis,PD)由于自身生物相容性好,中分子物质清除效率高等优点,成为目前终末期肾脏疾病的首选透析方式。但是反复发作腹膜炎症可使有效腹膜透析面积减少,从而导致腹膜对溶质的清除及水分的超滤功能减退甚至功能衰竭,是部分PD患者改行血液透析治疗的主要原因之一[1]。实验表明,腹膜长期处于高渗微环境,可最终破坏腹膜的整体结构性,葡萄糖及其与机体产生的炎变产物是致PD相关性腹膜超滤衰竭重要原因之一[2-3]。如何从病理生理学机制方面深入探究腹膜超滤衰竭的发病机理,成为近年来医学研究的重要课题内容。
现有研究证实人腹膜间皮细胞(peritoneal mesothelial cells,PMCs)具有多重重要的生理功能,如分泌、吸收、修复、支持等。在腹膜发生炎变时,PMCs自身分泌的炎性因子和细胞因子,又影响到腹膜自身的修复[4-5]。本研究旨在探讨高糖致大鼠PMCs分泌肿瘤坏死因子α(TNF-α)和转化生长因子β1(TGF-β1)及苦参碱的抗纤维化作用,为临床防治腹膜纤维化,延缓病人的生命,有着极其重要的现实意义。
1 材料与方法
1.1材料选取健康BALB/c大鼠35只,雌雄兼用,体重100~120 g,同等条件下饲养,鼠龄6~8周,由贵阳医学院动物实验中心提供。
1.2主要试剂胎牛血清(FCS),DMEM-F12 BMSC培养基,胰蛋白酶液,卵母细胞裂解液,DAB显色剂(编号AR1022),抗体稀释液(编号AR1016),Hanks平衡盐溶液,多聚赖氨酸,枸橼酸盐缓冲液,以上均购自郑州益康生物工程有限公司;TNF-α ELISA试剂盒(上海恒远生物科技有限公司,编号:AR2053);TGF-β1ELISA试剂盒(上海恒远生物科技有限公司,编号:AR2095);即用型SABC免疫组化染色试剂盒(上海恒远生物科技有限公司,编号:SA1020);兔抗人细胞角蛋白18抗体、抗人波形蛋白(上海联硕生物科技有限公司);兔抗人第Ⅷ因子相关抗原抗体(上海联硕生物科技有限公司);2.5%、4.25%腹膜透析液2 L(广州百特公司);苦参碱注射液,每支150 mg(10 mL),山西振东泰盛制药有限公司,批号H20059335。
1.3主要仪器HW-08C型超级微量恒温器(上海旦鼎国际贸易有限公司);倒置显微镜和光学显微镜(上海蔡康光学仪器有限公司);无菌操作台(苏州江东精密仪器有限公司);流式细胞仪(Beckman Coulter公司);凝胶成像分析仪(UVI,英国);DNM-9602A酶标仪(上海圣科仪器设备有限公司)。
1.4方法
1.4.1PMCs分离和体外培养每次取大鼠1只,直接心脏注射2 mL左右10%水合氯醛后处死,将大鼠置于工作台上,圆针固定四肢,先后用0.22%聚维酮碘液、75%的乙醇充分消毒胸腹部皮肤,用镊子提起中线腹部皮肤,持剪刀自下向上剪开皮肤及皮下组织,暴露腹腔,用小眼科剪小心剔除壁层腹膜组织。将获取的腹膜组织剪成2~4 mm2的小块,置于Hanks混悬液中,自然沉淀后,再将组织块放入含150 mL/L NBS的DMEM-F12 BMSC培养基中,随后移入培养瓶内,置于37 ℃,5% CO2培养箱内慢慢培养。最初3 d内每天需更换培养液1次,培养4 d后每周更换培养液2次。约15~18 d组织块边缘新增殖的细胞逐渐铺开直至完全融合时,用免疫组化方法对细胞进行抗原抗体检测,鉴定为PMCs后,进一步行细胞因子测定[6]。
1.4.2分组及TNF-α和TGF-β1的测定细胞完全融合后,以每毫升105个接种于96孔培养板,待细胞铺满培养板,在不含血清的DMEM-F12 BMSC培养基中分别加入2.5%、4.25%葡萄糖腹透液和苦参碱溶液,依据药物浓度分设5组,每组分为15个复孔,每孔各加650 μL:2.5%葡萄糖组(n=15,A);低糖苦参碱组(2.5%葡萄糖,n=15,B);4.25%葡萄糖组(n=15,C);高糖苦参碱组(4.25%葡萄糖,n=15,D);对照组(n=15,E,仅加不含血清的DMEM-F12 BMSC培养基)。用药前抽吸苦参碱100 mg分别与2.5%、4.25%透析液2 L配成浓度为5.0%的溶液。分别于培养后第24、48、72小时收集培养上清液,采用ELISA法测定上清液中TNF-α和TGF-β1的浓度,具体操作步骤按试剂盒上说明书进行。

2 结 果
2.1PMCs的培养和鉴定培养的腹膜组织48~72 h后,细胞逐渐从组织块边缘长出并增殖铺开,在光镜下细胞边界清晰,大小一致,欠规则排列。卵圆形细胞在瓶底贴壁生长,呈克隆样增殖,约18 d铺满培养瓶底部,倒置显微镜下见细胞呈多边形,有的边缘呈现齿轮状与周围细胞镶嵌排列,呈典型上皮细胞样形态。且抗人角蛋白、抗人波形蛋白染色阳性,抗Ⅷ因子相关抗原单克隆抗体阴性。
2.2光镜下各组大鼠PMCs表现18 d后在普通光镜下,可见E组和B组腹膜间皮细胞小,呈卵圆形或圆形,生长较为密集; A组、C组及D组可见腹膜间皮细胞大,呈梭形或多边形,分布较为稀疏。上述现象在C组表现更为显著,见图1。
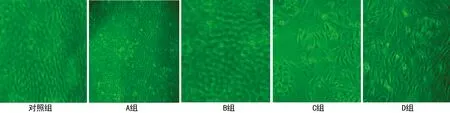
图1 各组大鼠腹膜间皮细胞18 d光镜下形态学表现(×400)
2.3TNF-α的分泌及苦参碱的抑制作用PMCs分泌TNF-α,A组培养上清液中TNF-α水平较对照组无明显增加(t=1.778,P=0.182);而在C组,培养上清液中TNF-α水平较对照组增加明显,差异有统计学意义(t=3.835,P=0.025)。PMCs分泌TNF-α水平B组较A组减少,但差异无统计学意义(t=1.785,P=0.235);D组较C组下降明显,差异有统计学意义(t=3.753,P=0.018),见表1。
表1 不同时间各组TNF-α的分泌情况
a:P<0.05,与对照组比较;b:P<0.05,与C组比较。
2.4TGF-β1的分泌及苦参碱的抑制作用PMCs分泌TGF-β1,A组,培养上清液中TGF-β1浓度较对照组略有增加(t=1.788,P=0.236);而在C组,培养上清液中TGF-β1浓度较对照组明显增加,差异有统计学意义(t=3.958,P=0.024)。PMCs分泌TGF-β1水平B组较A组减少,但差异无统计学意义(t=1.864,P=0.357);D组较C组下降明显,差异有统计学意义(t=4.123,P=0.032),见表2。
表2 不同时间各组TGF-β1的分泌情况
a:P<0.05,与对照组比较;b:P<0.05,与C组比较。
3 讨 论
腹膜超滤功能衰竭是PD患者结束治疗的常见原因。各种腹膜纤维化进程中都会伴随着炎性反应,包括PMCs的凋亡及炎性细胞因子的释放,成纤维细胞增殖,细胞外基质成分过多聚集并异常修复,间充质细胞转化等腹膜超微结构的病理变化[7-9]。本文以大鼠PMCs为研究对象,通过高糖刺激PMCs分泌TNF-α和TGF-β1,苦参碱的抑制作用,研究其在腹膜纤维化机制中的可能作用。
TNF-α作为一种重要的炎症因子,在腹膜纤维化过程中发挥着重要的作用。叶玲等[9]研究证实,在TNF-α的作用下,PMCs表达白细胞介素8、单核细胞趋化肽1明显活跃,同时间皮细胞也能合成细胞间黏附分子和血管细胞黏附分子,有利于炎性细胞黏附并进入腹腔。本文利用体外培养的大鼠PMCs,经不同浓度的葡萄糖液刺激,发现经一定时间作用后,PMCs确实能分泌TNF-α,从分子水平上证实PMCs对高糖刺激可产生应答反应。这与黄振华等[10]的研究一致。尽管在高糖刺激下PMCs仅能分泌较低水平的TNF-α,但由于它是前炎性介质,能够影响整个炎症反应的各个阶段,可能是导致腹膜纤维化的发生机制之一。
TGF-β1已被公认为调节细胞生长和分化的中枢介质,参与组织纤维化的整个进程。TGF-β1一方面直接刺激细胞外基质成分如胶原Ⅰ、Ⅲ、Ⅴ,纤维连接蛋白、蛋白多糖等的形成,同时也具有抑制细胞外基质降解酶的作用,从而造成细胞外基质成分过多蓄积[11]。目前已构建的人TGF-β1反义RNA真核表达载体,发现其在防治腹膜纤维化进程中起着重要的作用;另一方面,通过调节基质受体-整合素的表达,促进细胞与基质黏附;此外,TGF-β1也可通过自分泌作用诱导其本身的表达,从而放大其生物活性[12-13]。本研究显示,在高糖的作用下,PMCs能分泌较多的TGF-β1,且随着时间的延长进一步表达上调。以往的研究显示,TGF-β1一旦存在,可诱发其自身转录,通过信号通路 TGF-β1/Smad2/3调节相关基因的表达,进而促使细胞外基质的生成,促进纤维化的发生[14]。因此,本实验PMCs 在高糖刺激下产生TGF-β1的过程,除了PMCs的自分泌外,可能还与TGF-β1诱导其自身转录有关。
苦参碱具有多重药理作用和功效,如抗肝脏纤维化、防止肾小球硬化、抗肿瘤、和心血管保护等方面作用[15]。以往的研究主要集中在其对抗肾纤维化作用方面,而对腹膜纤维化抑制作用则报道较少。姜燕等[16]将150只Wistar大鼠通过尾部静脉注射阿霉素(2 mg/kg)建立肾纤维化大鼠模型,随机分为5组:对照组、模型组、苯那普利组、低剂量苦参碱组(50 mg/kg)和高剂量苦参碱组(100 mg/kg),每日对应药物灌胃,分6批先后处死各组大鼠,结果表明:相对于模型组,苯那普利组、低剂量以及高剂量苦参碱组肾脏病理改变轻微,组织内核因子-κB蛋白的表达水平较低,而抑制性κB蛋白的表达水平反而增高;苯那普利组和高剂量苦参碱组各观察指标均优于低剂量苦参碱组。证明苦参碱可抑制肾纤维化的发生从而起到保护肾组织的作用。本实验通过细胞形态学观察和免疫组织化学分析,均证实所培养细胞为PMCs[6]。A、C组与B、D组相比,大鼠腹膜间皮细胞体积增大,形状呈梭形、分布较稀疏,尤其是在C组更为明显,说明A、C组细胞在体外培养过程中受到抑制,且与葡萄糖浓度有关。而加入苦参碱后细胞生长受到的抑制作用减轻,且PMCs分泌的TNF-α和TGF-β1明显减少,其机理可能是通过苦参碱拮抗PMCs分泌TNF-α和TGF-β1的表达进而间接保护PMCs,也可能是通过终止其他炎性介质的转录,减少细胞外基质的蓄积,进而限制炎症反应的进一步发展。路娜等[17]发现苦参碱能够抑制高糖诱导的大鼠肾小管上皮-间充质转化,其机制通过抑制TGF-β1/Smads信号通路致纤维化效应有关。综上所述,苦参碱具有多重生物学效应,通过多种机制参与抗腹膜硬化进程,然而其确切病理生理学机制尚需进一步深入研究。
本实验证实苦参碱对高糖致大鼠PMCs分泌TNF-α和TGF-β1的确有一定的抑制作用,为中药防治腹膜纤维化提供了新的思路。
[1]段丽萍,董捷.复发和重现性腹膜透析相关腹膜炎的临床特点及转归[J].中国血液净化,2015,14(2):65-69.
[2]杨芦蓉,杨林,钟文旗,等.腹膜透析患者腹膜转运类型与营养状况的相关性研究[J].重庆医学,2013,42(35):4281-4283.
[3]Krediet RT,Struijk DG.Peritoneal changes in patients on long-term peritoneal dialysis[J].Nat Rev Nephrol,2013,9(7):419-429.
[4]郭春艳,刘虹.腹膜透析腹膜结构和功能保护的新策略[J].中国血液净化,2014,13(2):113-118.
[5]金珍木,李素蘋,朱小春.腹膜透析相关性腹膜炎的临床特点分析[J].中华医院感染学杂志,2014,24(6):1435-1437.
[6]马姝琛,严海东,庄守纲,等.大鼠腹膜间皮细胞的分离培养方法[J].同济大学学报:医学版,2012,33(6):19-21.
[7]易觅譞,陈国纯,刘伏友.腹膜炎后腹膜透析超滤衰竭的机制研究进展[J].中国血液净化,2012,11(11):588-591.
[8]Diao JN,Sheng MX,Zhu XX,et al.The influence of Radix Astragali injection on dialysis efficiency and peritoneal structure of rat with high permeability of the peritoneal dialysis[J].J Nanjing Univ Tradit Chin Med,2011,27(1):58-62.
[9]叶玲,祝胜郎,陈结慧,等.大鼠腹膜间皮细胞中转化生长因子β1对TNF-α表达的影响[J].中国热带医学,2013,13(6):667-670.
[10]黄振华,冯振伟,叶智明,等.腹膜透析患者血清铁调素25、肿瘤坏死因子α水平和颈动脉粥样硬化的关系[J].中国动脉硬化杂志,2013,21(12):1093-1096.
[11]管静,赵德晟.氟伐他汀抑制高糖腹透液诱导人腹膜细胞TGF-β合成及细胞外基质产生的机制研究[J].临床和实验医学杂志,2013,12(20):1617-1619,1622.
[12]Chinashi H,Ito Y,Mizuno M,et al.TGF-β1promotes lymphangiogenesis during peritoneal fibrosis[J].J Am Soc Nephrol,2013,24(10):1627-1642.
[13]张红利,郝丽荣.TGF-β/Smad信号通路在腹膜纤维化发生、防治中的作用[J].医学综述,2013,19(7):1173-1175.
[14]李军,司维柯,赵宸,等.苦参碱与氧化苦参碱影响荷瘤小鼠肿瘤生长及其免疫调节作用的研究[J].重庆医学,2011,40(27):2719-2721.
[15]李屹,张丽楠,杨磊.苦参碱药理作用研究进展[J].实用中医药杂志,2012,28(5):423-424.
[16]姜燕,龚燕梅,曾红兵,等.苦参碱对实验性大鼠腹膜纤维化的影响[J].中国医院药学杂志,2008,28(24):2110-2112.
[17]路娜,王雅棣,姚波,等.苦参碱对人胚肺成纤维细胞增殖和凋亡的干预作用[J].中医学报,2014,29(8):1168-1169.
The influence of high glucose on cytokine secreted by peritoneal mesothelial cells in rats and the intervention effect of matrine
Zhu Shiyan1,Gan Ping2,Liao Yu1,Wu Jianfang1,Long Guihua1
(1.DepartmentofNephrology,theHospitalofLongjiang,Foshan,Guangdong528318,China;2.DepartmentofNephrology,theAffiliatedHospitalofGuiyangMedicalCollege,Guiyang,Guizhou510000,China)
ObjectiveThis study was designed to investigate the effect of matrine on high glucose-induced tumor necrosis factor-α(TNF-α)and transforming growth factor-β1(TGF-β1) overexpression in rat peritoneal mesothelial cells(PMCs),and to explore the possible mechanism in the peritoneal fibrosis.Methodsology The rat PMCs were incubated in vitro,and then assigned into 5 groups on the basis of the added drug concentrations:2.5% glucose group (n=15,A);Glucose + 2.5% matrine group (n=15,B);4.25% glucose group (n=15,C);Glucose + 4.25% matrine group (n=15,D);Blank control group (n=15,control group,added the DMEM/F12 medium).The levels of TNF-α and TGF-β1in the supernatants were measured by ELISA method at the different time (24h,48h,72h),and observed the changes of PMCs under the microscope.ResultsCompared with the groups of A,C and D,the PMCs in the control group and B group were small,round,spindle,irregular or intensive.The expression of TNF-α and TGF-β1in the A group was lightly higher than that of the control group,but the level in the C group was significantly higher than that of the control group (P<0.05).As compared with the A group,The level of TNF-α and TGF-β1expressed in the B group were decreased (P>0.05),but the lever in the D group was significantly lower than that of the C group (P<0.05).ConclusionMatrine might be helpful to resist the overexpression of TNF-α and TGF-β1induced by high glucose,and then protect the PMCs.
glucose;matrine;tumor necrosis factor-α;transforming growth factor-β1;peritoneal mesothelial cells
朱士彦(1972-),硕士,副主任医师,主要从事临床血液净化及肾小球疾病的诊治工作。
论著·基础研究doi:10.3969/j.issn.1671-8348.2016.27.008
R459.5
A
1671-8348(2016)27-3770-03
2016-02-12
2016-04-06)
