红花石蒜中一个新的石蒜生物碱
2016-11-01李正辉刘吉开艾洪莲
何 隽,李正辉,冯 涛,刘吉开,艾洪莲
(中南民族大学 药学院,武汉 430074)
红花石蒜中一个新的石蒜生物碱
何隽,李正辉,冯涛,刘吉开,艾洪莲*
(中南民族大学 药学院,武汉 430074)
石蒜生物碱结构独特,生物活性多样.本文采用硅胶柱色谱、Sephadex LH-20凝胶柱色谱、半制备HPLC等方法,从采自昆明的红花石蒜球茎的乙醇提取物中,分离出了一个新的石蒜生物碱,通过高分辨质谱、红外、紫外以及一维、二维核磁共振等多种波谱手段确定了其结构,并命名为6β-ethoxycrinamine (1).
红花石蒜;石蒜生物碱;分离和结构鉴定
石蒜生物碱因其结构独特,生物活性多样,长期得到有机化学家的青睐[1-4]. 目前已经从石蒜科植物中获得超过100个石蒜生物碱[5], 这些生物碱表现出多种生物活性,比如:抗病毒、昆虫拒食、抑制肿瘤、以及乙酰胆碱酯酶抑制活性[6-9]. 前期,我们从石蒜科植物红花石蒜的球茎提取物中分离出了14个石蒜生物碱,包括3个新的生物碱. 其中化合物6β-acetoxycrinamine表现出对人体肿瘤细胞株的抑制活性[10]. 进一步对该种植物的化学成分进行研究,发现一个新的石蒜生物碱,通过各种波谱手段确定了其结构,并命名为6β-ethoxycrinamine (1) (图1). 本文将对该化合物的分离和结构鉴定进行报道.
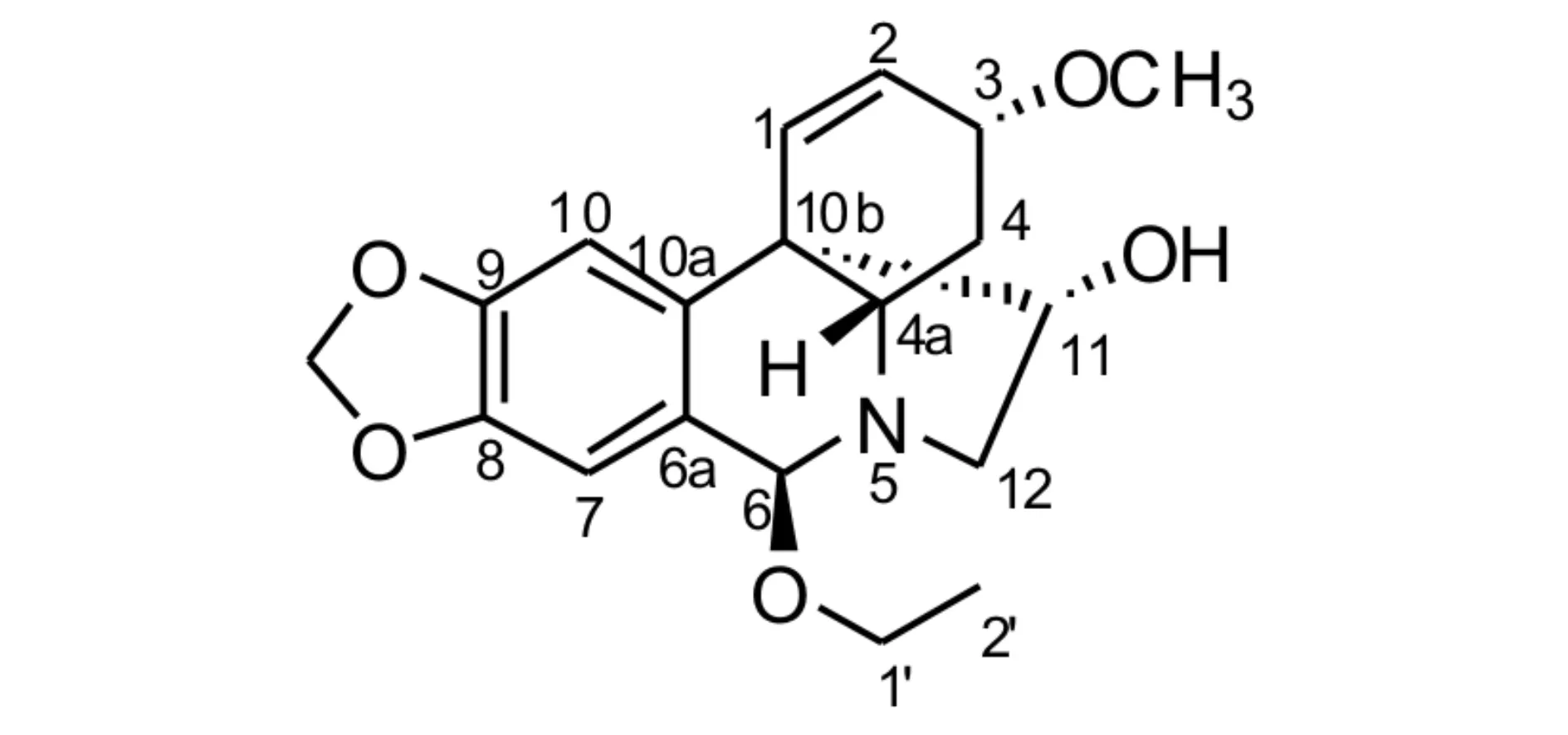
图1 化合物1的结构图Fig.1 Structure of compound 1
1 实验部分
1.1样品、试剂和仪器
1H和13C NMR由Bruker AM-400,Avance Ш 600测定,内标为TMS,其中,1H-NMR在600 MHz,400 MHz下测定,13C-NMR在150 MHz,100 MHz下测定; HR-EI-MS由Waters Autospec Premier P776质谱仪测定,HR-ESI-MS由API QSTAR Pulsar测定,比旋光度由Jasco-P-1020旋光仪测定,红外光谱由Bruker Tensor 27 FT-IR型红外光谱仪测定(KBr压片),紫外光谱由Shimadzu UV-2401PC型分光光度计测定.
柱色谱材料:柱色谱用硅胶(80~100目和200~300目)与GF254 TLC板均由青岛海洋化工厂生产;Sephadex LH-20为瑞典Amersham Biosciences公司出品;反相材料Chromatorex (40~75 μm)由日本Fuji Silysia化学公司出品;分析型HPLC为Agilent 1100,色谱柱为Agilent Zorbax SB-C18柱(4.6 mm×150 mm),粒径5 μm;制备型HPLC为Agilent 1260,色谱柱为Agilent Zorbax SB-C18柱(9.4 mm×150 mm),粒径5 μm. 显色方法为紫外灯下波长254和365 nm处观察荧光,碘蒸气显色及10%硫酸乙醇溶液显色剂加热显色.
1.2样品采集
红花石蒜球茎购买于云南昆明菊花村药材市场. 样本由中国科学院昆明植物研究所成晓老师鉴定,标本保存于中国科学院昆明植物研究所(标本号:KIB20090911.2).
1.3提取和分离
红花石蒜球茎5 kg切片晾干后粉碎,用95%乙醇按体积比1∶3提取3次,每次24 h. 提取液减压浓缩至2 L(此时提取液为水溶液),用10%盐酸调节pH至2~3,加入1.5 L乙酸乙酯萃取3次以除去脂溶性成分. 用10%氨水调节水层pH值至9~10,再用乙酸乙酯萃取3次得到脂溶性生物碱总提物22 g. 将此22 g提取物经硅胶柱层析,以氯仿/甲醇(从1∶0至0∶1)为流动相洗脱得到6个组分A-F. 组分D(3.3 g)经硅胶柱层析,以石油醚/丙酮(从10∶1至2∶1)为流动相洗脱得到12个亚组分D1-D12. 组分D6(110 mg)用反相硅胶柱层析,用甲醇/水(从3∶7至6∶4)为流动相(加入流动相体积的0.1%的三乙胺)洗脱,然后再用凝胶Sephadex LH-20柱层析,以100%甲醇为流动相纯化得到化合物1(6.0 mg).
2 结构鉴定
化合物1为无色油状物,易溶于氯仿、丙酮、甲醇等常见有机溶剂,不溶于水. 碘化铋钾显色反应呈橙色,推测其可能为生物碱类成分. 高分辨软电离质谱(HR-ESI-MS)推测出分子式为C19H23NO5(m/z:346.1651 [M + H]+;计算值:346.1654,C19H24NO5),不饱和度为9. 红外(IR)光谱数据显示结构中含有羟基(3433/ cm)和苯环(1502、1482 /cm)结构. 紫外(UV)光谱在294和240 nm处的吸收峰显示结构中含有共轭系统.
从1H NMR图谱中可以明显地观察到一个三重峰的甲基信号δH1.24 (3H, t,J=H7.0 Hz),一个甲氧基信号δH1.24(3H, s),二氧亚甲基信号δH5.91和5.87 (each 1H, d,J=H1.2 Hz),四个烯碳质子信号δH6.77 (s),6.73 (s),6.38 (d,J=H10.1 Hz),6.35 (dd,J=H10.1, 1.2 Hz) (表1).13C NMR图谱显示有19个共振信号,通过DEPT图谱可以归属为2个甲基(包括一个甲氧基)、4个亚甲基、8个次甲基和5个季碳信号(表1). 这些数据特征显示出化合物1可能为石蒜生物碱,并同已知化合物6-hydroxycrinamine具有较高的结构相似性. 仔细和已知化合物6-hydroxycrinamine的核磁数据进行对照发现,化合物1中多出一个乙氧基基团(-OCH2CH3),并通过HMBC图谱中的相关信号δH4.00(H-1′) →δC94.6 (C-6)确定该基团链接在C-6位(图2). 通过全面的HMBC数据分析确定化合物1的其他结构片段和化合物6-hydroxycrinamine一致.
表1化合物1的1H (400 MHz)和13C (100 MHz) NMR数据(氯仿-d,耦合常数J)
Tab. 11H (400 MHz) and13C (100 MHz) NMR data for 1 (CDCl3,δin ppm and J in Hz)

no.δHδC16.38(d,J=H10.1)126.7(d)26.35(dd,J=H10.1,1.2)132.6(d)33.88-3.90(m)72.4(d)42.08(ddd,J=H13.6,13.2,5.2)1.88(dd,J=H13.6,4.4)28.0(t)4a3.63(dd,J=H13.2,4.4)56.4(d)64.52(s)94.6(d)6a127.4(s)76.73(s)109.5(d)8146.2(s)9147.6(s)106.77(s)102.6(d)10a136.4(s)10b50.1(s)113.87(dd,J=H6.4,3.2)78.6(d)123.29(dd,J=H14.0,3.2)3.18(dd,J=H14.0,6.4)58.6(t)1'4.00(dt,J=H15.6,7.0)3.62-3.64(m)63.8(t)2'1.24(t,J=H7.0)15.4(q)OCH2O5.91(d,J=H1.2)5.87(d,J=H1.2)100.9(t)OCH33.34(3H,s)56.2(q)
通过ROESY图谱确定化合物1的相对立体构型. 在ROESY图谱中,H-6和H-12有明显的相关,表明H-6为α构型,其他ROESY相关信号表明化合物1 的立体构型与抑制化合物6-hydroxycrinamine一致(图2). 因此,通过上述数据推断可以确定化合物1的结构如图1所示,并命名为6β-ethoxycrinamine.

图2 化合物1的主要2D NMR相关示意图Fig. 2 Key 2D NMR correlations of compound 1
3 结果与讨论
红花石蒜中含有石蒜碱型、加兰他敏型、文殊兰型等多种类型的生物碱. 这类生物碱具有抗肿瘤、抗菌、抗疟疾、抗病毒、镇痛和抗乙酰胆碱酯酶等多方面的药理活性. 其中加兰他敏被用于治疗重症肌无力、小儿麻痹后遗症等,近年来又被广泛应用于治疗阿尔茨海默病,受到了人们的广泛关注. 本文采用多种柱层析手段对红花石蒜球茎的生物碱提取物进行分离,并利用多种现代波谱手段确定了一个新的石蒜生物碱类成分,丰富了其化合物的结构类型,为红花石蒜生理活性的研究奠定了化学基础.
[1]Sanchez I H, Soria J J, Lopez F J, et al. Total synthesis of racemic lycoramine [J]. J Org Chem, 1984, 49(1): 157-163.
[2]Parker K A, Kim H J. A short stereospecific synthesis of (dl)-lycoramine. Control of relative stereochemistry by dipole effects [J]. J Org Chem, 1992, 57(2): 752-755.
[3]Kita Y, Arisawa M, Gyoten M, et al. Oxidative intramolecular phenolic coupling reaction induced by a hypervalent iodine (III) reagent: leading to galanthamine-type Amaryllidaceae alkaloids [J]. J Org Chem, 1998, 63(19): 6625-6633.
[4]Fan C A, Tu Y Q, Song Z L, et al. An efficient total synthesis of (±)-lycoramine [J]. Org Lett, 2004, 6(25): 4691-4694.
[5]Kornienko A, Evidente A. Chemistry, biology, and medicinal potential of narciclasine and its congeners [J]. Chem Rev, 2008, 108(6): 1982-2014.
[6]Griffin C, Sharda N, Sood D, et al. Selective cytotoxicity of Pancratistatin-related natural Amaryllidaceae [J]. Cancer Cell Int, 2007, 7(1):17.
[7]Liu X S, Jiang J, Jiao X Y, et al. Lycorine induces apoptosis and down-regulation of Mcl-1 in human leukemia cells [J]. Cancer Lett, 2009, 274(1), 16-24.
[8]Arrigoni O, Arrigoni-LisoR, G. Calabrese, Lycorine as an inhibitor of ascorbic acid [J]. Nature, 1975, 256(5517): 513-514.
[9]Arrigoni O, Arrigoni-Liso R, Calabrese G. Ascorbic acid as a factor controlling the development of cyanide-insensitive respiration [J]. Science, 1976, 194(4262): 332-333.
[10]Feng T, Wang Y Y, Su J, et al. Amaryllidaceae Alkaloids fromLycorisradiata[J]. Helvetica Chimica Acta,2011,94:178-183.
A New Amaryllidaceae Alkaloid fromLycorisradiata
HeJuan,LiZhenghui,FengTao,LiuJikai,AiHonglian
(College of Pharmacy, South-Central University for Nationalities, Wuhan 430074, China)
Amaryllidaceae alkaloids were a kind of alkaloids with unique structure and wide range of biological activities. Using gel column chromatography, Sephadex LH-20, and semi-preparative HPLC, a new Amaryllidaceae alkaloid, 6β-ethoxycrinamine (1), was isolated from the bulbs ofLycorisradiata. The new structure was established by means of spectroscopic methods.
Lycorisradiata;Amaryllidaceae alkaloid;isolation and structural elucidation
2016-06-08*通讯作者艾洪莲,研究方向:民族药用植物学,E-mail:2015050@mail.scuec.edu.cn
何隽(1982-),女,讲师,博士,研究方向:民族药用植物化学,E-mail: 2015048@mail.scuec.edu.cn
国家自然科学基金地区科学基金资助项目(31560010) ,中南民族大学中央高校基本科研业务费专项资金资助项目(CZY16010)
O692.3;Q946.88
A
1672-4321(2016)03-0054-03
