溪黄草不同基原植物的抗菌和抗真菌活性研究△
2016-11-01莫小路邱蔚芬黄珊珊曾庆钱陈瑜珍
莫小路,邱蔚芬,黄珊珊,曾庆钱,陈瑜珍
(广东省中药研究所,广东 广州 510520)
溪黄草不同基原植物的抗菌和抗真菌活性研究△
莫小路*,邱蔚芬,黄珊珊,曾庆钱,陈瑜珍
(广东省中药研究所,广东 广州 510520)
目的探究溪黄草不同基原植物的抗菌和抗真菌活性,为建立中药溪黄草的质量标准提供参考。方法分别以80%的乙醇水溶液和水为溶剂对6种溪黄草基原植物进行超声波提取,以金黄葡萄球菌、表皮葡萄球菌、枯草芽孢杆菌、大肠杆菌、变形杆菌和绿脓杆菌为供试细菌,以白色念珠菌、酿酒酵母和产黄青霉为供试真菌,采用琼脂平板扩散法测定各溪黄草基原植物醇提物和水提物的抗菌和抗真菌活性,用液体二倍稀释法测定其最小抑制浓度(MIC)。结果6种基原植物的醇提物对供试的革兰阳性菌均有较强的抑菌活性,而对阴性菌抑制较弱或无抑制;其中,溪黄草和显脉香茶菜对金黄色葡萄球菌的抑菌活性最强,MIC分别为0.063、0.125 g·mL-1。6种基原植物的醇提物中,溪黄草的抗真菌活性最强,其对白色念珠菌和酿酒酵母的MIC均为0.125 g·mL-1。6种基原植物的水提物对供试细菌和真菌几乎没有抑制活性。结论6种溪黄草基原植物中,溪黄草醇提物的抗菌和抗真菌活性最强。
溪黄草;抗菌活性;抗真菌活性;基原;线纹香茶菜
溪黄草为广东及周边地区民间习用草药,有清热利湿、退黄、凉血散瘀的功效,常用于治疗急性黄疸型肝炎、急性胆囊炎、痢疾和肠炎等病症[1],是“消炎利胆片”、“胆石通胶囊”等中成药以及“溪黄草茶”等保健品的重要原料,具有广泛的市场,但各地溪黄草药材的植物来源各不相同,其基原植物有数种。据《中药大辞典》和《全国中草药汇编》等文献记载[2-3],溪黄草基原为唇形科香茶菜属(Rabdosia)植物线纹香茶菜Rabdosialophanthoides(Buch.-Ham.ex D.Don) Hara以及溪黄草R.serra(Maxim)Hara的全草;而《广东省中药材标准》[4]中,溪黄草的来源主要有4种,除了线纹香茶菜外,还有其两个变种:纤花线纹香茶菜R.lophanthoidesvar.graciliflora(Benth.) Hara和狭基线纹香茶菜R.lophanthoidesvar.gerardiana(Benth.) Hara,以及同属的溪黄草Rabdosiaserra(Maxim.) Hara。陈建南等[5]对广东溪黄草资源调查的显示:市售溪黄草商品药材品种主要为狭基线纹香茶菜和溪黄草。近年来,溪黄草的开发应用日益广泛,各地使用不同溪黄草基原势必带来溪黄草产品的质量控制问题,而目前关于溪黄草不同基原的活性成分及药理药效学方面的比较研究少有报道,因此,本文对香茶菜属的几个常用作溪黄草的药用植物进行体外抑菌作用的研究,为溪黄草资源评价和相关产品质量控制提供实验依据。
1 仪器与材料
1.1 植物材料
供试植物经广东省中药研究所蔡岳文教授鉴定,分别为唇形科香茶菜属的溪黄草Rabdosiaserra(Maxim.) Hara、线纹香茶菜R.lophanthoides(Buch-Ham.ex.D.Don)Hara、纤花线纹香茶菜R.lophanthoidesvar.graciliflora(Benth.) Hara、狭基线纹香茶菜R.lophanthoidesvar.gerardiana(Benth.) Hara、长叶香茶菜R.stracheyi(Benth.ex Hook.f.) Hara、显脉香茶菜R.nervosa(Hemsl.) C.Y.Wu et H.W.Li。
1.2 供试菌种
供试细菌金黄色葡萄球菌(Staphylococcusaureus)、表皮葡萄球菌(Staphylococcusepidermidi)、枯草芽孢杆菌(Bacillussubtilis)、普通变形杆菌(Proteusvulgaris)、大肠杆菌(Escherichiacoli)、绿脓杆菌(Pseudomonasaeruginosa)和真菌白色念珠菌 (Candidaalbicans)购自广东省微生物菌种保藏中心。供试真菌酿酒酵母(Saccharomycescerevisiae)和产黄青霉(Pencicilliumchrysogenum)为本实验室保藏菌种。各菌种以试管斜面保存于5 ℃备用。
1.3 主要仪器
KH-5200DB型台式数控超声波清洗仪(昆山禾创超声仪器有限公司),超净工作台(美国Thermo公司)、MJP-250型霉菌培养箱(广东环凯微生物科技有限公司)、MLS-3750型高压灭菌器(SANYO公司)、微量移液器(Finnpipette)及XW-80A型漩涡混合器(上海琪特分析仪器公司)等。
1.4 主要试剂
甲醇、95%乙醇均为国产分析纯,卡那霉素(进口试剂分装),均购自广州威佳生物技术有限公司;营养肉汤、营养琼脂、沙保氏培养基(广东环凯微生物科技有限公司)。
2 方法
2.1 抑菌活性物质的提取制备
2.1.1 乙醇提取物的制备 分别取溪黄草6种基原植物的地上部分约1 kg,剪切成1 cm长的碎片,60 ℃烘干,分别称取烘干的药材碎片50 g,按1∶10的比例加入80%乙醇水溶液,室温浸泡40 min后,参照文献方法[6],于35 ℃、频率40 kHz超声波提取55 min,趁热抽滤,滤液用旋转蒸发仪浓缩得到乙醇提取物(浸膏),用50 mL甲醇将提取物溶解后过滤,滤液中生药的质量浓度为1 g·mL-1,作为醇提物供试药液,即供试药液每1 mL含生药1 g,本文中所涉及的供试药液浓度均按此定义。
2.1.2 水提物的制备 同2.1.1方法,取烘干药材碎片按1∶10的比例加入蒸馏水浸泡40 min,于35 ℃、频率40 kHz超声波提取55 min,趁热抽滤,滤液用旋转蒸发仪浓缩得到水提物(浸膏),用50 mL蒸馏水将提取物溶解后过滤,滤液中生药的质量浓度为1 g·mL-1,作为水提物供试药液。
2.2 供试菌液的制备
供试细菌菌液:挑取在新鲜斜面培养基上培养24 h的供试菌种,接种至营养肉汤培养基中,摇匀后于37 ℃培养20~24 h,菌液浓度约为108cfu·mL-1(用平板稀释菌落计数法测定),将此菌液用无菌0.9%氯化钠溶液稀释到1.5×105cfu·mL-1,备用。
供试真菌菌液:取在新鲜斜面培养基上培养5~7 d的供试菌种,加入无菌0.9%氯化钠溶液2 mL,轻轻摇晃试管,使孢子或酵母细胞充分进入0.9%氯化钠溶液中,将菌液倒入无菌小烧杯内,用0.9%氯化钠溶液调整至浓度为1×106~6×106cfu·mL-1(血球计数板测定),备用。
2.3 体外抑菌活性测定
参照中国生物药品检验法操作[7],采用琼脂平板扩散法中的菌基平板打孔法进行体外抑菌活性测定。将100 μL稀释菌液与冷却至40 ℃的营养琼脂培养基15 mL混合后,倒入直径为9 cm的平皿中静置冷凝。用无菌打孔器在琼脂平板上均匀打上3个直径为6 mm的孔,相邻两孔之间距离30 mm以上,挑出孔内琼脂培养基,将不同浓度的供试药液滴入孔内(每孔30 μL),醇提物的阴性对照滴加甲醇溶液,水提物的阴性对照滴加无菌水,阳性对照滴加卡那霉素0.9%氯化钠溶液(100 mg·mL-1)。所有平板置37 ℃培养箱内培养24 h后,观察、测定抑菌圈大小。每个处理6个重复,测定结果采用统计软件SPSS17.0进行数据分析。
2.4 最小抑菌浓度(Minimal Inhibition Concentration,MIC)的测定
取含生药1 g·mL-1的供试药液,采用二倍稀释法[7]对供试药液进行梯度稀释,在各稀释管中加入100 μL浓度为104~105cfu·mL-1的菌悬液,混匀,置培养箱内37 ℃培养24 h后,每管吸取100 μL涂布于营养琼脂培养基上,置培养箱内37 ℃培养20~24 h,以平板中无供试菌落生成的最低药液浓度为供试药液对该菌的最小抑菌浓度(MIC)。
2.5 体外抗真菌活性测定
采用琼脂平板扩散法中的菌基平板滤纸片法[8]进行体外抗真菌活性测定。将灭菌后的沙保氏培养基制成平板,待充分凝固后,在培养基上滴加100 μL稀释的供试真菌菌液并均匀涂布。灭菌滤纸片(直径为6 mm)在供试药液中浸泡30 min,将含有饱和供试药液的滤纸片取出,贴在培养基表面并轻压使其接触良好。分别用浸渍甲醇溶液和无菌水的滤纸片作为醇提物和水提物的阴性对照,同法贴于培养基表面。将所有平板置培养箱内30 ℃培养3~5 d。观察、测定抑菌圈大小。每个处理3个重复,测定结果采用统计软件SPSS 17.0进行数据分析。
2.6 真菌最小抑菌浓度(MIC)的测定
采用倍比稀释法[7],将供试药液稀释成相应浓度后,与沙保氏培养基以1∶1的比例混合,对照组为无菌0.9%氯化钠溶液与沙保氏培养基以1∶1混合。待培养基冷凝后,在培养基中央滴入浓度为103~104cfu·mL-1的供试真菌菌液20 μL,置培养箱内30 ℃培养20~24 h,观察培养基中的菌落生长情况,以培养基中无供试菌落生成的最低药液浓度为供试药液对该菌的最小抑菌浓度(MIC)。
3 结果
3.1 不同基原溪黄草乙醇提取物的抑菌活性
供试的6种溪黄草基原植物醇提物对金黄色葡萄球菌、表皮葡萄球菌、枯草芽孢杆菌、普通变形杆菌生长都有一定程度的抑制作用,其中,溪黄草和显脉香茶菜的醇提物对金黄色葡萄球菌、表皮葡萄球菌和枯草芽孢杆菌的抑菌圈直径都超过了25 mm,与阴性对照相比差异具有统计学意义(P<0.01),显示高度的抑制活性。而对于供试的3个革兰氏阴性菌,6种溪黄草基原植物的乙醇提取物中,仅有溪黄草、纤花线纹香茶菜和显脉香茶菜的醇提物对普通变形杆菌有中度抑制,差异具有统计学意义(P<0.05);而大肠杆菌和绿脓杆菌对所有基原植物的醇提物均不敏感(见表1)。
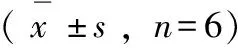
表1 不同基原溪黄草乙醇提取物的抑菌活性
注:与阴性对照相比,*P<0.05,**P<0.01。
3.2 不同基原溪黄草水提取物的抑菌活性
供试的6种溪黄草基原植物的水提物的抑菌结果显示:在生药的质量浓度为1 g·mL-1时,仅有溪黄草、纤花线纹香茶菜和显脉香茶菜对金黄色葡萄球菌和表皮葡萄球菌有低度抑制活性,抑菌圈直径均低于13.0 mm,但对其他供试菌均没有抑制作用;而线纹香茶菜、狭基线纹香茶菜和长叶香茶菜对所有供试菌均无抑制作用,抑菌圈直径小于6 mm。即6种溪黄草基原植物的水提物均无明显抑菌作用。
3.3 不同基原溪黄草乙醇提取物的最小抑菌浓度(MIC)及抑菌效果
根据抑菌活性试验结果,对有抑制作用的溪黄草基原植物醇提物进行最小抑菌浓度(MIC)的测定。结果显示,溪黄草和显脉香茶菜的抑菌效果最好,其中溪黄草对金黄色葡萄球菌、表皮葡萄球菌和枯草芽孢杆菌的最小抑制浓度分别为0.063、0.125、0.125 g·mL-1,而长叶香茶菜的抑菌效果最差(见表2)。
由于添加醇提物之后,试管内的溶液有浑浊,不易观察到是否有菌生长,本研究采用平板涂布培养的结果来判断菌的生长,所测的最小抑菌浓度(MIC)也是供试药液的最小杀菌浓度(MBC)。
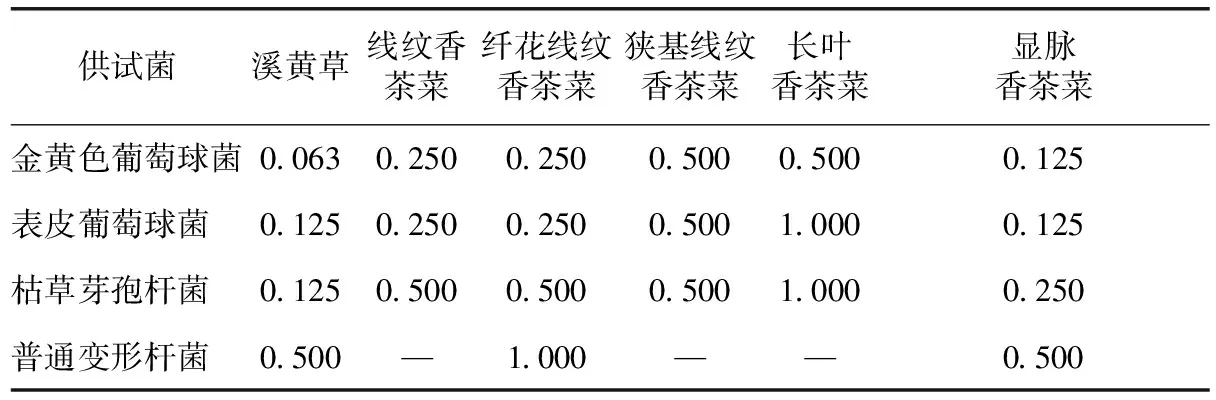
表2 溪黄草基原植物醇提物的最小抑菌浓度测定 /g·mL-1
3.4 不同基原溪黄草的抗真菌活性
采用平板菌基滤纸片法对不同基原溪黄草的醇提物和水提物进行体外抗真菌活性测定的结果显示,不同基原的醇提物对供试真菌均有一定程度的抑制作用,其中,溪黄草、线纹香茶菜和显脉香茶菜的抑菌效果显著(P<0.05);而长叶香茶菜的抑菌效果最弱(见表3)。而不同基原溪黄草的水提物对供试真菌的抑菌圈直径均小于6 mm,没有抑菌作用。
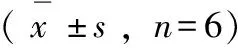
表3 溪黄草基原植物醇提物对供试真菌的抑制作用
注:与阴性对照相比,*P<0.05;—表示无抑菌作用。
3.5 不同基原溪黄草醇提物的最小抑真菌浓度(MIC)
采用药液倍比稀释法对3种供试真菌的最小抑菌浓度(MIC)进行测定,结果见表4。结果显示,不同基原溪黄草中,溪黄草的真菌抑制作用最强,其中对白色念珠菌和酿酒酵母的MIC值均为0.125 g·mL-1,线纹香茶菜和显脉香茶菜次之,最弱为长叶香茶菜。

表4 溪黄草基原植物醇提物对供试真菌的最小抑菌浓度(MIC) /g·mL-1
4 讨论
溪黄草在临床上主要用于治疗各种肝炎、胆囊炎等病,但也有研究表明溪黄草具有抑菌活性[9],而各地作为溪黄草入药的植物有近10种,这些植物的化学成分可能各不相同,其药理活性可能也有差异。溪黄草的几个基原植物都是香茶菜属植物,而孙汉董等[10-11]对香茶菜属的研究显示,该属植物大多含有丰富的二萜类成分,如特征性的贝壳杉烷型二萜,具有较强的抗菌作用和细胞毒活性。从本研究进行的体外抑菌试验看,各不同基原的溪黄草其抑菌作用有相似之处:其抑菌活性物质主要存在乙醇提取部位,水提物均未表现出抑菌作用,且醇提物对供试的革兰阳性菌都有较强的抑制作用,而对革兰阴性菌则没有抑制。但各基原植物间的抑菌活性仍有差别,其中,抑菌作用最强的是溪黄草和显脉香茶菜,长叶香茶菜最弱。6种溪黄草基原植物中,仅溪黄草乙醇提取物显示较好的抗真菌作用,其对白色念珠菌和酿酒酵母的最低抑菌浓度(MIC)均为0.125 g·mL-1,其他基原植物醇提物的抗真菌作用都很弱,并且所有基原植物的水提物均未显示出抗真菌作用。
显脉香茶菜也叫蓝花柴胡,其形态与溪黄草非常相似,其抑菌活性也与溪黄草相近。而在《中药大辞典》中作为溪黄草正品的基原植物——线纹香茶菜,在本研究中显示抑菌活性很低,原因可能与其提取物的成分有关。近年来报道的有关溪黄草化学成分分析研究的结果显示,溪黄草的不同基原植物都有酯类、黄酮类等共有成分,但各主体成分的含量差别很大,其中,纤花线纹香茶菜和溪黄草富含酯类和羧酸类等物质,而线纹香茶菜和狭基线纹香茶菜中富含黄酮类物质[12]。此外,对不同基原溪黄草中咖啡酸与迷迭香酸的含量测定[13]及水溶性成分分析结果[14]显示:溪黄草中这些成分的含量均低于其他基原植物,然而在本研究中,溪黄草在6种基原植物中显示了最好的抗菌和抗真菌活性,因此,其活性成分可能不是上述几类,具体成分还需做进一步分析研究。
溪黄草是多种中成药和保健品的主要原料,并且是广东民间广泛使用的特色中药,其市场需求量极大,但由于其基原植物多样,没有统一的质量控制标准,其药材生产上存在质量不稳定、产品开发利用率较低等问题。本研究对溪黄草的不同基原植物进行体外抗菌活性的测定,对于溪黄草的药材质量评价和质量控制均具有重要意义,但提取物的成分复杂,具体的抗菌活性成分还有待于进一步深入研究。
[1] 肖树雄,杨启存,吕红.溪黄草的来源及混淆品的鉴别[J].中药材,1993,16(9):24-26.
[2] 南京中医药大学.中药大辞典:下册[M].2版.上海:上海科学技术出版社,2006:3541-3542.
[3] 全国中草药汇编编写组.全国中草药汇编:上册[M].北京:人民卫生出版社,1978:860.
[4] 广东省中药材标准编委会.广东省中药材标准:第二册[M].广州:广东科技出版社,2004:204-205.
[5] 陈建南,赖小平,刘念.广东溪黄草药材的原植物调查及商品鉴定[J].中药材,1996,19 (2):73-74.
[6] 段志芳,梁盛年,谭细雪.溪黄草黄酮的超声波法提取与活性研究[J].应用化工,2007,36(3):232-235.
[7] 马绪荣,苏德模.药品微生物学检验手册[M].北京:科学出版社,2001:211-216.
[8] 王洁,唐春萍,江涛,等.香鳞毛蕨有效部位对糠秕马拉色菌的体外抗真菌作用研究[J].中成药,2015,37(3):642-645.
[9] 梁盛年,段志芳,付莉.溪黄草乙醇提取物的体外抗菌活性测定[J].食品科技,2003,21(12):58-60.
[10] SUN H D,HUANG S X,HAN Q B.Diterpenoids from Isodon species and their biological activities[J].Natural Product reports,2006,23:673-698.
[11] LIU X,XUE Y B,DONG K,et al.Three newent-kaurane diterpenoids fromIsodonrubescensand their cytotoxicities [J].Chinese Journal of Natural Medicines,2012,10(6):464-470.
[12] 黄冬兰,陈小康,徐永群.溪黄草四种基源植物的二维相关红外光谱鉴别研究[J].光散射学报,2015,27(1):64-68.
[13] 朱德全,黄松,陈建南,等.不同品种、不同产地溪黄草咖啡酸与迷迭香酸的含量测定[J].中国实验方剂学杂志,2013,19(2):114-117.
[14] 唐海明,陈建南,张扬,等.HPLC法同时测定不同来源溪黄草药材中8 个水溶性成分的含量[J].药物分析杂志,2015,35(2):228-234.
AntibacterialandAntifungalActivitiesofDifferentPlantResourcesofHerbaIsodonSerra
MOXiaolu*,QIUWeifen,HUANGShanshan,ZENGQingqian,CHENYuzhen
(GuangdongInstituteofTraditionalChineseMedicine,Guangzhou510520,China)
Objective:To investigate the antibacterial and antifungal activities of different plant resources of HerbaIsodonSerra,and provide research evidence for the herbs’ quality control.MethodsThe tested plants were extracted with 80% ethanol and distilled water,respectively,and under ultrasonic wave of 40 KHZ for 55 min.The ethanol and water extracts were both tested their antibacterial and antifungal activities with disk diffusion method,the tested bacteria wereStaphylococcusaureus,Staphylococcusepidermidi,Bacillussubtilis,Proteusvulgaris,Escherichiacoliandseudomonasaeruginosa,whileCandidaalbicans,SaccharomycescerevisiaeandPencicilliumchrysogenumwere the tested fungi.The Minimal Inhibition Concentration (MIC) of the extracts were tested by doubling dilution method.ResultsThe ethanol extract of 6 plants showed middle to high antibacterial activities to tested Gram-positive bacteria while little antibacterial activities to Gram-negative bacteria,and among them,the extract fromIsodonserrashowed the highest antifungal activity.All water extract from 6 plants showed scarce antibacterial nor antifungal activities to all tested microbes.ConclusionIsodonserrahas the highest antibacterial and antifungal activity among 6 tested plant resources of herbaIsodonSerra.
Isodonserra;antibacterial activities,antifungal activities;plant resources;Isodonlophanthoides
2015-10-16)
广东省中医药管理局项目(20131275)
*
莫小路,教授,研究方向:药用植物组织培养与资源开发;Tel:(020) 28854883,E-mail:moxl@gdyzy.edu.cn
10.13313/j.issn.1673-4890.2016.8.008
