响应面法优化柠条锦鸡儿总黄酮超声提取工艺及其体外抗氧化性研究
2016-10-31陆丽娜康淑荷
寇 亮,李 璐,陆丽娜,康淑荷,*
(1.西北民族大学化工学院,甘肃兰州 730030;2.环境友好复合材料及生物质利用甘肃省高校重点实验室,甘肃兰州 730030)
响应面法优化柠条锦鸡儿总黄酮超声提取工艺及其体外抗氧化性研究
寇亮1,2,李璐1,2,陆丽娜1,2,康淑荷1,2,*
(1.西北民族大学化工学院,甘肃兰州 730030;2.环境友好复合材料及生物质利用甘肃省高校重点实验室,甘肃兰州 730030)

柠条锦鸡儿,总黄酮,响应面法,超声辅助提取,抗氧化活性
柠条锦鸡儿(Caraganakorshinskiikom)又称柠条、大白柠条、毛条等,为多年生锦鸡儿属(CaraganaFabr.)灌木,根系庞大,入土深,具有独特的形态变化和生态适应性,抗干旱、抗寒冷,是我国西北干旱、半干旱地区一种重要的控制荒漠化的多年生灌木,主要分布于甘肃、宁夏、内蒙古、山西、陕西等地[1-4]。柠条锦鸡儿的根、茎、叶皆可入药,有滋阴养血、通经、镇静和止痒等功效,用于治疗发热、头晕头痛、炎症和妇科疾病,在传统中医药中应用历史悠久[5]。它还是高蛋白植物,可作为备选的食品添加剂原料,同时也是荒漠及荒漠草原地带的优良动物饲料[6]。
锦鸡儿属植物富含黄酮类化合物[7],该类化合物具有调脂、清除自由基、抗菌、抗肿瘤等药理活性[8],还是一种天然的抗氧化剂,在食品、药品、化妆品中都有广泛应用[9]。目前,对柠条锦鸡儿的研究大多聚焦于生物分类学、遗传多样性和生态价值[10],对其中的黄酮类化合物的提取及生物活性研究却鲜有报道。张华等[11]比较超声波-水浴提取法、微波提取法和液氮-乙醇提取法提取柠条锦鸡儿中总黄酮得率,发现得率由高到低依次为:超声波-水浴提取法、微波提取法、液氮-乙醇提取法。本论文运用超声辅助提取法、通过Box-Behnken设计-响应面法优化柠条锦鸡儿总黄酮的提取工艺,并对其体外抗氧化性进行研究,以期为进一步开发利用该植物提供理论依据。响应面曲线法优化柠条锦鸡儿总黄酮提取工艺及其体外抗氧化性研究笔者未见文献报道。
1 材料与方法
1.1材料与仪器
柠条锦鸡儿采摘自甘肃省兰州市五泉山麓,经西北民族大学化工学院制药工程教研室主任师永清教授鉴定为锦鸡儿属植物柠条锦鸡儿Caraganakorshinskiikom。选取柠条锦鸡儿地上部分叶及细枝条,室内阴干后,备用。芦丁对照品购自上海士锋科技有限公司。其他试剂均为市售商品级分析纯试剂。
SP-2100型紫外-可见分光光度计上海光谱仪器有限公司;UX620H型电子分析天平日本岛津公司;AB204-S型电子天平瑞士梅特勒公司;SB25-12DT型超声波清洗机宁波新芝生物科技股份有限公司;DHG-9023A型电热恒温鼓风干燥箱上海森信实验仪器有限公司;DFT-200型高速中药粉碎机温岭市林大机械有限公司。
1.2实验方法
1.2.1芦丁标准曲线的制作准确称取于105 ℃干燥的芦丁对照品10 mg,80%乙醇定容至10 mL,混合均匀,静置,得到1 mg/mL芦丁标准溶液,备用。从上述配制的芦丁标准溶液中吸取0.0、0.5、1.0、1.5、2.0、2.5 mL分别加入6个干燥的25 mL的容量瓶中,各加入80%乙醇至8 mL,加入1 mL 5%的NaNO2溶液摇匀后静置6 min,再加入1 mL 10% Al(NO3)3溶液,摇匀,静置5 min后加入4% NaOH溶液10 mL,最后再用80%乙醇定容并摇匀后静置15 min。以未加芦丁标准品的溶液作为空白对照,分别于510 nm处测定6个容量瓶中标准溶液的吸光度值[12]。
1.2.2柠条锦鸡儿中总黄酮的提取柠条锦鸡儿地上部分叶及细枝条室内阴干后粉碎过24目筛,准确称取3.00 g,置于100 mL锥形瓶中,用乙醇浸泡,在50 ℃水温下,50 kHz超声提取,过滤。滤渣再以相同的条件重复以上步骤超声、过滤,合并两次滤液至100 mL容量瓶中并用乙醇定容,从中精密量取1 mL溶液至25 mL的容量瓶中,用“1.2.1”中所述方法配制溶液。以波长510 nm处测量得到的吸光度值来计算总黄酮的得率方程为:
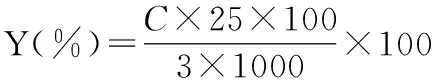
式中:C为待测溶液中总黄酮浓度(mg/mL),Y为总黄酮得率(%)。
1.2.3单因素实验以超声时间、料液比、乙醇浓度和提取次数四个因素为研究对象,以柠条锦鸡儿总黄酮得率为指标进行单因素实验。
1.2.3.1超声时间对总黄酮得率的影响以柠条锦鸡儿中的总黄酮得率为指标,在固定料液比1∶30 g/mL、乙醇浓度70%、提取2次的条件下,考察不同超声时间(20、30、40、50、60 min)对总黄酮得率的影响。
1.2.3.2料液比对总黄酮得率的影响以柠条锦鸡儿中的总黄酮得率为指标,在固定超声时间40 min、乙醇浓度70%、提取2次的条件下,考察不同料液比(1∶10、1∶20、1∶30、1∶40、1∶50 g/mL)对总黄酮得率的影响。
1.2.3.3乙醇浓度对总黄酮得率的影响以柠条锦鸡儿中的总黄酮得率为指标,在固定料液比1∶30 g/mL、超声时间为40 min、提取2次的条件下,考察不同乙醇浓度(50%、60%、70%、80%、90%)对总黄酮得率的影响。
1.2.3.4提取次数对总黄酮得率的影响以柠条锦鸡儿中的总黄酮得率为指标,在固定料液比1∶30 g/mL、超声时间为40 min、乙醇浓度为70%的条件下,考察不同提取次数(1次、2次、3次)对总黄酮得率的影响。
1.2.4响应面法优化柠条锦鸡儿总黄酮提取工艺在单因素实验结果基础上,按照Box-Benhnken 中心组合实验设计原理,采用Design-Expert 8.05b软件设计响应面实验。本实验选择超声时间(A)、料液比(B)、乙醇浓度(C)三个因素为考察因素,因素水平见表1。

表1 因素水平编码

1.2.5.1对羟基自由基(·OH)的清除实验测定方法参考相关文献[13-14],取一支10 mL容量瓶,依次加入1 mL 6 mmol/L H2O2溶液、2 mL 2 mmol/L FeSO4溶液、4 mL 6 mmol/L水杨酸乙醇溶液,蒸馏水定容,混合均匀,在37 ℃水浴环境下静置20 min,于510 nm波长处测定吸收波长A0。取5支10 mL量瓶依次编号为1~5,依次加入浓度为0.2、0.4、0.6、0.8、1.0 mg/mL的柠条锦鸡儿总黄酮提取液,然后严格按照测定A0的操作步骤分别加入同剂量相同试剂,蒸馏水定容至10 mL,置于37 ℃水浴环境下保温20 min,在510 nm波长处测定吸收波长Ax。另取5支10 mL容量瓶按照测定Ax操作分别加入柠条锦鸡儿总黄酮提取液,以蒸馏水代替上述混合溶液做为对照实验组,严格按照测定A0操作进行实验,于510 nm测定吸收波长Ax0。
样品溶液对(·OH)清除率计算公式:[1-(Ax-Ax0)/A0]×100%
式中:A0-空白组溶液的吸光度值;Ax-样品组吸光度值;Ax0-对照组吸光度值。
式中:A0-空白组溶液的吸光度值;Ax-样品组吸光度值;Ax0-对照组吸光度值。
1.2.5.3对DPPH·自由基的清除实验测定方法参考相关文献[13,16-17]。DPPH·储备液的准备:称取1,1-二苯基-2-三硝基苯肼5.0 mg,加无水乙醇进行溶解后定容于50 mL量瓶中,混合均匀。取六支10 mL量瓶按照1~6进行编号,均加入5.0 mL DPPH·储备液,加入自0.0~2.0 mg/mL以0.4 mg/mL为单位浓度梯度的柠条锦鸡儿总黄酮溶液,无水乙醇溶液定容,于暗处放置30 min,在517 nm波长下测定吸收波长A0及Ax。另取5支10mL容量瓶,严格按照测定Ax步骤,用无水乙醇溶液代替DPPH·储备液做对照实验组,测定Ax0。
样品溶液对DPPH·清除率按以下公式计算:[1-(Ax-Ax0)/A0]×100%
式中:A0-空白组溶液的吸光度值;Ax-样品组吸光度值;Ax0-对照组吸光度值。
1.2.5.4对ABTS+自由基的清除实验测定方法参考相关文献[18-19]。ABTS+储备液的配制:2.45 mmol/L过硫酸钾与7.00 mmol/L ABTS溶液等量均匀混合,黑暗放置反应15 h。向生成的ABTS+溶液中加入无水乙醇,以期于734 nm获得值为0.70±0.02的吸收值。取六支10 mL量瓶并编号1~6,均加入8.0 mL ABTS+储备液,再分别加入浓度为0.0 mg/mL至1.0 mg/mL以0.2 mg/mL为浓度梯度的柠条锦鸡儿总黄酮溶液,加无水乙醇进行定容,在30 ℃室温静置10 min,于734 nm处测定吸收波长A0及Ax。另取5支10 mL容量瓶严格按照测定Ax步骤,用无水乙醇代替ABTS+储备液做对照实验组,测定Ax0。
样品溶液对ABTS+清除率按照以下公式计算:[1-(Ax-Ax0)/A0]×100%
式中:A0-空白组溶液的吸光度值;Ax-样品组吸光度值;Ax0-对照组吸光度值。
1.3数据处理
运用Microsoft Excel(Office 2010)及Design-Expert 8.05b软件进行数据整理及分析。
2 结果与分析
2.1芦丁标准曲线的绘制
以芦丁对照品溶液浓度(mg/mL)(C)为横坐标、吸光度值(A)为纵坐标绘制标准曲线。得到回归方程为:A=6.0228C-0.0128,r=0.9997,线性范围为 0.0044~0.0222 mg/mL,线性关系良好。
2.2单因素实验结果
2.2.1超声时间的选择图1表明,20~40 min内得率随超声时间的增加而增大,在超声时间40 min时,柠条锦鸡儿总黄酮的得率出现最优值;当继续增加超声提取时间,得率略有下降,可能是由于增加超声时间黄酮类化合物已渐达饱和、不再明显溶出,并且随着超声时间的延长,植物细胞膜逐渐被破坏,其中的粘液等杂质溶出使提取液粘度增大,影响了提取效果[20]。因此,选择超声提取时间为30~50 min进行Box-Behnken实验设计。

图1 超声时间对柠条锦鸡儿总黄酮得率的影响Fig.1 The effect of times of extraction on the yield of total flavonoids
2.2.2料液比的选择图2可见,料液比对柠条锦鸡儿总黄酮得率的影响较大,随溶剂量的增加总黄酮的得率也增加,当料液比达到1∶30 g/mL时得率最大,继续增加溶剂量后得率反而有所降低,原因有可能是:料液比过小,黄酮溶解不充分;料液比过大,则样品中一些非黄酮类的化合物溶解度增大,与黄酮类化合物竞争性溶出,从而干扰黄酮的提取使其得率减小[13]。故选择料液比为1∶20~1∶40 g/mL进行Box-Behnken实验设计。

图2 料液比对柠条锦鸡儿总黄酮得率的影响Fig.2 The effect of solid/liquid ratio on the yield of total flavonoids
2.2.3乙醇浓度的选择图3表明,当乙醇浓度在50%~80%之间,柠条锦鸡儿总黄酮的得率随浓度增加而增大;当乙醇浓度为80%时总黄酮得率达到最大,继续增加乙醇浓度,总黄酮得率呈现下降趋势。原因可能是由于随着乙醇浓度增大,黄酮类化合物达到饱和,同时一些亲脂性强的色素、杂质等成分溶出量增加,这些成分与黄酮类化合物竞争性溶出,从而导致黄酮类化合物得率下降[21]。本实验选取乙醇浓度为70%~90%进行Box-Behnken实验设计。
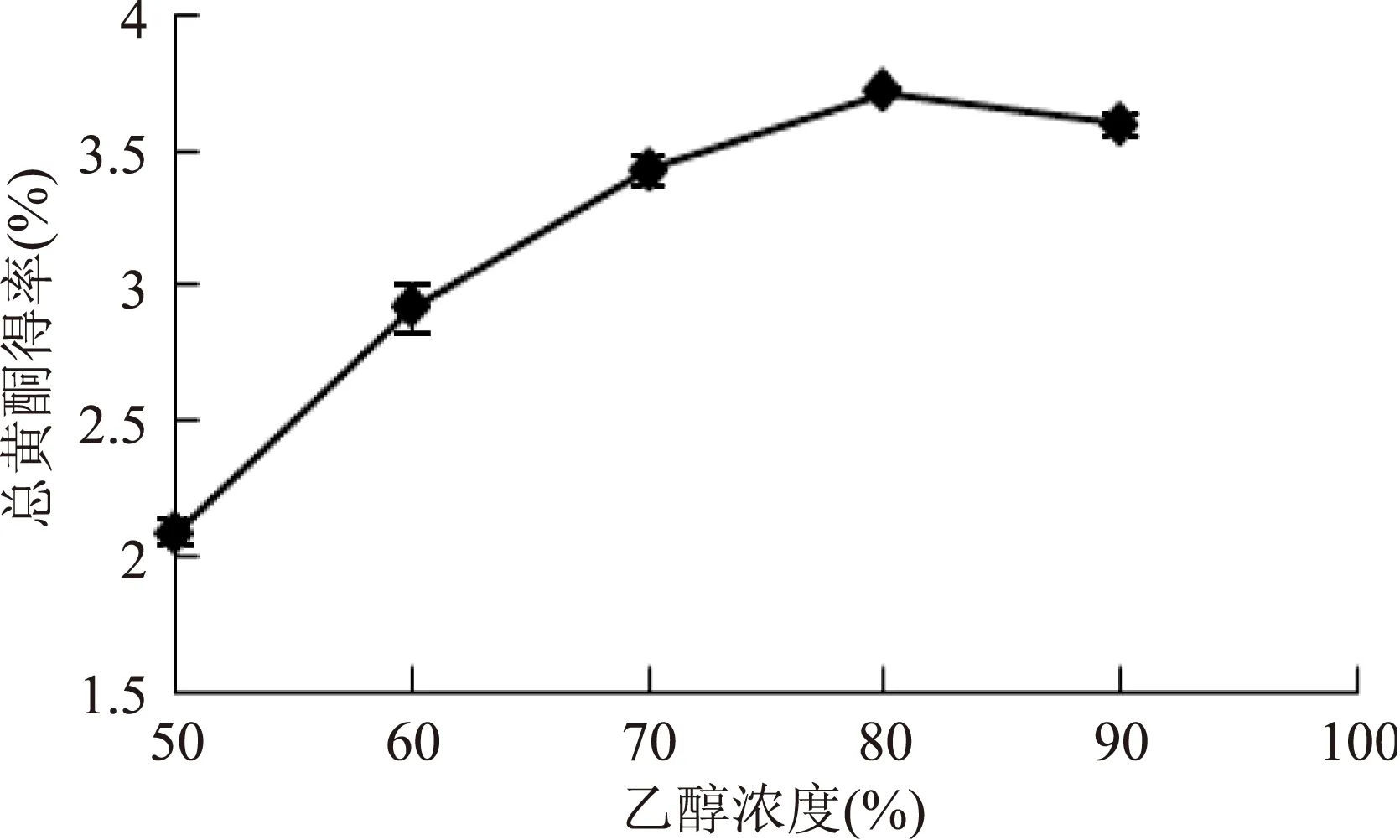
图3 乙醇溶液浓度对柠条锦鸡儿总黄酮得率的影响Fig.3 The effect of ethanol concentration on the yield of total flavonoids
2.2.4提取次数的选择图4表明,提取次数为3次时,柠条锦鸡儿总黄酮的得率有最大值,但提取2次与提取3次的差别不大,而且能耗大大增加,从实验时间和试剂成本方面考虑,选择提取次数2次较为合适。

图4 提取次数对柠条锦鸡儿总黄酮得率的影响Fig.4 The effect of times of extraction on the yield of total flavonoids
2.3响应面实验与结果
2.3.1响应面法确定柠条锦鸡儿总黄酮的较优提取条件以A:超声时间(min)、B:料液比(g/mL)、C:乙醇浓度(%)作为自变量,以柠条锦鸡儿总黄酮得率Y(%)作为其响应值,响应面分析实验方案及结果见表2。

表2 Box-Behnken实验设计及结果
采用Design-Expert 8.05b软件对表2中数据进行多项式拟合回归,建立多元二次响应面回归模型:Y(%)=3.72+0.081A+1.875×10-3B-0.12C+0.077AB+0.059AC+2.000×10-3BC-0.10A2-0.11B2-0.11C2,实验因素对响应值的影响不是简单的线性关系,A、C、AB、AC、A2、B2、C2对得率Y 的影响非常显著。表3回归统计分析结果表明:模型的F=60.92,p<0.0001,表明实验的二次模型是非常显著的,具有统计学意义。失拟项p值=0.0802>0.05,相关系数R2=0.9874,说明所得方程与实际拟合中非正常误差所占比例小,即失拟项是不显著的。结果显示此模型与实际实验拟合较好,可以很好地描述所得实验结果,真实的实验点用该方程代替进行分析是具有可行性的。通过F值可知,各单因素对柠条锦鸡儿总黄酮得率的影响程度大小依次为:乙醇浓度>超声时间>料液比;每两因素交互作用对柠条锦鸡儿总黄酮得率的影响因素大小依次为:超声时间和料液比>超声时间和乙醇浓度>料液比和乙醇浓度。

表3 响应面设计回归方程的方差分析
注:*表示显著性差异,p<0.05;**为极显著性差异,p<0.01。根据该模型绘制出各交互因素响应曲面图见图5。从图5a可看出,响应面坡度较陡,响应值随超声时间的变化率大于料液比的变化率,说明二者在交互作用中超声时间对总黄酮得率的影响大于料液比。同理,从图5b中可知乙醇浓度对总黄酮得率的影响大于超声时间;从图5c中可知乙醇浓度对总黄酮得率的影响大于料液比。观察对比图5a、图5b和图5c中响应面的坡度和等高线,图5a中响应面的坡度最陡,其等高线也更趋向于椭圆形,说明超声时间和液料比的交互作用最为显著;图5b中响应面的坡度较缓,其等高线也较圆,说明超声时间和乙醇浓度有较显著的交互作用但弱于超声时间和液料比;图5c中响应面最为平缓,其等高线也更趋向于圆形,说明料液比和乙醇浓度的交互作用较不显著。总之,此结果与模型中F值分析结果一致。
Design-Expert程序模拟出来的RSM结果显示,柠条锦鸡儿总黄酮的较优提取工艺为:超声时间42.61 min、料液比1∶30.98 g/mL、乙醇浓度75.12%;总黄酮得率的预测值为3.762%。
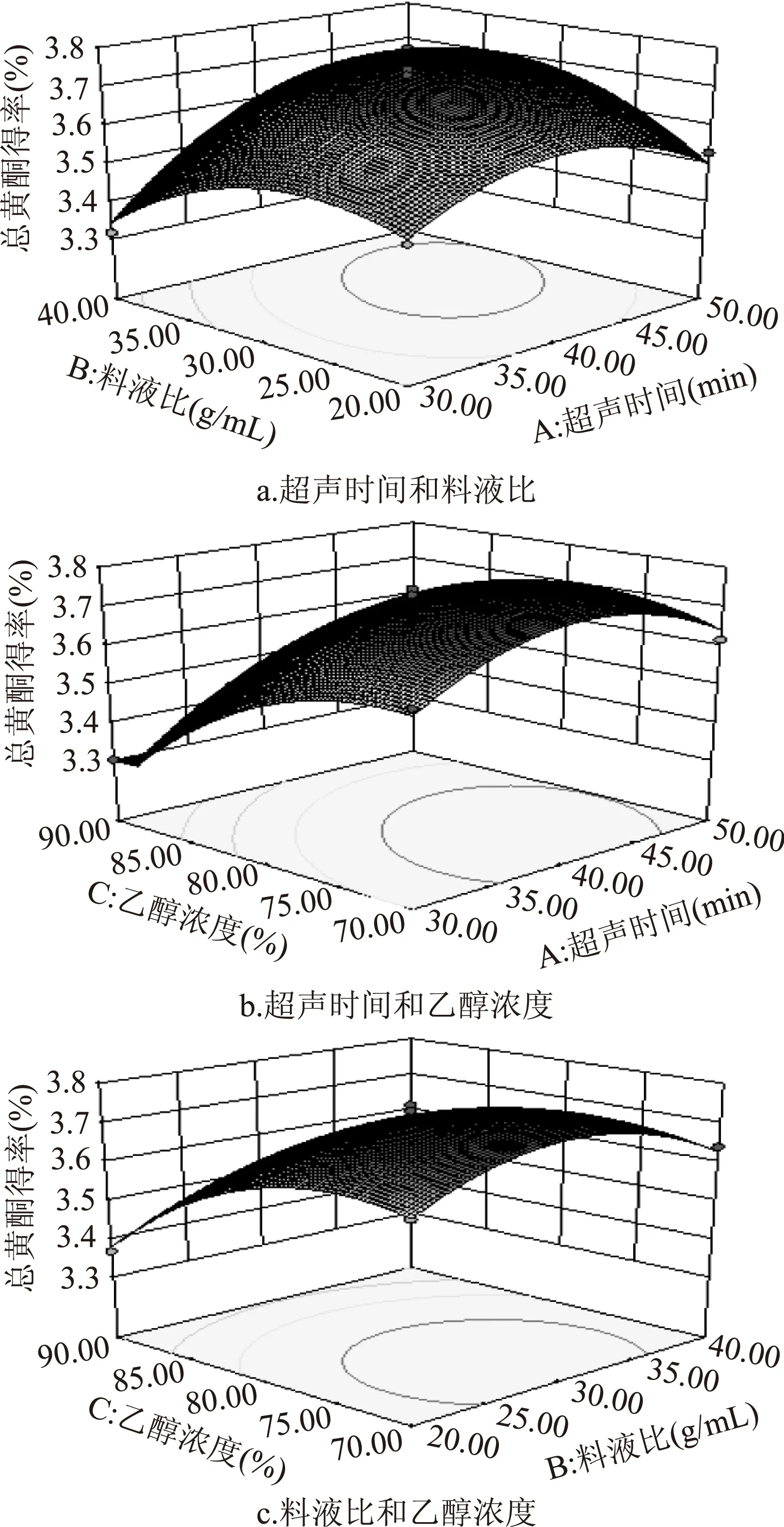
图5 各提取因素之间的交互作用影响响应面图Fig.5 Response surface plots showing the mutual effects of different factors on the yield of total flavonoids
2.3.2验证实验根据实验实际操作情况,将实验条件设置为:超声提取时间43 min、料液比1∶30 g/mL、乙醇浓度75%,进行3次重复实验(见表4)。计算得总黄酮得率的平均值为3.743%,RSD为0.94%,与模型总黄酮得率的预测值3.762%相比,误差仅0.5%,说明响应面优化得到的提取工艺条件可靠性高,可预测性好。
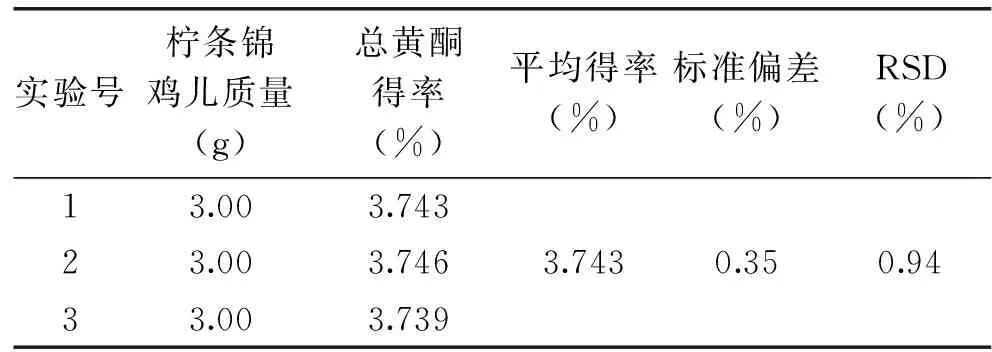
表4 工艺验证结果
2.4抗氧化性实验的结果分析
2.4.1对羟基自由基(·OH)的清除实验结果根据图6能够得知,柠条锦鸡儿总黄酮对羟基自由基(·OH)有显著的清除效果。在受测浓度范围内,其清除羟基自由基(·OH)的作用比相同浓度的VC要略强,且随着柠条锦鸡儿总黄酮溶液浓度的增加,清除率不断增加,柠条锦鸡儿总黄酮浓度为1.0 mg/mL时清除率不再有明显的增加,清除率达90%。

图6 柠条锦鸡儿总黄酮对羟基自由基清除Fig.6 Scavenging effects of total flavonoids on ·OH

图7 柠条锦鸡儿总黄酮对超氧自由基清除Fig.7 Scavenging effects of total flavonoids on ·
2.4.3对DPPH·的清除实验结果根据图8能够得知,在受测浓度范围内,VC对DPPH·始终保持很明显的清除作用,都能达到95%以上;柠条锦鸡儿总黄酮对DPPH·的清除效果也较显著,但明显弱于VC,其清除率随总黄酮浓度增大不断增加,柠条锦鸡儿总黄酮浓度接近于0.8 mg/mL时清除率不再有明显的增加,浓度为1.0 mg/mL时清除率达40%以上。

图8 柠条锦鸡儿总黄酮对DPPH·的清除Fig.8 Scavenging effects of total flavonoids on DPPH·
2.4.4对ABTS+自由基的清除实验的结果按照“1.2.5.4”中所述方法计算出ABTS+自由基得清除率,结果如图9。图9显示,在受测浓度范围内,VC对ABTS+自由基有很强的清除作用,0.6 mg/mL以后清除率就保持在90%以上;柠条锦鸡儿总黄酮对ABTS+自由基的清除作用相对弱于VC,但依然有着较为明显的清除作用,在浓度达到0.8 mg/mL时清除效果最佳,清除率达到76%。随着总黄酮浓度进一步增大,对ABTS+自由基清除率又有所降低,这种情况分析认为与“2.4.2”中的情况原因类似,但具体原因仍待进一步求证。

图9 柠条锦鸡儿总黄酮对ABTS+自由基清除Fig.9 Scavenging effects of total flavonoids on ABTS+
3 结论

[1]牛西午.中国锦鸡儿属植物资源研究-分布及分种描述[J].西北植物学报,1999,19(5):107-133.
[2]关林婧,马成仓.21世纪锦鸡儿属植物研究进展[J].草地学报,2014(4):697-705.
[3]中国科学院中国植物志编辑委员会.中国植物志(第24卷)[M].北京:科学出版社,1993:161.
[4]Yang H Y,Song X L,Yuan T Q,et al. Fractional Characterization of Hemicellulosic Polymers Isolated fromCaraganakorshinskiiKom[J]. Industrial & Engineering Chemistry Research,2011,50(11):6877-6885.
[5]强伟,胡娜,韩丽娟,等.柠条锦鸡儿籽油体外抗真菌作用及其机制研究[J].天然产物研究与开发,2012,24(11):1614-1617.
[6]Zhong C,Wang R,Zhou Z,et al. Functional Properties of Protein Isolates fromCaraganakorshinskiiKom. Extracted by Three Different Methods[J]. Journal of Agricultural & Food Chemistry,2012,60(41):10337-10342.
[7]刘红霞,林文翰,杨峻山.锦鸡儿属植物化学成分及药理作用研究进展[J].中国药学杂志,2004(5):14-17.
[8]方一杰,徐岩成,安毛毛,等.黄酮类化合物的药动学和药理作用研究进展[J].药学服务与研究,2015(1):6-9.
[9]陈红梅,谢翎.响应面法优化半枝莲黄酮提取工艺及体外抗氧化性分析[J].食品科学,2016(2):45-50.
[10]Zhong C,Sun Z,Zhou Z,et al. Chemical Characterization and Nutritional Analysis of Protein Isolates fromCaraganakorshinskiiKom.[J]. Journal of Agricultural & Food Chemistry,2014,62(14):3217-3222.
[11]张华,特布沁,包玉英.不同方法对柠条锦鸡儿中总黄酮含量测定的影响[J].安徽农业科学,2013,41(1):318-318.
[12]庞庭才,胡上英,钟秋平,等.响应面法优化超声辅助提取银叶树果壳黄酮的工艺[J].中药材,2014(12):2289-2293.
[13]许远,魏和平,吴彦,等.响应面优化襄荷总黄酮提取及抗氧化研究[J].食品工业科技,2015(5):233-239.
[14]胡琴,齐云,许利平,等.葛根黄酮的体外抗氧化活性研究[J].中药药理与临床,2007(6):29-31.
[15]陆晓婷,张超,张晖,等.黑籽瓜种子蛋白酶解工艺及抗氧化性研究[J].食品科技,2015(5):73-78.
[16]徐秀泉,虞倩,徐颖,等.赶黄草总黄酮超声提取工艺的响应面法优化及其体外抗氧化活性分析[J].中国实验方剂学杂志,2012,18:38-41.
[17]徐运飞,刘琴,宋珅,等.响应面法优化黄参多糖的提取工艺及其体外抗氧化活性[J].天然产物研究与开发,2015,12:2116-2123.
[18]段宙位,窦志浩,何艾,等.青金桔皮中多酚的提取及其抗氧化性研究[J].食品工业科技,2015(10):244-248.
[19]郑朋朋,李珊,戚丽蓉,等.山楂多糖的提取及其抗氧化性作用[J].中国酿造,2015(6):107-113.
[20]刘伟,何晓燕,陈文强,等.响应面优化野生樱桃李叶总黄酮的超声辅助提取工艺[J].天然产物研究与开发,2015,v.2710:1765-1770.
[21]王宗成,蒋玉仁,刘小文,等.响应面优化生姜茎叶总黄酮提取工艺及其抗氧化活性研究[J].天然产物研究与开发,2015,v.2709:1582-1588.
[22]井乐刚,路芳,张永忠.大豆异黄酮的抗氧化活性[J].食品与发酵工业,2004(2):62-65.
Optimization of extraction of total flavonoids fromCaraganakorshinskiikom with ultrasound technology by response surface analysis and evaluation of its antioxidant activityinvitro
KOU Liang1,2,LI Lu1,2,LU Li-na1,2,KANG Shu-he1,2,*
(1.Chemical Engineering College of Northwest University for Nationalities,Lanzhou 730030,China; 2.Key Laboratory for Utility of Environment-friendly Composite Materials and Biomass in Universities of Gansu Province,Lanzhou 730030,China)

Caraganakorshinskiikom;flavonoids;response surface methodology;ultrasonic-assisted extraction;antioxidant activity
2016-03-03
寇亮(1983-),男,硕士,实验师,研究方向:药物化学及天然有机化学,E-mail:kouliang83@163.com。
康淑荷(1972-),女,硕士,副教授,主要从事天然药物的研究与开发,E-mail:523429214@163.com。
中央高校基本科研业务费专项资金项目(31920160049)。
TS201.2
B
1002-0306(2016)17-0225-07
10.13386/j.issn1002-0306.2016.17.036
