蚕蛹蛋白源血管紧张素转换酶抑制肽抑制机理研究
2016-10-31王朝阳赵钟兴陶萌良王欣辉孙华菊魏雅男
王朝阳,赵钟兴,陶萌良,王欣辉,孙华菊,魏雅男
(广西大学化学化工学院,广西高校资源化工应用新技术重点实验室,广西南宁 530004)
蚕蛹蛋白源血管紧张素转换酶抑制肽抑制机理研究
王朝阳,赵钟兴*,陶萌良,王欣辉,孙华菊,魏雅男
(广西大学化学化工学院,广西高校资源化工应用新技术重点实验室,广西南宁 530004)
以纯化得到的两条具有ACE抑制活性的肽(P1和P2)为基础,通过基质辅助激光解吸电离飞行时间质谱(MALDI TOF MS)确定P1、P2的氨基酸序列,并采用固相合成法合成,随后对它们的抑制动力学进行研究,最后用Sybyl软件分别将其与ACE进行分子对接。结果表明:P1的氨基酸序列为Gly-Asn-Pro-Trp-Met(IC50值为12.61 μg/mL),为非竞争性抑制肽,抑制常数Ki,1=0.037 mmol/L;P2的氨基酸序列为Asn-Arg-Tyr-Leu-Arg(IC50值为14.68 μg/mL),为竞争性抑制肽,其抑制常数Ki,2=0.020 mmol/L;P1、P2都能与ACE活性位点氨基酸残基形成氢键。P1、P2可以作为预防高血压的功能性食品,为蚕蛹蛋白的进一步开发利用提供理论基础。
蚕蛹蛋白,血管紧张素转换酶,抑制肽,分子对接,抑制动力学
血管紧张素转化酶(Angiotensin I-Converting enzyme,ACE,EC3.4.15.1)是一种在人体内广泛存在的二羧肽酶,能够催化血管紧张素Ⅰ生成血管紧张素Ⅱ,同时使舒缓激肽降解引起机体血压升高[1]。目前,市场上常用药物如卡托普利、赖诺普利等ACE抑制剂类药物易引起干咳、味觉障碍、皮疹等副作用[2],越来越多的学者开始从自然界中寻找安全高效的ACE抑制剂类药物。
蚕蛹是蚕蛾科昆虫家蚕蛾的蛹,是桑蚕产业的主要副产物。研究表明,蚕蛹富含蛋白质,且氨基酸比例适当,是一种优质的蛋白质来源,其水解产物具有抗氧化、抗疲劳、降血压等功能[3-6]。本课题组在前期实验中已从蚕蛹蛋白酶解液中得到具有ACE抑制活性的肽P1和P2[7-8],本实验通过基质辅助激光解吸电离飞行时间质谱(MALDI TOF MS)确定氨基酸序列,并对其抑制动力学进行研究,最后运用Sybyl软件分别模拟所得肽与ACE活性位点结合情况,为蚕蛹源ACE抑制肽的工业化和应用提供理论和技术支持。
1 材料与方法
1.1材料与设备
肽P1(Gly-Asn-Pro-Trp-Met)和P2(Asn-Arg-Tyr-Leu-Arg)从蚕蛹蛋白酶解产物中分离纯化得到[8],确定其氨基酸序列后由上海吉尔生化有限公司合成(经高效液相色谱法鉴定其纯度98%以上)。
马尿酰组氨酰亮氨酸(HHL)、血管紧张素转换酶(ACE)美国Sigma公司;甲醇(色谱纯)天津市科密欧化学试剂有限公司;赖诺普利(标准品)中国食品药品检定研究院;其他试剂均为分析纯。
1260高效液相色谱仪美国安捷伦科技有限公司;SHZ-88水浴恒温振荡器金坛市医疗器械厂;4800基质辅助激光解吸电离飞行时间质谱仪美国应用生物系统公司。
1.2实验方法
1.2.1肽序列结构鉴定将纯化得到的肽P1和P2样品配成超纯水溶液用于鉴定其氨基酸序列。取1 μL样品在MALDI靶板上点样晾干后加入1 μLα-氰基-4-羟基肉桂酸溶液,并以不加样品的α-氰基-4-羟基肉桂酸溶液为空白对照。仪器工作模式为:一级质谱采用Refletor Positive,分子量为500~1500 u;二级质谱采用1KV positive。采用正离子模式和自动获取数据的模式采集数据[9]。
1.2.2肽的固相合成按照鉴定出的肽的一级序列,采用固相合成法合成肽P1(Gly-Asn-Pro-Trp-Met)和P2(Asn-Arg-Tyr-Leu-Arg),该工作由上海吉尔生化有限公司完成,采用高效液相和电喷雾电离质谱检测合成肽的纯度及分子量,经高效液相色谱法鉴定其纯度大于98%。
1.2.3抑制活性的测定根据吕汶骏等[7]检验ACE抑制活性的方法并加以改进,将ACE、HHL用硼酸缓冲液(浓度为0.1 mol/L、pH8.3,含NaCl 0.3 mol/L)分别配制0.1 U/mL ACE溶液和5.8 mmol/L HHL溶液。取适量样品、硼酸缓冲液和ACE溶液共460 μL于离心管中,在37 ℃条件下保温10 min;再加入40 μL HHL溶液反应,1 h后加入1.0 mol/L HCl溶液100 μL中止反应,同时以不加样品为空白样。反应液滤膜过滤后色谱分析。
使用Agilent 1260色谱系统,色谱柱为ZORBAX SB C18色谱柱(4.0 mm×150 mm,5 μm);流动相为甲醇∶水=15∶85(v/v)(含0.1%三氟乙酸);流速为1.0 mL/min;检测波长为228 nm。根据空白和样品反应液中马尿酸峰面积计算抑制率。
式中,A为空白反应液中马尿酸的峰面积,mAU;B为样品反应液中马尿酸的峰面积,mAU。
1.2.4抑制肽与ACE可逆反应类型判别根据1.2.3所述实验方法,在加样和空白的反应体系中,分别利用不同浓度ACE进行反应初速度检测,并以赖诺普利为阳性对照。以ACE浓度[E]为横坐标,反应初速度(V0)为纵坐标作图,结合动力学曲线特征推断P1和P2对ACE的抑制类型。
1.2.5抑制肽对ACE抑制类型判别根据1.2.3所述实验方法,在HHL浓度分别为0.696、1.044、1.392、1.740、2.088 mmol/L的条件下,测定空白样和样品(P1、P2)浓度分别为20、40 μg/mL时ACE酶促反应速度,以赖诺普利为阳性对照(浓度分别为0.0001 μg/mL和0.0002 μg/mL)。绘制底物浓度[S]和反应初速度(V0)的Lineweaver-Burk双倒数图判断P1和P2对ACE的抑制类型。不同类型抑制剂具有不同的动力学方程式,其中,非竞争性抑制剂的动力学方程如式(1)所示,竞争性抑制剂的动力学方程如式(2)所示[10],计算ACE米氏常数Km与P1和P2抑制常数Ki。
式(1)
式(2)
式中,V0-反应初速度,mmol/(L·min);vmax-最大反应速度,mmol/(L·min);[S]-底物HHL的浓度,mmol/L;[I]-ACE抑制肽的浓度,mmol/L;Km-米氏常数。
1.2.6抑制肽与ACE活性中心的模拟对接利用Sybyl X-2.1.1软件构建多肽分子,使用Powell方法在Tripos力场下进行优化,采用Gasteiger-Huckel算法对各原子赋予电荷,完成后对多肽进行模拟退火计算搜索低能构象,初始温度为1000 K,冷却温度为100 K,高温平衡时间为1000 fs,降温时间为1000 fs,进行10个循环,对搜索到的低能构象再进行能量优化,将得到的构象进行对接计算。
从PDB数据库中下载ACE-赖诺普利复合物三维模型(代码:1086)[11],使用Sybyl X-2.1.1的默认流程进行蛋白准备,用MMFF99力场进行分子优化后加氢、加电荷,同样采用Gasteiger-Huckel算法赋予电荷,为处理方便,删除复合物中的所有水分子,使用Surflex-dock模式进行对接,分子对接的原型分子是采用automatic模式产生的,其余参数为默认,每个对接分子保留20个构象,选用Total_Score 打分最高的构象进行分析。
2 结果与分析
2.1氨基酸序列的结构鉴定
对蚕蛹蛋白中性蛋白酶水解产物分离得到的两条肽进行MALDI TOF MS解析。由图1可知,它们的分子离子峰分别为604.31 u和721.34 u,通过解析得到P1氨基酸序列为Gly-Asn-Pro-Trp-Met(图1a所示,b1~b5为肽P1的分子识别峰)、P2氨基酸序列为Asn-Arg-Tyr-Leu-Arg(图1b所示,y1~y5为肽P2的分子识别峰),并对其ACE抑制活性进行测定,得到IC50值分别为12.61 μg/mL(P1)和14.68 μg/mL(P2)。对目前有关蚕蛹蛋白源ACE抑制多肽的文献进行整理发现IC50值在5.01~47.00 μg/mL范围内[12-15],与这些多肽相比本实验中得到的蚕蛹蛋白源ACE抑制多肽具有较高的抑制活性。
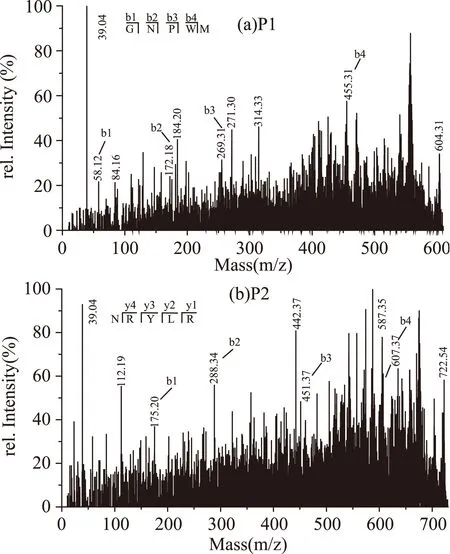
图1 抑制肽的MALDI TOF MS图谱Fig.1 MALDI TOF MS spectrum of inhibitory peptide
2.2抑制肽对ACE可逆反应类型判别
根据抑制剂与酶结合的特点和作用方式,可以将抑制剂分为可逆性抑制剂和不可逆性抑制剂。根据1.2.3的实验方法,以酶浓度[E]为横坐标,反应初速度(V0)为纵坐标作图,如图2所示。当反应体系中不存在抑制剂时,反应速率曲线通过坐标系原点;当反应体系中分别加入P1、P2、赖诺普利后,反应速率曲线通过原点,但斜率比无抑制剂时减小,由此可以判断P1、P2、赖诺普利对ACE均为可逆性抑制[16]。

图2 抑制剂对ACE的抑制动力学曲线Fig.2 Inhibition kinetic curves of inhibitor on ACE
2.3抑制肽对ACE的抑制类型判别
根据抑制剂、底物和酶三者的相互关系,可逆抑制又可分为竞争性抑制、非竞争性抑制和反竞争性抑制三种类型。根据1.2.4所述实验方法,绘制Lineweaver-Burk双倒数图,见图3。加入P1的两条速率曲线与没有抑制剂的速率曲线相交于横坐标说明P1为非竞争性抑制剂(图3a),加入P2、赖诺普利的两条速率曲线与没有抑制剂的速率曲线相交于纵坐标,说明P2、赖诺普利为竞争性抑制剂(图3b和图3c)。
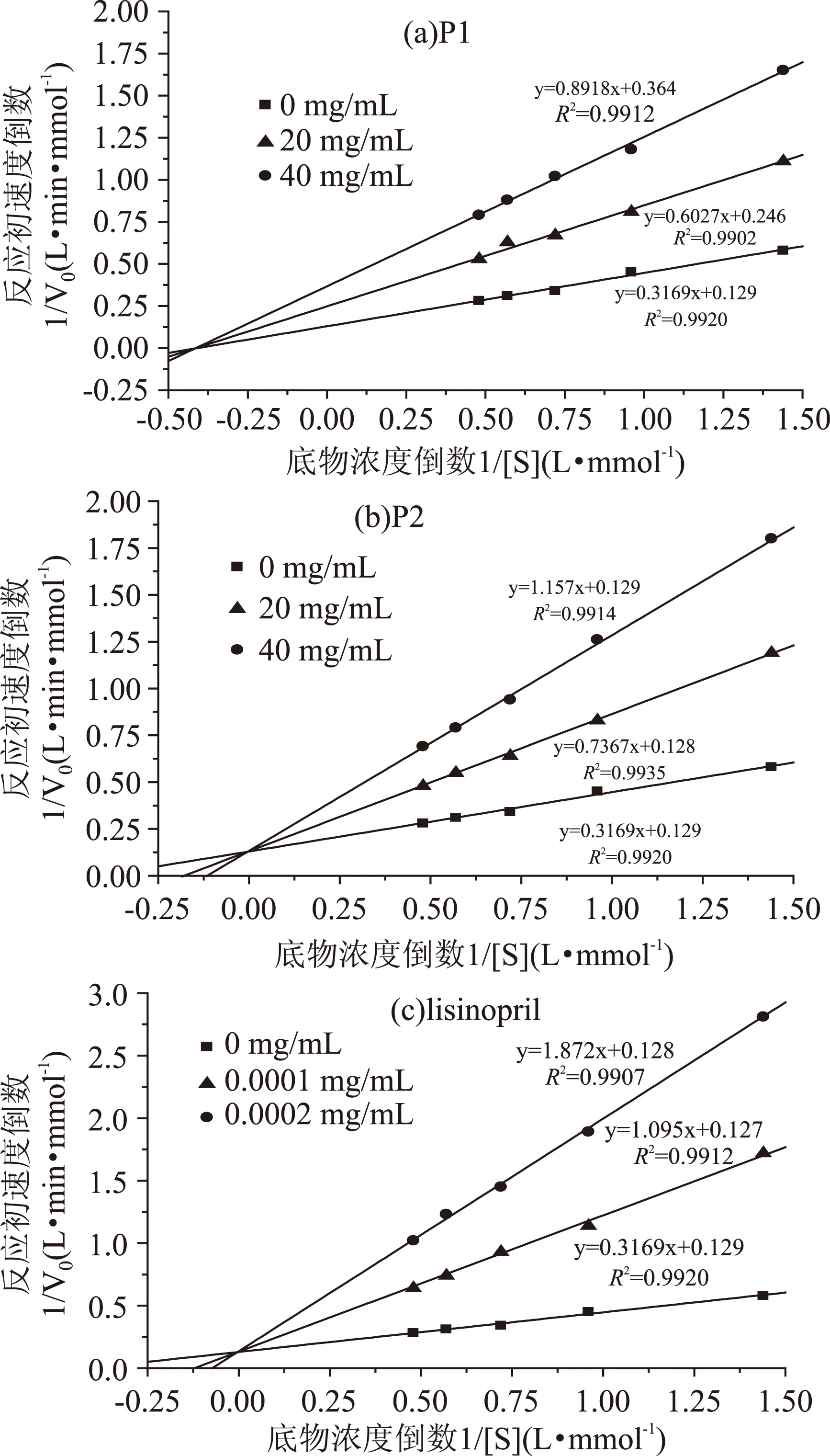
图3 抑制剂对ACE的Lineweaver-Burk图Fig.3 Lineweaver-Burk plots of inhibitors against ACE
将图3a~图3c中的数值分别带入到式(1)、式(2)中,得到ACE的米氏常数Km=2.45 mmol/L,与文献值相差不大(2.6 mmol/L)[17]。同时得到P1的抑制常数Ki,1=0.037 mmol/L,P2的抑制常数Ki,2=0.020 mmol/L,赖诺普利的抑制常数Ki,3=0.99×10-7mmol/L。抑制剂的抑制常数越小,其对酶的抑制作用越强。和赖诺普利相比,肽P1和P2对ACE的抑制作用较弱,与IC50值趋势相同。
2.4抑制肽与ACE活性中心的模拟对接
2.4.1对接结果分析分子对接方法是从已知结构的受体(靶蛋白或活性位点)和配体出发,通过化学计量学方法模拟分子的几何结构和分子间相互作用力来进行分子间相互作用识别并预测受体—配体复合物结构的方法[18]。为了研究抑制肽与ACE的相互作用,使用Sybyl软件中的Surflex-dock模块将常用药物赖诺普利、底物HHL及P1、P2与ACE进行了分子对接,分子对接结果如图4所示。
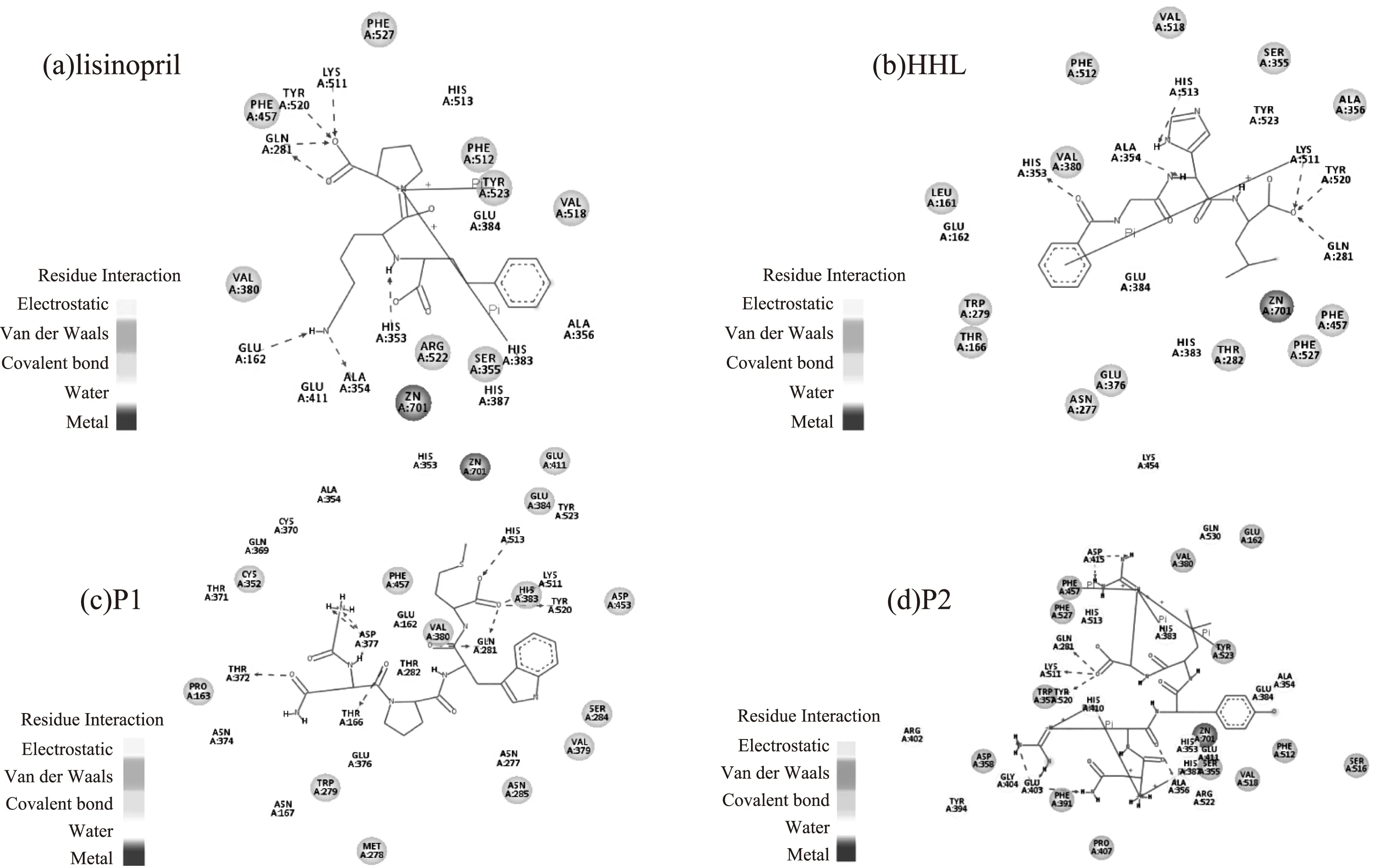
图4 复合物的相互作用模型Fig.4 The interaction models of complex
在图4a中赖诺普利与ACE的Glu162、Gln281、His353、Ala354、Lys511、Tyr520形成氢键,图4b中HHL与ACE的Gln281、His353、Ala354、Lys511、His513、Tyr520形成氢键(图4b),与文献中的记录吻合[19-20]。在图4c中P1与ACE的Thr166、Gln281、Thr372、Asp377、Lys511、His513、Tyr520形成氢键,图4d中P2与ACE的Gln281、Ala356、Glu403、Asp415、Lys511、Tyr520形成氢键。
据文献报道,ACE活性中心主要由三部分构成(S1,S2和S1’),其中S1由Ala354,Glu384和Tyr523等氨基酸残基组成,S2由Gln281、His353、Lys511、His513和Tyr520等氨基酸残基组成,而S1’仅由氨基酸残基Glu62组成[21]。P1能够与活性中心的Gln281、Lys511、His513和Tyr520形成氢键,P2能够与活性中心的Gln281、Lys511和Tyr520形成氢键,与已报道的蚕蛹蛋白源ACE抑制肽Ala-Ser-Leu[12](与活性中心Gln281、His353和Ala354形成氢键)和Ala-Pro-Pro-Pro-Lys-Lys[15](与活性中心的Glu162和His353形成氢键)相比,P1和P2能够占据较多活性中心的氨基酸残基。
2.4.2分子叠加分析将对接后的分子结构进行叠加,如图5所示,赖诺普利分子和HHL分子能够重叠,说明与赖诺普利结合后的ACE不能与底物HHL继续结合,从分子结构上支持了赖诺普利属于竞争性抑制剂[11]。同时,P2也可以和HHL分子进行叠合,而P1不能与HHL叠合,从分子结构上证明P2为竞争性抑制剂,P1为非竞争性抑制剂,与2.3的实验结果一致。
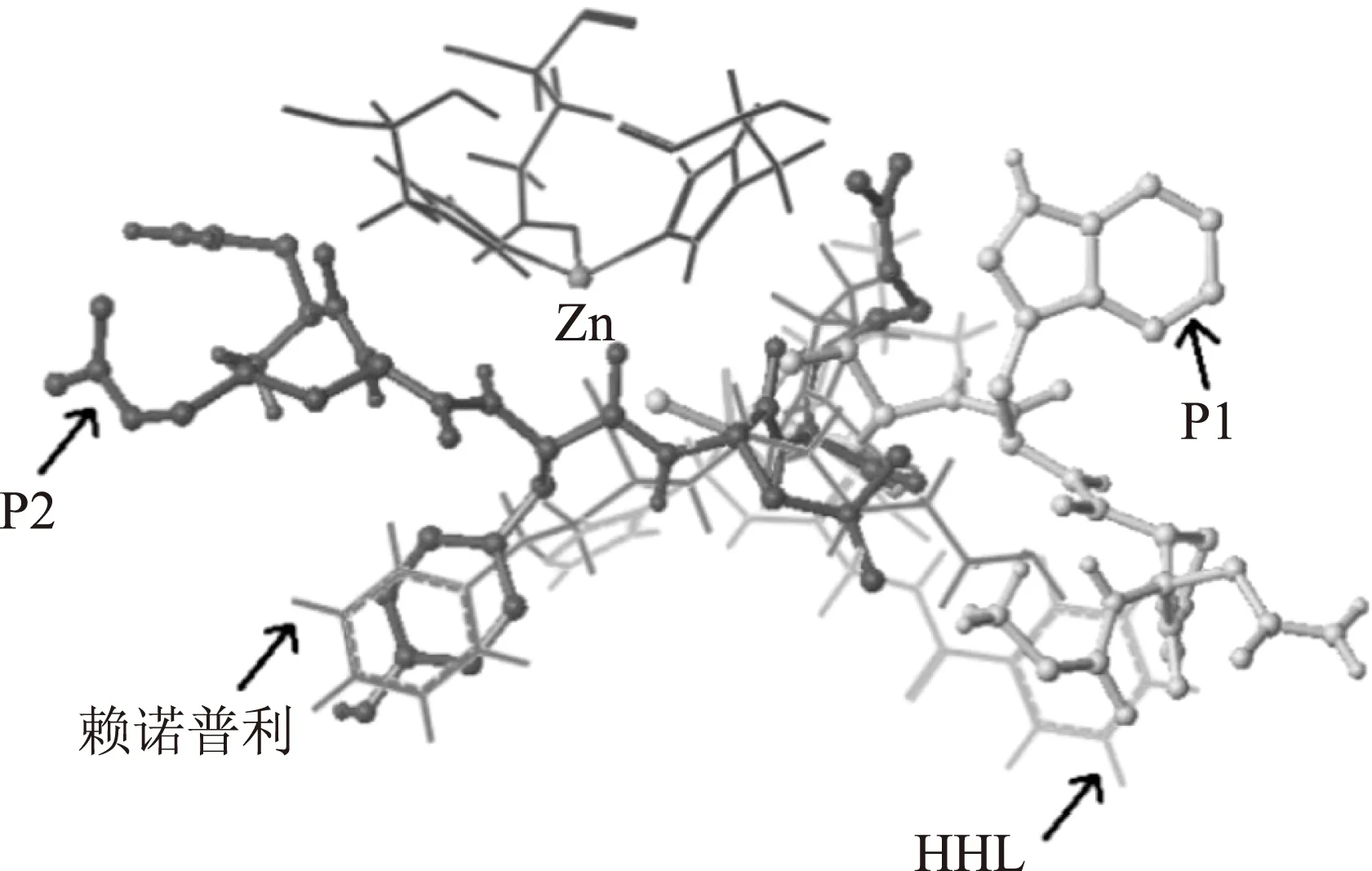
图5 HHL、赖诺普利、P1、P2与1086结构叠加Fig.5 Overlap of HHL,lisinopril,P1,P2 with 1086
3 结论
通过MALDI TOF MS对多肽序列进行分析,得到P1氨基酸序列为Gly-Asn-Pro-Trp-Met,P2氨基酸序列为Asn-Arg-Tyr-Leu-Arg,其IC50分别为12.61 μg/mL和14.68 μg/mL。通过抑制动力学曲线可知,P1、P2均为可逆性抑制;P1为非竞争性抑制剂,其抑制常数为Ki,1=0.037 mmol/L;P2为竞争性抑制剂,其抑制常数为Ki,2=0.020 mmol/L。分子对接结果表明,P1与ACE的Thr166、Gln281、Thr372、Asp377、Lys511、His513、Tyr520形成氢键;P2与ACE的Gln281、Ala356、Glu403、Asp415、Lys511、Tyr520形成氢键;与已报道的蚕蛹蛋白源ACE抑制多肽相比,可以占据更多ACE活性口袋中的氨基酸残基。将对接后的分子进行叠加,P1不能和HHL分子重合,P2可以和HHL分子重合,从分子水平上证明了P1为非竞争性抑制肽,P2为竞争性抑制肽。
[1]Ni H,Li L,Liu G,et al. Inhibition mechanism and model of an angiotensin I-converting enzyme(ACE)-inhibitory hexapeptide from yeast(Saccharomycescerevisiae)[J]. PLoS One,2012,7(5):e37077.
[2]Chen J,Wang Y,Ye R,et al. Comparison of analytical methods to assay inhibitors of angiotensin I-converting enzyme[J]. Food Chemistry,2013,141(4):3329-3334.
[3]胡居吾,范青生. 蚕蛹蛋白精制工艺研究概况[J]. 中国食品添加剂,2004(5):25-28.
[4]赵钟兴,廖丹葵,孙建华,等. 蚕蛹蛋白酶解产物体外抗氧化和降血压活性筛选及响应面工艺优化[J]. 食品科学,2011,32(23):186-191.
[5]徐家玉,吕晓华. 蚕蛹蛋白缓解运动性疲劳的实验研究[J]. 现代预防医学,2008,35(12):2309-2311.
[6]Wang W,Shen S,Chen Q,et al. Hydrolyzates of silkworm pupae(Bombyx mori)protein is a new source of angiotensin I-converting enzyme inhibitory peptides(ACEIP)[J]. Current Pharmaceutical Biotechnology,2008,9(4):307-314.
[7]吕汶骏,赵钟兴,廖丹葵,等. 蚕蛹蛋白及其水解产物中氨基酸组成分析[J]. 食品科学,2012,33(12):228-232.
[8]吕汶骏. 蚕蛹蛋白中性蛋白酶水解产物中降血压肽的分离纯化研究[D]. 南宁:广西大学,2013.
[9]兰雄雕. 磁性琼脂糖微球固定化猪肺血管紧张素转化酶分离长蛇鲻降血压肽的研究[D]. 南宁:广西大学,2015.
[10]戚以政,汪叔雄. 生化反应动力学与反应器[M]. 第二版. 北京:化学工业出版社,1999.
[11]Natesh R,Schwager S L,Sturrock E D,et al. Crystal structure of the human angiotensin-converting enzyme-lisinopril complex[J]. Nature,2003,421(6922):551-554.
[12]Wu Q,Jia J,Yan H,et al. A novel angiotensin-I converting enzyme(ACE)inhibitory peptide from gastrointestinal protease hydrolysate of silkworm pupa(Bombyx mori)protein:Biochemical characterization and molecular docking study[J]. Peptides,2015,68:17-24.
[13]Jia J,Wu Q,Yan H,et al. Purification and molecular docking study of a novel angiotensin-I converting enzyme(ACE)inhibitory peptide from alcalase hydrolysate of ultrasonic-pretreated silkworm pupa(Bombyx mori)protein[J]. Process Biochemistry,2015,50(5):876-883.
[14]Li X,Li Y,Huang X,et al. Identification and characterization of a novel angiotensin I-converting enzyme inhibitory peptide(ACEIP)from silkworm pupa[J]. Food Science and Biotechnology,2014,23(4):1017-1023.
[15]Wang W,Wang N,Zhou Y,et al. Isolation of a novel peptide from silkworm pupae protein components and interaction characteristics to angiotensin I-converting enzyme[J]. European Food Research and Technology,2011,232(1):29-38.
[16]王镜岩. 生物化学[M]. 第三版(上). 北京:高等教育出版社,2002.
[17]Cushman D W,Cheung H S. Spectrophotometric assay and properties of the angiotensin-converting enzyme of rabbit lung[J]. Biochemical Pharmacology,1971,20(7):1637-1648.
[18]段爱霞,陈晶,刘宏德,等. 分子对接方法的应用与发展[J]. 分析科学学报,2009,25(4):473-477.
[19]倪贺. 酵母来源血管紧张素转移酶抑制多肽的制备及其抑制机理的研究[D]. 广州:华南理工大学,2012.
[20]Jimsheena V K,Gowda L R. Arachin derived peptides as selective angiotensin I-converting enzyme(ACE)inhibitors:Structure-activity relationship[J]. Peptides,2010,31(6):1165-1176.
[21]Rohit A C,Sathisha K,Aparna H S. A variant peptide of buffalo colostrumβ-lactoglobulin inhibits angiotensin I-converting enzyme activity[J]. European Journal of Medicinal Chemistry,2012,53:211-219.
Inhibition mechanism of angiotensin I-converting enzyme inhibitory peptide from silkworm pupa protein
WANG Chao-yang,ZHAO Zhong-xing*,TAO Meng-liang,WANG Xin-hui,SUN Hua-ju,WEI Ya-nan
(School of Chemistry and Chemical Engineering,Guangxi University,Guangxi Colleges and Universities Key Laboratory of New Technology and Application in Resource Chemical Engineering,Nanning 530004,China)
Basing on two angiotensin I-converting enzyme(ACE)inhibitory peptides(P1 and P2)which were purified before,the amino acid sequences of P1 and P2 were determined by MALDI TOF MS,and then they were synthesized by solid phase peptide synthesis. Subsequently,their inhibition kinetics was studied. Finally,their molecular dockings to ACE were studied by Sybyl,respectively. Results showed that P1 was Gly-Asn-Pro-Trp-Met with an IC50value of 12.61 μg/mL,which was a non-competitive inhibition peptide with a Ki,1value of 0.037 mmol/L,and P2 was Asn-Arg-Tyr-Leu-Arg with an IC50value of 14.68 μg/mL,which was a competitive inhibition peptide with a Ki,2value of 0.020 mmol/L,and both of them could form hydrogen bond with the residue amino acid in the active site of ACE. P1 and P2 could be used as functional food against hypertension,which provide a theoretical basis for further development and utilization of silkworm pupa protein.
silkworm pupa protein;angiotensin I-converting enzyme;inhibitory peptides;molecular docking;inhibition kinetics
2016-03-03
王朝阳(1990-),男,硕士研究生,研究方向:生物化工,E-mail:wcyang14@163.com。
赵钟兴(1979-),男,博士,副教授,研究方向:生物化工,E-mail:zzxx@gxu.edu.cn。
国家自然科学基金(31401629);广西自然科学基金(2013GXNSFBA019031);广西研究生教育创新计划(YCSZ2015026)。
TS201.2
A
1002-0306(2016)17-0148-05
10.13386/j.issn1002-0306.2016.17.020
