杨梅凋萎病菌侵染、传播及树体内分布规律
2016-10-31任海英梁森苗郑锡良戚行江朱潇婷颜丽菊
任海英,梁森苗,郑锡良,戚行江,*,朱潇婷,颜丽菊
(1. 浙江省农业科学院 园艺研究所,浙江 杭州 310021; 2.浙江省临海市特产技术推广总站,浙江 临海 317000)
杨梅凋萎病菌侵染、传播及树体内分布规律
任海英1,梁森苗1,郑锡良1,戚行江1,*,朱潇婷2,颜丽菊2
(1. 浙江省农业科学院 园艺研究所,浙江 杭州 310021; 2.浙江省临海市特产技术推广总站,浙江 临海 317000)
为了制定有效的杨梅凋萎病防控措施,对凋萎病菌分生孢子侵染、传播、病害周年发生动态及病菌在树体内分布规律进行了研究。结果表明:2×101~2×106mL-1浓度范围内的分生孢子溶液都能侵染杨梅致病,主要通过嫩枝的皮口及伤口侵入,有2个侵染高峰期分别是5月和6月中旬至7月中旬。凋萎病菌分生孢子周年均可捕捉到,5月中旬至6月中旬和8月底至10月中旬为两个分生孢子捕捉高峰期。凋萎病周年都有新病枝出现,发病高峰期集中在9月中旬至11月初,在果园内海拔低、流水冲刷严重的位置先发病。周年内发病杨梅树内拟盘多毛孢的分离菌株数及DNA拷贝数都是健康树的2~6倍。凋萎病菌可以周年寄生在杨梅的整个树体内,没有明显的菌量高峰期,嫩枝位置菌量最大。
杨梅凋萎病;异色拟盘多毛孢;小孢拟盘多毛孢;分生孢子
杨梅(Myricarubra)是我国南方特有的珍稀水果,果实甜酸适口,风味独特,截至2013年全国杨梅栽培面积约35万 hm2,年产量约120万 t,已成为长江以南各省市果品发展的支柱产业,成为山区农民增收致富的主要途径。凋萎病于2004年首先在浙江省发现,在福建、江西、广西、广东等地也有陆续发生。凋萎病是近年来危害杨梅产业的主要病害,首先引起杨梅部分嫩梢干枯,然后整株树的嫩梢干枯数量逐渐增多,一般3~5年整棵树就会死亡[1]。凋萎病发生后影响杨梅树体对氮、钙等营养元素的吸收和传递[2-3],根际菌根活力降低[4]。凋萎病发病速度快、传染力强,如不及时控制病害的传播,必将严重威胁到杨梅产业的可持续发展。
杨梅凋萎病的病原菌为异色拟盘多毛孢(Pestalotiopsisversicolor)和小孢拟盘多毛孢(P.microspora)[1],两种真菌对营养的利用非常广泛,20~30 ℃菌丝生长良好[5-6]。还能寄生于杨梅叶片引起叶斑病[7-8]。拟盘多毛孢属真菌属于子囊菌门,主要以内生菌的形式存在,也是重要的植物病原菌,引起多种植物病害,如茶轮斑病、枇杷灰斑病、咖啡轮斑病、苹果叶斑病、番石榴果斑病、粗榧枯死病[9-14]等。
不同品种的杨梅对凋萎病抗性差异明显,目前的主栽品种东魁是敏感品种[15]。温度以及相对湿度能显著影响凋萎病菌分生孢子的萌发及其侵染[16]。虽然凋萎病的综合防治技术已经有报道[17],但是有关凋萎病的流行规律及病菌在杨梅树体内分布的研究较少。为此,我们就凋萎病的周年消长及传播规律,病菌在杨梅树体内的时间及空间分布;凋萎病菌分生孢子侵染浓度、扩散和传播方式等进行了相关研究。以期为进一步探明病菌在树体内的分布规律,研究病菌与杨梅的互作机制,以便为制定切实有效的防治措施提供依据。
1 材料与方法
1.1调查地点及时间
试验选择在瑞安市、天台县和临海市的东魁杨梅果园,凋萎病发生率在5%左右。每个县选定1个果园,品种为东魁,树龄为15~20年。试验时间为2012年1月至2014年12月。
1.2分生孢子侵染浓度、途径及时期
1.2.1分生孢子侵染浓度
将纯化后异色拟盘多毛孢(P.versicolor)XJ27和小孢拟盘多毛孢(P.microspora)YS26菌株产生的分生孢子用无菌水洗下[1],用血球计数板法计数,按照1∶1比例配制成不同浓度的分生孢子混合悬浮液,配制浓度如下:2×101,2×102,2×103,2×104,2×105,2×106mL-1,采用叶痕伤口接种法[1],接种后第5天调查发病病情级数及其发病枝条数,以确定分生孢子侵染浓度。每个分生孢子浓度接种20个枝段,统计发病率和病情指数[15]。
1.2.2分生孢子侵染途径的观察
按照1∶1比例配制杨梅凋萎病病原菌强致病力菌株XJ27和YS26的分生孢子混合溶液,浓度为2×105mL-1,备用。
选择杨梅带有嫩叶15~40 cm长的枝条,分别在当年生嫩叶片正面、反面及叶柄长度中间位置、厚实的老叶片正面、反面及叶柄长度中间位置、嫩枝5~40 cm长(绿色半木质化的)、老枝5~40 cm长(木质化的)进行接种,刺伤或者无伤,每处理20次重复。
伤口接种方法是叶片或者叶柄伤口用针刺10个孔,枝条用刀片割出5 mm左右的伤口,深达木质部,去掉皮层,每孔用移液器加入新配制的分生孢子悬浮液20 μL,无伤接种是在相应位置滴加等量分生孢子悬浮液,以灭菌水接种作为对照。接种后叶片放在培养皿内,吸水灭菌滤纸保湿。接种后的枝条培养在250 mL的三角瓶内的无菌水中,塑料袋套48 h保湿。接种材料置于25 ℃培养箱内饱和湿度下恒温培养5 d,调查发病病情级数及其发病枝条数,统计发病率和病情指数[15]。
1.2.3分生孢子侵染时期确定
使用40 cm×20 cm的硫酸纸袋于杨梅新梢抽生之前3月底随机选择树势及病情一致的10棵杨梅树,在每棵树的东、西、南、北四个方位随机选择套袋800个,每隔15 d在东、西、南、北四个方位每棵树每个方位去掉2个袋子,共去掉40个袋子,枝梢暴露15 d后再把袋子套回去。随着新梢的不断生长,更换不同规格的纸袋,实验持续时间从2014年3月30日至2014年8月30日,当年12月初打开所有袋子调查枝梢发病率,袋子有破损的枝条不调查。一直套着袋子的枝梢为对照。
1.3分生孢子传播规律
在临海发生凋萎病的果园内,选择发病程度轻(单株枝条发病率大约5%)、发病程度严重(单株枝条发病率大约25%)各3棵果树以及完全没有发病的3棵果树(单株枝条发病率为0)作对照。杨梅树冠滴水线处与树冠中心位置一样高(大约1.5 m高度)的东、西、南、北四个方位各悬挂涂抹凡士林的载玻片2片,从2013年的3月下旬开始至2014年的3月上旬结束,每15 d捕捉一次。40×10倍光镜下镜检凋萎病菌分生孢子数量。整张载玻片的面积为12 cm2,仔细扫描观察每张载玻片5 cm2内分生孢子数量,镜检面积占玻片面积1/2.4,换算为整张玻片上的分生孢子数量,计算不同发病程度的杨梅树每次收集到的24个载玻片总共捕捉到的分生孢子数量。
1.4凋萎病的周年消长及传播规律
1.4.1凋萎病周年消长
2013年3月底至2014年3月底每月调查2次。每果园采用5点取样法每点选择4棵树,每个时间点3个果园共调查60株树的凋萎病新出现的干枯枝条数量,老的干枯枝条不再统计。统计全年3个果园的不同时间总发生凋萎病枝条数量。
1.4.2凋萎病的周年传播
2013年12月31日选择临海一典型杨梅园内山脚下发病严重的3棵相邻的杨梅树作为传播源头标记为1~3号,病情级数分别为7,9,9,病情级数标准参考任海英等[17]建立的方法,每棵树的病情指数分级标准如下:0级指整个树体没有发病枝梢;1级指整个树体的发病枝梢≤10%;3级指10%<发病枝梢占整个树体的总枝梢数≤25%;5级指25%<发病枝梢占整个树体的总枝梢数≤50%;7级指50%<发病枝梢占整个树体的总枝梢数≤75%;9级指75%<发病枝梢占整个树体的总枝梢数≤100%。相邻树体两两之间直线距离大约为4~5 m,选择26棵杨梅树并做好标记。选择的树体相互之间直线距离为20~25 m,并且调查病情级数,于2014年12月31日再次调查标记杨梅树体的病情级数,分析凋萎病围绕发病中心的周年传播情况。
1.5杨梅树体内病菌空间分布样品采集
选择发重病(整个树体大约75%枝梢发病)、中等发病(整个树体大约25%枝梢发病)和发病轻(整个树体大约10%枝梢发病)的8年生东魁果园,从2013年5月至2014年3月每隔2个月进行取样,每次每地取样3棵树,取样位置从树根部至主干(一次分支)、二次分枝、三次分支、四次分支、五次分支、六次分支、七次分支、顶端有病症嫩枝和叶片。根、主干和各分支使用5 mm便携式电钻钻孔取锯沫,每部分样品平均分成2份,称取同等质量的叶片研磨成粉末,一份用来组织分离真菌菌株,一份用来分子检测病菌相对数量。取完全没有凋萎病的3棵健康杨梅树样品,作为对照,取样方法同上。
1.6拟盘多毛孢真菌的分离纯化
利用组织分离方法[18]分离纯化杨梅样品内的拟盘多毛孢真菌。每份样品称取10 g锯沫,均匀播散在PDA培养基(青岛日水生物技术有限公司)平板上。25 ℃培养3 d后分离纯化真菌菌落,纯化后菌落在12 h光照(1 000 μmol ·m2·s-1)12 h黑暗,25 ℃下培养诱导产生分生孢子,显微观察分生孢子,鉴定为拟盘多毛孢的菌株统计真菌菌落数。
1.7实时荧光定量PCR
利用杨梅凋萎病菌的检测引物对Pvm1L/Pvm1R[19],Pvm1L∶5′-GAAA TGACGCTCGAACAGGC-3′,Pvm1R∶5′-TGAAGAACGCAGCGAA ATGC-3′,进行杨梅凋萎病菌的菌量检测。实验程序参考任海英等[19]的方法。利用CTAB方法[20]提取10 μg样品的基因组DNA,作为模板浓度稀释到标准曲线范围内(100~200 ng·μL-1左右),按照TaKaRa SYBR Premix DimerEraserTM(Perfect Real Time,货号RR091A)的荧光定量试剂盒选择20 μL的体系说明进行操作。Real time PCR程序:95 ℃ 30 s, 95 ℃ 5 s,55 ℃ 30 s,72 ℃ 34 s,40个循环。实时荧光定量PCR的每个样品重复3次。得出每个样品的Ct值,然后根据标准曲线计算出目标片段的拷贝数。
1.8数据统计处理
所有数据使用Excel 2003和DPS 9.5处理,显著性差异使用Duncan新复极差法分析。
2 结果与分析
2.1分生孢子侵染浓度、途径及时期
2.1.1分生孢子侵染浓度
在分生孢子浓度2×10~2×106mL-1范围内都能引起接种枝条100%发病,但是发病程度有差异,2×10 mL-1的分生孢子引起的发病程度最轻,病情指数为1;2×102,2×103,2×104mL-1浓度范围内的分生孢子引起的发病程度相同,病情指数都是3;2×105mL-1浓度及以上发病程度严重,病情指数在5以上(图1),与其他浓度的分生孢子溶液引起的病情指数差异显著。由此可见,病原菌分生孢子浓度影响发病程度,在凋萎病的传播蔓延过程中分生孢子单位密度是一个重要因素。
2.1.2分生孢子侵染途径
凋萎病菌接种后发现,虽然病菌在嫩叶正面和反面、老叶的正面和反面、嫩叶和老叶的叶柄都能引起杨梅组织发病,但是病症不是凋萎病症,而是枯斑病症,而且叶片比叶柄容易发病,嫩叶比老叶容易发病,反面比正面容易发病。伤口及无伤接种发病率有显著性差异。凋萎病菌侵染嫩枝和老枝时都引起凋萎病症,并且嫩枝有伤时最容易发病,发病率达到62%,嫩枝无伤时发病率25%,老枝有伤和无伤发病率较低,分别为15%和9%(表1),各处理之间发病率都达到显著性差异。由此可见,凋萎病菌主要是通过嫩枝的皮口及伤口侵入。

柱上短线代表平均值的标准误,没有相同字母表示差异显著(P<0.05)。图1 分生孢子浓度与凋萎病发生的关系Fig.1 The relationship between the concentration of conidia and the incidence of twig blight disease on bayberry
2.1.3侵染时间
没拆袋的杨梅嫩枝凋萎病的发生率是35%。从2014年3月底至8月底凋萎病菌有2个侵染高峰期,分别是5月和6月中旬至7月中旬,其中5月1日至5月16日的时间段内,侵染率达到54.55%,5月16日—5月30日与6月15日—6月30日的侵染率相同,都是50%。7月30日至8月15日这段时间内侵染率降至最低,低至16.67%,但是8月15日至8月30日凋萎病侵染率又有升高,与3月底4月初相近,侵染率达到33.33%(图2)。这说明在东魁杨梅的果实发育及成熟采摘期是杨梅凋萎病菌的主要侵入时期。
2.2分生孢子周年传播规律
在杨梅果园中周年均可捕捉到分生孢子,发病的树周围收集的孢子量大于健康树,发病程度严重的树收集的量大于发病程度轻的树(图3)。有2个捕捉高峰期,第一个在当年的5月中旬至6月中旬,第二个在当年的8月底至10月中旬,其中发病严重的树在当年的8月底捕捉到的分生孢子数量最多,捕捉量为458个。最少捕捉量出现在当年7月中旬、当年12月中旬至翌年3月中旬,发病轻及其健康的树捕捉分生孢子数量少于15个,甚至没有(图3)。以上结果说明,杨梅树凋萎病菌周年均可产生、释放分生孢子。
表1凋萎病菌侵染杨梅的途径
Table 1The infection way ofPestalotiopsispathogen on bayberry

接种部位接种方式病症发病率/%嫩叶片正面无伤枯斑25e有伤枯斑47d嫩叶片反面无伤枯斑42d有伤枯斑79a嫩叶柄无伤枯斑0g有伤枯斑56c老叶片正面无伤枯斑6f有伤枯斑53c老叶片反面无伤枯斑28d有伤枯斑71a老叶柄无伤枯斑0g有伤枯斑8f嫩枝无伤凋萎25e有伤凋萎62b老枝无伤凋萎9f有伤凋萎15e
注:同列不同行数据后没有相同小写字母表示差异显著(P<0.05)。

柱上没有相同小写字母表示差异显著(P<0.05)。下同。1,2,3,4,5,6,7,8,9,10的暴露开始时间分别是2014年的3月30日、4月15日、5月1日、5月16日、5月30日、6月15日、6月30日、7月15日、7月30日、8月15日,持续时间为15 d。图2 杨梅嫩枝暴露时间与凋萎病发病率的关系Fig.2 The relationship between the exposed time of bayberry shoots and disease incidence of twig blight disease
2.3凋萎病的周年消长及传播规律
2.3.1病害周年消长规律调查
从3个县的3个果园的60株树的周年调查结果(图4)可以看出:每月都有新病枝出现,出现的高峰期在当年的9月中旬至11月初。9月和10月新生病枝占全年的45.5%。周年中当年12月至翌年3月病枝增长数量少于其他月份,一年后杨梅凋萎病严重程度大幅度增长,调查果园病株的平均病枝数从1.6个增加到54.5个(图4)。这说明凋萎病病枝出现在秋季的杨梅树上明显多于其他季节,而且树体一旦发病,如果没有有效防治措施,病情会迅速恶化。
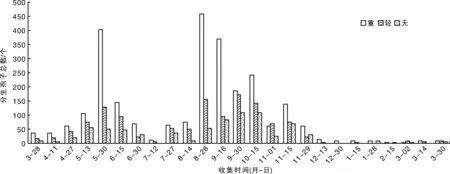
图3 杨梅凋萎病菌分生孢子周年传播规律Fig.3 The anniversary spread of the conidia of Pestalotiopsis spp. on bayberry
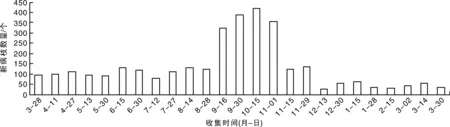
图4 浙江杨梅凋萎病周年消长规律动态Fig.4 The anniversary dynamic of twig blight disease of bayberry in Zhejiang Province
2.3.2凋萎病的周年传播情况
按照图5的空间分布发现,凋萎病发病有明显的中心源,发病最早最严重的位置是果园内海拔最低、小路下侧流水冲刷最严重的树体,初次调查的中心源头1号树由病情7级上升为9级,两棵9级病情的树势衰弱更加严重,频临死亡。距离1,2,3号树体25 m左右的19号树体病情由7级发展至9级。距离中心50 m左右的20号树体病情略微有加重。其他海拔高度相近的4,5,6,7,8,21,22,23水平直线距离在150 m内的树体都由0病级发展为1级。海拔高度20~30 m范围内距离中心源较近的位置有两个亚中心源,分别是10,11号和15,16,17号,其中距离中心源较近的10号和15号病情发展较快,周年后从病情2级和1级分别发展至7级和3级,而11,16,17号病情没有明显恶化。但是围绕亚中心,周年后凋萎病有明显外延,12,13,18号都由健康树体变为1级病情。随着海拔高度继续升高,海拔30 m以上的树体,距离中心源直线距离也增加50 m以上,凋萎病尚未发生(图5)。这说明凋萎病有中心发病源,而且发病中心在果园内海拔低、流水冲刷严重的位置,外延传播首先在海拔高度相似、直线距离相近的位置,然后才沿着高海拔的位置不断攀升,周年传播非常快,超过直线距离100 m,多点发病后,传染源不断叠加,传播能力增强。
2.4不同发病程度杨梅树体内拟盘多毛孢菌周年总分离情况
健康树与不同发病程度的组织分离和实时荧光定量的树体内拟盘多毛孢含量趋势是一致的。健康杨梅树分离的拟盘多毛孢菌株数明显少于凋萎病发病植株,发病严重的树体分离的菌株数显著多于中等发病及轻发病的树体,但是发病中等及轻的树体分离菌株的数量没有显著性差异。健康树周年分离的菌落数约300个,中等发病及轻发病的树体周年分离菌落数大约是健康树的2倍,发病严重的树体分离的菌落数约是健康树的3倍(图6)。
实时荧光定量PCR检测拟盘多毛孢菌株在1 μg杨梅锯沫内的DNA拷贝数,健康杨梅组织内的拟盘多毛孢菌株DNA拷贝数为8.7×105,轻病、中等发病及重病的杨梅树内拟盘多毛孢的DNA拷贝数分别是健康树的3,5和6倍(图7)。

图5 凋萎病的周年传播情况Fig.5 The anniversary spread of twig blight disease

图6 周年杨梅树体内拟盘多毛孢菌株分离数Fig.6 Colony number of isolated Pestalopsis spp. from bayberry plants throughout the year
2.5杨梅树体的不同位置拟盘多毛孢菌分布
杨梅树体每个位置的10 g锯沫分离拟盘多毛孢菌株的克隆数都大于6个,其中健康杨梅树分离的菌株数在6~38个,总体低于发病杨梅树分离的菌株数量,发病杨梅树每个取样位置分离菌株的数量在7~325个不等。发病杨梅树根部分离的拟盘多毛孢菌株数最少,占整株树分离量的1.10%~1.81%,嫩枝位置分离量最多,占整株树分离量的35.64%~38.65%。其他主干及各分支分离菌量各占整株树分离量的5.10%~9.21%(图8)。这说明拟盘多毛孢菌株引起的杨梅凋萎病是系统性病害,并且在嫩枝位置菌量最大。
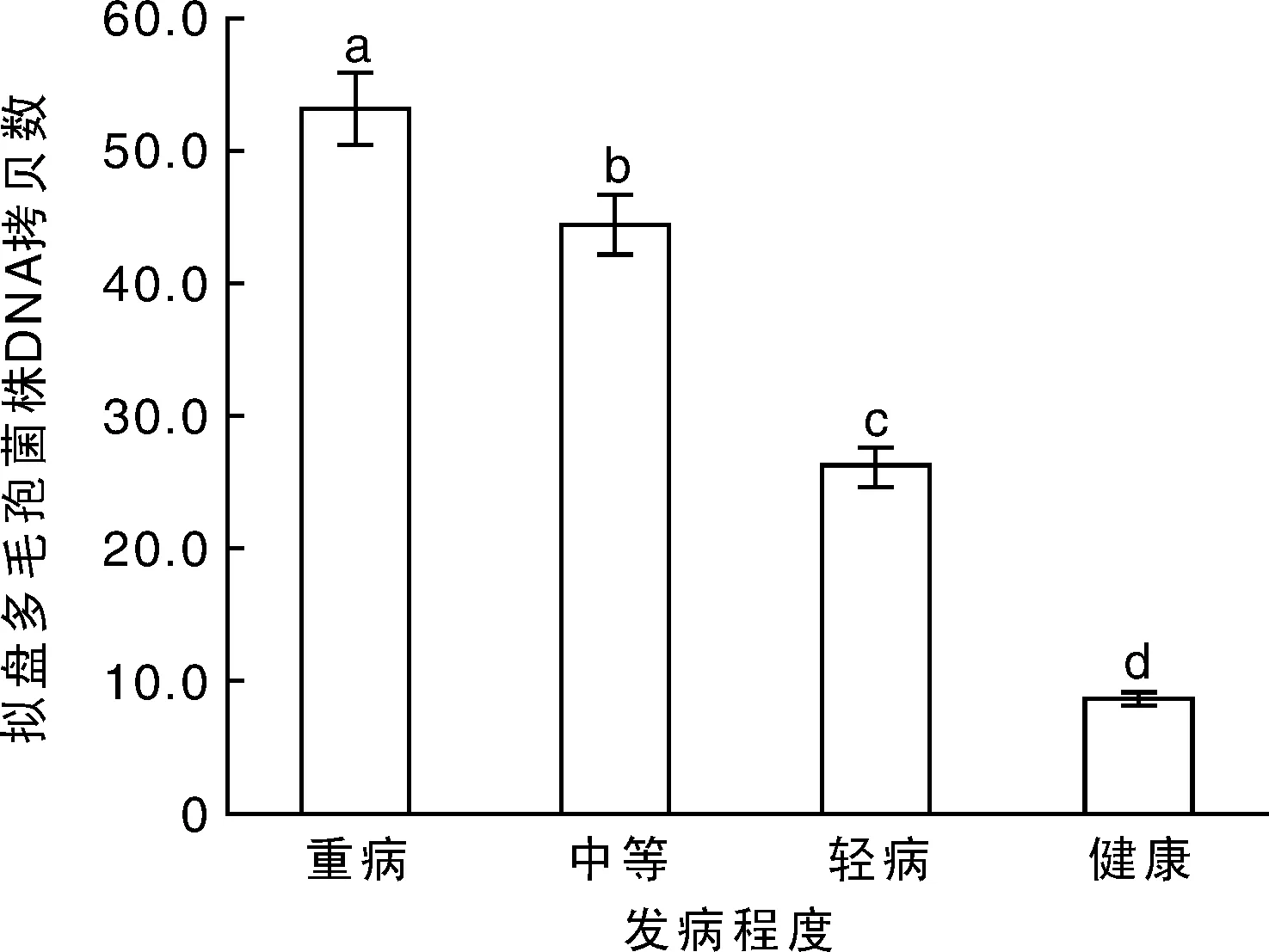
图7 周年杨梅树体内拟盘多毛孢菌株DNA拷贝数Fig.7 DNA copy number of Pestalopsis spp. from bayberry plants throughout the year
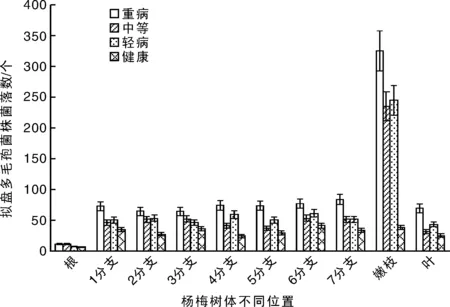
图8 杨梅树体不同位置拟盘多毛孢菌株分离数Fig.8 Colony number of the isolated Pestalopsis spp. from the different parts of bayberry plants
1 μg杨梅树体不同位置的样品拟盘多毛孢菌株DNA拷贝数的趋势与菌株分离数的趋势是一致的,健康树的拟盘多毛孢DNA拷贝数为(0.01~12.73)×104,总体低于发病树的菌株DNA拷贝数,发病树的每个位置样品拟盘多毛孢DNA拷贝数为(3.32~215.23)×104。发病杨梅树根部拟盘多毛孢菌株DNA拷贝数最少,占整株树样品总量的1.89%~8.01%,嫩枝位置菌株DNA拷贝数最多,占整株树样品总量的40.47%~72.04%。其他主干及各分支菌株 DNA各占整株树样品菌株DNA量的0.97%~17.64%(图9)。这也说明拟盘多毛孢菌株引起杨梅凋萎病后,是系统性病害,并且在嫩枝位置菌量最大。
2.6周年不同时间杨梅树体内拟盘多毛孢菌分布
从菌株分离数量来看,健康的杨梅树样品周年分离菌株数量变化不大,少于发病杨梅树,范围在31~62个,每次样品分离菌量占全年样品总量的11.7%~23.4%,发病的杨梅树周年分离菌量变化较大,范围在57~247个,每次样品分离菌量占全年样品总量的8.57%~27.08%。发病重、中等及轻的杨梅树没有明显一致的分离高峰时间(图10)。这说明拟盘多毛孢病菌周年都可以在杨梅树体内存活。
从拟盘多毛孢菌株的DNA拷贝数来看,健康杨梅树内菌株的周年变化较小,并且低于发病杨梅树,1 μg杨梅样品内菌株的DNA拷贝数是(1.12~1.46)×105个,每个时间段重病杨梅树的菌株DNA拷贝数都多于中等发病及轻发病的,菌株DNA拷贝数为(3.9~20.68)×105。发病杨梅树在9月份有1个一致的DNA拷贝数高峰,重病、中等及轻发病的DNA拷贝数量分别占到全年的31.25%,49.19%和51.21%,其他时间段浮动较大,分别占到全年DNA拷贝数的6.2%~21.35%(图11)。这也说明拟盘多毛孢病菌周年都可以在杨梅树体内存活。

图9 杨梅树体不同位置拟盘多毛孢菌株DNA拷贝数Fig.9 DNA copy number of Pestalopsis spp. in the different parts of bayberry plants

图10 不同时间杨梅树体内拟盘多毛孢菌株分离数Fig.10 Colony number of the isolated Pestalopsis spp. from bayberry plants at different time

图11 不同时间杨梅树体内拟盘多毛孢菌株DNA拷贝数Fig.11 Colony number of Pestalopsis spp. in the bayberry plants at different time
3 讨论
病菌侵染高峰期(第1个是当年的5月,第2个是当年的6月中旬至7月中旬)、病菌分生孢子释放高峰期(第1个在当年的5月中旬至6月中旬,第2个在当年的8月底至10月中旬)及病害发生高峰期(当年的9月中旬至11月初),从时间先后分析,凋萎病菌利用前年的分生孢子完成第一个侵染高峰,释放大量分生孢子,这是第一个分生孢子释放高峰,这些当年产生的分生孢子进行再侵染,完成病菌的第2次侵染高峰,随即又产生大量的分生孢子,完成分生孢子的第2个释放高峰。2次侵染高峰叠加起来,与其他时间段的侵染进行累加,到9月份发病的相对湿度及温度适合、树体生长势放缓时,凋萎病才大面积出现症状。
杨梅凋萎病分生孢子的侵染高峰期最早出现在5月,而发病高峰期出现在9月及以后,病害潜伏期长达4个多月,降雨和温度是主要的影响因素,这与苹果轮纹病、炭疽病和黑星病等相似[21-22]。杨梅凋萎病菌主要通过嫩枝上的伤口侵入,自然孔口为次,这与桉树焦枯病病原菌不同,后者主要以自然孔口为主[23]。气温、叶片湿度、雨量等综合系统影响分生孢子的产生、萌发、侵染及植物的发病程度[24-25]。离体研究发现:温度、相对湿度对杨梅凋萎病菌分生孢子的萌发及侵染有显著影响[16],但是果园内气温、叶片湿度及雨量等综合系统对杨梅凋萎病菌分生孢子的萌发、侵染及杨梅发病程度的影响有待深入研究。
分生孢子的密度与病害严重度的关系在其他植物病原真菌病害有报道[25],病害防治不是依赖病症出现及环境条件,而是根据分生孢子的密度或者一特定密度的分生孢子出现后的时间(天数)来确定药剂防治的时间。本研究结果也显示,分生孢子密度会影响发病程度。由于本研究属室内离体试验结果,如何根据果园内捕捉分生孢子的量来决定防治方案尚需要进一步深入的研究。
植物病害的大面积流行与栽培品种、树龄、土壤、气候等因素有一定的关系[26]。本研究中凋萎病周年能够发病,有发病高峰期,这与苹果腐烂病相似,但是高峰期时间不一样[27],发病情况明显受到季节和气候因素及立地条件的影响,这与很多植物真菌病害相似[21-23,28]。与非周年发病的病害相比,很可能是由于病菌寄生位置及致病机理的差异[23,28]。
杨梅凋萎病菌的分生孢子周年都可以传播,有传播高峰,这与苹果腐烂病相似,但是不同之处是杨梅凋萎病分生孢子的传播高峰期有2个,而苹果腐烂病只有一个分生孢子的传播高峰期[27]。苹果轮纹病、苹果炭疽病及樱桃褐斑病菌的分生孢子不是周年释放的[22,28]。杨梅凋萎病发生严重的分生孢子释放量大于发病程度轻的以及同果园内表现健康的,这与油菜褐斑病病情越重释放分生孢子的量越多相似[25]。温度和相对湿度能相互作用影响分生孢子的产生[25]。油菜褐斑病分生孢子的释放在相对湿度大于87%的时候受温度的影响,温度越高越容易释放[25],芒果畸形病病原菌(Fusariummangiferae)的释放在相对湿度低于55%时更容易收集到分生孢子[29]。降雨量影响子囊孢子的捕捉量[30]。杨梅凋萎病菌分生孢子的释放传播高峰期与其他时间相比,明显受到温度、相对湿度及降雨量的影响,但是具体变化阈值尚不明确,需要进一步研究。
分生孢子传播距离及扩散效率与温度、气流、降雨量、季节及昼夜变化等都有关系[31-34],本研究也表明杨梅凋萎病菌分生孢子的传播受到雨水及风的影响。杨梅凋萎病的传播有中心及近距离先传到的特点,但是山坡的海拔、风向、温度、降雨量、季节及昼夜等因素对分生孢子传播及扩散的具体影响尚需要深入研究。
发病杨梅树的拟盘多毛孢菌株在树体内的数量多于健康杨梅树体内菌量,病菌在树体内是系统性周年存在的。迄今为止,未见有关拟盘多毛孢菌量的快速增殖以及增殖后引起的结果可能是引起植物发病原因的报道。美国佛罗里达粗榧(Torreyataxifolia)持续发生枯死主要是由于小孢拟盘多毛孢(P.microspora)真菌长期以内生的方式存在于佛罗里达粗榧的树皮中,该真菌可以产生毒素毒害植物,导致大量佛罗里达粗榧出现全株枯死[14],小孢拟盘多毛孢由内生变为产生毒素的病原菌的原因尚未知。
本研究发现,发病杨梅树的拟盘多毛孢菌株在树体内的分布并不均匀,根部、主干、叶片等位置分布少,但是嫩枝位置菌量最大,在柑橘黄龙病上也存在病菌分布不均匀的情况。染黄龙病的柑橘植株的根、茎、花、果、叶、根中均可检测到黄龙病菌,但是病原菌的分布不均匀,果柄中含量最大[28,35-37],而且有明显黄龙病症状的样品更容易检测出黄龙病菌[28]。杨梅也是有凋萎病症的更容易检测到凋萎病菌[19],而果实、种子、花等是否携带凋萎病菌,尚有待深入研究。根据杨梅病菌主要定殖在嫩枝位置,主干及根部病菌量较少的特点,可以锯掉受侵染较重的部位,及时涂抹伤口保护剂,及时喷施防效好的杀菌剂,促使抽生健康枝梢,这在凋萎病的防治上已经取得了一定成效[17]。
[1]REN H Y, LI G, QI X J, et al. Identification and characterization ofPestalotiopsisspp. causing twig blight disease of bayberry (MyricarubraSieb. & Zucc) in China[J].EuropeanJournalofPlantPathology, 2013, 137(3): 451-461.
[2]郑锡良, 任海英, 徐云焕, 等. 凋萎病对杨梅的氮吸收和分配的影响[J]. 中国南方果树, 2013,42(1): 64-66.
[3]郑锡良, 任海英, 徐云焕, 等.凋萎病对杨梅树体钙吸收和分配的影响[J]. 浙江农业科学, 2013 (2): 183-185.
[4]任海英, 方丽, 戚行江, 等. 枝叶凋萎病对杨梅根际菌根的影响[J]. 浙江农业学报, 2012, 24(1): 81-84.
[5]REN H Y, LI G, LIANG S M, et al. Effects of culture media, carbon and nitrogen sources and environmental factors on mycelial growth and sporulation ofPestalotiopsismicrosporastrains, the agent of bayberry twig blight in southern China[J].AsiaLifeSciences, 2013, 22(2): 713-727.
[6]任海英, 李岗, 戚行江, 等.杨梅凋萎病菌异色拟盘多毛孢菌(Pestalotiopsisversicolor)的生物学特性研究[J]. 浙江农业学报, 2013, 25(6): 1309-1320.
[7]孙化田, 曹若彬.寄生果树上的拟盘多毛孢属真菌的鉴定[J]. 浙江农业大学学报, 1990(增刊2): 179-185.
[8]孙化田,陈国贵,曹若彬.中国拟盘多毛孢属四个新组合种[J]. 浙江农业大学学报, 1990(增刊2): 151-154.
[9]葛起新,陈育新,徐同.中国真菌志,拟盘多毛孢属[J].北京:科学出版社, 2009.
[10]贺春萍, 郑肖兰, 李锐, 等.红毛丹灰斑病病原菌鉴定及生物学特性研究[J]. 果树学报, 2010, 27(2): 270-274.
[11]陈长卿, 张博, 杨丽娜, 等. 越橘圆斑病病原菌鉴定及其生物学特性[J]. 东北林业大学学报, 2011, 39: 95-98.
[12]张小媛, 何红, 胡汉桥, 等. 红海榄赤斑病病原菌鉴定及其生物学特性研究[J]. 植物病理学报, 2009, 39 (6): 584-592.
[13]KEITH L M, VELASQUEZ M E, ZEE F T. Identification and characterization ofPestalotiopsisspp. causing scab disease of guava,Psidiumguajava, in Hawaii[J].PlantDisease, 2006, 90(1): 16-23.
[14]LEE J C, YANG X S, SCHWARTZ M, et al. The relationship between an endangered North American tree and an endophytic fungus[J].ChemistryandBiology, 1995, 2(11): 721-727.
[15]张振兰, 朱萧婷, 任海英, 等. 杨梅种质资源对凋萎病抗性评价[J]. 浙江农业科学, 2014 (10): 1567-1569, 1571.
[16]任海英, 戚行江, 梁森苗, 等.环境因子对杨梅凋萎病菌分生孢子萌发及侵染的影响[J]. 果树学报, 2015, 32(3): 474-480.
[17]任海英, 戚行江, 梁森苗, 等.杨梅凋萎病综合防治技术试验[J]. 浙江农业科学, 2014(12): 1849-1855.
[18]方中达. 植病研究方法[M].3版. 北京: 中国农业出版社, 1998.
[19]任海英, 戚行江, 梁森苗, 等.利用常规PCR和实时荧光定量PCR检测杨梅凋萎病菌[J]. 植物病理学报, 2016, 46(1):1-10 .
[20]SAGHAI MAROOF M A, BIYASHEV R M, YANG G P, et al. Extraordinarily polymorphic microsatellite DNA in barley: species diversity, chromosomal locations, and population dynamics[J].ProceedingsoftheNationalAcademyofSciencesoftheUnitedStatesofAmerica, 1994, 91(12):5466-5470.
[21]胡小平, 杨家荣, 田雪亮, 等.渭北旱塬苹果黑星病流行因子分析[J]. 中国生态农业学报, 2007, 15(2): 118-121.
[22]吴桂本, 刘传德, 王培松, 等.苹果轮纹病和炭疽病发生规律的研究[J]. 莱阳农学院学报, 2000, 17(2): 86-92.
[23]郑美珠.桉树焦枯病发病规律的研究[J]. 福建林学院学报, 2006, 26(4): 339-343.
[24]GONZALEZ-DOMINGUEZ E, ARMENGOL J, ROSSI V.
Development and validation of a weather-based model for predicting infection of loquat fruit byFusicladiumeriobotryae[J].PLoSONE, 2014, 9(9): e107547.
[25]KHAN J, QI A, KHAN M F R. Fluctuations in number ofCercosporabeticolaconidia in relationship to environment and disease severity in sugar beet[J].Phytopathology, 2009, 99(7):796-801.
[26]李有忠, 宋晓斌, 张学武.猕猴桃细菌性溃疡病发生规律研究[J]. 西北林学院学报, 2000, 15(2): 53-56.
[27]杜战涛, 李正鹏, 高小宁, 等.陕西省苹果树腐烂病周年消长及分生孢子传播规律研究[J]. 果树学报, 2013, 30(5): 819-822.
[28]程保平, 鹿连明, 彭埃天, 等. 柑橘多个品种和多个部位中黄龙病菌的检测与调查[J]. 广东农业科学, 2014 (11): 69-72.
[29]刘保友, 张伟, 栾炳辉, 等.大樱桃褐斑病病原菌鉴定与田间流行动态研究[J]. 果树学报, 2012, 29(4): 634-637.
[30]GAMLIEL-ATINSKY E, SZTEJNBERG A, MAYMON M, et al. Inoculum availability and conidial dispersal patterns ofFusariummangiferae, the causal agent of mango malformation disease[J].Phytopathology, 2009, 99(2):160-166.
[31]ROSSI V, CAFFI T, LEGLER S E. Dynamics of ascospore maturation and discharge inErysiphenecator, the causal agent of grape powdery mildew[J].Phytopathology, 2010, 100(12): 1321-1329.
[32]HORN B W, GREENE R L, SORENSEN R B, et al. Conidial movement of nontoxigenicAspergillusflavusandA.parasiticusin peanut fields following application to soil[J].Mycopathologia, 2000, 151(2): 81-92.
[33]NTAHIMPERA N, WILSON L L, ELLIS M A, et al. Comparison of rain effects on splash dispersal of threeColletotrichumspecies infecting strawberry[J].Phytopathology, 1999, 89(7): 555-563.
[34]SAVAGE D, BARBETTI M J, MACLEOD W J, et al. Seasonal and diurnal patterns of spore release can significantly affect the proportion of spores expected to undergo long-distance dispersal[J].MicrobialEcology, 2012, 63(3): 578-585.
[35]TUCKER K, STOLZE J L, KENNEDY A H, et al. Biomechanics of conidial dispersal in the toxic moldStachybotryschartarum[J].FungalGeneticsandBiology, 2007, 44(7): 641-647.
[36]LI W, LEVY L, HARTUNG J S. Quantitative distribution of ‘CandidatusLiberibacterasiaticus’ in citrus plants with citrus huanglongbing[J].Phytopathology, 2009, 99(2): 139-144.
[37]TATINENI S,SAGARAM U S,GOWDA S,et al. In planta distribution of‘CandidatusLiberibacterasiaticus’as revealed by polymerase chain reaction (PCR) and real-time PCR[J].Phytopathology, 2008, 98(5): 592-599.
(责任编辑张韵)
Infection, spread and distribution of pathogens of twig blight disease on bayberry
REN Hai-ying1, LIANG Sen-miao1, ZHENG Xi-liang1, QI Xing-jiang1,*, ZHU Xiao-ting2, YAN Li-ju2
(1.InstituteofHorticulture,ZhejiangAcademyofAgriculturalSciences,Hangzhou310021,China; 2.LinhaiSpecialtyTechnologyPromotionStationofZhejiangProvince,Linhai317000,China)
In order to develop the effective technologies to prevent and control the twig blight disease of bayberry, it was studied that how conidia infected and disseminated, how the twig blight disease occured and spread in the whole year, and how the fungi distributed in bayberry plants. The conidia solution with concentrations of 2×101to 2×106mL-1could infect bayberry mainly through the orifice and wound on the young shoots. The conidia had two peaks of infection, the whole May, the mid of June to the mid of July, respectively. The conidia could be captured throughout the year. There were 2 captured peaks, the mid of May to the mid of June, the end of August to the mid of October, respectively. The bayberry trees had new diseased shoots throughout the year, and the peak incidence was in the middle of September to the early of November. The twig blight disease had the centers, and the trees in the low altitude, water erosion serious position were infected firstly. The isolated fungal strains and DNA copy numbers of the diseased were 2-6 times of the healthy in a whole year. The pathogens could survive in the bayberry plants in the whole year with the most quantity in young shoots, but without obvious time peaks.
twig blight disease on bayberry;Pestalotiopsisversicolor;Pestalotiopsismicrospora;conidia
10.3969/j.issn.1004-1524.2016.04.14
2015-11-23
浙江省重大科技专项重点农业项目资助(2012C12009-5) ;公益性行业(农业)科研专项资助(201203089)
任海英(1974—),女,山东沂水人,博士,副研究员,从事果树病理学研究。E-mail: renhy@mail.zaas.ac.cn
,戚行江,E-mail:qixj@mail.zaas.ac.cn
S667.6
A
1004-1524(2016)04-0630-10
任海英,梁森苗,郑锡良,等. 杨梅凋萎病菌侵染、传播及树体内分布规律[J].浙江农业学报,2016,28(4): 630-639.
