草麻黄高通量转录组分析及黄酮类代谢途径相关基因的鉴定
2016-10-31成铁龙孙灿岳史胜青江泽平
马 婧,成铁龙,2,*,孙灿岳,邓 楠,史胜青,江泽平
(1.中国林业科学研究院 林业研究所/国家林业局林木培育重点实验室,北京 100091; 2.南京林业大学 生物与环境学院, 江苏 南京 210037; 3.南宁树木园,广西 南宁 530031)
草麻黄高通量转录组分析及黄酮类代谢途径相关基因的鉴定
马婧1,成铁龙1,2,*,孙灿岳3,邓楠1,史胜青1,江泽平1
(1.中国林业科学研究院 林业研究所/国家林业局林木培育重点实验室,北京 100091; 2.南京林业大学 生物与环境学院, 江苏 南京 210037; 3.南宁树木园,广西 南宁 530031)
草麻黄(EphedrasinicaStapf)植物富含黄酮类和生物碱类化合物,具有重要药用价值,并且适应性强,在防风固沙、改善沙漠环境等方面具有重要作用。通过对已测序草麻黄转录组的原始数据进行重新组装、拼接等生物信息学分析,共得到7 947 954个clean reads,13 389条unigene序列。经过Nr,KOGs,GO,KEGG和Swiss-Prot等数据库分析后,获得10 481个Nr注释,4 533个KOG功能注释,7 121个GO功能注释,5 833个KEGG注释,8 039个 Swiss-Prot注释,并利用KEGG通路分析技术发掘草麻黄中参与黄酮类化合物代谢途径相关基因,为克隆草麻黄黄酮合成关键基因、黄酮类化合物的生物合成提供重要的遗传资源,同时为其抗逆机制的研究和药用价值开发提供依据。
草麻黄;转录组;高通量测序;黄酮类化合物
草麻黄(EphedrasinicaStapf)属于麻黄科(Ephedraceae)麻黄属(Ephedra),是草本状灌木植物,属于超旱生、强旱生、旱生系列植物,根系发达,适应性强,四季常绿[1]。该属植物在防风固沙、增加植被覆盖等方面具有重要作用,是河西和西北荒漠地区的主要建群种[1]。麻黄属在我国有广泛的分布,现已报道的有19种[2],包括5个变种。在这19种麻黄植物中,草麻黄富含生物碱(主要为麻黄碱、伪麻黄碱)和黄酮类化合物[3-5],具有重要的药用价值,是中国特有的中草药。其中黄酮类化合物是植物在长期的生态适应过程中为抵御恶劣生态条件形成的一大类次生代谢产物,参与植物生态防御[6],它广泛存在于高等植物及羊齿植物的根、茎、叶、花、果实等[7],数量种类繁多、结构类型复杂多样[8]。该类化合物具有抑制酶活性、抗氧化、抗癌、抗菌、抗病毒、抗炎症、抗过敏、抗糖尿病并发症等功能,且无毒无害,对治疗和预防肿瘤、衰老、心血管病等退变性疾病有重要意义[8-9]。
中国是全球天然麻黄的主要产地,内蒙古、山西大部分地区均有较丰富的野生草麻黄资源[10]。近年来,人们由于经济利益的驱使对草麻黄进行了掠夺式的开发,导致麻黄资源日益匮乏。因此利用生物技术提高麻黄品质、开发新的麻黄资源成为今后麻黄生产利用的发展方向。目前药用植物黄酮类化合物的研究主要集中在提取工艺、成分分析及药理活性方面[11],同时分子生物学也开始涉及药用植物的研究。药用植物黄酮类化合物代谢合成途径中的相关功能基因的研究主要集中在CHS(查耳酮合成酶)基因[12-13]、CHI(查耳酮异构酶)基因[14-16]、IFS(异黄酮合成酶)基因[17]等。
随着高通量测序技术的出现,Groves等[18]利用RNA-seq技术在转录组水平对草麻黄的麻黄生物碱(麻黄碱和假麻黄碱)合成途径进行了发掘,初步发现了合成相关化合物的关键基因和通路;然而,并未见其对黄酮类合成代谢途径的报道。在邓楠等[19]对中麻黄黄酮类代谢途径的转录组水平初步鉴定的基础上,为更好地了解麻黄属植物中黄酮类代谢途径,本研究以草麻黄为研究对象,利用NCBI中已有的转录组原始数据,重新进行组装、拼接,获得草麻黄的重组装转录组数据,并初步发掘了黄酮类化合物代谢途径相关基因,为草麻黄中该途径关键合成基因的克隆、其遗传改良及药用价值的研究开发奠定基础。
1 材料与方法
1.1转录组原始数据来源
草麻黄转录组原始测序数据来自NCBI的SRA数据库,测序材料为草麻黄嫩梢(shoot),平台为Illumina Genome Analyzer II双端测序,编号为ERR364402,大小为1.5 G。
1.2数据的拼接和组装
首先将下载的raw reads进行过滤,去除带接头的reads,去除N(N表示无法确定碱基信息)的比例大于10%的reads,去除低质量reads(质量值Qphred≤5的碱基数占总reads的50%以上),获得clean reads。再用Trinity[20]对clean reads进行拼接,将Trinity拼接得到的转录本序列transcript,作为后续分析的参考序列,鉴于Trinity拼接的算法和原理,取每条基因中最长的转录本作为unigene,以此进行后续的分析。
1.3基因功能注释
为获得全面的基因功能信息,用Blast软件将所获得的unigene序列分别与Nr(非冗余蛋白数据库)、KOG(clusters of orthologous groups of proteins)和Swiss-prot比对(evalue<0.000 1),进行功能注释和分类处理。再对unigene进行GO(gene ontology)功能注释和分类,并用WEGO软件对GO注释结果分类作图,然后将unigene与KEGG(kyoto encyclopedia of genes and genomes)数据库进行比对,分析相关的代谢通路。
2 结果与分析
2.1草麻黄测序数据质量
草麻黄转录组测序统计共得到11 654 056 raw reads,7 947 954 clean reads。本次组装的Q20值为84.72%,Q30值为58.41%,序列碱基GC含量为48.40%,碱基错误率为0.31%,说明草麻黄转录组测序质量相对较好,测序数据准确度较高,能够满足后续分析研究的要求。
2.2草麻黄转录本组装情况
从图1可以看出:transcript和unigene长度分布结果一致,长度在200~500 bp的序列数量最多,分别为10 357(70.88%)和9 720(72.60%);长度大于2 000 bp的数量最少,分别为64(0.44%)和55(0.41%)。transcript和unigene长度的平均值分别为465和453 bp,N50/N90分别为553 bp/238 bp和525 bp/235 bp(表1)。N50/N90值越大,反映组装得到的长片段越多,组装效果越好。以上结果表明,组装的结果较好,可以用于后续分析和信息挖掘工作。
2.3基因功能注释结果
2.3.1注释结果统计
将草麻黄全部13 389条unigene序列分别与7个数据库进行比对,包括NR(NCBI官方蛋白序列数据库,包括了GenBank基因的蛋白编码序列),NT(NCBI官方核酸序列数据库,包括了GenBank,EMBL和DDBJ的核酸序列,但不包括EST,STS,GSS,WGS,TSA,PAT,HTG序列),KO(系统分析基因产物和化合物在细胞中的代谢途径以及这些基因产物功能的数据库),GO(国际标准化的基因功能描述的分类系统),Swiss-Prot(搜集了经过有经验的生物学家整理及研究的蛋白序列),PFAM(最全面的蛋白结构域注释的分类系统)和KOG(NCBI的基于基因直系同源关系的真核生物蛋白数据库)。由表2可知:在NR蛋白序列数据库获得注释的unigene数量为10 481条,是获得注释最多的数据库,占全部注释序列的78.28%。值得注意的是,有1 240条(9.26%)unigene序列在7个数据库都获得注释,至少在一个数据库注释成功的unigene数量为10 954条(81%),表明本次注释的结果较好,注释的成功率较高。将草麻黄序列与其他物种进行相似性比较,相似性最高的为松科的北美云杉[Piceasitchensis(Bong.) Carr.](38.1%),其次为原始被子植物无油樟(AmborellatrichopodaBaill.)(6.5%)和海枣(PhoenixdactyliferaL.)(2.9%)等(图2)。这也说明在进化上麻黄属与裸子植物云杉属亲缘关系更近些,而与被子植物亲缘关系则较远。

图1 草麻黄转录组unigene和transcipt数据长度分布图Fig.1 Unigene and transcipt data length distribution for transcriptome of Ephedra sinica Stapf
表1草麻黄转录组的unigene和transcript数据组装质量统计
Table 1Data assembly for unigene and transcript in transcriptome ofEphedrasinicaStapf
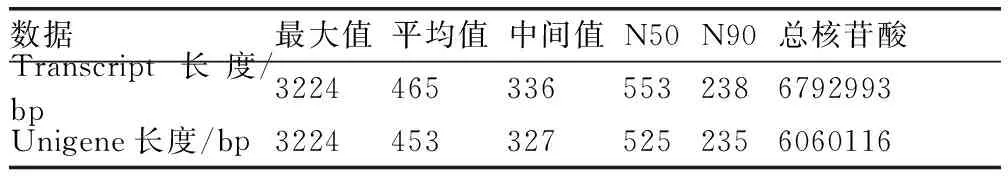
数据最大值平均值中间值N50N90总核苷酸Transcript长度/bp32244653365532386792993Unigene长度/bp32244533275252356060116
注:N50/N90为将拼接转录本按照长度从长到短排序,累加转录本的长度,到不小于总长50%/90%的拼接转录本的长度。
2.3.2草麻黄转录组GO分类结果
GO是一套国际标准化的基因功能描述的分类系统。GO分为3大类,分别为B生物过程(biological process),M分子功能(molecular function)和C细胞组分(cellular component),分别用来描述基因编码的产物所参与的生物过程、所具有的分子功能及所处的细胞环境。经过GO数据库分析后获得33 540个注释结果,其中生物过程15 527个,细胞组分9 703个,分子功能8 268个。图3为草麻黄嫩梢基因表达的总体情况,其中获得注释最多的为生物过程部分,而生物过程部分获得注释最多的为B1(代谢过程)3 952个,占生物过程总数的25.45%。值得注意的是,黄酮类化合物代谢途径正是B1(代谢过程)的一部分。关于黄酮类化合物代谢途径所属的次生代谢物代谢所占的比例则需要进一步的KOG功能分类。同时,在B7(刺激响应)和B9(信号传导)也获得了较多的GO注释unigene,它们可能直接参与草麻黄的胁迫响应过程,为研究草麻黄抗逆机制、提高草麻黄抗性奠定基础。
表2Unigene注释结果统计
Table 2Annotation for unigene ofEphedrasinicaStapf

蛋白数据库获得注释的unigene总数百分比/%NR1048178.28NT265319.81KO513138.32SwissProt803960.04PFAM690151.54GO712153.18KOG453333.85

图2 Nr数据库比对上的物种分布图Fig.2 Species distribution of Nr database
2.3.3草麻黄转录组KOG功能注释
KOG(eukaryotic ortholog groups)注释系统针对真核生物的基因产物进行直系同源分类的数据库,目前共有4 852个分类。将13 389条unigene序列进行KOG数据库分析后获得5 090个注释结果,包括4个功能分类(图4)。其中O类(蛋白质转译后修饰、蛋白转换、分子伴侣)获得761个注释结果,是获得注释最多的部分。黄酮类代谢途径所属的Q类(次生代谢产物生物合成、运输和分解代谢)共获得了208个注释。而黄酮类化合物又包括黄酮、黄酮醇、黄烷酮、黄烷酮醇、异黄酮、异黄烷酮、查耳酮等。草麻黄转录组中涉及的具体次生代谢通路还需要进一步的KEGG代谢通路分析。同时在T类(信号传导机制)和V类(防御机制)分别获得了354和53个注释,这些注释到的相关基因可能参与草麻黄的次生代谢物代谢和胁迫响应过程,为改良麻黄品质、提高麻黄抗性提供资源。

B:生物过程M:分子功能C:细胞组成B1 代谢过程B16 生物附着M1 结合C1 细胞B2 细胞过程B17 繁殖过程M2 催化活性C2 细胞组分B3 单一生物过程B18 繁殖M3 载体活性C3 细胞器B4 生物调节B19 免疫系统过程M4 结构分子活性C4 高分子配合物B5 定位B20 生长M5 核酸结合转录因子的活性C5 膜B6 生物过程调控B21 细胞杀伤M6 分子转导活性C6 膜组分B7 刺激响应B22 生物相M7 酶调节活性C7 细胞器组分B8 细胞组分组织或生物合成B23 节律性过程M8 蛋白结合转录因子的活动C8 膜蛋白B9 信号传递M9 受体活性C9 胞外区B10 多生物过程M10 抗氧化活性C10 病毒B11 涉及多细胞有机体的过程M11 通道调节活性C11 胞外区组分B12 发育过程M12 受体调节活性C12 细胞外基质B13 生物过程正调控M13 鸟嘌呤核苷酸交换因子活性C13 细胞外基质组分B14 生物过程负调控M14 金属伴侣蛋白活性C14 突触B15 移动C15 突触组分
图3草麻黄转录组的unigene GO功能分类
Fig.3GO function classification of unigene in transcriptome ofEphedrasinicaStapf


A RNA加工和修改M 细胞壁/膜/包膜生物合成B 染色体结构及动力系统O 蛋白质转译后修饰、蛋白转换、分子伴侣C 能量生产和转换P 无机离子运输和代谢D 细胞周期控制、细胞分裂、染色体分区Q 次生代谢产物生物合成、运输和分解代谢E 氨基酸运输和代谢R 一般功能预测F 核苷酸运输和代谢S 未知功能G 碳水化合物运输和代谢T 信号传导机制H 辅酶运输和代谢U 细胞内运输、分泌和膜泡运输I 脂类运输和代谢V 防御机制J 翻译、核糖体结构和生物转化W 细胞外结构K 转录Y 核结构L 复制、重组和修复Z 细胞骨架
图4草麻黄转录组的unigene KOG功能分类
Fig.4KOG function classification of unigene in transcriptome ofEphedrasinicaStapf
2.3.4草麻黄转录组KEGG分类
KEGG数据库涉及系统信息、基因组信息和化学信息,是系统分析基因产物在细胞中的代谢途径以及基因产物功能的数据库。利用KEGG数据库可以进一步研究基因在生物学上的复杂行为,有助于进一步研究特定基因的生物功能。将草麻黄转录组unigene序列与KEGG数据库进行比对,共获得5 833个注释结果,涉及代谢通路可分为5大类:细胞过程(cellular processes)(659个,11.30%),环境信息处理(environmental information processing)(465个,7.97%),遗传信息处理(genetic information processing)(1 235个,21.17%),代谢(metabolism)(2 586个,44.33%),生物系统(organismal systems)(888个,15.23%)(图5)。其中,获得注释最多的为代谢部分的碳水化合物代谢,获得562个注释,最少的为环境信息处理的信号分子和相互作用,为5个注释。在全部5 833个注释结果中,涉及次生代谢物代谢的unigene共288个,其中黄酮类化合物代谢相关基因共70个,包括类黄酮代谢相关基因56个,异黄酮代谢相关基因1个,黄酮和黄酮醇代谢相关基因13个(表3)。这说明本研究从草麻黄转录组中发掘到了较丰富的次生代谢相关基因,其中黄酮类不仅具有重要的药用价值,还可能参与草麻黄的胁迫响应。这些unigene序列为今后草麻黄的次生代谢遗传工程研究提供了遗传资源,也展现出了高通量测序技术鉴定代谢途径相关基因的实用性。
2.4草麻黄转录组中黄酮类化合物代谢相关基因发掘
植物在长期的进化过程中与其生存环境相互作用,并根据初生生长的需要产生各种类型的次生代谢物[21],在这些次生代谢物中,黄酮类化合物是植物在生态适应过程中为抵御恶劣生态条件而形成的,并参与植物生态防御、担当生殖过程的信使[22]。黄酮类化合物种类繁多,主要分为黄酮醇(flavonols)、黄酮(flavones)、异黄酮(isoflavones)和花色素苷(anthocyanins)等[23],并且,这些化合物在细胞内的合成过程发生在不同位置[24]。从KEGG分析可以看出,共获得黄酮类化合物代谢相关基因70个,表3列出了获得的代谢通路相关的unigene和注释信息,注释基因较多的为类黄酮代谢通路,代谢通路中注释的关键基因的位置和数量如图6所示。草麻黄黄酮类化合物合成的前体是简单酚类,其中PAL催化L-苯丙氨酸形成反式肉桂酸,从而提供了初生代谢和苯丙烷代谢途径之间的代谢联系。查尔酮合成酶(CHS)是接下来过程的第一个关键酶,将苯丙烷代谢途径引向黄酮类化合物的合成。CHS是苯丙烷系代谢途径中含量最丰富的酶之一,但该酶的催化效率较低,其转录受到高浓度肉桂酸的抑制及高浓度香豆酸的促进[25]。接下来步骤中的关键酶是查尔酮异构化酶(CHI),催化查尔酮合成柚皮素、二氢黄酮、无花色素等代谢物。黄酮醇合成酶(FLS)是黄酮醇合成代谢支路的关键酶,由此可合成槲皮素、杨梅素等具有药用价值的代谢物。本次草麻黄转录组鉴定阐明了草麻黄黄酮类化合物的生物合成途径并鉴定了关键酶的基因,为进一步研究次生代谢调控奠定了基础。这些基因的发现为进一步克隆其全长、研究其功能提供了基础数据,同时也为草麻黄黄酮类化合物的生物合成研究奠定了基础。本研究为应用生物技术方法获取草麻黄有效成分或其中间体提供了一定的科学依据。


G遗传信息处理C细胞过程B生物系统E环境信息处理M代谢G1 翻译C1 运输和代谢B1 内分泌系统B7 排泄系统E1 信号转导M1 碳水化合物代谢M7 其他氨基酸的代谢G2 折叠,分类和降解C2 细胞生长和死亡B2 神经系统B8 发育E2 膜转运M2 能量代谢M8 核苷酸代谢G3 转录C3 细胞共同体B3 环境的适应B9 感官系统E3 信号分子和相互作用M3 氨基酸代谢M9 萜类和酮类化合物的代谢G4 复制和修复C4 细胞运动B4 免疫系统M4 脂质代谢M10外来物质的降解和代谢B5 消化系统M5 辅酶因子和维生素代谢M11多糖的生物合成与代谢B6 循环系统M6 其他次生代谢产物的生物合成
图5草麻黄转录组的unigene KEGG代谢途径分类
Fig.5KEGG classification of unigene in transcriptome ofEphedrasinicaStapf
表3草麻黄转录组黄酮类化合物合成途径中的相关基因
Table 3Flavonoid biosynthesis related gene in transcriptome ofEphedrasinicaStapf

KO编号基因名称(英)基因名称(中)简写unigene序列编号黄酮和黄酮醇代谢通路ID:ko00944K05279Flavonol3-O-methyltransferase黄酮醇3’-O-甲基转移酶AtOMT1c10359_g1/c14996_g1/c14842_g1/K13083flavonoid3',5'-hydroxylase类黄酮3’,5’-羟化酶F3’5’Hc15359_g1/c10385_g1/c14503_g1/c12500_g1/c14398_g1/c12713_g1/K05280flavonoid3'-monooxygenase类黄酮3’-单加氧酶F3’Mc13173_g1/c7848_g1/c12719_g1/c5787_g1/类黄酮代谢通路ID:ko00941K13065ShikimateO-hydroxycinnamoyltrans-ferase莽草/荃宁酸酯转移酶HCTc7180_g1/c8816_g1/c10714_g1/c15475_g1/c8271_g1/c8791_g1/c5331_g1/c2415_g1/c11452_g1/K08695anthocyanidinreductase花青素还原酶ANRc10675_g1/c4165_g1/c13516_g1/c15063_g1/c14552_g1/K13083flavonoid3',5'-hydroxylase类黄酮3’,5’-羟化酶F3’5’Hc15359_g1/c10385_g1/c14503_g1/c12500_g1/c14398_g1/c12713_g1/K13082Bifunctionaldihydroflavonol4-reduc-tase/flavanone4-reductase二氢黄酮醇4-还原酶/黄酮4-还原酶DFRc8210_g1/c11065_g1/c13223_g1/c13781_g1/c11906_g1/c2285_g1/c13195_g1/c9960_g1/c8567_g1/K13081leucoanthocyanidinreductase无色花青素还原酶LARc9454_g1/c8813_g1/

续表3

图6 草麻黄黄酮代谢通路Fig.6 Flavonoids metabolic pathway of Ephedra sinica Stapf
3 讨论
草麻黄作为麻黄属中重要的药用植物、牧草品种和荒漠建群物种,其分子遗传方面的研究还处于空白状态,严重影响草麻黄的研究和利用。为了弥补这一空白,充分利用数据库中的数据资源,本研究对NCBI中SRA数据库中的草麻黄转录组测序原始数据经组装以及注释,获得了13 389条unigene序列,平均长度为453 bp,对比麻黄属中其他物种的转录组组装结果,如中麻黄(E.intermedin)转录组的unigene平均长度为482 bp,N50为612 bp[19],膜果麻黄(E.przewalskii)转录组的unigene平均长度为517 bp,N50为663 bp[26]。说明了本次数据组装的效果较好,获得了大量的遗传信息,为草麻黄这类基因组图谱尚未完成且遗传数据信息相对匮乏的非模式物种提供了良好的研究基础。
本研究对草麻黄转录组的鉴定,除了获得了CHS(查耳酮合成酶)基因、CHI(查耳酮异构酶)基因、IFS(异黄酮合成酶)基因、F3H(黄烷酮3羟化酶)基因、FLS(黄酮醇合成酶)基因、DFR(二氢黄酮醇还原酶)基因等研究较多且在黄酮类代谢途径中具有关键作用的基因以外,还获得了其他重要的基因,如肉桂酸合成关键基因PAL、槲皮素合成关键基因F3’5’H、黄酮合成关键基因FNS等。并且与中麻黄种子萌发期间黄酮类化合物合成途径相关基因相比[19],中麻黄种子萌发期间黄酮类合成涉及的基因家族在本次草麻黄注释中均获得,但注释的基因数量不同。IF7G(isoflavone 7-O-glucosyltransferase,异黄酮7-O-葡糖基转移酶)和FMT(flavonol 3-O-methyltransferase,黄酮醇3-O-甲基转移酶)仅在草麻黄转录组中有注释,而在中麻黄中并没有注释,其原因可能是组织特异性引起的,也可能是这2个基因具有种间特异性,这还需后续研究进一步鉴定。其中,IF7G是异黄酮代谢过程所特有的基因,异黄酮对人体有重要的作用,不仅具有抗氧化和抗肿瘤活性,还能预防心血管疾病和骨质疏松症[27-29]。但异黄酮在植物体内含量较低,目前的研究发现,天然的大部分异黄酮仅分布于豆类中,还远远不能满足人类的需求,通过化学手段合成异黄酮工艺较复杂、成本高,因此通过基因和代谢工程手段提高植物异黄酮的含量具有诱人的前景。虽然目前异黄酮合酶已经在非豆科植物中转化成功,但是转基因植株累积的异黄酮含量仅为普通大豆的20%~40%[30]。本研究中草麻黄IF7G基因的获得为IF7G基因的克隆及异黄酮的代谢遗传工程研究提供了重要的基因资源。
黄酮类化合物等植物次生代谢机制一直是十分活跃的前沿研究领域,这也是目前了解的最为清楚的植物次生代谢产物合成途径。植物药以其天然低毒的特点倍受青睐,而黄酮类化合物更是以其药理作用引人瞩目,开发利用植物的天然黄酮化合物已经成为目前的研究热点。另外,黄酮类化合物是植物在长期的生态适应过程中抵御外界恶劣生态条件、动物、微生物的攻击而产生的次级代谢产物,参与植物生态防御,提高植物在某些逆境胁迫中的抗性。草麻黄作为生长在干旱、盐碱地等极端条件下的植物,具有非常强的抗旱、耐盐碱、抗病等能力,具有较高的研究价值。本研究获得的草麻黄黄酮类等其他次生代谢物的相关基因,为克隆草麻黄中的黄酮合成关键基因提供了基础,为更好地研究其抗逆机制和药用价值以及开发提供了宝贵的遗传资源。
[1]孔红, 陈荃, 马骥. 麻黄属2种植物的核型研究[J]. 兰州大学学报(自然科学版), 2001, 37(3): 100-103.
[2]沈观冕. 中国麻黄属的地理分布与演化[J]. 植物分类与资源学报, 1995 (1): 15-20.
[3]吕霞, 郭青, 钟文英. 色谱法在麻黄生物碱手性分析中的研究进展[J]. 现代药物与临床, 2011, 26(3): 181-187.
[4]AL-KHALIL S, ALKOFAHI A, EL-EISAWI D, et al. Transtorine, a new quinoline alkaloid fromEphedratransitoria[J].JournalofNaturalProducts, 1998, 61(2): 262-263.
[5]陶华明, 朱全红, 刘永宏. 草麻黄根的黄酮类成分研究[J]. 中草药, 2011, 42(9): 1678-1682.
[6]诸姮, 胡宏友, 卢昌义, 等. 植物体内的黄酮类化合物代谢及其调控研究进展[J]. 厦门大学学报(自然科学版), 2007, 46(S1): 136-143.
[7]BANDELE O J, NEIL O. Bioflavonoids as poisons of human topoisomerase II alpha and II beta [J].Biochemistry, 2007, 46 (20): 6097-6108.
[8]延玺, 刘会青, 邹永青, 等. 黄酮类化合物生理活性及合成研究进展[J]. 有机化学, 2008, 28(9): 1534-1544.
[9]SAIJA A, SCALESE M, LANZA M, et al. Flavonoids as antioxidant agents: importance of their interaction with biomembranes [J].FreeRadicalBiology&Medicine, 1995, 19(4): 481-486.
[10]邵为民, 陈吉军, 兰江, 等. 吐鲁番地区麻黄草资源分布及其利用现状[J]. 新疆畜牧业, 2001 (1): 37-38.
[11]赵娅敏, 马好文, 孟淑娟. 紫花苜蓿中黄酮类化学成分及其生物活性研究进展[J]. 中草药, 2013, 44(22): 3245-3252.
[12]PETIT P, GRANIER T, D’ESTAINTOT B L, et al. Crystal structure of grape dihydroflavonol 4-reductase, a key enzyme in flavonoid biosynthesis [J].JournalofMolecularBiology, 2007, 368(5): 1345-1357.
[13]文海涛, 赵红英, 肖凤霞, 等. 化州柚查尔酮合成酶基因克隆与序列分析[J]. 生物学杂志, 2011, 28(1): 39-41.
[14]MEHDY M C, LAMB C J. Chalcone isomerase cDNA cloning and mRNA induction by fungal elicitor, wounding and infection [J].PlantPhysiology, 1987, 6(6): 1527-1533.
[15]刘春霞, 王玥, 崔明昆, 等. 灯盏花chi的克隆及其生物信息学分析[J]. 武汉植物学研究, 2010, 28(6): 682-690.
[16]刘长英, 赵爱春, 李军, 等. 桑树查尔酮异构酶基因的克隆与原核表达分析[J]. 林业科学, 2013, 49(2): 39-45.
[17]张丹凤. 蒙古黄芪异黄酮合成酶基因的克隆及序列分析[D]. 福州: 福建农林大学, 2004.
[18]GROVES R A, HAGEL J M, YE Z, et al. Transcriptome profiling of Khat(Cathaedulis) andEphedrasinicareveals gene candidates potentially involved in amphetamine-type alkaloid biosynthesis [J].PlosOne, 2015, 10(3): e119701.
[19]邓楠, 史胜青, 常二梅, 等. 基于中麻黄萌发种子转录组的黄酮类化合物合成途径基因的挖掘[J]. 林业科学研究, 2014, 27(6): 758-763.
[20]GRABHERR M G, HAAS B J, YASSOUR M, et al. Full-length transcriptome assembly from RNA-Seq data without a reference genome [J].NatureBiotechnology, 2011, 29(7): 644-652.
[21]陈晓亚. 植物生理与分子生物学[M]. 北京: 科学出版社, 1998: 390-399.
[22]MO Y, NAGEL C, TAYLOR L P. Biochemical complementation of chalcone synthase mutants defines a role for flavonols in functional pollen [J].ProceedingsoftheNationalAcademyofSciencesoftheUnitedStatesofAmerica, 1992, 89(15): 7213-7217.
[23]TAYLOR L P, GROTEWOLD E. Flavonoids as developmental regulators [J].CurrentOpinioninPlantBiology, 2005, 8(3): 317-323.
[24]HARBORNE J B. 黄酮类化合物[M]. 戴伦凯,译. 北京: 科学出版社, 1983.
[25]LOAKE G J, CHOUDHARY A D, HARRISON M J, et al. Phenylpropanoid pathway intermediates regulate transient expression of a chalcone synthase gene promoter [J].ThePlantCell, 1991, 3(8): 829-840.
[26]邓楠, 史胜青, 常二梅, 等. 膜果麻黄种子不同发育时期的转录组测序分析[J]. 东北林业大学学报, 2015, 43(2): 28-32.
[27]XU B, CHANG S K C. Characterization of phenolic substances and antioxidant properties of food soybeans grown in the North Dakota-Minnesota region [J].JournalofAgriculturalandFoodChemistry, 2008, 56(19): 9102-9113.
[28]PETERSON C A, SCHNELL J D, KUBAS K L, et al.
Effects of soy isoflavone consumption on bone structure and milk mineral concentration in a rat model of lactation-associated bone loss [J].EuropeanJournalofNutrition, 2009, 48(2): 84-91.
[29]LI S H, LIU X X, BAI Y Y, et al. Effect of oral isoflavone supplementation on vascular endothelial function in postmenopausal women: a meta-analysis of randomized placebo-controlled trials [J].TheAmericanJournalofClinicalNutrition, 2010, 91(2): 480-486.
[30]陈宣钦, 张乐, 徐慧妮, 等. 大豆异黄酮生物合成关键酶及其代谢工程研究进展[J]. 中国生物工程杂志, 2012, 32(7): 133.
(责任编辑侯春晓)
Characterization of transcriptome reveals pathway of flavonoids in Ephedra sinica Stapf
MA Jing1, CHENG Tie-long1,2,*, SUN Can-yue3, DENG Nan1, SHI Sheng-qing1, JIANG Ze-ping1
(1.KeyLaboratoryofTreeBreedingandCultivation,StateForestryAdministration/ResearchInstituteofForestry,ChineseAcademyofForestry,Beijing100091,China; 2.CollegeofBiologyandtheEnviroment,NanjingForestryUniversity,Nanjing210037,China; 3.NanningTreeGarden,Nanning530031,China)
EphedrasinicaStapf is not only an important medicinal plant rich in flavonoids and alkaloids, but also an important sand-fixing plant in the desert environment. In this study, the transcriptome ofE.sinicafrom SRA database in GenBank was further analyzed by bioinformatics method. 7 947 954 clean reads and 13 389 unigenes were acquired after de novo assembly; 10 481 annotations were acquired from Nr database, 4 533 from KOG database, 7 121 from GO database, 5 833 from KEGG database, 8 039 from Swiss-Prot database after function annotation against five databases. We also discovered a series of unigenes which were associated with flavonoids biosynthesis by KEGG pathway analysis, which benefits the cloning of related genes and biosynthesis of related components in flavonoids pathway. This study could provide
for understanding the resistance mechanism ofE.sinicaand utilization of its medicinal value in the future studies.
EphedrasinicaStapf; transcriptome; high-throughput sequencing; flavonoids
10.3969/j.issn.1004-1524.2016.04.11
2015-08-05
林木遗传育种国家重点实验室专项(CAFYBB2012040);国家自然科学基金资助项目(31270707)
马婧(1990—),女,山东临沂人,硕士研究生,研究方向为抗逆分子生物学。E-mail: majing19900121@sina.com
,成铁龙,E-mail:ctielong@126.com
S567.239
A
1004-1524(2016)04-0609-09
马婧, 成铁龙, 孙灿岳, 等. 草麻黄高通量转录组分析及黄酮类代谢途径相关基因的鉴定[J]. 浙江农业学报, 2016, 28(4): 609-617.
