基于LED激发光源的叶绿素荧光参数监测的植物生理分析
2016-10-31李亚迪崔会坤李征明邹秋颖纪建伟
李亚迪,崔会坤,李征明,邹秋颖,纪建伟
(沈阳农业大学 信息与电气工程学院,辽宁 沈阳 110866)
基于LED激发光源的叶绿素荧光参数监测的植物生理分析
李亚迪,崔会坤,李征明,邹秋颖,纪建伟*
(沈阳农业大学 信息与电气工程学院,辽宁 沈阳 110866)
试验设计了一套叶绿素荧光在线检测系统,通过MINI-PAM荧光仪可以实时检测到植物叶绿素的荧光参数,并采用LED光源模拟不同的光照条件,测量了植物在不同条件下的荧光参数以及快速光响应曲线。检测系统通过232串口通信协议同上位机通信,利用WinControl软件实现数据的采集与保存。结果表明,适宜的光照可以大大促进植物PSⅡ的最大量子产量,从而提高农作物的产量,受环境胁迫的植物的光合作用受到明显的抑制。
叶绿素荧光;调制荧光仪;串口通信;可编程电流源
光合作用是植物的重要化学反应,为生物所有的生命活动提供能量来源,可以说光合作用对于维持地球生态系统的正常运转起着关键的作用。叶绿素荧光可以作为探索植物光合作用的探针[1]。
叶绿素荧光诱导现象最早由Kautsky发现并和光合作用联系起来的,经过长时间的探索并逐渐形成了荧光诱导理论。如果将经过一定时间暗适应的叶子照光后,发现叶绿素荧光强度会随时间而改变,同时也与CO2的固定有关。叶绿素分子处于较低激发态时有3种途径释放能量回到稳定的基态,以热能形式散掉、光合作用和产生荧光,叶绿素荧光一般位于红光区和红外区。现常用于分析叶绿素荧光参数的技术称叶绿素荧光动力学技术,其在测定叶片光合作用过程中光系统对光能的吸收、传递、耗散、分配等方面具有独特的作用。
叶绿素荧光能反映光能吸收,同时所有光合作用过程的变化都能通过叶绿素荧光检测出来,而荧光测定技术不需破碎细胞,不伤害生物体,因此通过研究叶绿素荧光来间接研究光合作用的变化是一种简便、快捷、可靠的方法[2]。
1 系统组成及工作原理
该系统由LED阵列辐射模块,可编程恒流电源模块,环境因子检测模块,系统控制模块,MINIPAM荧光仪和上位机等模块组成(图1)。
环境因子检测模块对被测植物所处环境的温度、湿度、CO2浓度和光照度等进行检测,并将控制结果传给系统控制模块。MINI-PAM荧光仪将对叶绿素的荧光参数进行检测分析,同时通过232串口通信协议传送给上位机,上位机通过232串口通信协议同系统控制模块通信,可获得环境因子的信息,也可以对其发出控制命令。系统控制模块可以调控可编程电源模块电流的大小,而电源模块供给LED阵列模块电流的大小,能决定LED阵列光照度的强弱,从而使植物处于适宜生长的光照度下。
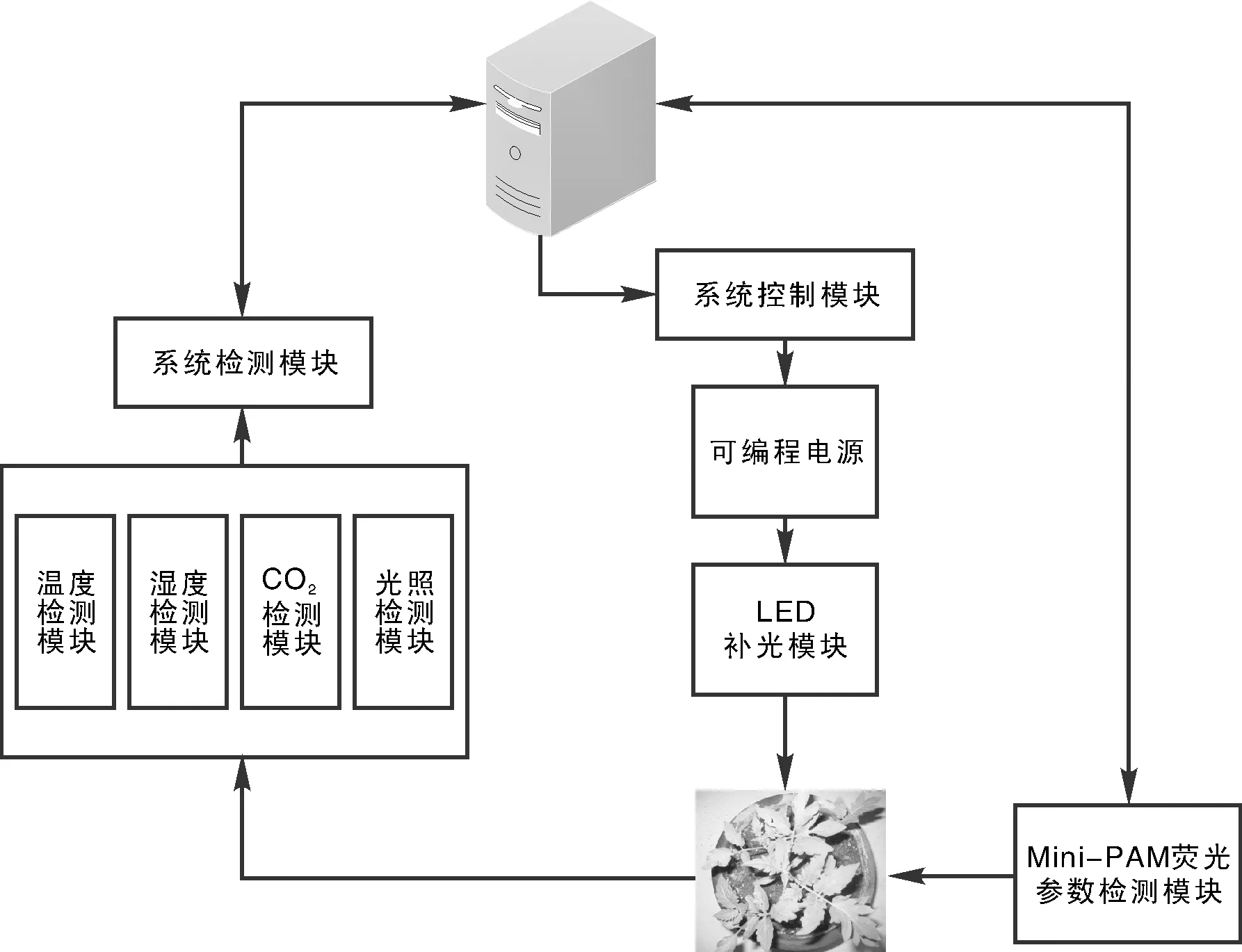
图1 检测系统总体原理图Fig.1 General schematic diagram of detection system
2 检测系统设计
2.1环境因子检测模块
植物生长状态将会受到所处环境的影响,为了保证对植物测量时不同组的数据具有对比性,要使植物所处的环境因子相同,要对植物周围的环境因子实时监测。该模块主要通过温湿度传感器、CO2浓度传感器、光照传感器等对周围环境监测。上位机开发采用面向对象Visual C++6.0软件平台,便于实时监测植物所处的环境,监控界面如图2所示。
2.2系统控制模块
系统控制模块采用ARM公司生产的STM32芯片为控制核心,STM32内部集成了A/D转换模块,串口通信模块和DMA模块等。系统控制模块要处理环境因子检测模块传递的数据信息,并通过232串口协议,将植物所处的温、湿度,CO2浓度,光照度等信息在上位机上显示出来。上位机可以发送指令到STM32,STM32将控制可编程电源模块输出电流的大小,进而控制LED阵列的光照度。
2.3LED阵列辐射模块
LED阵列辐射模块由电源模块和LED阵列组成。不同颜色和强度的光将对植物光合作用有着不同的影响。光合作用发生在可见光光谱(380~760 nm)范围内,光合作用贡献较大的是400~520 nm的蓝紫光和600~700 nm的红橙光。叶绿素主要有叶绿素a和叶绿素b,叶绿素a主要吸收蓝紫光和红光,叶绿素b吸收蓝紫光和橙色光。因此,植物进行光合作用时蓝光和红光对其有促进作用。研究表明,经过暗适应的植物叶片,随着光照度的不断增加,光合作用将呈线性增加,但当光照度达到一定值后,光合作用不再增加反而受到抑制,所以需要实时改变补光灯的强度,使植物在适宜条件下生长。
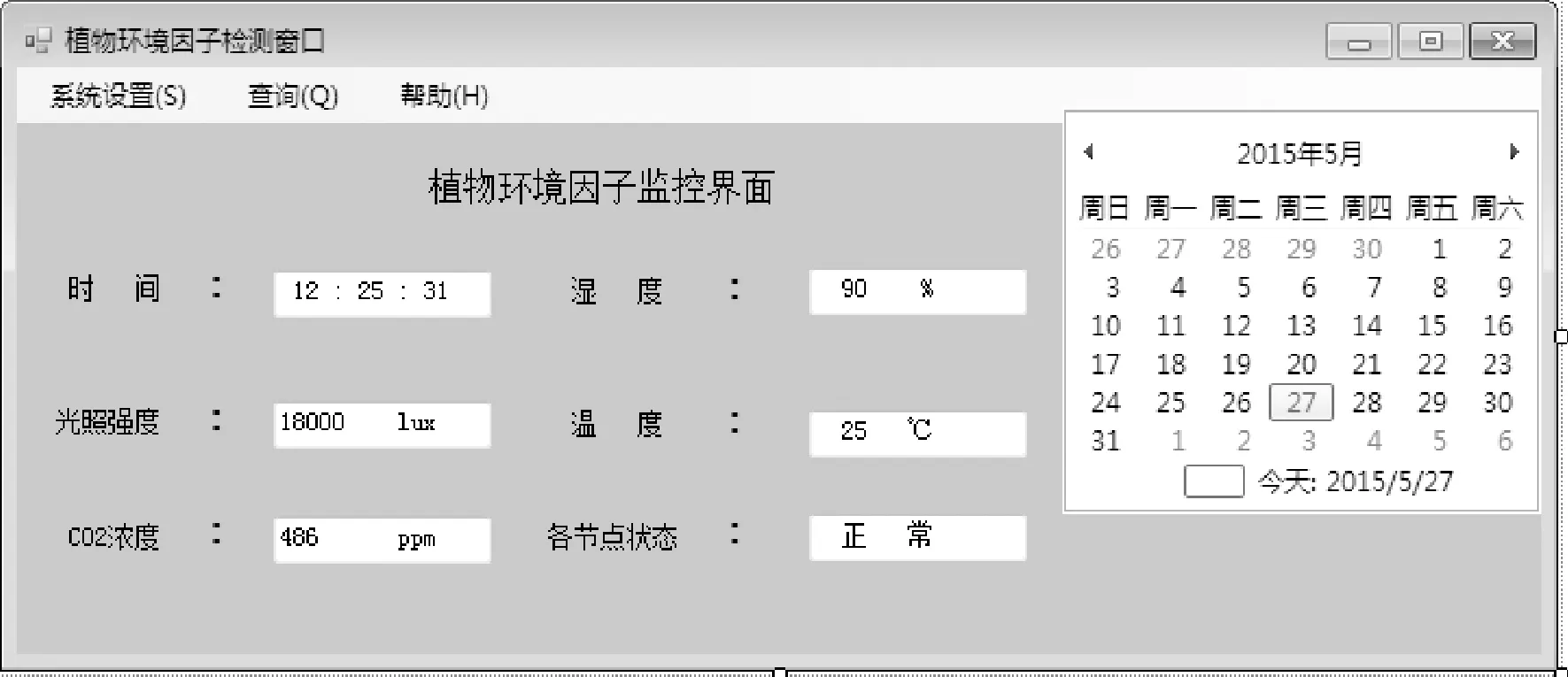
图2 植物环境因子监控界面Fig.2 Monitoring interface of plant environmental factors
在实验室条件下,对4种Philips公司生产的LED、OPPLE公司生产的LED、松下公司生产的LED和FSL公司生产的LED进行变电流测试,驱动电流变化范围为100~900 mA,测出了照度值的变化如图3所示,可以看出光照度随着驱动电流的增大而增大,而且有着很好的线性关系[3]。
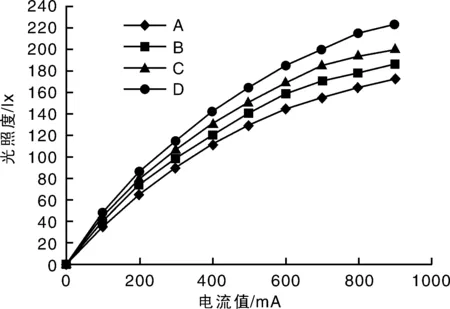
图3 不同驱动电流下4种LED的光照度Fig.3 Light intensity of 3 kinds of LED under different driving current
因此,本系统采用Philips公司生产的Luxeon型红蓝LED阵列,可以很好地满足植物对不同光照度的需求。通过前期的实验数据分析,最有利于植物生长的红蓝光比例约为4∶1,保证了相对均匀的照度,最大程度上确保每片叶子和整个植物得到均匀的光照。LED红光的中心波长为650 nm,蓝光的中心波长为470 nm,LED阵列由64个红灯,16个蓝灯组成,每4个红灯均匀分布在1个蓝灯的周围。LED之间的距离为10 mm,LED阵列功耗约为20 W,理想照明区域为60 mm×60 mm。LED阵列组合如图4所示,其中白色代表红灯,黑色代表蓝灯。
可编程电源可以通过编程使其横流输出,输出的电流稳定,不因负载阻值的变化而发生变化,能够满足要求的控制改变LED光源阵列的亮度。该电源电压输出为0~55 V,电流输出为0~8.5 A,可编程电压精度为0.05%+37.5 mV,电流精度为0.1%+10 mA。LED灯的基本工作原理为电压超过导通电压阀就可以发光,所以将电源电压设置在24 V,我们可以通过改变电流强度改变LED组合阵列的亮度。
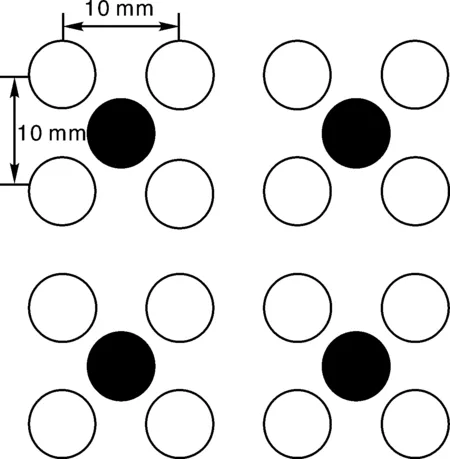
图4 红蓝LED组合阵列Fig.4 Red and blue LED array
2.4MINI-PAM
MINI-PAM是由WALZ公司生产的方便携带的超便携式调制荧光仪,十分方便于在野外操作,MINI-PAM采用了独特的调制技术和饱和脉冲技术,从而可以通过选择性的原位测量叶绿素荧光来检测植物光合作用的变化,它具有很强的灵敏度和选择性,即使在很强的、未经滤光片处理的环境下也可测定荧光产量而不受影响。它的调制测量光(ML)足够低,可以只激发色素的本底荧光而不起任何的光合作用,从而可以得到真实的记录基础荧光Fo。同时,MINI-PAM操作便捷,可对荧光参数进行测量和储存,也能进行荧光淬灭分析和记录光响应曲线等。
2.5植物荧光参数测量
被测植物通过充分暗适应后,类囊体膜上所有电子门均处于开放态,打开测量光(ML)即可得到暗适应植物叶片的最小荧光Fo,如图5所示,此时再给一个饱和脉冲(SP),所有电子门的能量都转化成了荧光和热,即可得到叶绿素最大荧光Fm[4]。
根据Fo和Fm可以计算出最大量子产量Fv/Fm=(Fm-Fo)/Fm,它反映植物的最大光合能力,通常情况下植物的Fv/Fm在0.80~0.85之间,当它下降时代表植物受到了胁迫。
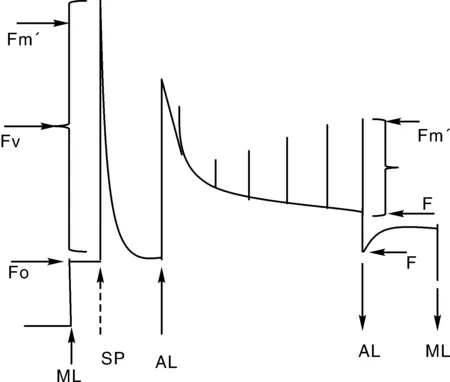
图5 叶绿素荧光诱导曲线Fig.5 Chlorophyll fluorescence induction curve
植物进行光合作用时,再给一个饱和脉冲,可以得到光适应样品的最大荧光Fm’,由实时荧光F和Fm’得到PSⅡ的实际量子产量Yield=ΦPSⅡ=ΔF/Fm’=(Fm’-F)/Fm’,它反映了植物的实际光合效率。根据PSⅡ的实际量子产量ΔF/Fm’和光合有效辐射(PAR)还可以计算出光合电子传输的相对速率rETR=ΔF/Fm’×PAR×0.84×0.5。其中植物的经验性吸光系数为0.84,0.5代表植物光合作用吸收的光能被两个光系统均分。
光合作用、叶绿素荧光和热是植物通过光合作用吸收的光能的主要的3个去向。如果植物的叶绿素荧光产量下降,说明植物的光合作用增强或者以热能形式散失了。叶绿素荧光产量下降我们称为荧光淬灭,荧光淬灭又分为光化学淬灭(光合作用引起)和非光化学淬灭(热能形式散失引起)。光化学淬灭系数qP=1-(F-Fo)/(Fm’-Fo’),非光化学淬灭系数qN=1-(Fm’-Fo’)/(Fm-Fo)。由于野外测量Fo’不方便,可以用Fo代替。
3 结果与分析
以品种为粉冠一号的番茄为例,在实验室条件下对番茄的荧光参数进行测定,首先用RS 232线(串口线)连接MINI-PAM背板上的RS-232口和上位机的COM1口,上位机可以通过软件WinControl获得MINI-PAM单机模式下测量的数据,打开WinControl软件,点击File菜单中的Data Transfer form PAM,就可以选择传输的数据,点击Start Transfer开始数据传输。打开Report就可以查看数据。MINI-PAM可以通过用户自己编写的程序来进行操作,通过Windows操作系统下的WinControl的参数进行设定,WinControl软件通讯参数中波特率设为96 000,数据位为8位,其余为默认参数即可。在定义终端参数时,Colums设为132,Terminal found设为Fixed sys。
WinControl软件操作界面如图6所示,可以选择测量叶绿素荧光诱导曲线和光响应曲线,右侧可以显示Fo和Fm,实时荧光强度F和光照强度PAR等。点击Memory即可提取储存的数据[5]。
如果采用自然光照,由于光强本身就有波动,再加上叶片的角度也不一样,导致叶片接收的光照强度差别很大,有的正对光照很强,有的跟阳光平行,受光很弱,这样我们就无法将规律找出来。在实验室条件下,用LED阵列提供的光源稳定,能很好的克服这些缺点。选择番茄的一个叶片,调节可编程电源的电流使光照稳定在光适应(PAR为200 μmol·m-2·s-1左右)和光抑制状态(PAR为2 000 μmol·m-2·s-1左右)下,我们获得番茄的PSⅡ的最大量子产量随时间的变化情况如图7所示[6]。
图7中被测植物在200 μmol·m-2·s-1光合有效辐射强度下照射3 h的PSⅡ最大量子产量Fv/Fm(经过暗适应后的),我们可以看到随着辐射时间的增加,Fv/Fm保持在0.80~0.85之间,说明植物的生理状态处于最佳状态。被测植物在2 000 μmol·m-2·s-1光合有效辐射强度下经过3 h的光照辐射,Fv/Fm下降到了0.24左右,只有正常生理状态(Fv/Fm约0.85)的30%左右,说明经过3 h的光抑制,植物的光合状态受到显著影响,植物受到了环境胁迫。
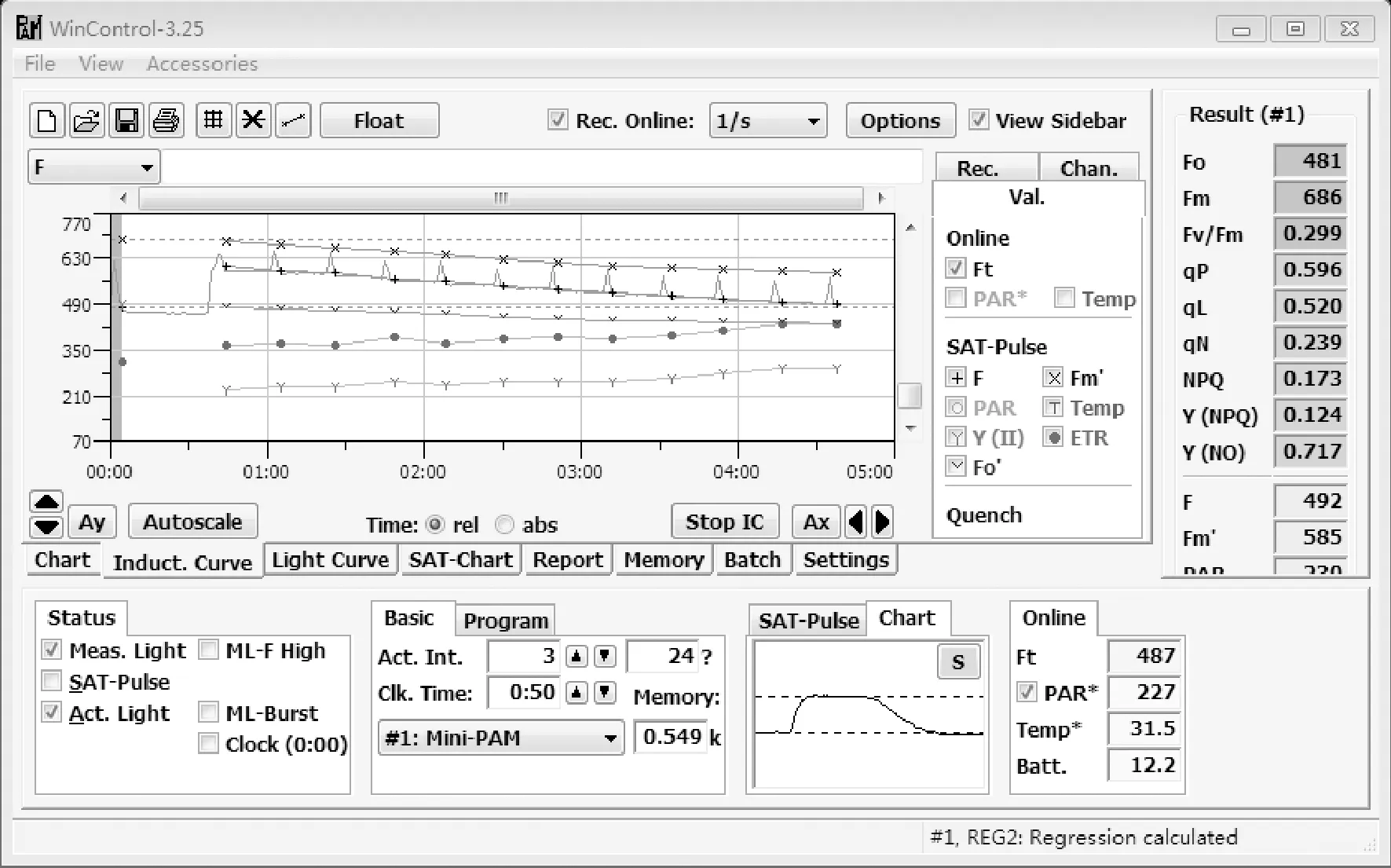
图6 WinControl监控界面Fig.6 WinControl monitor interface
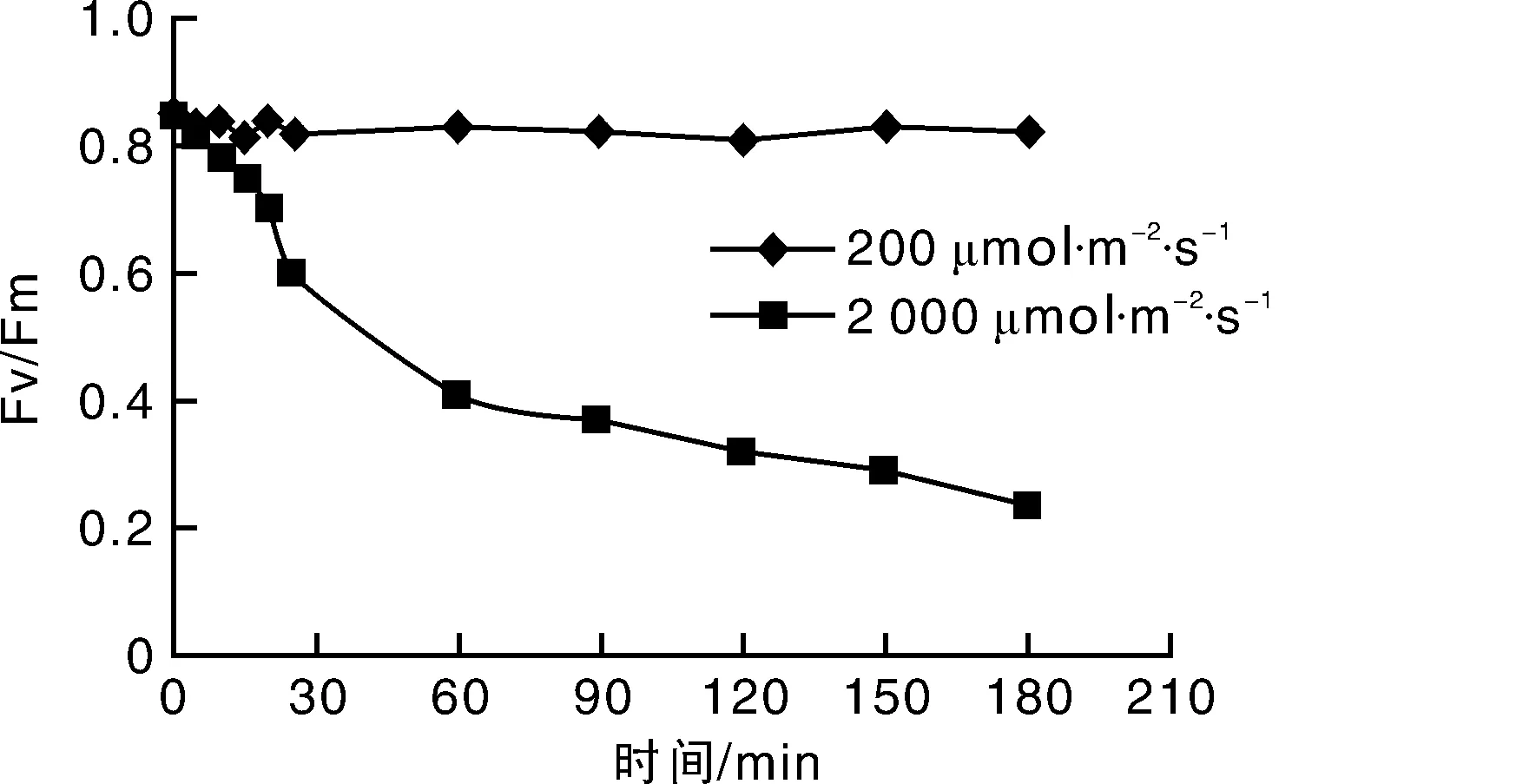
图7 不同光照下的PSⅡ的最大量子产量Fig.7 Maximum quantum yield of PSⅡ under different illumination
通过调节可编程电源的电流大小,使LED照射的PAR值达到稳定的200 μmol·m-2·s-1,图8-A为在光照强度为200 μmol·m-2·s-1下,连续照射3 h期间测得的番茄快速光响应曲线,快速光曲线是一个很灵敏的结果,能非常灵敏地反映样品的光合状态[7]。
我们可以看到0 min曲线,植物的ETRmax(植物最大光合速率)为8.5,此时的光化光强度为105 μmol·m-2·s-1,随着光化光强度的增加,植物的光合速率呈下降趋势。随着照射时间的增长,植物的光合速率也不断的增加。照射到15 min的时候,植物的ETRmax达到最大约为79.7,此时的光化光强度AL约为836 μmol·m-2·s-1,此时光照时间继续增加,其快速光响应曲线基本保持一致,而ETRmax将不再增大反而有微小的下降的趋势,说明15 min后,植物的光合速率趋于饱和,光照过多反而对光合速率有所抑制。
调节可编程电源的电流大小,使LED照射的PAR值达到稳定的2 000 μmol·m-2·s-1,图8-B为在光照强度为2 000 μmol·m-2·s-1下,连续照射3 h期间测得的植物快速光响应曲线。响应曲线的变化趋势同图8-A相似,随着测量的光化光强度的增加,均能达到一个最大ETRmax。在照射15 min的时候ETRmax达到最大,但ETRmax的值只有48.8,远低于光照强度为200μmol·m-2·s-1的ETRmax,并且随着光照时间的增加,快速光响应曲线整体下移明显,ETRmax显著下降。说明在强光的长时间照射下,光合器官利用光的效率逐渐下降,强光对光合作用的抑制明显[8]。
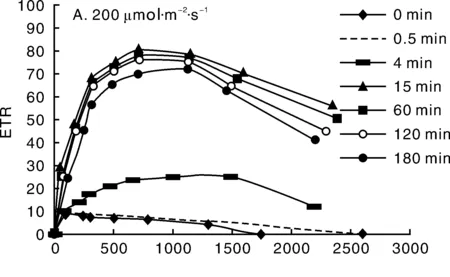
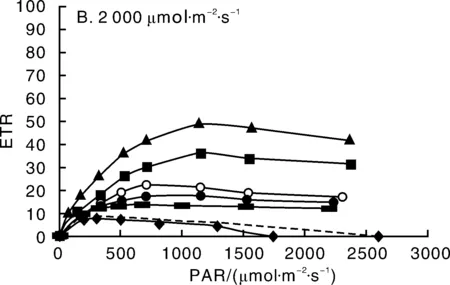
图8 两种光照强度下(200 和2 000 μmol·m-2·s-1)植物的快速光响应曲线Fig.8 Rapid response curve under 200 and 2 000 μmol·m-2·s-1 light intensity
通过对比相同植物的叶片在两种光照状态下的植物ETRmax,可以看出,植物的光合作用对光强较为敏感。适宜的光照度能使植物达到最大的光合速率和稳定的PSⅡ最大量子产量,使植物生长在最佳状态。
4 结论
通过控制可编程电源的电流大小来改变番茄照射的光照强度,利用MINI-PAM荧光仪对实验室条件下的番茄的荧光参数进行在线检测,在温和光照条件下和光抑制条件下测量番茄的PSⅡ最大量子产量Fv/Fm和植物最大光合速率。系统运行表明,系统运行可靠,可实时调整植物的光照强度,对比野外测量,能更准确的测量荧光参数,反映植物在不同胁迫环境下对光合作用的影响。对植物快速光响应曲线的分析表明,在适宜的光照条件下,植物的光合速率能达到最大值,对提高农作物的产量有很重要的应用价值。
[1]陈建明,俞晓平,程家安.叶绿素荧光动力学及其在植物抗逆生理研究中的应用[J].浙江农业学报,2006,18(1):51-55.
[2]武海,张树源,许大全,等.珊瑚树叶片叶绿素荧光非光化学猝灭的日变化和季节变化[J].植物生理学报,1997,23(2):145-150.
[3]杨昊谕,于海业,张蕾,等.基于激光诱导荧光光谱分析的黄瓜叶片叶绿素含量检测[J].农业机械学报,2009,40(10):169-172.
[4]崔瑾,徐志刚,邸秀茹.LED在植物设施栽培中的应用和前景[J].农业工程学报,2008,24(8):249-253.
[5]李征明,于辉,纪建伟,等.用于温室植物补光的LED组合光源的设计与优化[J].浙江农业学报,2015,27(3):454-459.
[6]RALPH P J,GADEMANN R.Rapid light curves:a powerful tool to assess photosynthetic activity[J].Aquatic Botany,2005,82(3):222-237.
[7]TAMULAITIS G,DUCHOVSKIS P,BLIZNIKAS Z,et al.High power light emitting diode based facility for plant cultivation[J].Journal of Physics D:Applied Physics,2005,38:3182-3187.
[8]ENGBERS G J.Influence of spectral light distribution and the photosynthetic acclimation to light of a tomato crop [D].Wageningen:Wageningen University,2006.
(责任编辑张韵)
Physiological analysis of chlorophyll fluorescence parameters monitoring of the excitation light source based on LED
LI Ya-di,CUI Hui-kun,LI Zheng-ming,ZOU Qiu-ying,JI Jian-wei*
(College of Information and Electrical Engineering,Shenyang Agricultural University,Shenyang 110866,China)
A set of on-line detection system for chlorophyll fluorescence was designed.The fluorescence intensity of chlorophyll was detected by MINI-PAM fluorescence detector,and LED light source were used as different light conditions,fluorescence parameters and fast response curves of plants under different conditions were measured.Detection system through 232 serial communication protocol with the host computer communication,WinControl software was used to achieve data collection and preservation.Experimental results showed that the suitable light could greatly promote the photosynthesis of plants,and thus improve the yield of crops,and the photosynthesis of plants under the environmental stress was obviously inhibited.
chlorophyll fluorescence;modulation fluorescence instrument;serial communication;programmable current source
浙江农业学报Acta Agriculturae Zhejiangensis,2016,28(3):509-514http://www.zjnyxb.cn
李亚迪,崔会坤,李征明,等.基于LED激发光源的叶绿素荧光参数监测的植物生理分析[J].浙江农业学报,2016,28(3): 509-514.
10.3969/j.issn.1004-1524.2016.03.24
2015-08-15
辽宁省教育厅优秀人才支持计划(LR2013033);辽宁省教育厅科学研究一般项目(L2012253)
李亚迪(1991—),男,辽宁朝阳人,硕士研究生,主要研究方向为农业生物环境智能化检测与控制系统。 E-mail:1073212407@qq.com
,纪建伟,E-mail∶jianweiji7879@hotmail.com
Q945.11
A
1004-1524(2016)03-0509-06
