兔出血症病毒SYBR Green Ⅰ实时荧光定量PCR检测方法的建立及初步应用
2016-10-31李桂黎姚学萍杨泽晓
王 波,李桂黎,王 印,姚学萍,杨泽晓
(四川农业大学 动物医学院,四川 成都 611130)
兔出血症病毒SYBR Green Ⅰ实时荧光定量PCR检测方法的建立及初步应用
王波,李桂黎,王印,姚学萍,杨泽晓*
(四川农业大学动物医学院,四川 成都611130)
兔病毒性出血症(rabbit hemorrhagic disease,RHD)是一种具有高度传染性的疾病,严重威胁养兔业的健康发展。为了建立一种能够快速、高效、敏感的检测RHDV的方法,试验设计了一对特异性引物进行PCR扩增,得到RHDV VP60基因中979 bp的保守序列,并将其克隆到pMD19-T载体中作为标准品建立标准曲线;在扩增区域内设计一对简并引物,建立SYBR Green Ⅰ荧光定量PCR检测方法,优化反应条件,并验证该方法的敏感性、特异性、重复性。结果表明:该方法可检测到的模板的最低拷贝数为8.18×101copies,只能特异性扩增RHDV,pGM19-T-EBHSV、兔巴氏杆菌、兔沙门氏菌、兔大肠埃希菌和健康兔组织RNA的扩增均为阴性,具有良好的特异性和重复性;同时用此方法对人工感染家兔的内脏分别进行检测,结果表明SYBR Green Ⅰ荧光定量PCR能快速检测到不同脏器中的兔病毒性出血症病毒RNA含量,可用于临床兔瘟病毒的检测。
兔病毒性出血症病毒(RHD);VP60;SYBR Green Ⅰ;实时荧光定量PCR
兔病毒性出血症(rabbit hemorrhagic disease,RHD)是一种急性的、具有高度传染性、高致死性的疾病[1],又称兔瘟。它由兔出血症病毒(rabbit hemorrhagic disease virus,RHDV)引起,在自然条件下主要侵害青年兔和成年兔,2月龄以下的仔兔自然感染时一般不会发病死亡。兔瘟病毒感染兔群时发病率和死亡率高达90%~100%,已成为严重危害养兔业健康发展的一种疾病。1984年该病首先在我国江苏省暴发[2],随后欧、亚、美、澳四大洲的一些国家均报道有本病流行[3],随着世界各地关于兔瘟报道的增多,说明兔瘟现在已呈现出全球流行性[4-5]。世界动物卫生组织在1989年将兔瘟列为B类传染病,我国也将其列为二类传染病。
RHDV属于杯状病毒科(Caliciviridae)兔病毒属(Lagovirus)[6],是没有囊膜的、单股正链RNA病毒[7]。目前被广泛用来检测的方法主要有:血凝试验、Western blot、酶联免疫吸附试验、免疫琼扩试验、RT-PCR等。这些方法的前期准备比较烦琐、耗时费力,而且试验敏感性低,SYBR Green Ⅰ荧光定量PCR作为荧光定量PCR方法中的一种,当荧光染料嵌合于DNA双链结构的小沟部位后,会发射荧光信号,随着PCR反应的进行,SYBR Green Ⅰ不断与新合成的dsDNA结合,荧光强度随着聚合反应的进行逐渐增加,便可被荧光探测系统检测到[8],荧光强度又与初始模板浓度量相关,既可定性检测也可定量检测。考虑到RHDV的变异,本研究根据GenBank中已公布RHDV VP60基因序列设计1对简并引物,对兔瘟病毒的SYBR Green Ⅰ实时荧光定量检测方法进行了初步研究。
1 材料与方法
1.1主要试剂
荧光定量SYBR Green Ⅰ染料购买自生工生物工程(上海)股份有限公司;病毒基因组RNA提取试剂盒、DNA胶回收纯化试剂盒、质粒提取试剂盒购买自天根生化科技(北京)有限公司;反转录试剂盒购买自宝生物工程(大连)有限公司;大肠杆菌DH5α感受态细胞由四川农业大学动物检疫实验室制备并保存。
1.2毒株
感染兔出血症病毒(RHDV)的病料、兔巴氏杆菌病菌种、兔沙门氏菌病菌种、兔大肠埃希菌菌种、健康兔组织由四川农业大学动物医学院实验室保存;欧洲野兔综合征病毒(EBHSV)重组阳性质粒由四川农业大学动物医学院实验室王印[9]老师构建并保存。
1.3引物的设计与合成
在NCBI上下载已公布的RHDV VP60基因序列若干条,用DNAStar进行比对分析,利用Beacon Designer 8软件在其保守区设计一对特异性引物F1,F2,可扩增VP60基因的片段长度为979 bp,上游引物F1:5′-TCACTGGTGTTGGCAATG-3′,下游引物F2:5′-CAGACATAAGAAAAGCC-3′;在F1,F2引物的扩增区域内,设计1对SYBR Green Ⅰ荧光定量PCR引物P1(5′-TGGAGATYGGTTTRAGTG-3′),P2(5′-AATGAGTTCAGTCARGTCAA-3′),可扩增的片段为165 bp。引物由北京擎科新业生物技术有限公司合成。
1.4病毒RNA的提取及反转录
根据病毒基因组RNA提取试剂盒说明书提取组织中病毒RNA,作为模板进行反转录,反转录体系为10.0 μL,其中5×PrimeScript Buffer 2.0 μL,RNase Free dH2O 2.0 μL,Ramdom 6 mers 2.0 μL,Oligo dT Primer 0.5 μL,PrimeScript RT Enzyme Mix I 0.5 μL,RNA 3.0 μL。反转录程序为:37℃ 15 min,87℃ 5 s。得到cDNA,-20℃保存。
1.5VP60基因的PCR扩增和质粒的构建
用反转录得到的cDNA作模板进行PCR扩增,扩增的反应总体系为20.0 μL:其中2×Taq Master Mix 10.0 μL,cDNA 2.0 μL,F1、F2各1.0 μL(10 μmol·L-1),加超纯水至20.0 μL。反应程序为:95℃ 5 min;94℃ 30 s,57℃ 45 s,72℃ 1 min,35个循环;72℃延伸10 min。扩增后用1%琼脂糖凝胶电泳进行检测。
将目的片段纯化回收,把回收的DNA连接到pMD19-T载体,再转化到大肠杆菌DH5α感受态细胞中,构建重组质粒pMD-19T-VP60,经PCR鉴定后,将阳性质粒送北京擎科新业生物技术有限公司测序鉴定。将构建的质粒pMD-19T-VP60利用核酸蛋白仪测定其在260和280 nm处的吸光度,计算出DNA的浓度和纯度,之后将其进行10倍梯度稀释,作为阳性定量的标准模板,进行荧光定量PCR的扩增和建立标准曲线。
1.6实时荧光定量PCR的扩增及标准曲线的建立
将简并引物P1和P2进行PCR扩增,反应条件和反应程序同上,扩增后用1%琼脂糖凝胶电泳进行检测,验证引物是否合理。
用阳性质粒做模板进行SYBR Green Ⅰ荧光定量PCR扩增,将其反应条件和反应程序进行优化,确定其最佳反应条件和反应程序;将重组质粒进行10倍梯度稀释,作为荧光定量PCR扩增的模板,建立SYBR Green Ⅰ荧光定量PCR扩增的标准曲线。
1.7特异性试验
将实验室保存的欧洲野兔综合征病毒重组质粒、兔巴氏杆菌病菌种、兔沙门氏菌病菌种和兔大肠埃希菌菌种复苏,用菌液当模板,进行SYBR Green Ⅰ荧光定量PCR扩增。
1.8敏感性试验
将制备的阳性质粒标准品按10倍梯度稀释后,进行荧光定量PCR扩增,以此来测定荧光定量PCR所能检测出来的模板的最低拷贝数。
1.9重复性试验
用同一次提取的不同浓度的阳性质粒作为模板,在同一次试验中做3个重复,进行荧光定量PCR 扩增,测定标准品的稳定性,同时做阴性对照。
1.10初步应用
将含RHDV的病料组织研磨液经过过滤后,取1 mL对健康成年家兔(3只)进行腹腔注射,3 d后家兔死亡。分别取心脏、肝脏、脾脏、肺脏、肾脏提取RNA,反转录为cDNA,用建立的SYBR Green Ⅰ荧光定量PCR方法进行检测,同时与普通RT-PCR[10]的检测结果进行比较。
2 结果与分析
2.1VP60基因的PCR扩增
从实验室保存的病料中提取RNA,将其反转录成cDNA后用F1,F2和P1,P2分别进行PCR扩增,经琼脂糖凝胶电泳检测后分别得到979 bp的目的片段(图1-A)和165 bp的目的片段(图1-B),均无杂带,与预期的结果相符。

M: DL2000 Marker;1: 病料扩增产物;2: 靶基因扩增产物图1 RHDV VP60和靶基因PCR扩增Fig.1 PCR results of RHDV VP60 and target gene
2.2质粒的构建
将PCR扩增产物用0.8%琼脂糖凝胶纯化回收,连接到pMD19-T载体,转化到大肠埃希菌DH5α感受态细胞,构建重组质粒pMD-19T-VP60,将其测序结果直接在NCBI上BLAST,得到的结果与RHDV VP60基因的同源性为96%。用核酸蛋白仪测定其浓度为32.9 mg·L-1,pMD-19T长度为2 692 bp,引物扩增长度为979 bp,DNA length=载体长度+引物扩增片段,即DNA length=(2692+979)bp=3671 bp,根据拷贝数计算公式:(6.02×1023)×质粒浓度(g·mL-1)/DNA length×660=copies·mL-1,得到重组质粒DNA拷贝数:(6.02×1023×32.9×10-6)μg·mL-1/(3671×660)=8.18×1012copies·μL-1。
2.3荧光定量PCR标准曲线的建立
将阳性质粒经10倍梯度稀释后选取8.18×107~8.18×1012拷贝数的样品作为模板进行荧光定量PCR扩增,通过对引物浓度的优化、退火温度的优化和各程序反应时间的优化,最终确定的最佳反应条件和反应程序为:在20.0 μL的反应体系中,2×SG Fast qPCR Master Mix 10.0 μL,P1和P2各加0.5 μL,DNF Buffer 2.0 μL,模板2.0 μL,灭菌超纯水5.0 μL;反应程序为:95℃ 3 min;95℃ 5 s,57℃ 10 s,72℃ 30 s,共40个循坏;生成动力学曲线(图2)和标准曲线(图3)。由图可见,NTC无特异性扩增,在所测定的范围内标准品与Ct值之间存在线性关系,线性回归方程Ct=-3.383×lgcopies+34.946(R2=0.997)。
2.4特异性试验
用建立的SYBR Green Ⅰ荧光定量PCR反应体系对RHDV阳性质粒、EBHSV阳性质粒、兔巴氏杆菌、兔沙门氏菌、兔大肠埃希菌和兔健康组织RNA进行荧光定量PCR检测,结果表明所设计的引物只能特异性的扩增RHDV,对EBHSV阳性质粒、兔巴氏杆菌、兔沙门氏菌等的检测结果均为阴性(图4),说明所建立SYBR Green Ⅰ荧光定量PCR方法具有很好的特异性。
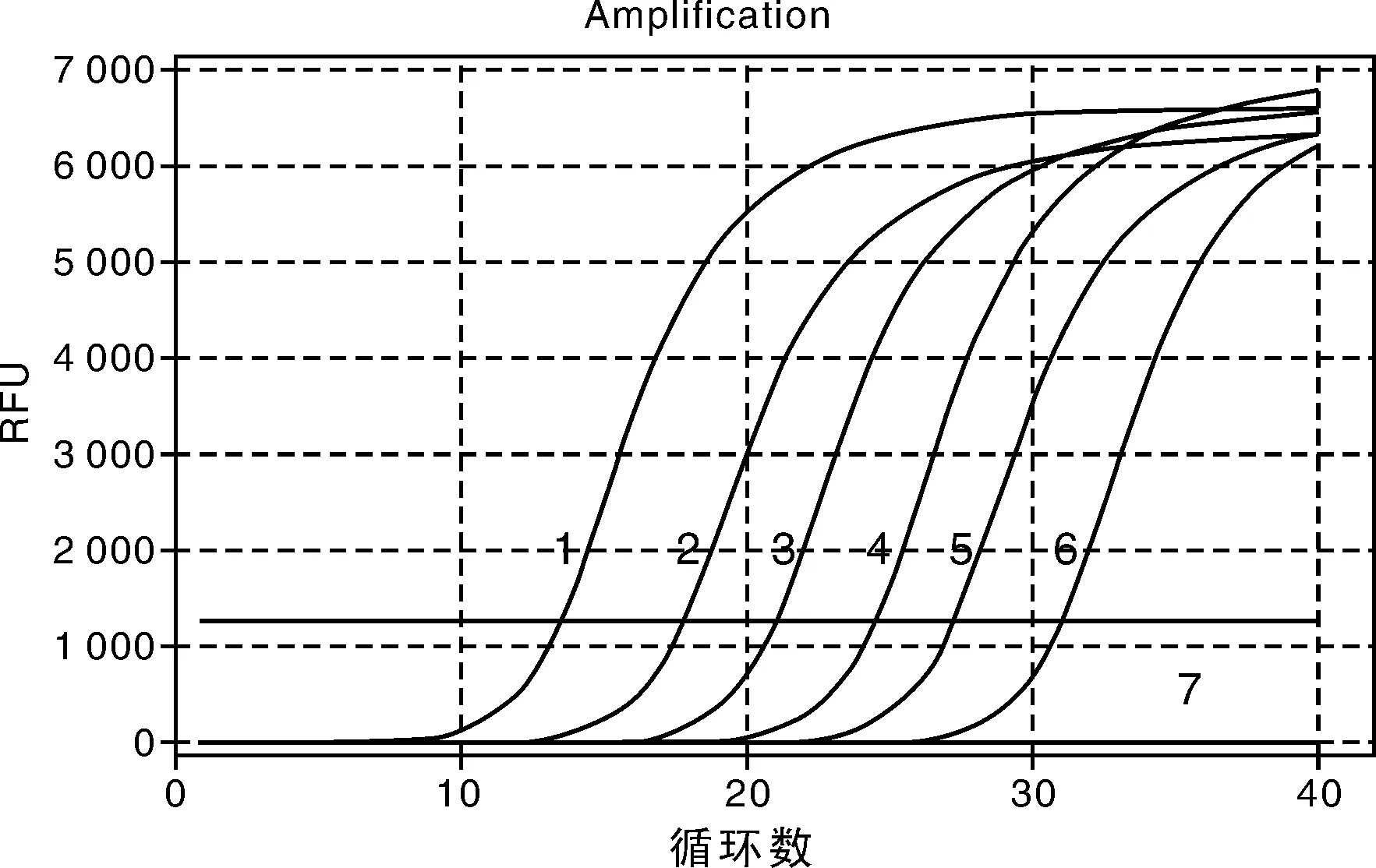
1,8.18×1012 copies·mL-1;2,8.18×1011 copies·mL-1;3,8.18×1010 copies·mL-1;4,8.18×109 copies·mL-1;5,8.18×108 copies·mL-1;6,8.18×107 copies·mL-1;7,NTC(ddH2O)。图2 SYBR Green Ⅰ荧光定量PCR动力学曲线Fig.2 The amplification of SYBR Green Ⅰ real-time PCR
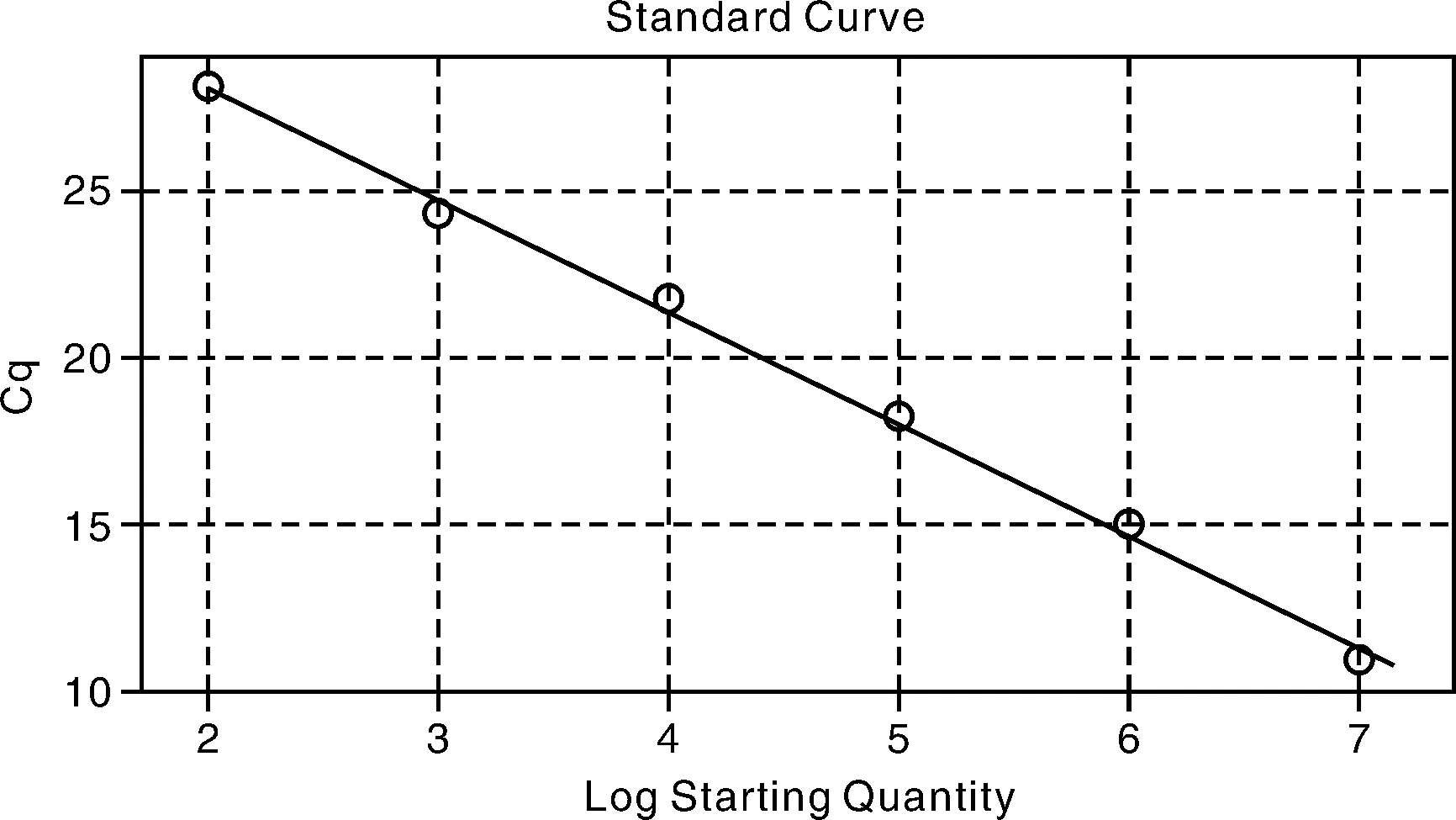
图3 标准曲线Fig.3 The standard curve of SYBR Green Ⅰ real-time PCR

1:RHDV;2:pGM-T-EBHSV;3:兔巴氏杆菌;4: 兔沙门氏菌;5: 兔大肠埃希菌;6: 健康兔组织RNA;7:NTC(ddH2O)。图4 SYBR Green Ⅰ荧光定量PCR的特异性试验Fig.4 The specificity assay of SYBR Green Ⅰ real-time PCR
2.5敏感性试验
将制备的阳性质粒10倍梯度稀释后,作为模板进行荧光定量PCR扩增,得到的扩增曲线(图5)显示,在8.18×100copies时与阴性对照结果基本重合,说明其灵敏度为8.18×101copies。
2.6重复性试验
选取质粒浓度为8.18×1012~8.18×107copies·mL-1的样品模板按制备标准曲线的反应程序和反应条件进行荧光定量PCR扩增,所得到的样品Ct值在组内的变异系数分别为1.12%,0.34%,0.36%,0.23%,0.51%,0.29%(表1),而Tm值一直维持相同的数值(81℃),同时,从PCR扩增曲线(图6)可以看出每个样本的3条S曲线之间的误差都不到1个循环,说明此方法具有良好的重复性和准确性。

1,8.18×106 copies;2,8.18×105 copies;3,8.18×104 copies;4,8.18×103 copies;5,8.18×102 copies;6,8.18×101 copies;7,8.18×100 copies;8,NTC(ddH2O)。图5 SYBR Green Ⅰ荧光定量PCR的灵敏度试验Fig.5 The sensitivity assay of SYBR Green Ⅰ real-time PCR
表1SYBR Green Ⅰ荧光定量PCR重复性试验
Table 1The reproducibility assay of SYBR Green Ⅰ real-time PCR
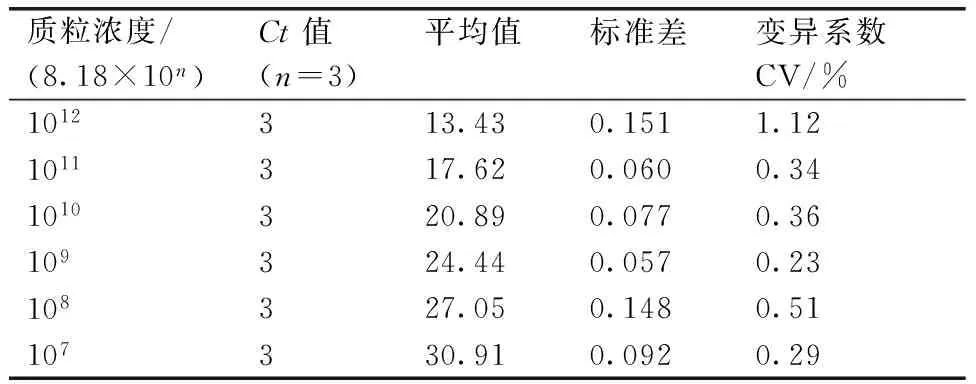
质粒浓度/(8.18×10n)Ct值(n=3)平均值标准差变异系数CV/%1012313.430.1511.121011317.620.0600.341010320.890.0770.36109324.440.0570.23108327.050.1480.51107330.910.0920.29

1,8.18×1012 copies·mL-1;2,8.18×1011 copies·mL-1;3,8.18×1010 copies·mL-1;4,8.18×109 copies·mL-1;5,8.18×108 copies·mL-1;6,8.18×107 copies·mL-1;7,NTC(ddH2O)。图6 SYBR Green Ⅰ荧光定量PCR的重复性试验Fig.6 The reproducibility assay of SYBR Green Ⅰ real-time PCR
2.7初步应用
用建立的SYBR Green Ⅰ荧光定量PCR法和普通RT-PCR法同时对实验室人工感染家兔的内脏分别进行检测,扩增完成后系统自动分析得到各脏器的Ct值(表2),根据Ct值的大小与各脏器的含毒量相关性可知脏器中含毒量最多的是脾脏。普通RT-PCR方法的检测结果(图7)显示脾脏的条带最清晰,病毒含量最高,而心脏、肺脏的条带不明显,病毒含量相对较低,与SYBR Green Ⅰ荧光定量PCR检测结果相符合,表明荧光定量PCR方法在RHDV的检测中不仅可以定量检测,而且具有更高的敏感性。
表2人工感染家兔内脏的Ct值
Table 2The Ct value of artificial infection rabbits

人工感染兔心脏肝脏脾脏肺脏肾脏A(Ct)28.0525.4018.6922.2235.45B(Ct)33.6121.2819.3531.2229.55C(Ct)23.8023.9021.8223.6126.40

M:DL2000 Marker;1: 心脏;2: 肝脏;3: 脾脏;4: 肺脏;5: 肾脏。图7 家兔内脏RHDV RT-PCR检测部分结果Fig.7 RT-PCR detection of rabbit organs
3 讨论
实时荧光定量PCR方法是20世纪90年代发展起来的一种新型核酸定量技术。目前,在临床医学和生命科学领域都得到了广泛的应用,已成为病毒含毒量检测的常用方法[11],它解决了传统PCR方法在DNA序列扩增和之后的产物分析中量化困难的问题。SYBR Green Ⅰ染料法与荧光探针法相比,染料法不需设计、标记荧光探针,成本更低;另外,DNA在扩增和分析的过程都在同样的封闭系统完成,避免了样品和产物的污染,而且不需要进行PCR后续的实验处理或电泳检测,更加省时,操作更简便,可直接进行定性分析和定量分析,具有很好的实用性。
兔瘟自暴发以来,已给养兔业造成了严重的经济损失,亚洲、欧洲、澳洲对于兔瘟的报道也越来越多[12-13],近年来虽有所控制,但仍有散发的报道。所以,建立一种快速、准确、省时的检测方法很有必要。考虑到RHDV存在基因突变,本试验通过在RHDV VP60序列的保守区设计简并引物,并优化引物浓度、退火温度及反应程序,成功建立了一种SYBR Green Ⅰ荧光定量PCR检测方法。简并引物具有相对较宽的检测范围,解决了因基因变异引起的难以扩增的问题,国内尚无使用简并引物检测RHDV的荧光RT-PCR研究的公开报道。2015年,Liu等[14]报道设计1对普通特异性引物建立了一种RHDV SYBR Green Ⅰ 荧光RT-PCR方法,并对临床样品和人工感染样品进行了检测,结果显示,受检样品中脾脏含毒量最多,这与本研究的检测结果一致。然而2007年张秀娥等[15]报道用建立的RHDV TaqMan MGB荧光RT-PCR检测方法,并对人工感染家兔内脏的病毒含量进行检测,结果显示,病毒在肝脏含量高于脾脏、血液、心脏、肺脏、肾脏和体液,这可能与病毒感染剂量或者感染途径有关。本研究采用一对带有简并碱基的引物通过反应条件优化、特异性试验、敏感性试验、标准曲线建立和人工感染样品的检测应用建立了RHDV的SYBR Green Ⅰ荧光定量PCR方法,该方法能检测到的阳性质粒标准品的最低拷贝数为8.18×101copies,样品的组内变异系数为0.23%~1.12%,重复性和准确性高,与平行检测RT-PCR方法检测结果一致,且具有比普通RT-PCR更高的敏感性。因此,本试验建立的SYBR Green Ⅰ荧光定量PCR方法在定性、定量方面均具有良好的实用性,不仅可用于不同地方不同RHDV毒株的实验室快速检测诊断,也可用于RHDV不同组织中定量检测和致病机制的相关研究中。
[1]ESTEVES P J,ABRANTES J,CARNEIRO M,et al.Detection of positive selection in the major capsid protein VP60 of the rabbit haemorrhagic disease virus (RHDV) [J].Virus Research,2008,137(2):253-256.
[2]MITRO S,KRAUSS H.Rabbit hemorrhagic disease:a review with special reference to its epizootiology [J].European Journal of Epidemiology,1993,9(1):70-78.
[3]MARTTHAEI M,KERR P J,READ A J,et al.Comparative quantitative monitoring of rabbit hemorrhagic disease viruses in rabbit kittens [J].Virology Journal,2014,11(1):109-120.
[4]DALTON K P,NICIEZA I,BALSEIRO A,et a1.Variant rabbit hemorrhagic disease virus in young rabbits,Spain [J].Emerging Infectious Diseases,2012,18(12):2009-2012.
[5]OEM J K,LEE K N,ROH I S,et al.Identification and characterization of rabbit hemorrhagic disease virus genetic variants isolated in Korea [J].Journal of Veterinary Medical Science,2009,71(11):1519-1523.
[6]陈柳,云涛,刘光清,等.兔出血症病毒衣壳蛋白VP60在杆状病毒表达系统中的表达及细胞内定位[J].浙江农业学报,2010,22(2):135-139.
[7]PARRA F,PRIETO M.Purification and characterization of a calicivirus as the causative agent of a lethal hemorrhagic disease in rabbits [J].Journal of Virology,1990,64(8):4013-4015.
[8]BUSTIN S A,MUELLER R.Real-time reverse transcription PCR (qRT-PCR) and its potential use in clinical diagnosis [J].Clinical Science,2005,109(4):365-379.
[9]王印,杨泽晓,韩雪清,等.兔出血症病毒与欧洲野兔综合征病毒复合RT-PCR检测方法的建立[J].中国兽医科学,2011,41(11):1165-1170.
[10]肖跃强,刘吉山,杨慧,等.兔出血症病毒RT-PCR检测方法的建立和应用[J].中国动物传染病学报,2014,22(3): 82-86.
[11]JOHNSON G,NOLAN T,BUSTIN S A.Real-time quantitative PCR,pathogen detection and MIQE [J].Methods in Molecular Biology,2013,943:1-16.
[12]EDEN J S,KOVALISKI J,DUCKWORTH J A,et al.Comparative phylodynamics of rabbit hemorrhagic disease virus in Australia and New Zealand [J].Journal of Virology,2015,89(18):9548-9558.
[13]EMBURY-HYATT C,POSTEY R,HISANAGA T,et al.The first reported case of rabbit hemorrhagic disease in Canada [J].Canadian Veterinary Journal La Revue Veterinaire Canadienne,2012,53(9):998-1002.
[14]LIU W K,DANG R Y,WANG X L,et al.Development of a SYBR-based real-time PCR to detect rabbit hemorrhagic disease virus (RHDV) and analyze its tissue distribution in experimentally infected rabbits [J].Virologica Sinica,2015,30(3):228-230.
[15]张秀娥,田夫林,李希友,等.TaqMan MGB探针实时检测兔病毒性出血症[J].中国兽医学报,2007,27(6):814-817.
(责任编辑卢福庄)
Establishment and application of SYBR Green Ⅰ real-time PCR for detection of rabbit hemorrhagic disease virus
WANG Bo,LI Gui-li,WANG Yin,YAO Xue-ping,YANG Ze-xiao*
(College of Veterinary Medicine,Sichuan Agricultural University,Chengdu 611130,China )
Rabbit hemorrhagic disease is a highly contagious disease which causes serious damage to the healthy development of rabbit keeping.In order to establish a quick,efficient and sensitive detection method,a pair of specific primers were designed for PCR amplification to obtain 979 bp sequence of rabbit hemorrhagic disease virus(RHDV) VP60 gene.Then cloned it into pMD19-T vector to construct recombinant plasmid named pMD-19T-VP60,which was served as template to establish the standard curve.Meanwhile,a pair of degenerate primer was designed in the amplification region to establish the SYBR Green Ⅰ real-time PCR detection method,and the reaction condition was optimized,and the sensitivity,specificity and reproducibility were tested.The results showed that the SYBR Green Ⅰ real-time PCR could specifically detect RHDV that the limited detection content was 8.18×101copies and no amplification of pGM19-T-EBHSV,Pasteurella multocida,Salmonella,Escherichina coli and healthy organs from rabbits.At the same time,this method was used to detect the internal organs of artificial infection rabbits.The results showed that the SYBR Green Ⅰ fluorescence quantitative PCR could quickly detect the content of the virus RNA in different organs.So this assay could be applied in clinical diagnosis of RHDV.
rabbit hemorrhagic disease virus(RHDV);VP60;SYBR Green Ⅰ;real-time quantitative PCR
浙江农业学报Acta Agriculturae Zhejiangensis,2016,28(3):400-405http://www.zjnyxb.cn
王波,李桂黎,王印,等.兔出血症病毒SYBR Green Ⅰ实时荧光定量PCR检测方法的建立及初步应用[J].浙江农业学报,2016,28(3):400-405.
10.3969/j.issn.1004-1524.2016.03.07
2015-11-04
国家自然科学基金资助项目(3140222);四川省教育厅青年基金资助项目(11ZB064)
王波(1990—),女,四川邛崃人,硕士研究生,研究方向为预防兽医学。E-mail:18728156822@163.com
,杨泽晓,E-mail:yzxyang2003@126.com
S852.65+9.6
A
1004-1524(2016)03-0400-06
