产γ-氨基丁酸益生菌的筛选及其生物活性研究
2016-10-31徐毓琴戴茜茜唐慧琴谷笑笑潘康成
徐毓琴,戴茜茜,唐慧琴,谷笑笑,潘康成,2,
(1.四川农业大学 动物医学院,四川 成都 611130;2.动物疫病与人类健康四川省重点实验室,四川 成都 611130)
产γ-氨基丁酸益生菌的筛选及其生物活性研究
徐毓琴1,戴茜茜1,唐慧琴1,谷笑笑1,潘康成1,2,*
(1.四川农业大学 动物医学院,四川 成都 611130;2.动物疫病与人类健康四川省重点实验室,四川 成都 611130)
为筛选具有生物拮抗活性和耐酸耐胆盐能力的高产γ-氨基丁酸(GABA)的菌株,首先从待分离样品中筛选出可疑菌株,然后利用纸层析和HPLC-MS进行定性和定量分析,筛选出高产γ-氨基丁酸菌株。通过细菌形态、生理生化特性并结合细菌16S rDNA序列对高产菌株进行鉴定,同时研究高产菌株对3株动物性病原菌的生物拮抗作用及其耐酸耐胆盐试验。结果表明,从泡菜中筛选出的菌株GA8为高产γ-氨基丁酸菌株,在含有1% L-谷氨酸钠的GYP培养基中37℃培养48 h,产GABA量达3.50 g·L-1,经鉴定该菌株为植物乳杆菌;该菌株全菌液和上清液对鸡白痢沙门氏菌、鸡源大肠杆菌和金黄色葡萄球菌有一定的抑制作用,其菌体悬液无抑菌能力;该菌初始活菌数为108cfu·mL-1时,在pH 2.0的酸性环境中处理4 h后,活菌数能达到106cfu·mL-1以上;0.3%胆盐处理4 h,活菌数达到103cfu·mL-1左右。表明所筛选出的产γ-氨基丁酸菌株GA8具有一定的抑菌性能和耐酸能力,但耐胆盐能力不强。
益生菌;γ-氨基丁酸;生物拮抗;耐酸耐胆盐
γ-氨基丁酸(GABA)是一种非蛋白质氨基酸,在谷氨酸脱羧酶催化下,由谷氨酸脱羧形成[1],具有镇静安神、免疫调节、降血压、抗疲劳、改善脑机能等多种生理功能,能参与体内多种代谢活动。Ali等[2]研究发现,给大鼠口服γ-氨基丁酸,可以改善顺铂引起的大鼠肾毒性副作用,而且不影响顺铂的治疗效果。乳酸菌[3]、酵母菌[4]、红曲霉菌[5]等都能利用自身合成的谷氨酸脱羧酶将谷氨酸转化成GABA,并普遍应用于食品、药品加工行业中,以提高人类的免疫能力,起到保健的作用。Ratanaburee等[6-7]将产GABA乳酸菌应用于食品和饮料中以改善口感,增强体质。Diana等[8]在西班牙奶酪中分离出产GABA的乳酸菌,发现该菌有调节血压的作用。穆琳[9]在酸奶中添加GABA乳酸菌,提高了酸奶的发酵工艺与品质。
由于抗生素的大量使用,耐药性、药物残留及环境污染等问题显现出来,所以开发出替代抗生素的新型产品迫在眉睫,而益生菌作为功能性食品成为新的研究热点。产γ-氨基丁酸益生菌优化与发酵方面的研究已经非常广泛,但有关产γ-氨基丁酸益生菌生物拮抗作用及耐酸耐胆盐方面的研究却相对较少,本试验旨在筛选出产γ-氨基丁酸益生菌并探讨其抑菌效果及耐酸耐胆盐能力。
1 材料与方法
1.1材料与试剂
土壤和粪便采自四川农业大学雅安校区实验农场,泡菜、酸奶、豆豉购自四川省雅安市吉选超市。鸡白痢沙门氏菌CVCC533购自中国兽医药品监察所,鸡源大肠杆菌和金黄色葡萄球菌由本实验室保存。
γ-氨基丁酸标准品(SIGMA),猪胆盐(北京奥博星生物技术公司),L-谷氨酸钠和茚三酮(成都科龙化工试剂厂。电子天平(沈阳龙腾电子有限公司),高速冷冻离心机(SIGMA),液相色谱质谱连用仪(AGILENT),PCR仪(BIO-RAD),凝胶成像系统(BIO-RAD)。
营养肉汤:牛肉膏5 g、蛋白胨10 g、氯化钠5 g、蒸馏水1 L,pH 7.2,1×105Pa高压灭菌15~20 min。如制备营养琼脂,在上述成分中加入1.8%的琼脂粉。
GYP种子培养基:葡萄糖10 g、酵母粉10 g、蛋白胨5 g、醋酸钠2 g、硫酸镁0.02 g、硫酸锰0.001 g、硫酸亚铁0.001 g、氯化钠0.001 g、蒸馏水1 L,pH 6.8,1×105Pa高压灭菌15 ~ 20 min。
GYP发酵培养基:GYP种子培养基中添加1%的L-谷氨酸钠,pH 6.8,1×105Pa高压灭菌15 ~ 20 min。
1.2方法
1.2.1菌株的分离与纯化
分别称取10 g土壤、泡菜、酸奶、豆豉及粪便样品,加入带玻璃珠的90 mL灭菌生理盐水三角瓶中,37℃ 200 r·min-1振荡1 h,无菌操作进行10倍递进稀释,取浓度10-4和10-5稀释液0.1 mL分别涂布于营养琼脂平板上,分别37℃恒温需氧或厌氧培养2 d。挑取单菌落进行革兰氏染色,将革兰氏染色阳性菌进行反复划线纯化后,接种于斜面培养基中,4℃保存备用。
1.2.2产GABA菌株的初步筛选
将得到的菌株接种于100 mL GYP种子培养基中,30℃静置或振荡培养1 d,然后以5%的接种量接入100 mL GYP发酵培养基中,30℃静置或振荡培养2 d,对发酵液进行GABA定性和相对定量分析。
定性分析:采用纸层析法进行测定,展开剂(正丁醇∶冰醋酸∶水体积比为4∶1∶3)中含有4 g·L-1的茚三酮溶液便于显色。取发酵上清液0.5 μL进行点样,以5 g·L-1GABA标准样品作为对照,当展开剂距层析纸前沿1 cm时,将层析纸放于70℃烘箱中显色5 min,观察是否有GABA斑点。
相对定量分析:将GABA标准品配成0.10,0.20,0.30,0.40,0.50,0.60,0.70,0.80,0.90,1.00 g·L-1的标准溶液。对标准溶液和上述待测发酵液进行点样、展层等同定性分析,将标准溶液与待测样品一致的斑点剪下,洗脱,洗脱液在分光光度计波长520 nm处测定吸光值。绘制GABA标准曲线并求出回归曲线,将待测样品的吸光值带入公式,求出待测样品的GABA含量。
1.2.3发酵液中GABA的精确定量分析
采用HPLC-MS法对上述获得相对高产的产GABA菌株发酵液进行精确的定量分析,用50 g·L-1三氯乙酸稀释上述相对高产菌株培养48 h的上清液至适当浓度,处理后的样品送北京辉奥生物技术有限公司检测GABA含量。
1.2.4高产γ-氨基丁酸菌株的初步鉴定
参考《伯杰细菌鉴定手册》[10]测定,对产GABA菌株进行菌落、细菌形态和生理生化特性鉴定。同时参照文献[11]对分离菌株进行需氧性试验。
1.2.5菌株的16S rDNA序列同源性分析
按照参考文献[12]的方法提取细菌基因组DNA,采用16S rDNA基因通用引物进行PCR扩增,PCR产物经2%琼脂糖凝胶电泳,紫外灯下观察,若出现1.5 kb左右的单一条带,则证明已成功扩增目标16S rDNA序列。将PCR产物送成都擎科梓熙生物技术有限公司测序。将得到的16S rDNA序列提交到NCBI核酸数据库中进行BLAST在线对比,并在GenBank核酸数据库中随机选取部分细菌16S rDNA序列,用MEGA 5.2软件进行多序列对比,构建系统发育树,确定菌株的进化分类地位。
1.2.6高产GABA菌株对3株病原菌的生物拮抗试验
将筛选出的高产GABA菌株和3株病原菌分别接种于营养肉汤中,病原菌置于37℃,150 r·min-1水浴振荡24 h,产GABA菌株置于37℃,30 r·min-1水浴振荡24 h。用灭菌生理盐水分别对3株病原菌进行稀释并调整菌液浓度为1×106cfu·mL-1。将高产GABA菌株培养物(全菌液)4 000 g离心10 min,上清液经滤膜过滤后得无菌上清液;同时将菌体沉淀物用灭菌生理盐水洗涤3次后重悬,调整菌体浓度为2×108cfu·mL-1,即为菌体悬液,然后参照文献[13],每组3个重复,用牛津杯法分别进行全菌液、上清液和菌体重悬液对3株病原菌的生物拮抗试验。
1.2.7菌株的耐酸试验
取pH为2,3,4的灭菌营养肉汤各4.5 mL,分别接入0.5 mL的高产GABA菌株菌悬液(菌浓度为1×108cfu·mL-1),37℃恒温培养0,2和4 h,每组3个重复,采用平板计数法检测细菌活菌数。
1.2.8菌株的耐胆盐试验
取含猪胆盐为0.1%,0.2%,0.3%和0.4%的灭菌营养肉汤各4.5 mL,分别接入0.5 mL的高产GABA菌株菌悬液(菌浓度为1×108cfu·mL-1),37℃恒温培养0,2和4 h,每组3个重复,采用平板计数法检测细菌活菌数。
1.2.9试验数据处理
试验得到的数据均用Excel进行记录、整理。
2 结果与分析
2.1产GABA菌株的初步筛选
将分离纯化得到的菌株制备菌种后,转接于GYP发酵培养基,30℃静置或振荡培养2 d后,采用纸层析对发酵液进行GABA的定性检测,结果发现,分离纯化的所有菌株中,有16株产GABA(图1)。将这16株GABA显色的斑点,经洗脱后,在波长520 nm处测定吸收值并带入标准曲线(y = 0.1238x + 0.1353,R2= 0.996 9,y表示吸光度,x表示GABA浓度),计算γ-氨基丁酸的量,结果见表1。结果显示,GA8号菌株产GABA量最高,产量为3.915 g·L-1。
2.2HPLC-MS法精确定量
挑选产GABA产量较高的的GA4,GA6,GA8,GA9和GA11号菌株,经发酵后采用HPLC-MS法检测分析,根据GABA标准品图谱(图2-A),发现样品均在相同时间出现峰值(图2-B)。GA4,GA6,GA8,GA9和GA11号菌株产GABA量分别为2.78,2.90,3.50,2.62和2.12 g·L-1,其中GA8号菌株产GABA量最高,检测结果与初步筛选结果一致。
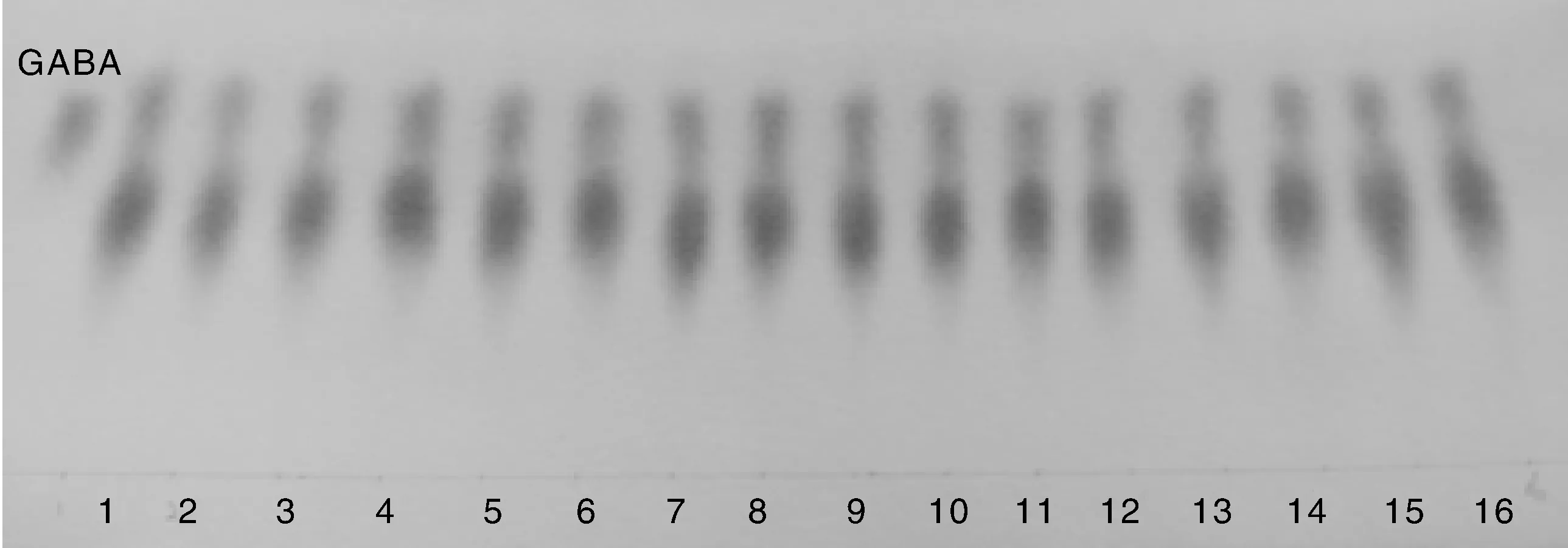
图1 GABA纸层析定性检测Fig.1 Qualitative detection of GABA by paper chromatography
表1不同菌株产γ-氨基丁酸量的结果
Table 1The results of γ-Aminobutyric acid produced by different strains
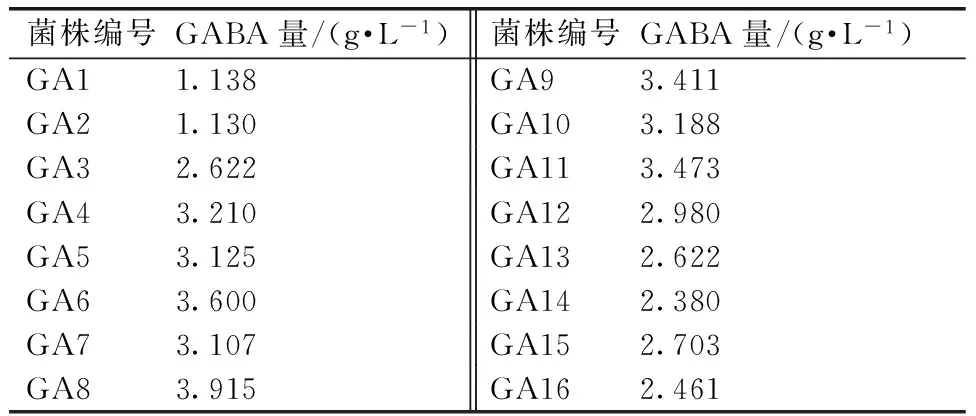
菌株编号GABA量/(g·L-1)菌株编号GABA量/(g·L-1)GA11.138GA93.411GA21.130GA103.188GA32.622GA113.473GA43.210GA122.980GA53.125GA132.622GA63.600GA142.380GA73.107GA152.703GA83.915GA162.461
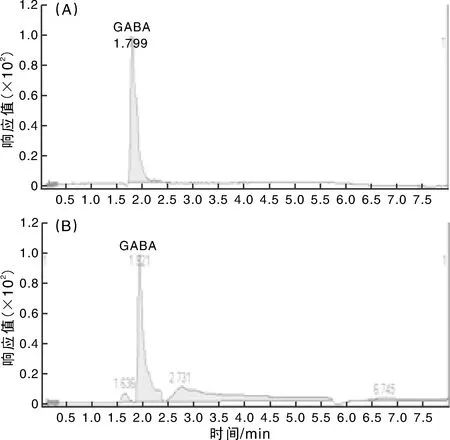
图2 GABA标准品(A)和样品(B)图谱Fig.2 The HPLC-MS maps of GABA standard (A) and the sample (B)
2.3菌株的初步鉴定
将产量最高的GA8菌株接种于营养琼脂培养基,37℃需氧及厌氧培养48 h,细菌菌落为乳白色、针尖大小、圆形凸起、边缘整齐、湿润,厌氧或兼性厌氧。革兰氏染色为阳性,显微镜下观察为杆状,单个、成对或成链状。参考《伯杰细菌鉴定手册》,菌株GA8的生理生化特征见表2。
2.4菌株的16S rRNA序列分析
以提取的菌株基因组DNA为模板,采用细菌16S rDNA通用引物进行PCR扩增,扩增产物经琼脂凝胶电泳检测,得到一条长度约1.5 kb的条带,将其回收、测序,测得其序列长度为1 449 bp。
表2菌株GA8的生理生化特征
Table 2Physiological and biochemical property of GA8 strain
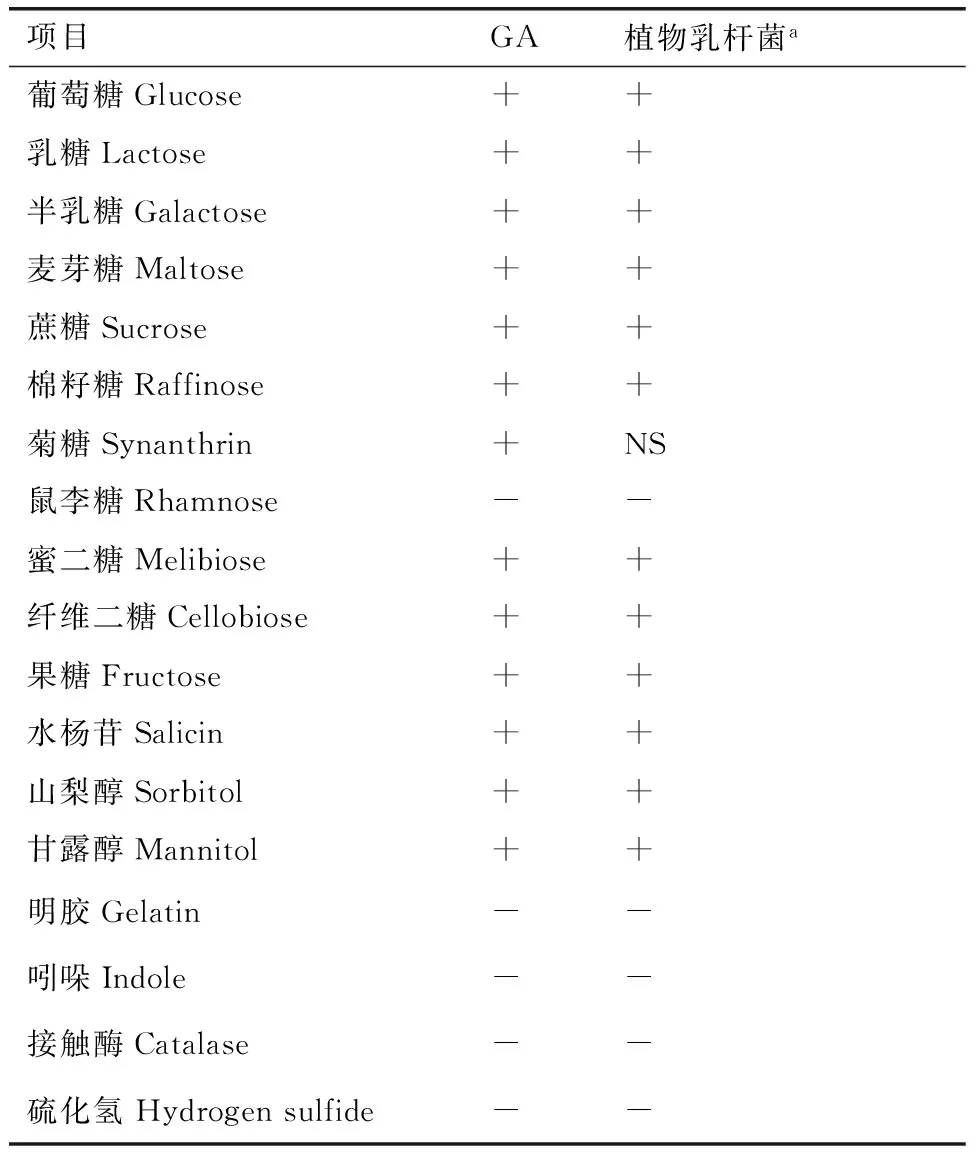
项目GA植物乳杆菌a葡萄糖Glucose++乳糖Lactose++半乳糖Galactose++麦芽糖Maltose++蔗糖Sucrose++棉籽糖Raffinose++菊糖Synanthrin+NS鼠李糖Rhamnose--蜜二糖Melibiose++纤维二糖Cellobiose++果糖Fructose++水杨苷Salicin++山梨醇Sorbitol++甘露醇Mannitol++明胶Gelatin--吲哚Indole--接触酶Catalase--硫化氢Hydrogensulfide--
注:a表示《伯杰细菌鉴定手册》上植物乳杆菌生理生化特征;“+”为阳性,“-”为阴性,NS为未检测。
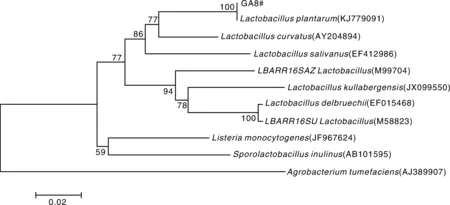
图3 菌株GA8的16S rDNA系统进化树Fig.3 Phylogenetic tree of GA8 strain based on the 16S rDNA sequence
将得到的序列与NCBI核酸数据库中的基因序列进行BLAST比对,结果显示,前100个序列相似性均为99%,其中确切命名为植物乳杆菌的就有77条序列,同源性达到99%。系统进化树(图3)显示,菌株GA8的16S rRNA与已知的植物乳杆菌(Accession No.KJ779091)在一个分支上,相似性达100%。结合菌株GA8的菌落特征、细菌形态特征、生理生化特性与16S rRNA序列分析结果,确定菌株GA8为植物乳杆菌(Lactobacillus plantarum)。
2.5菌株GA8对3株病原菌的生物拮抗作用
菌株GA8对3株病原菌的生物拮抗作用结果见表3。由表3可知,菌株GA8全菌液、上清液对鸡白痢沙门氏菌、鸡源大肠杆菌和金黄色葡萄球菌有一定的抑制作用,而菌体悬液对3株病原菌无抑制作用,表明菌株GA8对3株病原菌起抑制作用的不是细菌菌体而主要是上清液。
表3对致病菌的抑菌活性结果(Φ/mm)
Table 3The antibacterial activity against pathogenic bacteria (Φ/mm)
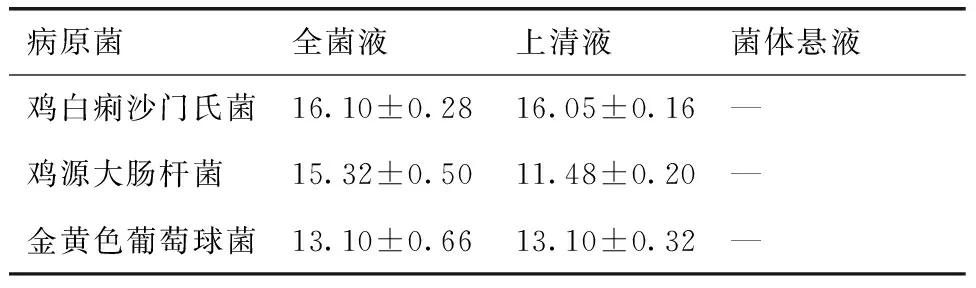
病原菌全菌液上清液菌体悬液鸡白痢沙门氏菌16.10±0.2816.05±0.16—鸡源大肠杆菌15.32±0.5011.48±0.20—金黄色葡萄球菌13.10±0.6613.10±0.32—
2.6耐酸试验结果
胃液pH为3左右,且食物通过胃的时间一般为1~2 h,因此乳酸菌作为益生菌应该具有较好的耐酸性。从表4可以看出,菌株GA8初始活菌数为1.1×108cfu·mL-1,pH 2.0的环境中4 h后活菌数仍然在106cfu·mL-1以上,表明菌株GA8具有一定的耐酸性。
表4菌株GA8对酸的耐受性(lg cfu·mL-1)
Table 4The pH tolerance of strain GA8 (lg cfu·mL-1)

pH菌落数0h2h4h28.04±0.067.06±0.046.08±0.0738.04±0.068.10±0.128.61±0.0348.04±0.068.38±0.048.66±0.04
2.7菌株GA8耐猪胆盐试验
菌株通过胃液后会在小肠中遇到胆盐,故菌株要有足够的耐胆盐能力才能在肠道内发挥作用。由表5可知,菌株GA8初始活菌数为1.1×108cfu·mL-1,0.1%胆盐处理4 h活菌数能达到6.0×107cfu·mL-1以上,0.3%胆盐处理4 h活菌数只能达到103cfu·mL-1左右,而0.4%胆盐处理2 h后活菌数为0 cfu·mL-1,表明菌株GA8对胆盐的耐受性不强。
表5菌株GA8对猪胆盐的耐受性 (lg cfu·mL-1)
Table 5The bile salt-tolerance of Strain GA8 (lg cfu·mL-1)
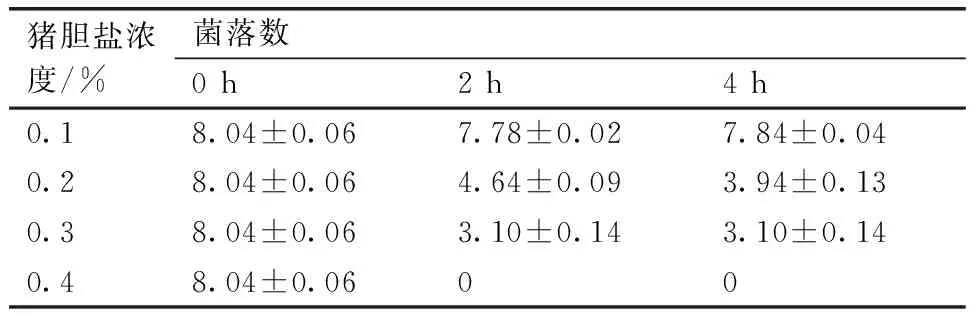
猪胆盐浓度/%菌落数0h2h4h0.18.04±0.067.78±0.027.84±0.040.28.04±0.064.64±0.093.94±0.130.38.04±0.063.10±0.143.10±0.140.48.04±0.0600
3 讨论
3.1产GABA菌株的筛选
曾小群等[14]采用纸层析法从新疆酸马奶中分离出产γ-氨基丁酸戊糖乳杆菌S5,在含1% L-谷氨酸钠的MRS发酵培养基中培养,产γ-氨基丁酸量为1.61 g·L-1。Binh等[15]从朝鲜泡菜中分离出的短乳杆菌K203,发酵72 h后,可将60 g·L-1的L-谷氨酸转化成γ-氨基丁酸,含量可高达44.4 g·L-1。谢芳等[16]从新鲜水牛乳中筛选出3株高产γ-氨基丁酸菌株G-24,G-25和G-29,鉴定为乳酸乳球菌乳酸亚种,在含有1%谷氨酸的MRS液体培养基中,产γ-氨基丁酸含量可达0.6 g·L-1。本试验采用纸层析定性、HPLC-MS定量、生理生化检验和16S rDNA序列同源性分析筛选出一株产GABA菌株,命名为GA8,GABA产量为3.50 g·L-1,经鉴定为植物乳杆菌。菌株GA8产GABA量较高,为其他高产GABA益生菌的筛选和研究奠定了一定的基础。各分离菌株产GABA量的不同,可能是样品来源、菌株种类、发酵条件及L-谷氨酸钠添加量的不同,造成GABA产量的不同。
3.2对病原菌的抑制效果
本试验运用牛津杯法进行抑菌试验,发现菌株GA8的全菌液和上清液有抑菌能力,而菌体悬液无抑菌效果,由此可以看出,菌株GA8具有一定的抑菌性。陈光明等[17]对内蒙古地区不同来源的乳酸菌进行抑菌试验时发现,菌株代谢产物有较强抑菌活性而菌体本身并无抑菌活性,且对大肠杆菌、金黄色葡萄球菌抑菌作用最强,对沙门氏菌抑菌作用较弱。李清等[18]从豆酱中分离的植物乳杆菌DJ-04对大肠杆菌、沙门氏菌和金黄色葡萄球菌都有不同程度的抑制作用。熊涛等[19]从猪粪中筛选出的罗伊氏乳杆菌发酵全菌液有较强的抑制作用,这与本研究不尽相同。本研究中菌株GA8全菌液和上清液对致病菌有较好的抑制作用,菌体本身则对致病菌无抑制作用,可能是上清液中的乳酸、某种酶或细菌素起到了抑菌作用,也可能上清液中还含有其他的抑菌物质,具体是哪种物质还需进一步研究。
3.3耐酸耐胆盐效果
靳志强等[20]从饮料中筛选出的植物乳杆菌在pH 3环境中培养4 h后活菌数在106cfu·mL-1左右,可以在0.5%胆盐中生长,有较好的耐胆盐能力。Kabore等[21]从猴面包树种子发酵产物中分离出的乳酸菌分别在pH 2.5和0.3%胆盐中培养4 h后均有存活。本研究中菌液在pH 2时,培养4 h仍有存活,活菌数能达到106cfu·mL-1以上;在0.1%猪胆盐中培养4 h后,活菌数能达到107cfu·mL-1以上,0.3%猪胆盐中培养4 h后活菌数只能达到103cfu·mL-1左右,而在0.4%猪胆盐中培养2 h后菌株不生长。表明本研究筛选出的产GABA植物乳杆菌有一定的耐酸能力,但耐胆盐能力不强,可能是菌种性能不同所造成的。若作为微生态制剂应用于实际生产中,可使用包被等手段进行处理,以提高其在胃肠道中的存活率,充分发挥其作用。
[1]ROBERRTS E,FRANKEL S.γ-Aminobutyric acid in brain:Its formation from glutamic acid [J].Journal of Biological Chemistry,1950,187(1):55-63.
[2]ALI B H,AL-SALAM S,ZA’ABI M A,et al.Renoprotective effects of gamma-Aminobutyric acid on cisplatin-induced acute renal injury in rats [J].Basic &Clinical Pharmacology &Toxicology,2014,116(1):62-68.
[3]贤乾隆.产γ-氨基丁酸乳酸菌的筛选及其功能性发酵酸奶的研制[D].柳州:广西科技大学,2013.
[4]蒋冬花,李杰,后家衡,等.水果表面高产γ-氨基丁酸酵母菌菌株的筛选、鉴定和发酵条件优化[J].浙江农业学报,2008,20(6):396-401.
[5]张圆林,王昌禄,陈勉华,等.高产γ-氨基丁酸的红曲霉菌株筛选及发酵条件优化[J].食品科学技术学报,2014,32(5):35-40.
[6]RATANABUREE A,KANTACHOTE D,CHARERNJIRATRAKUL W,et al.Enhancement of γ-aminobutyric acid in a fermented red seaweed beverage by starter culture Lactobacillus plantarum DW12 [J].Electronic Journal of Biotechnology,2011,14(3):1.
[7]RATANABUREE A,KANTACHOTE D,CHARERNJIRATRAKUL W,et al.Enhancement of γ-aminobutyric acid (GABA) in Nham (Thai fermented pork sausage) using starter cultures of Lactobacillus namurensis NH2 and Pediococcus pentosaceus HN8[J].International Journal of Food Microbiology,2013,167(2):170-176.
[8]DIANA M,TRES A,QUILEZ J,et al.Spanish cheese screening and selection of lactic acid bacteria with high gamma-aminobutyric acid production [J].LWT-Food Science and Technology,2014,56(2):351-355.
[9]穆琳.产γ-氨基丁酸乳酸菌的研究与应用[D].杭州:浙江大学,2008.
[10]布坎南,吉本斯.伯杰.细菌鉴定手册[M].北京:科学出版社,1984.
[11]ABE Y,UMEMURA S,SUGIMOTO K I,et al.Effect of green tea rich in γ-aminobutyric acid on blood pressure of Dahl salt-sensitive rats[J].American Journal of Hypertension,1995,8(1):74-79.
[12]黄锐之.细菌DNA的一种大量提取方法[J].微生物学通报,1991(1):47-50.
[13]刘冬梅,李理,杨晓泉,等.用牛津杯法测定益生菌的抑菌活力[J].食品研究与开发,2006,27(3):110-111.
[14]曾小群,盛姣铃,潘道东,等.新疆酸马奶中产γ-氨基丁酸乳酸菌的筛选与鉴定[J].中国食品学报,2013,13(10):191-196.
[15]BINH T T T,WAN-TAEK J,WOO-JIN J,et al.Optimization of γ-amino butyric acid production in a newly isolated Lactobacillus brevis[J].Biotechnology Letters,2014,36(1):93-98.
[16]谢芳,曾庆坤,杨承剑,等.水牛乳中高产γ-氨基丁酸乳酸菌的筛选与鉴定[J].中国酿造,2015,34(4):102-105.
[17]陈光明,于晨龙,杨晓宇,等.内蒙古地区不同来源乳酸菌对病原菌的体外抑菌试验研究[J].黑龙江畜牧兽医,2014,15(8):5-9.
[18]李清,王英,刘小莉,等.一株广谱抑菌活性乳酸菌的筛选及特性研究[J].微生物学通报,2015,42(2):332-339.
[19]熊涛,邓耀军,廖良坤,等.罗伊氏乳杆菌NCU801的鉴定及抑菌性能研究[J].食品与发酵工业,2015,41(2):24-29.
[20]靳志强,王延祥,李平兰,等.植物乳杆菌耐酸耐胆盐的体外试验及其降胆固醇作用[J].中国食品学报,2009,9(5):24-28.
[21]KABORE D,SAWADOGOLINGANI H,DICKO M H,et al.Acid resistance,bile tolerance and antimicrobial properties of dominant lactic acid bacteria isolated from traditional “maari” baobab seeds fermented condiment [J].African Journal of Biotechnology,2012,11(5):1197-1205.
(责任编辑侯春晓)
Screening of γ-aminobutyric acid-producing probiotics and characterization of its biological activity
XU Yu-qin1,DAI Xi-xi1,TANG Hui-qin1,GU Xiao-xiao1,PAN Kang-cheng1,2,*
(1.College of Veterinary Medicine,Sichuan Agricultural University,Chengdu 611130,China;2.Key Laboratory of Animal Disease and Human Health of Sichuan Province,Chengdu 611130,China)
The purpose of the present study was to screen a high γ-aminobutyric acid (GABA) -producing probiotics,which had the ability of biological antagonism and tolerance of acid and bile salt.The suspicious strains which producing GABA were analyzed qualitatively and quantitively by paper chromatography and high performance liquid chromatography and mass spectrometry (HPLC-MS).Combining the morphological,physiochemical properties with 16S rDNA sequencing analysis,a high GABA-producing bacterium was identified.Then the inhibition of this high GABA-producing strain against three pathogen bacteria from animal and the tolerance of acid and bile salt were performed.The results showed that the strain GA8 which isolated from pickle had high yield of GABA;it was cultured in GYP medium containing 1% L-glutamate at 37℃ for 48 h,the yield of GABA reached 3.50 g·L-1;it was identified as Lactobacillus plantarum.The bacteria liquid and supernatant of GA8 strain culture had some inhibitory effect on Salmonella pullorum,Escherichia coli and Staphylococcus aureus,and GA8 strain had no bacteriostasis ability.When the initial concentration of living bacteria was 108cfu·mL-1,the living bacteria could reach more than 106cfu·mL-1after cultured on medium with pH 2.0 for 4 h and 103cfu·mL-1after cultured on medium contained bile salt 0.3% for 4 h.The results indicated that the strain GA8 had some antibacterial properties and acid resistance,but bile salt resistant ability was not prominent.
probiotics;γ-aminobutyric acid;bioantagonism;acid and bile salt tolerance
浙江农业学报Acta Agriculturae Zhejiangensis,2016,28(3):502-508http://www.zjnyxb.cn
徐毓琴,戴茜茜,唐慧琴,等.产γ-氨基丁酸益生菌的筛选及其生物活性研究[J].浙江农业学报,2016,28(3):502-508.
10.3969/j.issn.1004-1524.2016.03.23
2015-08-03
“教育部长江学者和创新团队发展计划”创新团队(IRT0848);四川农业大学教学改革研究项目(X2011008)
徐毓琴(1990—),女,四川眉山人,在读硕士研究生,研究方向为动物微生态。E-mail:xuyuqinflavor@163.com
,潘康成,E-mail:pankangcheng71@126.com
S667.4
A
1004-1524(2016)03-0502-07
