固态锂空气电池研究进展
2016-10-29张晓平温兆银
张 涛,张晓平,温兆银
固态锂空气电池研究进展
张 涛,张晓平,温兆银
(中国科学院能量转换材料重点实验室,中国科学院上海硅酸盐研究所,上海 200050)
锂空气电池的理论能量密度高达3505 W·h/kg,能够实现的能量密度预计可达到600 W·h/kg,是实现续航里程达到500~800 km的电动汽车的重要动力电源体系。锂空气电池面临稳定性、效率、实用性和安全性等挑战,特别是需要具备在空气环境下工作的能力。发展固态锂空气电池能够从根本上解决实用性问题,有效解决安全性问题,同时也是提高锂空气电池稳定性的重要途径。本文对固态锂空气电池在电池结构、电极/电解液界面调控、电池成型方法以及电池性能与机理等方面的研究进展进行总结,在每一部分都围绕其对于解决锂空气电池目前所面临的SEAS主要问题的贡献和仍然存在的问题进行评述,并试图提出下一阶段的研究思路,明确固态锂空气电池的发展前景。
固态锂空气电池;固体电解质;复合空气正极;锂金属基负极;界面调控
锂空气电池是利用锂金属和空气中的氧气实现化学能-电能直接转换的清洁储能体系。根据锂金属质量计算的二次锂空气电池的理论能量密度高达11400W·h/kg,接近于汽油的能量密度(13000W·h/kg),这是将其应用于电动汽车动力电源的研究源动力。如果计入来自于空气的反应物氧气的质量,其理论能量密度为3505W·h/kg(Li2O2),能够实现的能量密度预计可达到600W·h/kg左右的水平,应用于电动汽车可使得一次充电续航里程达到500~800 km。从2008年开始,日本新能源与产业技术发展机构(NEDO)和美国IBM公司分别制定了开发二次锂空气电池以期实现电动汽车续航里程700公里和500英里的目标。
到目前为止,根据4电子或2电子氧气还原正极反应,锂空气电池可分为两类。一类是水系锂空气电池,采用保护型锂金属复合负极和水系电解液,在空气环境下工作,电化学放电产物为LiOH或LiOAc等[1];另一类是非水系锂空气电池,直接使用锂金属负极和非水系电解液,电化学放电产物为Li2O2[2]。由于锂空气电池的开放性特点,空气中的水分、二氧化碳、氮气甚至其它大气污染成分都会溶解在电解液中和锂金属负极发生反应,所以目前国内外对于非水系锂空气电池的研究绝大多数在纯氧气或者干燥后的氮氧混合气体中进行。2014年12月,日本丰田公司发布了首款商业化氢氧燃料电池轿车,使用储存在70 MPa钢瓶(相当于700个大气压)中的氢气作为燃料,一次加氢续航里程可以达到500 km以上。相比于氢氧燃料电池体系,二次锂空气电池动力电池的特点在于用金属锂代替了高压氢气,不携带高压钢瓶并且可以进行充电。但是,如果锂空气电池只能在纯氧气环境下运行,势必要携带笨重高压的氧气钢瓶,这样就失去了锂空气电池的高比能特点。图1展示了氢氧和锂氧电池的运行环境,可以看出,锂空气动力电池必须具备直接在空气环境下运行的能力,这是实现其应用于新能源汽车动力电源的必然要求。
包括在空气环境下工作这一前提在内,目前,实现二次锂空气电池的长程续航目标所面临的主要问题可以归纳为SEAS,即稳定性(stability)、效率(efficiency)、实用性(applicability)和安全性(safety)。稳定性主要包括碳基正极和非质子型电解液在超氧离子环境中的稳定性[3-4];效率主要包括提高电池的能量利用效率和输出功率[5-6];实用性主要是如何实现二次锂氧气电池直接在空气中运行,即最终从二次锂氧气电池发展到二次锂空气电池[7-8];安全性主要是反复充放电过程中会产生锂枝晶,刺穿隔膜后在使用有机电解液的电池体系中引发燃烧和爆炸[9-10]。
发展固态锂空气电池能够从根本上解决实用性问题,有效解决安全性问题,同时也是提高锂空气电池稳定性的重要途径。具体来说,在固态锂空气电池中,致密的固态电解质将空气正极侧和锂金属负极侧分离,能够完全防止大气成分和锂金属的直接反应,使固态锂空气电池具备直接在空气环境下运行的能力;从安全性观点来说,固态电解质具备更高的机械强度来阻止锂枝晶的穿透;从稳定性观点来说,以氧化物体系为主的固态电解质有望表现出对超氧离子的优良的化学和电化学稳定性,同时也能够有效解决开放型空气电池的漏液和电解液挥发问题。但是,由于固态电解质本身的锂离子电导率通常比液态的水系和非水系电解液低,在电池组装过程中和锂金属以及空气正极之间的界面阻抗较大,造成固态锂空气电池的能量利用效率和输出功率目前低于液态的水系和非水系电解液体系。
在本文中,我们将对固态锂空气电池在电池结构、电极/电解液界面调控、电池成型方法以及电池性能与机理等方面的研究进展进行总结,在每一部分都围绕其对于解决锂空气电池目前所面临的SEAS主要问题的贡献和仍然存在的问题进行评述,并试图提出下一阶段的研究思路,明确固态锂空气电池的发展前景。
1 固态锂空气电池概述
固态锂空气电池可分为半固态(quasi-solid-state)和全固态(all-solid-state)两种。SAMMELLS等[11]在1987年报道了第一种半固态锂空气电池,电池结构如图2所示。该电池使用固态氧化锆氧离子(O2-)导体作为电解质,负极是浸润在LiF、LiCl和Li2O三元熔盐中的LiFeSi2合金。在600~850 ℃的工作温度下,氧离子穿过氧化锆固态电解质,在熔盐中和锂离子结合生成Li2O放电产物。因此该电池的放电容量由Li2O在熔盐中的浓度决定,理论能量密度高达4266 W·h/kg。尽管该电池的充放电是基于氧离子而非目前一般的锂离子传输模式,工作温度太高,但是它的一些特点值得注意。在650 ℃高温下,三元熔盐的离子电导率高达5 Ω-1/cm,电池的放电电流密度甚至能够达到200 mA/cm2。相比之下,目前报道的固态锂空气电池,其放电电流密度基本上不超过2 mA/cm2。这为提高固态锂空气电池的输出功率提供了几点启示:①选择合适的工作温度以提高电池体系的离子电导率;②在空气正极,如果发生的是4电子的氧气还原反应,其反应动力学足够提供100 mA/cm2以上的电流密度;③合适的电极结构设计非常重要,例如负极侧的熔盐体系能够为Li2O放电产物提供足够的容纳空间,有利于充放电可逆反应的快速进行。
由于基于氧离子传导的半固态锂空气电池工作温度太高,目前对于固态锂空气电池的研究集中在使用锂离子导电固态电解质,在60~150 ℃中温环境下工作。KUMAR等[12]在2010年报道了第一种基于锂离子传输的半固态锂空气电池,结构如图3所示。该电池使用NASICON结构的18.5Li2O∶6.07Al2O3∶37.05GeO2∶37.05P2O5(LAGP)固态电解质、锂金属负极和多孔碳正极。正负极和固态电解质之间分别采用高分子聚合物聚环氧乙烷(PEO)、锂盐和Li2O、BN粉体的混合物作为缓冲层,目的是提高锂离子导电率,降低电极/固态电解质之间的界面阻抗。由于PEO在温度60℃左右发生固态晶体相到液态无定形相的转化后才能够提供10-4S/cm以上的锂离子电导率,因此该电池被归属于半固态锂空气电池,充放电基于Li2O2在多孔碳正极的生成和分解,在85℃下充放电电流密度为0.1 mA/cm2。这种半固态锂空气电池由于聚合物缓冲层的存在,结构比较复杂。KITAURA等[13]在2012年报道了不使用缓冲层的全固态锂空气电池,其中锂金属负极和LAGP固态电解质以及碳正极直接热压在一起,如图3所示。由于不含有聚合物缓冲层,这种电池在室温下工作,开路电压约3.1 V,放电平台约2.6 V,充放电电流密度可达到0.5 mA/cm2,其充放电反应也是基于Li2O2在多孔碳正极的生成和分解。
综上所述,固态锂空气电池的发展经历了工作温度由高温到中温和室温,电池结构从复杂到简单,电池反应从基于氧离子传输在负极生成放电产物到基于锂离子传输在正极生产放电产物的过程。尽管如此,由于倍率性能上的巨大差距,目前基于锂离子传输的固态锂空气电池有待在电池结构、界面调控、充放电机理等方面取得更进一步的突破。
2 电池结构
固态锂空气电池的组成包括5个部分:正极、负极、电解质、集流体和外壳。其中的关键部件是正极、负极和电解质,固态化电解质起到离子传导和隔膜的双重作用[14]。放电时,金属锂负极被氧化为Li+,同时释放出电子,Li+经过电池内路含有Li+的电解液到达多孔空气电极,而电子则通过外电路传递给空气正极。到达正极的Li+和电子结合外界的O2反应形成Li2O2,进而在正极上进行沉积,此过程被称为氧还原反应(ORR);充电时,Li2O2在外加电压的情况下发生反应,生成Li+并释放出O2,使电池实现可逆循环,此过程被称为氧析出反应(OER)[15]。在空气环境下,由于水分、二氧化碳和其它大气污染成分,反应过程比以上基础电化学过程复杂很多。
2.1 固体电解质
固体电解质是锂空气电池的基础,要求具有优良的机械强度和致密度、较高的锂离子电导率、较宽的电化学窗口、并且对锂金属具有化学稳定性。目前在固态锂空气电池中应用的固体电解质包括无机固体电解质、高分子聚合物和复合电解质。无机固体电解质主要是NASICON结构的Li1.35Al0.25T1.75P2.7Si0.3O12(LATP)[7-8,16-17]和LAGP[12-13,18-21]。高分子聚合物主要是PEO[22-24],也包括聚偏氟乙烯和六氟丙烯共聚物[P(VDF-HFP)][25]、聚乙二醇二甲醚(PEGDME)[26]、聚甲基丙烯酸甲酯掺杂聚苯乙烯[P(MMA-St)][27]。提高稳定性是固态电解质研究的重点,包括对锂金属的化学稳定性和在充放电过程中对超氧离子的电化学稳定性。尽管LATP具有离子电导率、机械强度和已商业化等综合性优势,并在固态锂空气电池中获得广泛使用,但是和锂金属直接接触时Ti4+被还原,导致界面阻抗显著增加[28]。LAGP通常被认为是比LATP更为稳定的电解质,但是近期的研究结果表明也存在和锂金属的还原反应。目前来看,Garnet结构的LiLa3M2O12[M=Zr(LLZ)、Nb、Ta、Sb、Bi,=5 或7]对锂金属的电化学稳定性较高,是很有希望的一种固态电解质[29]。PEO在电压大于开路电压(OCV,约3 V Li)的氧化环境下,其氧化程度随电压的升高而显著提升,可能与PEO中自由基形成的速率增加有关[30]。
电解质的复合化是一个重要的方向,能够显著提高固态电解质的力学性能、锂离子电导率、对锂金属的化学稳定性和充放电电位窗口等。目前的研究包括无机固体电解质和高分子聚合物的复合,高分子聚合物和氧化物纳米粉体(如SiO2)以及液态电解质(如吡咯基离子液体PYR14TFSI)的复合 等[25-27,31]。最近,KUMAR等[31]报道了一种三层结构的陶瓷层-聚合物层-陶瓷层固体电解质隔膜,通过电子线蒸发沉积技术将LAGP包覆在聚乙烯(PE)膜的两面,形成LAGP-PE-LAGP结构,如图4所示。这种复合电解质隔膜和锂金属接触后界面阻抗较低,室温下在1.3 mA/cm2的电流密度下对锂金属进行充放电循环,极化较低。但是这种隔膜在使用前需要在含有锂盐的电解液中浸润,因此不能说是真正的固态电解质。其表现出的对锂金属的稳定性可能与浸润的电解液有关。
(b)(c)
图4 电解质复合化形成LAGP-PE-LAGP三层结构以及其充放电曲线:(a)聚乙烯膜扫描电镜图;(b)包覆LAGP后的聚乙烯膜扫描电镜图;(c)Li-复合电解质-Li对称电池的充放电曲线,电流密度1.3 mA/cm2[31]
Fig.4 SEM images of (a) PE and (b) LAGP-coated (130 nm) PE separators; (c) 300th cycle cell polarization of Li/Li symmetrical cells during Li plating-stripping at current density=1.3 mA/cm2, using PE and LAGP-coated flexible separator/electrolyte[31]
2.2 复合空气正极
对于使用液态电解液的锂空气电池来说,由于液体能够浸润到空气正极中传输锂离子,空气正极只需要多孔载体和催化剂。固态锂空气电池的空气正极在制备过程中除了多孔正极载体和催化剂,还要加入上述固态电解质如LATP、LAGP或PEO等以提高锂离子电导率,形成电子-锂离子-氧气空间网络结构,因此是一种载体和电解质复合的空气电极。电极的制备根据处理温度不同主要有两种方法,一是将多孔载体、固态电解质和催化剂用黏结剂混合后擀膜,在较低温度(<300 ℃)下烘干后裁成电极片[19];另一种方法是将多孔载体、固体电解质和催化剂混合后压片,在高温(>600 ℃)和惰性气氛保护下烧结成型[13]。混合过程中正极载体和电解质粉体的接触如果不够充分,或者压片烧结时气孔闭塞,会造成空气电池的倍率和循环性能低下。最近,ZHU等[8]用气孔率75%的LATP多孔电解质代替粉体,将其浸渍在10%(质量分数)的蔗糖溶液中,取出后在纯氩气中650 ℃处理3 h,获得了以固态电解质为骨架的LATP-C复合空气正极,如图5所示。他们还用硅油[Si(CH3)2O]处理这种复合正极,阻止空气中水分和CO2的渗透,同时允许氧气分子扩散,获得了较高的放电倍率和循环性能。需要注意的是硅油并不能完全阻止水分子的渗透,硅油覆盖在碳和LATP表面,也会降低三相反应的活性位,但是这种固态电解质骨架式结构为设计复合空气正极提供了新思路。
多孔碳是固态锂空气电池通常采用的载体材料,包括导电炭黑、碳纳米管、石墨烯等[8,16,27]。碳材料具有成本低、导电性好和强的吸附性等特点,其良好的氧还原性和可控合成的结构也为复合空气正极的设计提供了多样性[32-34]。但是,碳材料在高电位下的不稳定性以及自身和放电产物Li2O2的反应等依然是制约碳作为空气电极的重要因素[35]。MCCLOSKEY等[3]研究发现在电池反应过程中,Li2O2和碳界面会生成Li2CO3阻止Li2O2和碳的进一步反应,尽管生成的碳酸盐是有限的,但是这有限的碳酸盐也会阻碍电池进一步的催化放电反应,最终导致电池性能的下降。因此,在固态锂空气电池中,用非碳材料代替碳材料是进一步提高电化学性能的重要方法。
目前,在固态锂空气电池的研究中尚未见到采用非碳材料的报道。但是非碳材料的研究已经成为非水系锂空气电池的一个重要方向,目前国内外报道的其它具有代表性的非碳载体有:纳米多孔金[2]、导电玻璃(ITO)[35]和纳米多孔钌非碳载体[36]、TiC纳米颗粒[37]、TiSi2纳米网[38]、Co3O4纳米线[39]、RuO2纳米片和中空球[40-41]等。这些非碳载体在超氧离子环境中反应活性低、稳定性高,从而使得采用这些非碳载体的非水系锂空气电池能够或者更接近于在电压截止模式下稳定循环,同时具备较高的能量利用效率。此外,催化剂在固态锂空气电池的研究中也只是处于起步状态,KITAURA等[18]和LIU等[20]采用碳纳米管同时作为载体和催化剂,KICHAMBARE等[21]报道了介孔氮掺杂的活性炭材料作为载体和催化剂,但是目前尚未见到针对复合空气正极氧气还原/析出反应的高活性催化剂材料的报道。
2.3 锂金属负极
固态锂空气电池使用金属锂作为负极活性物质。由于锂空气电池的开放性特点,对于使用液态电解液的锂空气电池,金属锂的保护是首要考虑的问题。而对于固态锂空气电池,固态电解质能够有效的保护锂金属,因此其首要问题是提高锂金属和固态电解质接触时的化学和电化学稳定性;其次是在反复充放电过程中锂枝晶的生长顶破固态电解质,由此可能产生的安全问题;最后,电池在深度放电时,消耗的锂金属使得锂金属和固态电解质之间产生空隙,由此带来的界面分离和电池形变问题在固态锂空气电池体系中也表现的特别突出。锂金属合金化可能是解决以上问题较为有效的途径。HASSOUN等[42]用嵌锂的硅-碳复合物形成的Li-Si合金代替锂金属来提高锂空气电池的安全性,电池能够进行正常的充放电,基于正负极质量计算的LiSi-O2电池的理论能量密度为980 W·h/kg。HE等[43]在最近的一篇综述中也建议用锂金属合金来解决界面分离问题,用Li-Al或者Li-Si合金代替纯锂金属,在电池持续放电过程中,尽管锂金属被不断消耗,但是留下来的Al或者Si可以作为框架,一方面保持和固态电解质如LAGP和LLZ等的界面接触,另一方面支撑电极结构降低形变程度。尽管这一结构被建议用于水系或组合型锂空气电池,但是在固态锂空气电池的锂金属负极设计中同样适用。
在框架式锂金属负极的设计方面,CUI课题 组[44-46]最近发表了一系列成果。例如,将熔融金属锂注入三维的C/Si框架,从而实现性能远高于纯金属锂的负极材料,如图6所示。采用中空碳球包裹种子层生长金属锂,从而抑制在反复充放电过程中锂枝晶的生长,大幅度提升了循环稳定性,300次循环后库仑效率保持在98%。利用具有纳米孔道的亲锂层状石墨烯片作为金属锂的框架材料,制备了由7%(质量分数)石墨烯和93%金属锂组装的石墨烯-锂金属复合负极,在循环过程中,负极的尺度改变仅为约20%。这些设计对于固态锂空气电池很有借鉴意义,用于固态锂空气电池将可能解决稳定性、安全性和形变等一系列问题。
(c)
图6 框架式锂金属负极设计的示意图和光学图像:(a)框架式锂金属设计示意图;(b)在框架表面气相沉积硅膜改变表面对锂金属的润湿性;(c)亲锂和憎锂表面的对比图[44]
Fig.6 Schematic and optical images of Li encapsulation by melt infusion
3 界面调控与电池成型
界面调控对于固态锂空气电池整体性能的影响非常关键。尽管固体电解质如LATP、LLZ的室温离子电导率能够做到高达1×10–3S/cm[47-48],但是整电池的放电倍率和循环性能仍然较差,其中最关键的因素就是锂金属/固体电解质和空气正极/固体电解质的界面。固态锂空气电池不但面临着固态电池常见的界面问题,如固-固界面阻抗较大、与电极的化学和电化学稳定性差、界面应力大等,也存在着独有的挑战和机遇,如在氧气还原/析出过程中,超氧离子、超氧化锂等中间产物参与界面化学演变过程,形成复杂中间相,通过对这种中间相的调控,可能对电池性能产生正面效果。固态锂空气电池的界面调控和电池成型通常是密不可分的整体,界面调控的方法决定了采用何种电池成型技术。
3.1 界面调控
固态锂空气电池中的界面调控分别在空气正极侧和锂金属侧进行。ZHANG等[7]报道了一种界面柔性化的方法来调控固态电解质/空气正极界面,即用凝胶态空气正极代替固态空气正极,构建了新型的固态/凝胶态界面。这种凝胶态空气正极由咪唑基离子液体(EMITFSI)和单壁碳纳米管组成。由于咪唑基离子液体的阳离子EMI和碳纳米管的电子云之间存在cation-非共价键作用,EMI阳离子能够锚定在碳纳米管表面,将通常聚集缠绕成束的单壁碳纳米管解开,形成均匀分散甚至单根状态,并在此过程中形成三维交联的空间网状凝胶态。在这种凝胶态空气正极中,电子通过碳纳米管传递,锂离子通过离子液体传输,氧气分子通过空间网状结构直接扩散到反应位进行还原反应[49]。这种凝胶态空气正极可以直接涂布在固态电解质LATP的表面,组装成复合型锂空气电池器件,如图7所示。在充放电过程中,这种界面具有以下特点:①凝胶态空气正极和固态电解质形成接触良好,具有持久黏着力的界面,能够显著降低界面阻抗;②凝胶态空气正极对放电产物具有优异的容纳空间,有效地降低了界面应力,即使在放电容量高达53900 mA·h/g时,仍然保持95%的充电库仑效率。此外,还可以通过用合适的溶剂对离子液体进行部分萃取,从而调节凝胶态空气正极的离子液体和气孔的比例,进一步调控固态/凝胶态界面[50]。
在锂金属负极侧的界面调控主要通过在锂金属和固态电解质之间引入高分子聚合物缓冲层进行,由于高分子聚合物通常在高于晶态-无定形态转化点以上的温度下工作,因此也可以归入柔性化的范畴。在覆盖聚合物之前,可以对锂金属进行预处理控制表面钝化膜的生长。研究表明,在电解质体系加入CO2[51]、HF[52]或LiNO3[53]会促进锂表面钝化层的形成,同时会抑制枝晶的产生。对于作为缓冲层的聚合物,也可以通过表面修饰、本体改性、多相复合等方法降低界面阻抗,进一步抑制锂枝晶的生长。TEETER的课题组[54-55]在PEO基聚合物电解质表面吸附上各种形式的自组装单分子层(SAM),发现SAM中类似PEO链的一端吸附在聚合物电解质表面上,具有聚乙烯结构或其它结构的一端像尾巴一样整齐排列在外面,这样可以有效调节锂金属和PEO的界面性质,改善电池性能。IMANISHI的课题组[56-58]在PEO基聚合物电解质中引入BaTiO3、SiO2等纳米陶瓷粉体和离子液体等添加剂,通过这种多相复合的方法调节锂金属表面空间电荷的分布,并且设计了可视化对称电池,直接观察到多相复合对锂枝晶生长的抑制效果,这是调控固态锂空气电池负极界面的重要方法。
3.2 电池成型
固态锂空气电池的电池成型技术以固态电解质为核心,根据锂金属负极和空气正极与固态电解质之间是否存在缓冲层,可分为两类。目前采用缓冲层的电池成型技术报道较多,成型方法较为多样化。ZHANG等[28]在2008年首次将PEO作为锂金属负极的缓冲层,构建了Li/PEO/LATP三层结构锂金属复合负极用于锂空气电池。水分和氧气渗透率极低的铝塑复合膜被用于三层结构的封装,在封装过程中同时进行真空热封,封装后的复合负极在90~120 ℃进行热处理并自然冷却,使PEO缓冲层和锂金属及LATP电解质紧密结合,形成良好的界面。ZHU等[16]以铜片作为集流体,将锂金属夹在铜片和LATP电解质之间,锂金属和LATP电解质之间用浸透了商业碳酸乙烯酯电解液的玻璃纤维纸隔开,最后用丙烯酸酯AB胶封装,形成锂金属复合负极。
在空气正极一侧,也可以采用PEO聚合物作为缓冲层粘结多孔碳正极和固体电解质[12],但是由于PEO聚合物中的酰胺类锂盐如LiTFSI和LiFSI等在空气中潮解,目前在固态锂空气电池的研究中已经基本上不采用这种结构,而是将多孔空气正极直接和固态电解质进行结合。ZHOU课题组[13]采用固相法合成LAGP粉末,压片烧结后得到厚度1 mm、离子导电率2×10–4S/cm的LAGP固态电解质片。采用碳纳米管作为导电载体和催化剂,和LAGP粉末混合后分散在乙醇溶剂中,LAGP粉末和碳纳米管的质量比为100∶5。将乙醇分散液滴在LAGP电解质片上,在室温下干燥,然后在氩气保护下700 ℃煅烧10 min得到固态电解质和碳正极一体化的正极片,其中碳正极的厚度约为15 μm。在负极侧也不使用缓冲层,而是将锂负极直接热压在一体化正极片的另一侧,电池整体用铝塑膜封装。这种Li/LAGP/LAGP-C全固态锂空气电池是目前报道的最为简单的电池结构,如图8所示。
(b)
图8 (a)Li/LAGP/LAGP-C全固态锂空气电池示意图和(b)LAGP-C复合空气正极与LAGP固态电解质接触界面的扫描电镜图[13]
Fig.8 (a) Schematic diagram of an all-solid-state lithium-air battery using lithium anode, an inorganic solid electrolyte, and an air electrode composed of carbon nanotubes and solid electrolyte particles; (b) Cross-sectional FE-SEM images of the air electrode on the solid electrolyte layer[13]
4 电池性能与机理
尽管结构较为复杂,但是目前半固态锂空气电池的放电容量、循环次数、能量利用效率、电流密度等电池性能大多优于全固态锂空气电池。表1总结了近期报道的一些固态锂空气电池的电化学性能。在放电容量和循环性能方面,ZHANG等[7]报道的具有凝胶态/固态界面的半固态锂空气电池,在室温空气环境下限定放电容量为2000 mA·h/g(基于正极碳载体质量),循环100次后充放电库仑效率约82.5%,运行时间达到1880 h(约78天),如图9(a)所示。在电流密度方面,ZHU等[8]报道的具有以固态电解质为骨架的LATP-C复合空气正极的 半固态锂空气电池,在室温空气环境下能够在高达2 mA/cm2的电流密度下充放电,首次放电容量达到2849 mA·h/g,库仑效率约100%。当电流密度增大到3 mA/cm2时,尽管放电容量仍然有1577mA·h/g,但是已经不能在相同的电流密度下充电,如图9(b)所示。对于全固态锂空气电池,KITAURA等[13]报道的Li/LAGP/LAGP-C结构的电池器件在室温空气环境下能够在500 mA/g的电流密度下进行充放电,放电容量约500 mA·h/g,运行约10个循环,如图9(c)所示。但是,无论是半固态还是全固态锂空气电池,其能量利用效率只有55%~70%。ZHOU课题组[59]和GREY课题组[60]在近期分别报道了在纯氧气环境下能量利用效率高达90%以上的使用液态电解液的锂空气电池。因此,提高固态锂空气电池的能量利用效率是进一步提升电池电化学性能的研究重点。
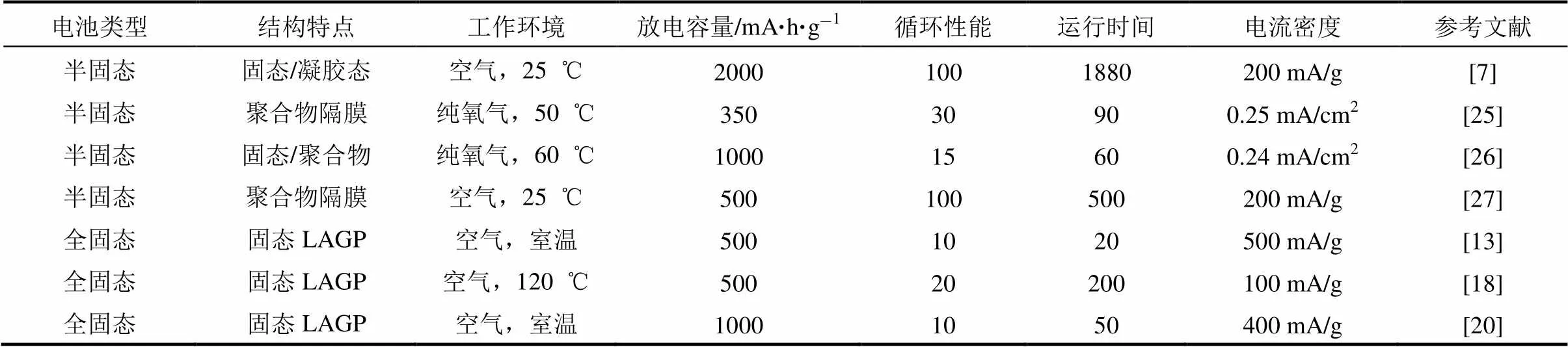
表1 近期报道的一些固态锂空气电池的结构及性能
(a)(b)(c)
图9 固态锂空气电池的电化学性能:(a)具有凝胶态/固态界面的半固态锂空气电池的充放电曲线,空气环境,25 ℃[7];(b)具有多孔状固态电解质LATP骨架-碳复合空气正极的半固态锂空气电池在不同电流密度下的充放电曲线,空气环境,25 ℃[8];(c)Li/LAGP/LAGP-C全固态锂空气电池的充放电曲线,空气环境,25 ℃[13]
Fig.9 Electrochemical performance of solid-state lithium-air batteries
阐明固态锂空气电池的氧气还原/析出机制、解析锂离子传输和电子转移过程动力学参数等是提高固态锂空气电池在空气环境下的电化学性能的基础。在空气环境下放电的电化学过程是:Li+O2=Li2O2,生成的Li2O2和空气中的水分发生化学反应生成LiOH,LiOH再和空气中的微量CO2发生化学反应生成Li2CO3。尽管CO2在空气中的含量只有0.03%,但是在长期放电过程中,电化学放电产物大部分转化为Li2CO3,最终的放电产物是大量Li2CO3、少量LiOH和微量Li2O2的混合物[7]。需要注意的是,放电产物Li2CO3不仅来自于Li2O2和空气中水分和二氧化碳的反应,在碳基空气正极中也部分来自碳载体和电解液的氧化分解[7,61]。在充电过程中,混合型放电产物发生电化学分解,由于分解所需要跨越的电化学势垒不同,LiOH和Li2O2首先发生分解(充电平台约3.5 V),Li2CO3随后在3.8 V以上电压平台分解,因此在充电过程中通常表现为两个平台,且平台的容量比例和放电深度有 关[7,61]。由此可见,设计针对Li2CO3分解的催化剂是降低空气环境下固态锂空气电池的充电过电位,提高其能量利用效率的关键。HONG等[62]发现多孔NiO纳米片能够有效地催化空气正极上Li2CO3产物的分解,其催化机理仍有待进一步的研究。
原位分析技术是实时揭示固态锂空气电池充放电机制的重要手段。ZHENG等[62]设计了用于环境扫描电子显微镜观察的微小规模的全固态锂空气电池,在纯氧环境下实时观察到电化学放电产物Li2O2的生长和分解过程,如图10所示。该研究团队发现,在放电过程中会形成不同形貌的放电产物,如球状和红血球状,同时在作为载体的碳纳米管表面也会包覆上一层放电产物;在充电过程中,放电产物的分解从其表面开始,并且沿着特定的方向,而不是先前认为的从放电产物和导电载体的接触点开始,这说明Li2O2本身的电子和离子导电性能够支持其生长和分解。碳纳米管表面包覆的产物层在充电过程中并非均匀分解,而是局部优先分解形成串珠状,推测该产物层在高分解电位下形成Li2O或转化为Li2CO3,降低碳纳米管导电性,导致循环性能劣化。这些发现为设计高效催化剂提供了新的思路。
(a) (b)
图10 使用微小规模的全固态锂空气电池,用环境扫描电子显微镜原位实时观察放电和充电过程中Li2O2的生成和分解过程:(a)经过0~3000 s的放电,Li2O2在碳纳米管-固态电解质-氧气三相界面生长到1.5 μm;(b)经过0~3200 s的放电,Li2O2逐渐分解[62]
Fig.10 Discharge and charge processes of the microscale all-solid-state Li-O2battery
5 结 语
综上所述,固态锂空气电池是解决锂空气电池这一开放型、高比能体系所面临的一系列挑战的最佳形态。固态电解质作为固态锂空气电池的核心材料,使得固态锂空气电池天然具备在空气环境下工作的能力,这是发展实用型锂空气电池的一个前提。固态锂空气电池的发展既面临着和固态锂金属电池、固态锂硫电池相似的问题,如锂金属和固态电解质的化学稳定性差、界面阻抗和界面应力大、电池成型技术要求高一致性差等,也面临着金属空气电池这一开放型体系独有的问题,如固态电解质和碳基正极载体在超氧离子和中间体的攻击下分解,氧气在固态电解质表面发生三相还原/析出反应的动力学参数低、催化剂在固相环境下的催化机理尚不明确等。
未来在提高稳定性方面,一方面可以通过复合化包括无机固体电解质和高分子聚合物的复合,高分子聚合物和氧化物纳米粉体以及液态电解质的复合等提高固态电解质的力学性能、锂离子导电率、对锂金属的化学稳定性和拓宽充放电电位窗口等,另一方面可以发展抗超氧离子、具有电子导电性并且质量轻、比表面积高的非碳正极载体材料来代替通常的碳基载体,应该能够显著提高电池结构的稳定性,进而提高电池的循环性能。在提高电池能量利用效率和输出功率方面,设计对Li2O2、LiOH和Li2CO3混合型放电产物的高效催化剂是重要手段,特别是针对具有较高分解电位的Li2CO3的催化材料,需要将几种单一功能的催化剂复合在正极结构中,或者开发多功能型催化剂;柔性化和框架式设计是构建合适的固态电解质/复合空气正极界面、提高电池输出功率的重要方法。在提高电池的安全性和实用性方面,框架式锂金属负极的设计可能解决锂枝晶生长和形变等一系列问题。总的来说,目前锂空气电池研究的技术准备水平(technology readiness level)在3~4之间,其中固态锂空气电池更是处于发展的起步阶段(TRL为1~2),在基础科学问题和关键技术中存在着许多挑战。但是发展高比能固态锂空气电池的需求是非常迫切的,高比能固态锂空气电池是新能源电动汽车动力电源的重要选项。
参 考 文 献
[1] ZHANG T,IMANISHI N,et al. A novel high energy density rechargeable lithium/air battery[J]. Chem. Commun.,2010,46:1661-1663.
[2] PENG Z Q,FREUNBERGER S A,CHEN Y H,et al. A reversible and higher-rate Li-O2battery[J]. Science,2012,337:563-566.
[3] MCCLOSKET B D,SPEDEL A,SCHEFFLER R,et al. Twin problems of interfacial carbonate formation in nonaqueous Li-O2batteries[J]. J. Phys. Chem. Lett.,2012,3:997-1001.
[4] FREUNBERGER S A,BRUCE P G,et al. Reactions in the rechargeable lithium-O2battery with alkyl carbonate electrolytes[J]. J. Am. Chem. Soc.,2011,133:8040-8047.
[5] CHEN Y H,FREUNBERGER S A,PENG Z Q,et al. Charging a Li-O2battery using a redox mediator[J]. Nat. Chem.,2013,5:489-494.
[6] MA Z,YUAN X X,LI L,et al. A review of cathode materials and structures for rechargeable lithium-air batteries[J]. Energy Environ. Sci.,2015,8:2144-2198.
[7] ZHANG T,ZHOU H. A reversible long-life lithium-air battery in ambient air[J]. Nat. Commun.,2013,4:1-7.
[8] ZHU X B,ZHAO T S,WEI Z H,et al. A high-rate and long cycle life solid-state lithium-air battery[J]. Energy Environ. Sci.,2015,8:3745-3754.
[9] SHUI J L,LIU D J,et al. Reversibility of anodic lithium in rechargeable lithium-oxygen batteries[J]. Nat. Commun.,2013,4:1-7.
[10] LEE K,PARK Y J. CsI as multifunctional redox mediator for enhanced Li-air batteries[J]. ACS Appl. Mater. Interfaces,2016,8:11893-11897.
[11] SEMKOW K W,SAMMELLS A F,et al. A lithium oxygen secondary battery[J]. J. Electrochem. Soc.,1987,134:2084-2085.
[12] KUMAR B,KUMAR J,LEESE R,et al. A solid-state, rechargeable, long cycle life lithium-air battery[J]. J. Electrochem. Soc.,2010,157:A50-A54.
[13] KITAURA H,ZHOU H. Electrochemical performance and reaction mechanism of all-solid-state lithium-air batteries composed of lithium, Li1+xAlGe2-(PO4)3solid electrolyte and carbon nanotube air electrode[J]. Energy Environ. Sci.,2012,5:9077-9084.
[14] 谭国强. 新型固态化锂二次电池及相关材料的制备与性能研究[D]. 北京理工大学,2014.
TAN G Q. Preparation and performance of the novel solid-state rechargeable lithium batteries and relative materials[D]. Beijing:Beijing Institute of Technology,2014.
[15] 刘清朝. 锂空气电池电极材料的制备和电化学性能研究[D]. 吉林大学,2015.
LIU Q Z. The preparation and electrochemical performance of electrode for lithium-air batteries [D]. Jilin:Jilin University,2015.
[16] ZHU X B,ZHAO T S,WEI Z H,et al. A novel solid-state Li-O2battery with an integrated electrolyte and cathode structure[J]. Energy Environ. Sci.,2015,8:2782-2790.
[17] SUZUKII Y,KAMI K,WATANABE K,et al. Characteristics of discharge products in all-solid-state Li-air batteries[J]. Solid State Ionics.,2015,278:222-227.
[18] KITAURA H,ZHOU H. All-solid-state lithium-oxygen battery with high safety in wide ambient temperature range[J]. Sci. Rep.,2015,5:doi:10.1038/srep13271.
[19] KUMAR B,KUMAR J. Cathodes for solid-state lithium-oxygen cells:Roles of nasicon glass-ceramics[J]. J. Electrochem. Soc.,2010,157:A611-A616.
[20] LIU Y,LI B,KITAURA H,et al. Fabrication and performance of all-solid-state Li-air battery with SWCNTs/LAGP cathode[J]. ACS Appl. Mater. Interfaces,2015,7:17307-17310.
[21] KICHAMBARE P,RODRIGUES S,KUMAR J. Mesoporous nitrogen-doped carbon-glass ceramic cathodes for solid-state lithium-oxygen batteries[J]. ACS Appl. Mater. Interfaces,2012,4:49-52.
[22] KITAURA H,ZHOU H,et al. Electrochemical performance of solid-state lithium-air batteries using carbon nanotube catalyst in the air electrode[J]. Adv. Energy Mater.,2012,2:889-894.
[23] HASSOUN J,CROCE F,ARMAND M,et al. Investigation of the O2electrochemistry in a polymer electrolyte solid-state cell[J]. Angew. Chem. Int. Ed.,2011,50:2999-3002.
[24] BALAISH M,PELED E,GOLODNITSKY D,et al. Liquid-free lithium-oxygen batteries[J]. Angew. Chem. Int. Ed.,2015,54:446-450.
[25] JUNG K N,LEE J I,JUNG J H,et al. A quasi-solid-state rechargeable lithium-oxygen battery based on a gel polymer electrolyte with an ionic liquid[J]. Chem. Commun.,2014,50:5458-5461.
[26] KIM H,KIM T Y,ROE V V,et al. Enhanced electrochemical stability of quasi-solid-state electrolyte containing SiO2nanoparticles for Li-O2battery applications[J]. ACS Appl. Mater. Interfaces,2016,8:1344-1350.
[27] YI J,LIU X,GUO S,et al. Novel stable gel polymer electrolyte:Toward a high safety and long life Li-air battery[J]. ACS Appl. Mater. Interfaces,2015,7:23798-23804.
[28] ZHANG T,IMANISHI N,HASEGAWA S,et al. Li/polymer electrolyte/water stable lithium-conducting glass ceramics composite for lithium-air secondary batteries with an aqueous electrolyte[J]. J. Electrochem. Soc.,2008,155:A965-A969.
[29] SUN Y. Lithium ion conducting membranes for lithium-air batteries[J]. Nano Energy,2013,2:801-816.
[30] HARDING J R,AMANCHUMWU C V,HAMMOND P T,et al. Instability of poly(ethylene oxide) upon oxidation in lithium-air batteries[J]. J. Phys. Chem. C,2015,119:6947-6955.
[31] KUMAR J,KICHAMBARE P,RAI A K,et al. A high performance ceramic-polymer separator for lithium batteries[J]. J. Power Sources,2016,301:194-198.
[32] LU J,PARK J B,SUN Y K,et al. Aprotic and aqueous Li-O2batteries[J]. Chem. Rev.,2014,114:5611-5640.
[33] KICHAMBARE P,KUMAR J,RODRIGUES S,et al. Electro- chemical performance of highly mesoporous nitrogen doped carbon cathode in lithium-oxygen batteries[J]. Journal of Power Sources,2011,196(6):3310-3316.
[34] NAKNANISHI S,MIZUNO F,NOBUHARA K,et al. Influence of the carbon surface on cathode deposits in non-aqueous Li-O2batteries[J]. Carbon,2012,50(13):4794-4803.
[35] LI F,YAMADA A,ZHOU H,et al. Ru/ITO:A carbon-free cathode for nonaqueous Li-O2battery[J]. Nano Lett.,2013,13:4702-4707.
[36] LIAO K,ZHANG T,ZHOU H,et al. Nano-porous Ru as a carbon- and binder-free cathode for Li-O2batteries[J]. ChemSusChem.,2015,8:1429-1434.
[37] THOTIYL M M O,FREUNBERGER S A,BRUCE P G,et al. A stable cathode for the aprotic Li-O2battery[J]. Nat. Mater.,2013,12:1050-1056.
[38] XIE J,YAO X H,WANG D,et al. Selective deposition of Ru nanoparticles on TiSi2nanonet and its utilization for Li2O2formation and decomposition[J]. J. Am. Chem. Soc.,2014,136:8903-8906.
[39] CAO J,XIE J,ZHAO X,et al. Tips-bundled Pt/Co3O4nanowires with directed peripheral growth of Li2O2as efficient binder/ carbon-free catalytic cathode for lithium-oxygen battery[J]. ACS Catal.,2015,5:241-245.
[40] LIAO K,ZHANG T,ZHOU H,et al. An oxygen cathode with stable full discharge-charge capability based on 2D conducting oxide[J]. Energy Environ. Sci.,2015,8:1992-1997.
[41] LI F,TANG D M,ZHANG T,et al. Superior performance of a Li-O2battery with metallic RuO2hollow spheres as the carbon-free cathode[J]. Adv. Energy Mater.,2015,doi:10.1002/aenm.201500294.
[42] HASSOUN J,JUNG H G,LEE D J,et al. A metal-free, lithium-ion oxygen battery:A step forward to safety in lithium-air batteries[J]. Nano Lett.,2012,12:5775-5779.
[43] HE P,ZHANG T,JIANG J,et al. Lithium-air batteries with hybrid electrolytes[J]. J. Phys. Chem. Lett.,2016,7:1267-1280.
[44] LIANG Z,LIN D,ZHAO J,et al. Composite lithium metal anode by melt infusion of lithium into a 3D conducting scaffold with lithiophilic coating[J]. Proc. Natl. Acad. Sci.,2016,113:2862-2867.
[45] YAN K,LU Z,LEE H W,et al. Selective deposition and stable encapsulation of lithium through heterogeneous seeded growth[J]. Nat. Energy,2016,1:doi: 10.1038/nenergy.2016.10.
[46] LIN D,LIU Y,LIANG Z,et al. Layered reduced graphene oxide with nanoscale interlayer gaps as a stable host for lithium metal anodes[J]. Nat. Nanotechnol.,2016,11:626-632.
[47] AONO H,SUGIMOTO E,SADAOKA Y,et al. Ionic-conductivity of the lithium titanium phosphate [Li1+xAlTi2-(PO4)3], [Li1+xScTi2-(PO4)3], [Li1+xYTi2-(PO4)3], [Li1+xLaTi2-(PO4)3] systems[J]. Electrochem. Soc.,1989,136:590-591.
[48] LI Y Q,CAO Y,GUO X X. Densification and lithium ion conductivity of garnet-type Li7-La3Zr2-TaO12(=0.25) solid electrolytes[J]. Chin. Phys. B,2013,22(7):1-5.
[49] ZHANG T,ZHOU H S. From Li-O2to Li-air batteries:Carbon nanotubes/ionic liquid gels with a tricontinuous passage of electrons, ions, and oxygen[J]. Angew. Chem. Int. Ed.,2012,51:11062-11067.
[50] ZHANG T,MATSUDA H,ZHOU H S. Gel-derived cation-stacking films of carbon nanotube-graphene complexes as oxygen cathodes[J]. ChemSusChem,2014,7:2845-2852.
[51] OSAKA T,MOMMA T,TAJIMA T,et al. Enhancement of lithium anode cyclability in propylene carbonate electrolyte by CO2addition and its protective effect against H2O impurity[J]. Journal of the Electrochemical Society.,1995,142(4):1057-1060.
[52] SHIRAISHI S,KANAMURA K,TAKEHARA Z I. Influence of initial surface condition of lithium metal anodes on surface modification with Hf[J]. Journal of Applied Electrochemistry,1999,29(7):869-881.
[53] WALKER W,GIORDANI V,UDDIN J,et al. A rechargeable Li-O2battery using a lithium nitrate/,-dimethylacetamide electrolyte[J]. J. Am. Chem. Soc.,2013,135:2076-2079.
[54] GRANVALET-MANCINI M,HONEYCYTT L,TEETERS D. Characterization of self-assembled molecular layers at the polymer electrolyte/lithium electrode interface[J]. Electrochimica Acta.,2000,45(8/9):1491-1500.
[55] GRANVALET-MANCINI M,TEERTERS D. The effects of chemical composition of adsorbed molecular layers on lithium electrode/ polymer electrolyte interface stabilization[J]. Journal of Power Sources,2001,97-98:624-627.
[56] ZHANG T,IMANISHI N,HASEGAWA S,et al. Water-stable lithium anode with the three-layer construction for aqueous lithium-air secondary batteries[J]. Electrochem. Solid-State Lett.,2009,12:A132-A135.
[57] LIU S,WANG H,IMANISHI N,et al. Eeffect of co-doping nano-silica filler and-methyl--propylpiperidinium bis(trifluoromethanesulfonyl) imide into polymer electrolyte on Li dendrite formation in Li/poly (ethylene oxide)-Li(CF3SO2)2N/Li[J]. J. Power Sources,2011,196:7681-7686.
[58] LIU S,IMANISHI N,ZHANG T,et al. Lithium dendrite formation in Li/PEO-lithium bis(trifluoromethanesulfonyl)imide and-methyl--propylpiperidinium bis(trifluoromethanesulfonyl)imide/Li cells[J]. J. Electrochem. Soc.,2010,157:A1092-A1098.
[59] LI F,WU S,LI D,et al. The water catalysis at oxygen cathodes of Li-O2cells[J]. Nat. Commun.,2015,6:doi: 10.1038/ncomms8843.
[60] LIU T,LESKES M,YU W,et al. Cycling Li-O2batteries via LiOH formation and decomposition[J]. Science,2015,350:530-533.
[61] HONG M,CHOI H C,BYON R.Nanoporous NiO plates with a unique role for promoted oxidation of carbonate and carboxylate species in the Li-O2battery[J]. Chem. Mater.,2015,27:2234-2241.
[62] ZHENG H,XIAO D,LI X. New insight in understanding oxygen reduction and evolution in solid-state lithium-oxygen batteries using an in situ environmental scanning electron microscope[J]. Nano Lett.,2014,14:4245-4249.
Progress in rechargeable solid-state Li-air batteries
ZHANG Tao, ZHANG Xiaoping, WEN Zhaoyin
(CAS Key Laboratory of Materials for Energy Conversion, Shanghai Institute of Ceramics, Chinese Academy of Sciences, Shanghai 200050, China)
The theoretical specific energy of lithium-air battery is as high as 3505 W·h/kg. The practical specific energy of this electrochemical energy storage system is estimated to be able to 600 W·h/kg, which is a promising value to sustain a driving range of 500~800 kilometers for electric vehicles. Currently lithium-air batteries are facing various challenges, such as stability associated with decomposition of carbon-based cathodes and electrolytes, low electric energy efficiency and power density, questionable applicability due to the common operation environment just in pure oxygen, and the safety issues related to lithium dendrites and so on, in particular, the ability whether can be operated in ambient air or not. Developing solid-state lithium-air batteries can solve the problem of applicability fundamentally, circumvent the safety issues completely, and which is also an important avenue to improve the stability of the battery system. In this paper, we reviewe the progress on the cell construction, the regulation of the electron/electrolyte interface, the cell assembly, the electrochemical performance and the mechanism for the solid-state lithium-air batteries. In every section, the contributions of the recent research progress on the SEAS challenges and the still remained questions will be commented. Based on these review, we attempt to propose some alternative approaches for the next stage, and suggest a development prospective for the solid-state lithium-air batteries.
solid-state Li-air batteries; solid-state Li-ion conducting electrolyte; complex air cathode; Li metal-based anode; interface regulation
10.12028/j.issn.2095-4239.2016.0056
TQ 152
A
2095-4239(2016)05-702-11
2016-08-01。
中国科学院百人计划,国家自然科学基金(51432010)及上海市科委项目(14JC1493000)。
张涛(1979—),男,研究员,主要研究方向为锂空气电池、新型高比能电池等,E-mail:taozhang@mail.sic.ac.cn;通讯联系人:温兆银,研究员,主要研究方向为钠(硫)电池及全固态锂离子电池、锂空气/锂硫等新型二次电池,E-mail:zywen@mail.sic.ac.cn。
