固定化胃蛋白酶的工艺优化*
2016-10-27周丽杰张可佳姜文杰李智博赵前程祁艳霞
周丽杰,张可佳,姜文杰,李智博,赵前程,祁艳霞
(大连海洋大学食品科学与工程学院,辽宁省水产品加工及综合利用重点实验室,辽宁 大连 116023)
固定化胃蛋白酶的工艺优化*
周丽杰,张可佳,姜文杰,李智博,赵前程,祁艳霞
(大连海洋大学食品科学与工程学院,辽宁省水产品加工及综合利用重点实验室,辽宁大连116023)
利用海藻酸钠-壳聚糖对胃蛋白酶进行固定化,以酶活回收率为指标,探讨不同的氯化钙浓度、固定化时间、游离胃蛋白酶稀释倍数、海藻酸钠浓度对固定化胃蛋白酶效果的影响。采用响应面分析法进行固定化工艺优化。结果表明:海藻酸钠浓度最佳固定化浓度为0.9%,游离酶稀释倍数为10倍,氯化钙浓度为3.6%,固定化时间为1.5 h,该条件下固定化酶的酶活回收率为 73.42%,连续反应5次,相对酶活力仍为61.20%。
海藻酸钠;壳聚糖;胃蛋白酶;固定化酶
胃蛋白酶是一种消化性蛋白酶,可将食物中的蛋白质分解为小的肽片段。游离酶不稳定和易变性的特性,限制了其在工业生产中的应用[1]。20世纪60年代,固定化酶作为一项新技术开始发展,固定化酶具有不溶于水,易于与产物分离;可反复使用;稳定性好等优点[2-3],并在生物医学、食品工业、环境保护等领域得到了广泛的使用[4]。
本试验主要研究影响海藻酸钠固定化胃蛋白酶的几个因素,确定胃蛋白酶固定化的最佳条件,并对固定化酶的稳定性进行研究,为固定化胃蛋白酶的应用提供理论依据。
1 实 验
1.1材料
胃蛋白酶、壳聚糖:北京索莱宝科技有限公司;海藻酸钠:青岛明月海藻集团有限公司,实验中所用其他试剂均为分析纯。
1.2方法
1.2.1制备固定化胃蛋白酶[5-7]
将一定量的海藻酸钠溶于pH 3.0乳酸-乳酸钠缓冲液中,加入稀释的胃蛋白酶溶液,冰浴环境下持续搅拌30 min,静置。用1%的醋酸溶液溶解壳聚糖,加入无水氯化钙。用注射器将含有胃蛋白酶的海藻酸钠溶液逐滴加到氯化钙溶液中,搅拌0.5 h,置于4 ℃冰箱中固定化一段时间。反应结束后,用缓冲液反复冲洗即得固定化酶。
1.2.2单因素实验
以固定化胃蛋白活性回收率为指标,探讨不同的氯化钙浓度、固定化时间、游离胃蛋白酶稀释倍数、海藻酸钠浓度对固定化胃蛋白酶效果的影响。
1.2.3响应面实验设计[8-10]
在单因素实验的基础上,依据Box-Benhnken中心组合设计原理,设计三因素三水平的响应面试验,如表1所示。

表1 响应面试验因素编码及水平Table 1 Factors and coded values of response surface methodology
1.2.4游离蛋白酶与固定胃蛋白酶活力的测定
采用福林-酚法测定胃蛋白活力,即GB/T 23527-2009(蛋白酶制剂)
1.2.5固定化酶活回收率的计算方法

1.2.6固定化胃蛋白酶性质的研究方法
(1)游离酶与固定化酶最适温度的研究
在不同的温度(30~60 ℃)下反应,测定游离酶和固定化酶的活力。
(2)游离酶与固定化酶最适pH的研究
在不同的pH(pH 1.0~5.0)下反应,测定游离酶和固定化酶的活力。
(3)固定化酶操作稳定性研究
按照酶活测定方法,在条件不变的情况下,连续反应五次,测定固定化酶的活力。
2 结果与讨论
2.1单因素实验结果
2.1.1氯化钙浓度对固定化酶的影响
如图1,固定化酶活力随氯化钙浓度的增加而增大,当氯化钙浓度达到3%时,固定化酶活性回收率最大,为46.25%。
2.1.2固定化时间对固定化酶的影响
如图2所示,1.5 h时,固定化酶活性回收率最大,为65.03%。时间越长,固定化酶活性回收率逐渐下降。
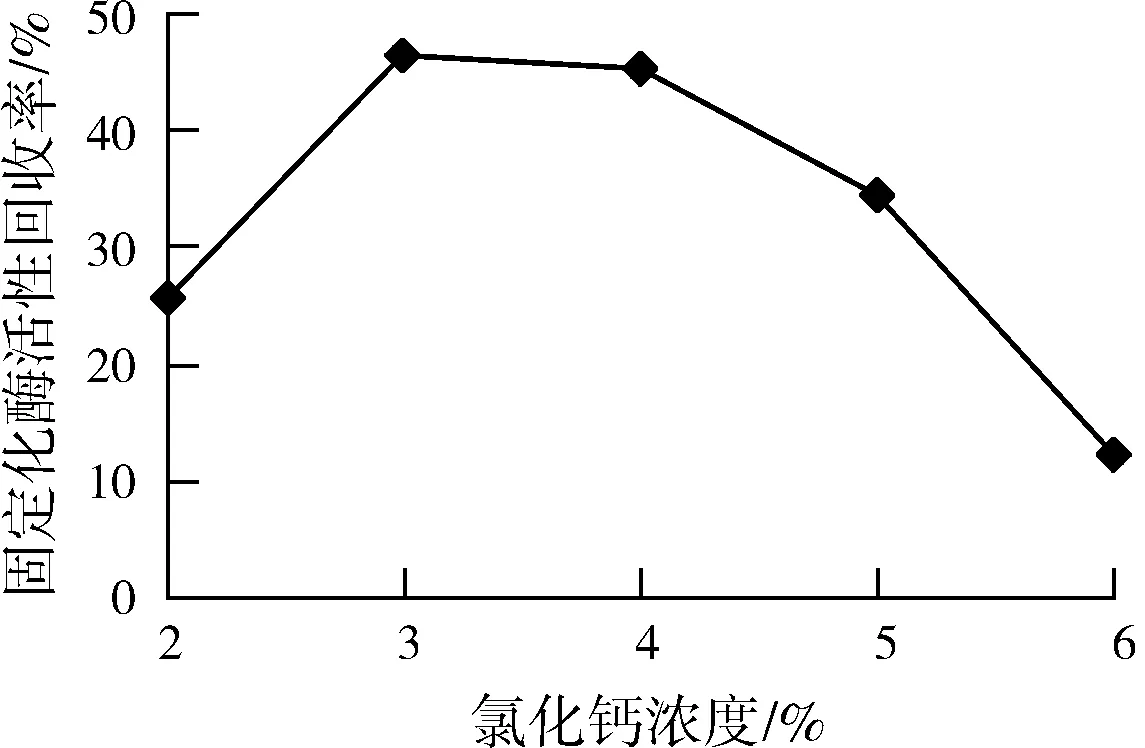
图1 氯化钙浓度对固定化酶活力影响Fig.1 Effect of CaCl2 concentration onimmobiiized enzyme

图2 固定化时间对固定化酶活力影响Fig.2 Effect of time on immobiiized enzyme
2.1.3游离酶稀释倍数对固定化酶的影响
如图3所示,固定化酶活力随游离酶稀释倍数的增加而逐渐增大,当稀释15倍时,固定化酶活性回收率最大为53.73%。
2.1.4海藻酸钠浓度对固定化酶的影响
如图4,固定化酶活力随海藻酸钠浓度增加而增大,当浓度为1.0%时,固定化酶活性回收率最大,为53.05%。
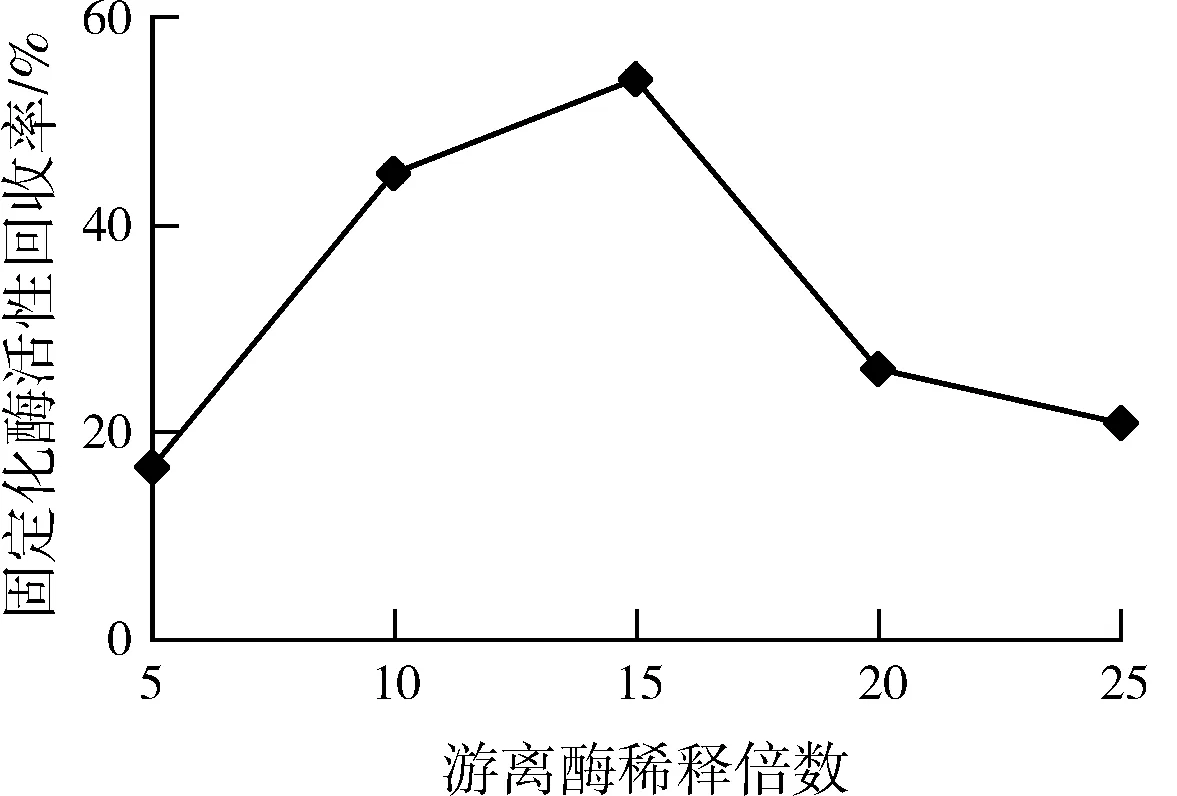
图3 游离酶稀释倍数对固定化酶影响Fig.3 Effect of diluted multiples onimmobiiized enzyme
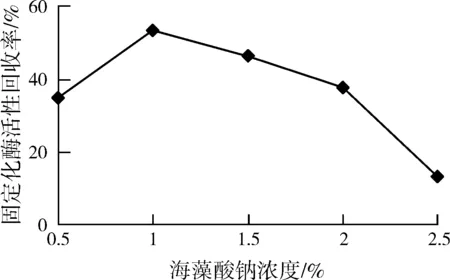
图4 海藻酸钠浓度对固定化酶影响Fig.4 Effect of alginate concentration on immobiiized enzyme
2.2响应面实验结果
2.2.1响应值固定化酶活回收率与影响因素间数学模型的建立
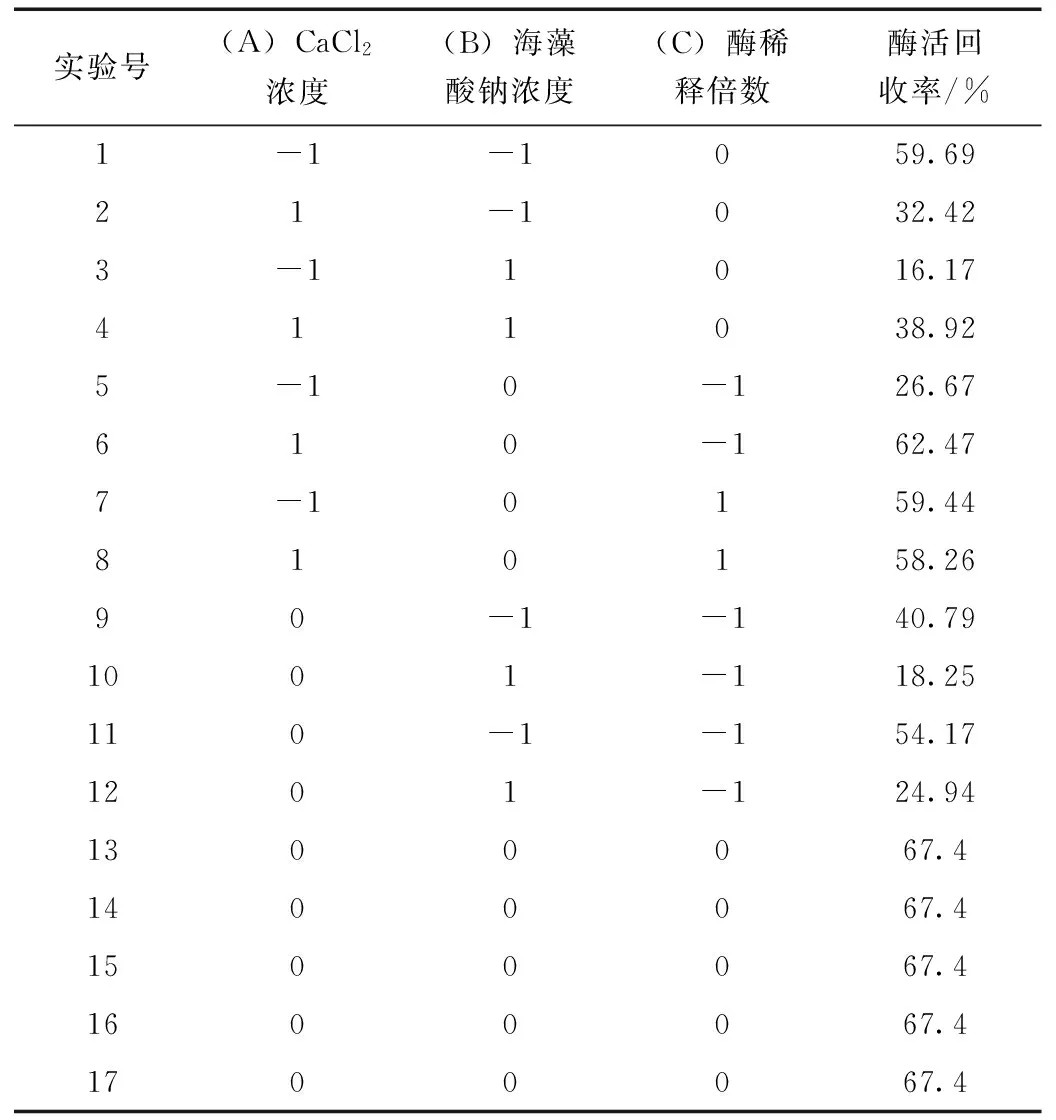
表2 响应面实验方案及结果Table 2 Design and result of response surface analysis
表2显示出不同条件对应的固定化酶活回收率,利用软件Design expert分析实验数据可得到固定化酶活回收率(Y)对自变量氯化钙浓度(A)、海藻酸钠浓度(B)及游离胃蛋白酶稀释倍数(C)的二次多项回归方程为:
Y=+67.4-3.77875×A-11.0825×B+6.07875×C+12.4725×A×B-9.245×A×C-1.6725×B×C-6.73×A2-23.9025×B2-8.96×C2
通过分析回归模型方差及显著性检验,得到该回归方程的P=0.0004(<0.01),说明该模型具有极显著性,使用该回归模型代替实验点可以有效地进行分析;失拟项F值为5.69>0.05,说明失拟项不显著,该方程对实验拟合情况好,实验误差小。相关系数的平方(R2)为0.9605,说明该方程的回归效果显著,该模型可以很好地反映响应值固定化酶活回收率与氯化钙浓度(A)、海藻酸钠浓度(B)及游离胃蛋白酶稀释倍数(C)变化关系。
2.2.2响应面交互作用分析与优化
图5显示的是两个因素交互作用对胃蛋白酶固定化效果的影响,如图5(A),不同的氯化钙浓度,海藻酸钠的浓度增加,固定化酶回收率先上升后下降;不同的海藻酸钠浓度,氯化钙的浓度增加,固定化酶回收率先无变化后减小。
如图5(B),不同的氯化钙浓度,游离酶稀释倍数逐渐增大,固定化酶回收率先增加后不变;不同的游离酶稀释倍数,氯化钙浓度的逐渐增加,固定化酶回收率先增加后减小。
如图5(C),不同的海藻酸钠浓度,游离酶稀释倍数的增加,固定化酶回收率先增加后下降;不同的游离酶稀释倍数,海藻酸钠浓度逐渐增加,固定化酶回收率先增加后不变。
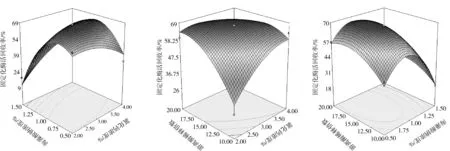
图5 各两因素交互作用影响(显著项)对固定化效果影响的响应面图Fig.5 Response surface analysis of significant effective interaction items of different parameters on immobilization
通过响应面分析法得出最优实验方案为:海藻酸钠浓度0.9%,游离酶稀释10倍,氯化钙浓度3.6%,固定化1.5 h,3次平行实验后平均值为73.42%。响应值的实验值与回归方程预测值吻合度良好,该模型能够较好地预测实际固定化效果。
2.3固定化胃蛋白酶的性质研究
2.3.1游离与固定化胃蛋白酶最适温度的研究
如图6(A),游离胃蛋白酶的最适温度为40 ℃,固定化胃蛋白酶的最适反应温度为50 ℃。固定化胃蛋白酶的耐热能力有所提升。
2.3.2游离与固定化胃蛋白酶的最适pH的研究
如图6(B),游离胃蛋白酶的最适pH为2.0,固定化之后胃蛋白酶的最适pH为3.0。固定化胃蛋白酶最适pH有所提高。
2.3.3固定化酶操作稳定性研究
固定化酶可以重复使用,在相同的条件下,连续反应5次,测定其相对酶活力,将第一次的测定的酶活力设定为为100%,结果如图6(C)所示,固定化胃蛋白酶的相对酶活力仍为61.20%。
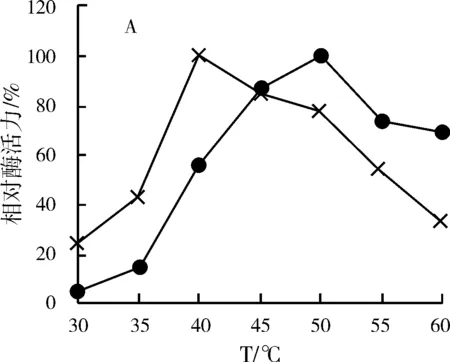

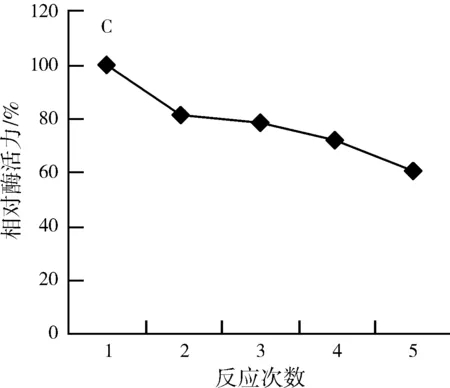
图6 固定化胃蛋白酶性质的研究Fig.6 Study on the properties of immobilized pepsin
3 结 论
通过单因素和响应面实验,得到最优的固定化酶制备工艺为海藻酸钠浓度0.9%,游离酶稀释10倍,氯化钙浓度3.6%,固定化时间1.5 h,在该条件下固定化酶的酶活回收率为 73.42%。该工艺制备的固定化胃蛋白酶的最适温度为50 ℃,其耐热性有了很大提升;固定化酶最适pH为3.0,比游离酶最适pH的耐受度有所提高;固定化胃蛋白酶连续反应5次,相对酶活力仍为61.20%,可知该方法制备的固定化胃蛋白酶反应具有良好的稳定性。
[1]李彦峰,李军荣,伏莲娣.固定化酶的制备及应用[J].高分子通报,2001(2):13-23.
[2]徐风彩, 姜涌明. 酶工程[M] . 北京:中国农业出版社, 2001:3-60.
[3]童海宝. 生物化工[M] . 北京: 化学工业出版社, 2001:68-116.
[4]周晓云. 酶技术[M] . 北京: 石油工业出版社, 1995:2-36.
[5]李晓静,侯俊财,江连洲,等. 海藻酸钠-壳聚糖固定化胃蛋白酶的研究[J].食品工业科技.2014,35(1): 168-173.
[6]王刚强,王维香,赵金梅. 海藻酸钠固定化胰蛋白酶的研究[J]. 西华大学学报:自然科学版,2011,30(4):109-112.
[7]张黎明,袁永俊,徐梦虬. 固定化胰蛋白酶的制备研究[J]. 食品与发酵科技. 2009,45(2):18-21.
[8]陈青,张小薇,林美,等.响应面法优化海藻酸钠固定α-淀粉酶的研究[J].广州化工.2015,43(3):92-94+107.
[9]E M Silva,H Rogez.Optimization of extraction of phenolics from Inga edulis leaves using response surface methodology[J].Separation and Purification Technology, 2007,55(3):381-387.
[10]Chandrika Liyana-Pathirana, Fereidoon Shahidi.Optimization of extraction of phenolic compounds from wheat using response surface methodology[J].Food Chemistry 2005, 93(1):47-56.
Study on Optimized Preparation Process of Immobilized Pepsin*
ZHOULi-jie,ZHANGKe-jia,JIANGWen-jie,LIZhi-bo,ZHAOQian-cheng,QIYan-xia
(Key Laboratory of Aquatic Product Processing and Utilization of Liaoning Province, College of Food Science and Engineering, Dalian Ocean University, Liaoning Dalian 116023, China)
The technology of pepsin’s immobilization with alginate and chitosan was illustrated. The enzymatic properties of the immobilized and pepsin were studied to get the optirnum conditions. The result of optimal immobilization conditions showed that the concentration of sodium alginate was 0.9%, the free enzyme diluted 10 times, concentration of CaCl2was 3.6%, crosslinking time was 1.5 h. The recovery of the immobilized enzyme could reach 73.42%. In addition, the immobilized enzyme activity could still be maintained 61.20% after repeated use five times.
alginate; chitosan; pepsin; immobilized enzyme
辽宁省海洋与渔业厅科研项目(201511)。
周丽杰(1989-),女,在读研究生,主要研究方向:食品生物技术。
李智博(1979-),女,副教授,主要研究方向:食品生物技术。
TS201
A
1001-9677(2016)018-0066-04
